Se describe la variación altitudinal de riqueza, recambio y composición de especies de micromamíferos mediante muestreos a lo largo de 4 transectos que van desde selvas a 500m hasta los desiertos altoandinos a 4 000m en el noroeste argentino. En general, la riqueza de micromamíferos decrece con la altitud, principalmente como consecuencia de la alta diversidad de murciélagos en las tierras bajas. En cambio, los micromamíferos terrestres mostraron un claro patrón curvilíneo de riqueza con un pico en altitudes intermedias, cerca de la línea superior de bosques a 2 700m. Los valores máximos de los índices de recambio de especies se localizaron en el extremo superior del gradiente a 3 500m. La composición de las comunidades de micromamíferos en cada transecto altitudinal individual fue concordante con el esquema fitogeográfico, encontrándose especies características de las selvas montanas, los bosques montanos y las estepas altoandinas. El análisis de los 4 transectos altitudinales juntos reveló que la altitud es la principal fuente de variación en la composición de especies. Latitudinalmente, los 2 transectos más septentrionales, similares entre sí, difirieron de los 2 más australes, principalmente en los sitios de altitudes intermedias, donde se ha documentado una alta concentración de roedores endémicos.
We describe the altitudinal variation in species richness, turnover and species composition of small mammals through field surveys along 4 transects ranging from tropical rainforests at 500m to high Andean deserts at 4 000m in northwestern Argentina. The elevation pattern of richness for all small mammals decreases with altitude, mainly due to the high diversity of bats in the lowlands. For the terrestrial small mammals there was a clear curvilinear pattern of richness with a peak near the upper tree line at 2 700m. The maximum values of the species turnover rates were located in the upper part of the gradient at 3 500m. The composition of small mammals communities in every single elevation transect was consistent with the phytogeographic scheme, with species characteristics of montane rainforest, temperate cloud forests and high Andean steppes. The analysis of the 4 altitudinal transects together revealed that elevation is the main source of variation in species composition. Latitudinally, the 2 northernmost transects, similar between each other, differed from the 2 southernmost, mainly at intermediate elevation, where a high concentration of endemic rodents has been documented.
La búsqueda de distintos tipos de patrones es un tema central y recurrente en biogeografía y ecología. La visión tradicional de una caída lineal de especies con la altitud, fue interpretada alguna vez como un patrón universal, semejante al observado en los gradientes latitudinales (Brown y Gibson, 1983; Begon et al., 1990). Sin embargo, meta-análisis y estudios recientes muestran que no existe un único patrón altitudinal de riqueza de especies, y que contrariamente al supuesto de una caída monotónica en función de la altitud, el caso más común es un pico de riqueza en altitudes intermedias (Rahbek, 1995; Brown, 2001; McCain y Grytnes, 2010). Para los micromamíferos terrestres, se ha demostrado que la existencia de un pico de riqueza en alturas intermedias es el patrón dominante en muchos sistemas montañosos del mundo, a pesar de estar lejos de considerarse un patrón universal (McCain, 2005). Los murciélagos, en cambio, presentan con similar frecuencia patrones de riqueza curvilíneos y de caída lineal con el aumento de la altitud (McCain, 2007). El conocimiento detallado de la variación altitudinal de la riqueza de especies en diferentes regiones del mundo es un requisito fundamental a la hora de indagar en los procesos que producen dichos patrones. En la presente investigación nos hemos centrado, justamente, en la documentación de los patrones de variación altitudinal en la riqueza y composición de especies de micromamíferos en los Andes del norte de Argentina.
Un rasgo característico del noroeste argentino (NOA) es su marcada heterogeneidad fisiográfica y ambiental, reflejada en el hecho de que con sólo un 15% de la superficie de Argentina, el NOA contiene al 50% de las regiones fitogeografías terrestres definidas por Cabrera (1976) para el país y al 48% de sus especies de mamíferos terrestres (Barquez et al., 2006). Los micromamíferos, por su parte, constituyen con frecuencia los elementos más numerosos de las comunidades naturales de mamíferos. De hecho, los 2 órdenes más diversos, Rodentia (42% de las especies de mamíferos) y Chiroptera (20%) están compuestos mayormente por especies de pequeño tamaño. En el NOA habitan 3 órdenes de mamíferos que contienen especies de pequeño tamaño: los roedores, con 73 especies que representan el 43% de las especies de roedores del país; los murciélagos, con 41 especies (68%) y los marsupiales didélfidos (Orden Didelphimorphia), con 11 especies (57%). Considerando estos antecedentes, los micromamíferos del NOA constituyen un objeto de estudio propicio para ecología de comunidades y pueden ser considerados como excelentes indicadores biogeográficos.
Si bien, las investigaciones sobre mamíferos del NOA se originaron hace más de un siglo, alrededor de 1890, son escasos los estudios sobre variaciones altitudinales realizados. Muchos se han centrado en taxonomía y distribución de las especies dentro de límites geopolíticos de las provincias (Mares et al., 1981, 1996, 1997; Díaz y Barquez, 1999, 2007; Díaz et al., 2000) o de regiones fitogeográficas (Barquez y Ojeda, 1992; Barquez y Díaz, 2001; Jayat et al., 2008). Otros estudios analizaron secundariamente la variación altitudinal de las especies; por ejemplo, Giannini (1999) describió la segregación altitudinal entre 2 especies de murciélagos del género Sturnira en un estudio sobre frugivoría, mientras que Ortiz y Pardiñas (2001) discutieron brevemente la distribución altitudinal de roedores sigmodontinos en el marco de las implicancias paleoambientales de un yacimiento fosilífero en la localidad de Tafí del Valle, Tucumán. Un análisis biogeográfico más inclusivo, muestra una caída latitudinal y altitudinal de la riqueza de órdenes de mamíferos en la provincia de Salta (Ojeday Mares, 1989). Más recientemente, Jayat et al. (2008) se centraron en un análisis de roedores sigmodontinos que habitan los pastizales de neblina en la selva de las yungas, registrando la distribución altitudinal de las especies. En tanto que Ferro y Barquez (2009) y Ferro (2013) analizaron la totalidad del espectro altitudinal en el sector más austral de las yungas, encontrando un patrón curvilíneo de riqueza tanto para micromamíferos terrestres a partir de datos de campo, como para roedores a partir de registros de colecciones, respectivamente.
En el presente estudio extendemos el análisis de distribución altitudinal tanto a nivel geográfico, incluyendo la totalidad de la extensión latitudinal de las laderas orientales (húmedas) de los Andes del NOA como sistemático incluyendo a roedores marsupiales y murciélagos. Nos centramos en la exploración, descripción y caracterización de las comunidades de micromamíferos mediante muestreos a lo largo de transectos altitudinales en 4 cadenas montañosas. En cada una de ellas, registramos los cambios de composición, riqueza, abundancia y recambio de especies. Además, caracterizamos la fauna de micromamíferos de los principales biomas del área y documentamos la distribución altitudinal de las diferentes especies.
Materiales y métodosÁrea de estudioEl noroeste Argentino (NOA) se encuentra entre los 22°–30° de latitud sur y 62°–68° de longitud oeste (Fig. 1). Incluye 5 provincias políticas: Jujuy, Salta, Tucumán, Catamarca y Santiago del Estero y 5 provincias biogeográficas: Chaco, Yungas, Monte, Prepuna y Puna (Morrone, 2001). Dentro de esta zona se establecieron 4 transectos altitudinales a lo largo del gradiente latitudinal de las yungas de Argentina, de norte a sur en: sierras de Zenta (Salta), sierras de Tilcara (Jujuy), cumbres Calchaquíes (Tucumán) y nevados del Aconquija (Tucumán;Fig. 1). Las cordilleras seleccionadas representan el primer gran escalón de los Andes al oeste de la llanura chaqueña (Aceñolaza y Toselli, 1981). Su orientación norte-sur y sus picos que se elevan entre 4 500 y 5 500m de altitud, actúan como barreras para los vientos húmedos que soplan del este durante el verano y producen gran cantidad de lluvia sobre las laderas orientales. El abundante y regular régimen de precipitación sustenta la porción más austral de las selvas de montaña Neotropicales, conocidas como Yungas, cuya distribución se extiende septentrionalmente hasta Venezuela por las laderas orientales de los Andes (Hueck, 1978; Cabrera y Willink, 1980).
Cabrera (1976) dividió a las yungas de Argentina en 3 distritos altitudinales: la selva de transición (350–600m), la selva montana (600–1 700m) y el bosque montano (1 700–3 500m). La selva de transición se ubica en la parte basal de las montañas; es una selva micrófila, semidecidua, en gran parte reemplazada por plantaciones de caña de azúcar desde principios del siglo XIX. La selva montana, el sector más lluvioso de las Yungas (1 500–2 000mm anuales), es una selva perenne, que se ubica en las laderas inferiores de las montañas, y puede ser dividida en 2 estratos altitudinales: la selva montana inferior, caracterizada por la dominancia de lauráceas (600–900m) y la selva montana superior, dominada por mirtáceas (900–1 700m) (Hueck, 1978). Los bosques montanos son formaciones boscosas caducifolias dominadas por Alnus acuminta (aliso del cerro), los que en muchos sitios aparecen inmersos en una matriz de pastizales, pastizales de neblina, particularmente entre los 2 000 y 2 700m. Por encima de los 2 800m desaparecen los árboles, excepto algunos bosquecillos aislados de Polylepis australis (queñua) en las laderas y quebradas rocosas más empinadas. Sin embargo, el paisaje es dominado por pastizales (Festuca eriostoma, Poa lilloi y Stipa saltensis) hasta, aproximadamente, 3 500m. A esta altura los pastizales se funden en un amplio ecotono con las desérticas estepas altoandinas de Festuca nardifolia y F. ortophylla (iro duro) (Cabrera, 1976).
Muestreo y análisisEn cada transecto altitudinal se registró la abundancia y composición de especies mediante muestreos directos. En cada sitio de estudio se colocaron 3 líneas de trampeo con 40 trampas Sherman, distanciadas entre sí por al menos 100m. Cada trampa fue colocada a intervalos regulares de 6 a 12m, cebadas con avena y revisadas todas las mañanas, totalizando 120 trampas por noche. Cada sitio fue muestreado durante 3 noches consecutivas, representando un esfuerzo de muestreo mínimo de 360 trampas-noche para los micromamíferos terrestres. Para los murciélagos se utilizaron entre 4 y 6 redes de niebla de 6, 9 o 12m. Las redes fueron revisadas a intervalos de 90min entre el anochecer, alrededor de las 20h, hasta las 02:00h. Tanto la abundancia como la riqueza fueron ponderadas por un esfuerzo de muestreo similar. La abundancia se estandarizó tomando el número de capturas por cada 100 trampas-noches (o metros-horas-red) mediante la siguiente expresión: número total de capturas / esfuerzo de muestreo total del sitio x 100. De igual manera, la riqueza de especies (= número total de especies en un sitio) fue referida a un mínimo esfuerzo de muestreo de 360 trampas-noche para los micromamíferos terrestres (número total de especies / esfuerzo de muestreo total del sitio x 360). Para los murciélagos la estandarización de riqueza se efectuó por cada 100 metros-horas-red.
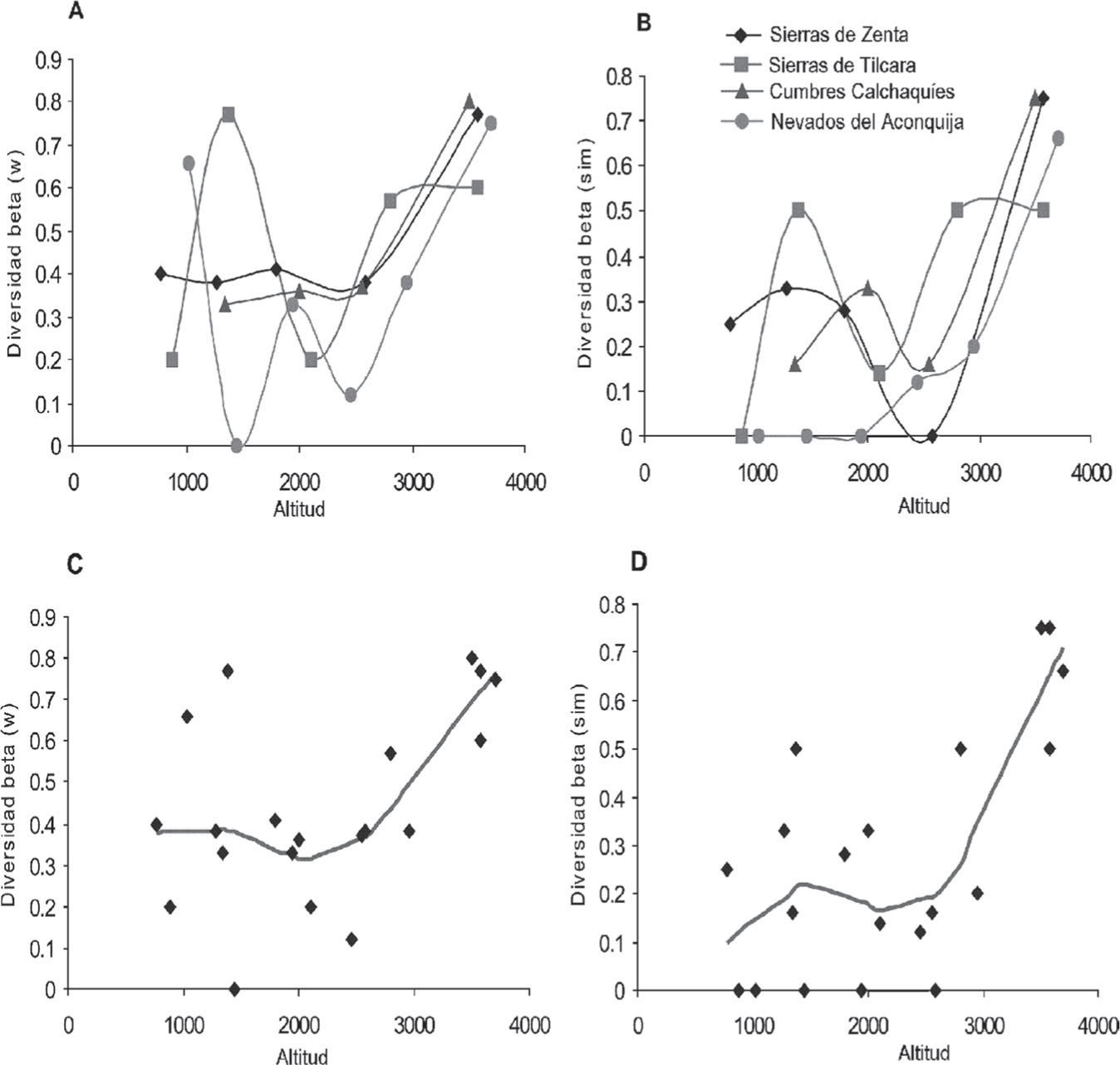
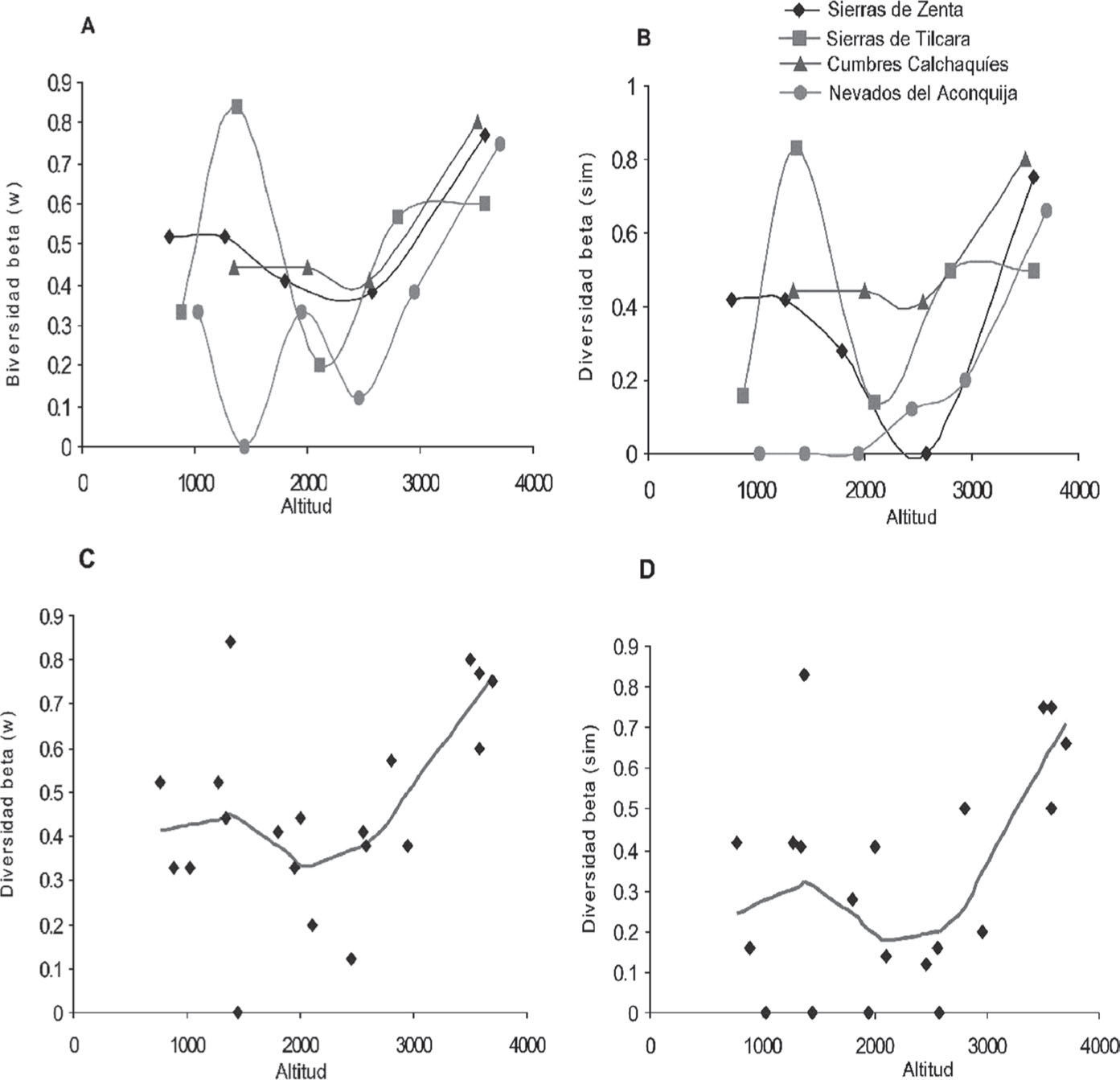
Para cuantificar el recambio de especies a lo largo del gradiente altitudinal calculamos 2 índices: el de Whittaker (βw; Whitaker, 1960), debido a que es el más ampliamente utilizado permite comparaciones con estudios publicados, y el índice βsim basado en Simpson (1943) (Lennon et al., 2001), porque es considerado independiente de los gradientes de riqueza, es decir, que mide el recambio de especies en sentido estricto (Koleff, 2005). El cálculo de ambos índices de diversidad beta a lo largo de los transectos altitudinales se realizó mediante comparaciones pareadas entre sitios contiguos mediante las expresiones detalladas en Koleff (2005).
El análisis de riqueza, abundancia y recambio de especies se dividió en 2: 1) micromamíferos terrestres, solamente y 2) todos los micromamíferos en conjunto, terrestres y voladores. Para los micromamíferos en conjunto, no fue posible comparar el éxito de captura, ya que se utilizaron técnicas diferentes y unidades de esfuerzo distintas; redes vs. trampas y metros-horas-red vs. trampasnoche. Por lo tanto, la variación altitudinal en el éxito de captura sólo se analizó para los micromamíferos terrestres. El mismo problema se presentó para estandarizar la riqueza de especies. Es por eso que, para graficar la variación altitudinal de riqueza de especies para los micromamíferos, se utilizó directamente el número de especies.
Para evaluar la relación entre altitud, riqueza, recambio de especies y abundancia de micromamíferos, se utilizó LOWESS (Locally Weighted Scatterplot Smoothing), una técnica de regresión que no asume previamente forma alguna de la relación entre las variables (lineal, curva, etc.) (Trexler y Travis, 1993). Esta técnica, ajusta polinomios de bajo grado, mediante suma de cuadrados localmente pesada, a un subconjunto de los datos. Así, a medida que se recorre la serie de datos completa es posible identificar la tendencia subyacente en un conjunto de datos (Trexler y Travis, 1993). Luego, una vez identificada la forma de la relación entre la altitud y alguna de las variables, puede elegirse un modelo de regresión (lineal, polinomial, etc.) para evaluar la significación estadística de la tendencia.
A fin de detectar patrones de composición de especies utilizamos el análisis de correspondencias (AC), una técnica de estadística multivariada apropiada para visualizar diferencias y similitudes de composición específica entre sitios (Gauch, 1994). El AC realiza una representación gráfica conjunta de las variables, sitios y especies, en la que la proximidad entre los puntos refleja el nivel de asociación entre los mismos, es decir, cuando más cercanos estén 2 puntos en el diagrama, mayor será el grado de asociación entre ellos (Greenacre y Vrba, 1984; Ter Braak, 1995). Así, el AC permite la detección de patrones comunes de composición de especies, gradientes de composición y recambio de especies. Una de las virtudes del AC, que lo torna muy propicio para analizar gradientes, es que ajusta modelos unimodales y permite determinar los óptimos en las curvas unimodales, como las que caracterizan a la relación entre distribución y abundancia de las especies (Whittaker, 1960; Brown, 1995). Entonces, la posición de una especie en el diagrama de ordenamiento puede ser interpretada como su óptimo en un gradiente ambiental hipotético (Ter-Braak, 1995). Sin embargo, un problema del AC es que produce una compresión de los ejes en los extremos, con respecto al medio del eje, haciendo que los objetos aparezcan “artificialmente” más próximos entre sí en los extremos; además, se puede producir una deformación llamada efecto arco sobre el eje 2. Para eliminar estas distorsiones se usó el análisis de correspondencias detendenciado (ACD; Hill y Gauch, 1980) mediante la división del primer eje en segmentos, dentro de los cuales los valores del eje 2 son promediados a 0.
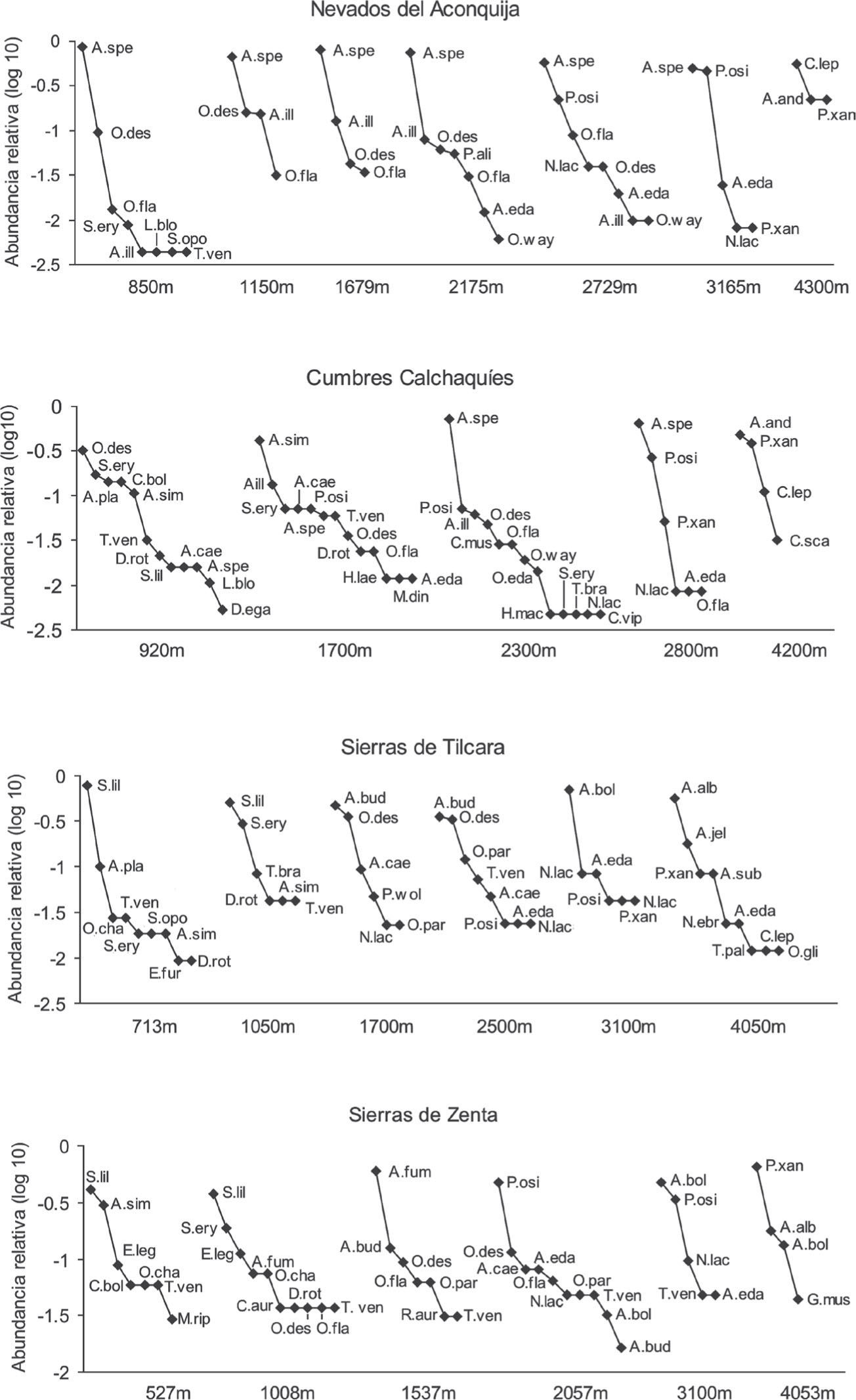
Para examinar la composición y abundancia relativa de las especies en cada sitio y los cambios que ocurren entre los mismos, se realizaron curvas de rango-abundancia. Primero se calculó el logaritmo base 10 de la abundancia relativa de cada especie en cada sitio; luego, se construyó el gráfico disponiendo los sitios de muestreo de cada transecto altitudinal en orden ascendente. Las especies de cada sitio, unidas por una línea, se disponen en orden decreciente de abundancia relativa; la distancia vertical entre las mismas expresa el valor del logaritmo en base 10 de su abundancia. Así es posible visualizar el número de especies, su identidad específica y la dominancia o rareza de cada una de ellas en cada sitio.
ResultadosEl esfuerzo total de muestreo fue de 12 146 trampasnoche para los micromamíferos terrestres y de 10 656 metros-horas-red para los murciélagos (Cuadro 1). Se capturaron 2 173 individuos de micromamíferos pertenecientes a 48 especies de 25 géneros y 7 familias. Esto incluye 2 especies de marsupiales (1 género y 1 familia), 14 especies de murciélagos (9 y 3) y 23 especies de roedores (15 y 4; Cuadro 2). A continuación se detallan los hallazgos de los muestreos por transecto.
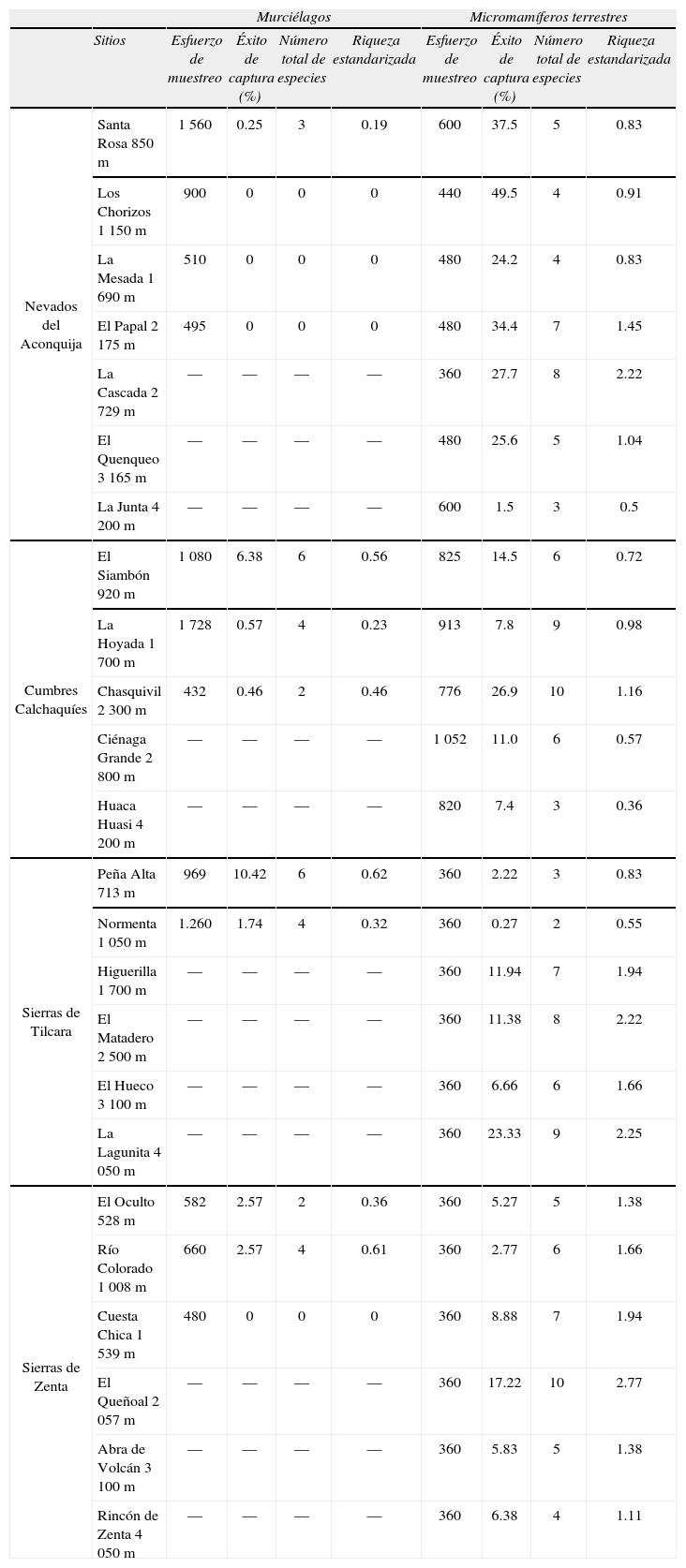
Esfuerzo de muestreo total de cada sitio, éxito de captura estandarizado expresado en porcentaje por cada 100 metros horas/red para murciélagos o cada 100 trampas noche para micromamíferos terrestres, el número total de especies registradas, riqueza estandarizada de especies por cada 100 metros horas/red para murciélagos y por cada 360 trampas noche para terrestres. Los guiones significan que no se realizó muestreo
| Murciélagos | Micromamíferos terrestres | ||||||||
| Sitios | Esfuerzo de muestreo | Éxito de captura (%) | Número total de especies | Riqueza estandarizada | Esfuerzo de muestreo | Éxito de captura (%) | Número total de especies | Riqueza estandarizada | |
| Nevados del Aconquija | Santa Rosa 850m | 1 560 | 0.25 | 3 | 0.19 | 600 | 37.5 | 5 | 0.83 |
| Los Chorizos 1 150m | 900 | 0 | 0 | 0 | 440 | 49.5 | 4 | 0.91 | |
| La Mesada 1 690m | 510 | 0 | 0 | 0 | 480 | 24.2 | 4 | 0.83 | |
| El Papal 2 175m | 495 | 0 | 0 | 0 | 480 | 34.4 | 7 | 1.45 | |
| La Cascada 2 729m | — | — | — | — | 360 | 27.7 | 8 | 2.22 | |
| El Quenqueo 3 165m | — | — | — | — | 480 | 25.6 | 5 | 1.04 | |
| La Junta 4 200m | — | — | — | — | 600 | 1.5 | 3 | 0.5 | |
| Cumbres Calchaquíes | El Siambón 920m | 1 080 | 6.38 | 6 | 0.56 | 825 | 14.5 | 6 | 0.72 |
| La Hoyada 1 700m | 1 728 | 0.57 | 4 | 0.23 | 913 | 7.8 | 9 | 0.98 | |
| Chasquivil 2 300m | 432 | 0.46 | 2 | 0.46 | 776 | 26.9 | 10 | 1.16 | |
| Ciénaga Grande 2 800m | — | — | — | — | 1 052 | 11.0 | 6 | 0.57 | |
| Huaca Huasi 4 200m | — | — | — | — | 820 | 7.4 | 3 | 0.36 | |
| Sierras de Tilcara | Peña Alta 713m | 969 | 10.42 | 6 | 0.62 | 360 | 2.22 | 3 | 0.83 |
| Normenta 1 050m | 1.260 | 1.74 | 4 | 0.32 | 360 | 0.27 | 2 | 0.55 | |
| Higuerilla 1 700m | — | — | — | — | 360 | 11.94 | 7 | 1.94 | |
| El Matadero 2 500m | — | — | — | — | 360 | 11.38 | 8 | 2.22 | |
| El Hueco 3 100m | — | — | — | — | 360 | 6.66 | 6 | 1.66 | |
| La Lagunita 4 050m | — | — | — | — | 360 | 23.33 | 9 | 2.25 | |
| Sierras de Zenta | El Oculto 528m | 582 | 2.57 | 2 | 0.36 | 360 | 5.27 | 5 | 1.38 |
| Río Colorado 1 008m | 660 | 2.57 | 4 | 0.61 | 360 | 2.77 | 6 | 1.66 | |
| Cuesta Chica 1 539m | 480 | 0 | 0 | 0 | 360 | 8.88 | 7 | 1.94 | |
| El Queñoal 2 057m | — | — | — | — | 360 | 17.22 | 10 | 2.77 | |
| Abra de Volcán 3 100m | — | — | — | — | 360 | 5.83 | 5 | 1.38 | |
| Rincón de Zenta 4 050m | — | — | — | — | 360 | 6.38 | 4 | 1.11 | |
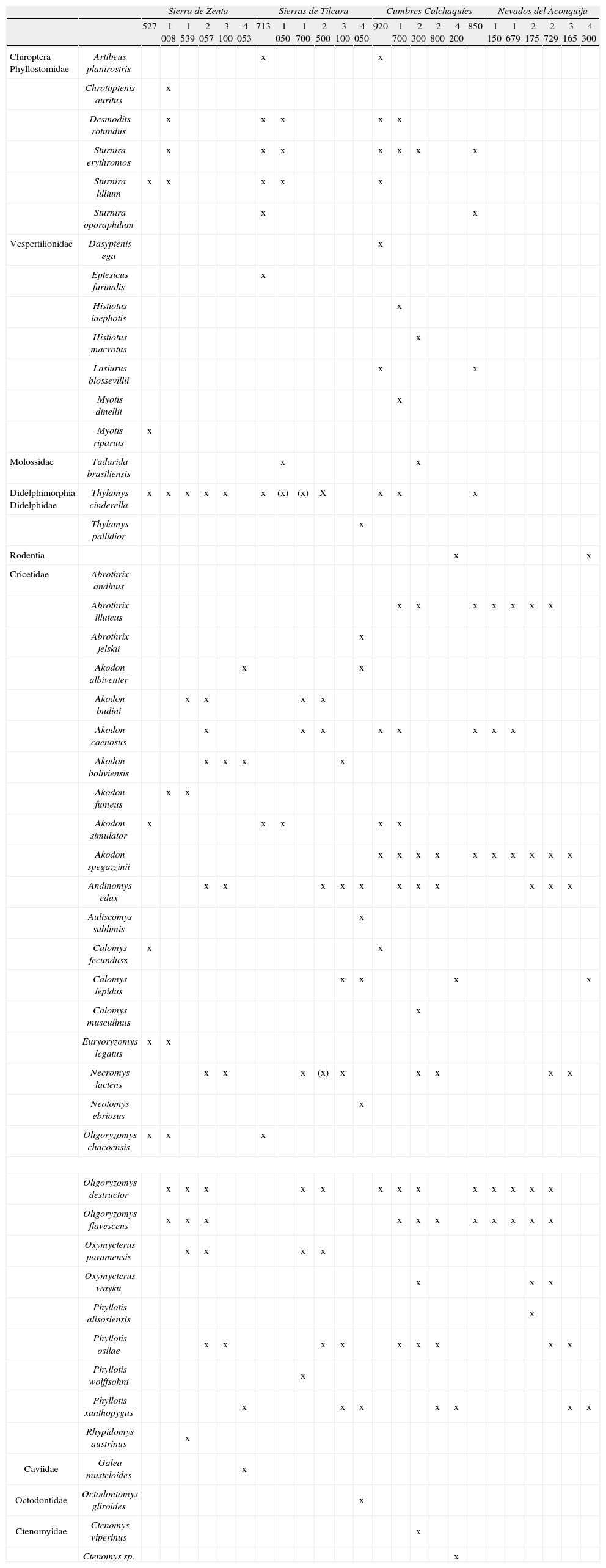
Presencia de micromamíferos registrados, por sitio, en los 4 transectos altitudinales. Las cruces ente paréntesis indican presencias inferidas, en virtud de la ocurrencia comprobada de esas especies en puntos altitudinales superiores e inferiores
| Sierra de Zenta | Sierras de Tilcara | Cumbres Calchaquíes | Nevados del Aconquija | ||||||||||||||||||||||
| 527 | 1 008 | 1 539 | 2 057 | 3 100 | 4 053 | 713 | 1 050 | 1 700 | 2 500 | 3 100 | 4 050 | 920 | 1 700 | 2 300 | 2 800 | 4 200 | 850 | 1 150 | 1 679 | 2 175 | 2 729 | 3 165 | 4 300 | ||
| Chiroptera Phyllostomidae | Artibeus planirostris | x | x | ||||||||||||||||||||||
| Chrotoptenis auritus | x | ||||||||||||||||||||||||
| Desmodits rotundus | x | x | x | x | x | ||||||||||||||||||||
| Sturnira erythromos | x | x | x | x | x | x | x | ||||||||||||||||||
| Sturnira lillium | x | x | x | x | x | ||||||||||||||||||||
| Sturnira oporaphilum | x | x | |||||||||||||||||||||||
| Vespertilionidae | Dasyptenis ega | x | |||||||||||||||||||||||
| Eptesicus furinalis | x | ||||||||||||||||||||||||
| Histiotus laephotis | x | ||||||||||||||||||||||||
| Histiotus macrotus | x | ||||||||||||||||||||||||
| Lasiurus blossevillii | x | x | |||||||||||||||||||||||
| Myotis dinellii | x | ||||||||||||||||||||||||
| Myotis riparius | x | ||||||||||||||||||||||||
| Molossidae | Tadarida brasiliensis | x | x | ||||||||||||||||||||||
| Didelphimorphia Didelphidae | Thylamys cinderella | x | x | x | x | x | x | (x) | (x) | X | x | x | x | ||||||||||||
| Thylamys pallidior | x | ||||||||||||||||||||||||
| Rodentia | x | x | |||||||||||||||||||||||
| Cricetidae | Abrothrix andinus | ||||||||||||||||||||||||
| Abrothrix illuteus | x | x | x | x | x | x | x | ||||||||||||||||||
| Abrothrix jelskii | x | ||||||||||||||||||||||||
| Akodon albiventer | x | x | |||||||||||||||||||||||
| Akodon budini | x | x | x | x | |||||||||||||||||||||
| Akodon caenosus | x | x | x | x | x | x | x | x | |||||||||||||||||
| Akodon boliviensis | x | x | x | x | |||||||||||||||||||||
| Akodon fumeus | x | x | |||||||||||||||||||||||
| Akodon simulator | x | x | x | x | x | ||||||||||||||||||||
| Akodon spegazzinii | x | x | x | x | x | x | x | x | x | x | |||||||||||||||
| Andinomys edax | x | x | x | x | x | x | x | x | x | x | x | ||||||||||||||
| Auliscomys sublimis | x | ||||||||||||||||||||||||
| Calomys fecundusx | x | x | |||||||||||||||||||||||
| Calomys lepidus | x | x | x | x | |||||||||||||||||||||
| Calomys musculinus | x | ||||||||||||||||||||||||
| Euryoryzomys legatus | x | x | |||||||||||||||||||||||
| Necromys lactens | x | x | x | (x) | x | x | x | x | x | ||||||||||||||||
| Neotomys ebriosus | x | ||||||||||||||||||||||||
| Oligoryzomys chacoensis | x | x | x | ||||||||||||||||||||||
| Oligoryzomys destructor | x | x | x | x | x | x | x | x | x | x | x | x | x | ||||||||||||
| Oligoryzomys flavescens | x | x | x | x | x | x | x | x | x | x | x | ||||||||||||||
| Oxymycterus paramensis | x | x | x | x | |||||||||||||||||||||
| Oxymycterus wayku | x | x | x | ||||||||||||||||||||||
| Phyllotis alisosiensis | x | ||||||||||||||||||||||||
| Phyllotis osilae | x | x | x | x | x | x | x | x | x | ||||||||||||||||
| Phyllotis wolffsohni | x | ||||||||||||||||||||||||
| Phyllotis xanthopygus | x | x | x | x | x | x | x | ||||||||||||||||||
| Rhypidomys austrinus | x | ||||||||||||||||||||||||
| Caviidae | Galea musteloides | x | |||||||||||||||||||||||
| Octodontidae | Octodontomys gliroides | x | |||||||||||||||||||||||
| Ctenomyidae | Ctenomys viperinus | x | |||||||||||||||||||||||
| Ctenomys sp. | x | ||||||||||||||||||||||||
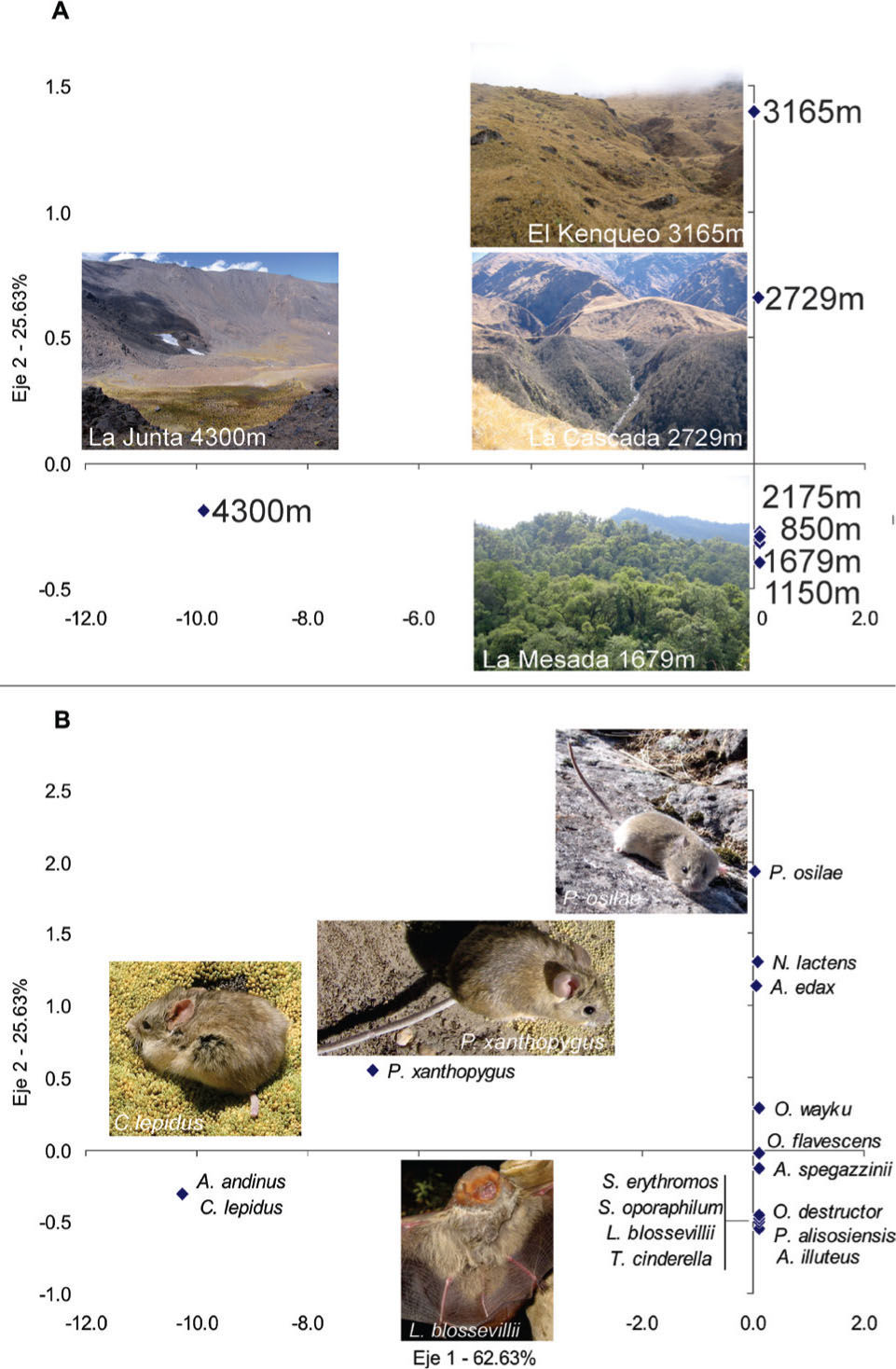
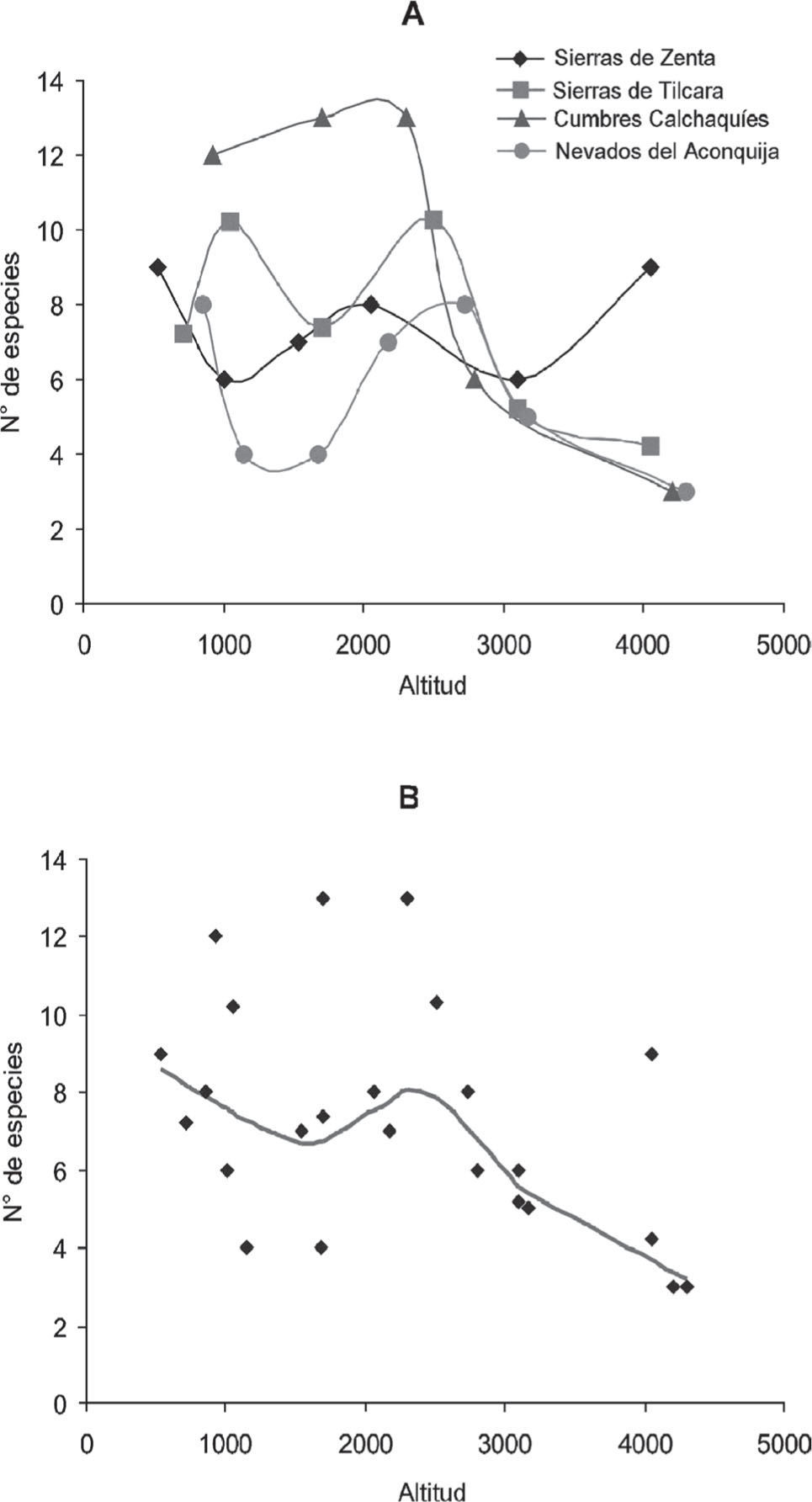
Se registraron 16 especies de micromamíferos (Cuadro 2). La variación de la riqueza de especies fue bimodal, con un pico a 850 y otro a 2 700m de altitud. Estos picos de riqueza difieren en la composición de especies a nivel de orden, con gran aporte de murciélagos y marsupiales a 850m, pero solamente roedores a 2 700m. Los índices de recambio de especies, βw y βsim, alcanzan sus valores máximos entre los 2 sitios de mayor altura: 3 165 y 4 200m (Cuadro 3). El AC también revela una marcada división entre la composición de especies de la cumbre y las laderas húmedas orientales. Sobre el eje 1 (62% de la variación total en las comunidades de micromamíferos), el sitio de mayor altitud (4 300m) se ubica en el lado positivo, mientras que los restantes sitios lo hacen en el extremo negativo (Fig. 2a). Las especies Abrothrix andinus y Calomys lepidus caracterizan a las cumbres del Aconquija, junto con Phyllotis xanthopygus, la cual fue capturada también en los pastizales de neblina a 3 165m; de ahí su posición intermedia entre los 2 grupos de especies sobre el eje 1 (Fig. 2b). El eje 2 (25% de la variación remanente) describe el gradiente altitudinal desde las selvas hasta los pastizales (Fig. 2a). La correspondencia de las especies denota presencia exclusiva y alta abundancia de Phyllotis osilae, Necromys lactens y Andinomys edax en los pastizales a 3 165m y la disminución en abundancia o ausencia de especies como Abrothix illuteus, Oligoryzomys destructor y O.flavescens, características de los bosques y de selvas de menor altitud (Fig. 2b).
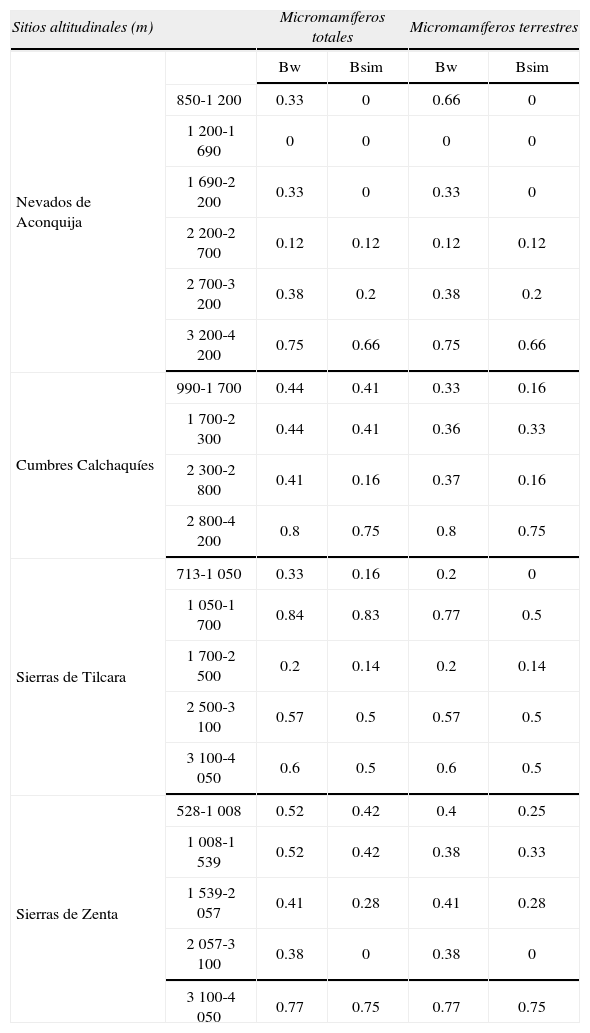
Valores de índices de recambio de especies Bw: índice de Whittaker y Bsim: índice de Simpson
| Sitios altitudinales (m) | Micromamíferos totales | Micromamíferos terrestres | |||
| Nevados de Aconquija | Bw | Bsim | Bw | Bsim | |
| 850-1 200 | 0.33 | 0 | 0.66 | 0 | |
| 1 200-1 690 | 0 | 0 | 0 | 0 | |
| 1 690-2 200 | 0.33 | 0 | 0.33 | 0 | |
| 2 200-2 700 | 0.12 | 0.12 | 0.12 | 0.12 | |
| 2 700-3 200 | 0.38 | 0.2 | 0.38 | 0.2 | |
| 3 200-4 200 | 0.75 | 0.66 | 0.75 | 0.66 | |
| Cumbres Calchaquíes | 990-1 700 | 0.44 | 0.41 | 0.33 | 0.16 |
| 1 700-2 300 | 0.44 | 0.41 | 0.36 | 0.33 | |
| 2 300-2 800 | 0.41 | 0.16 | 0.37 | 0.16 | |
| 2 800-4 200 | 0.8 | 0.75 | 0.8 | 0.75 | |
| Sierras de Tilcara | 713-1 050 | 0.33 | 0.16 | 0.2 | 0 |
| 1 050-1 700 | 0.84 | 0.83 | 0.77 | 0.5 | |
| 1 700-2 500 | 0.2 | 0.14 | 0.2 | 0.14 | |
| 2 500-3 100 | 0.57 | 0.5 | 0.57 | 0.5 | |
| 3 100-4 050 | 0.6 | 0.5 | 0.6 | 0.5 | |
| Sierras de Zenta | 528-1 008 | 0.52 | 0.42 | 0.4 | 0.25 |
| 1 008-1 539 | 0.52 | 0.42 | 0.38 | 0.33 | |
| 1 539-2 057 | 0.41 | 0.28 | 0.41 | 0.28 | |
| 2 057-3 100 | 0.38 | 0 | 0.38 | 0 | |
| 3 100-4 050 | 0.77 | 0.75 | 0.77 | 0.75 | |
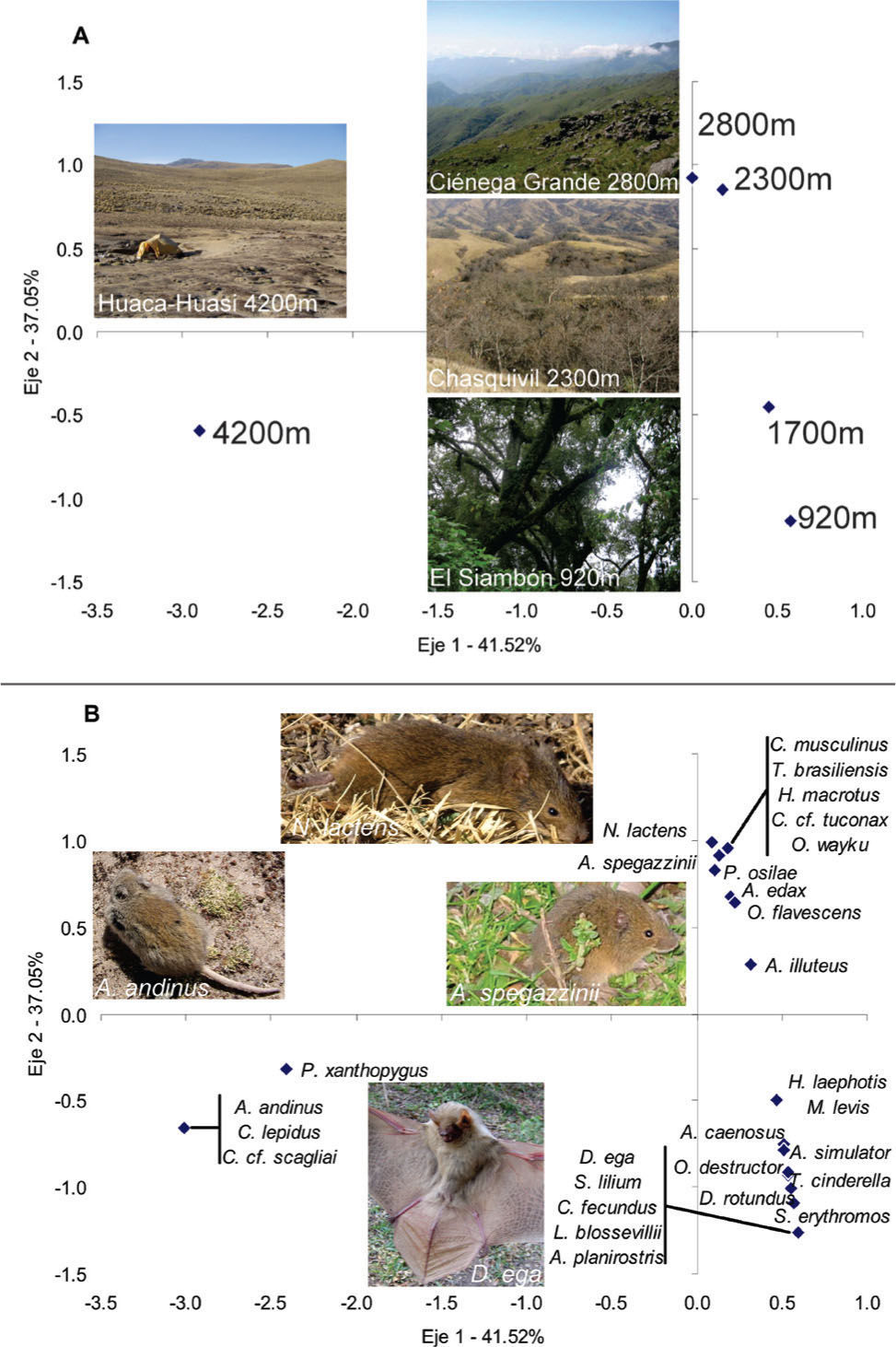
Se documentaron 27 especies en este transecto. La máxima riqueza de especies de micromamíferos se registró a 1 700m con 13 especies (8 de roedores, 4 de murciélagos y 1 marsupial) (Cuadro 2). Los 2 índices de recambio de especies, βw y βsim, mostraron una variación similar con la altitud con sus máximos valores entre 2 800 y 4 200βm (Cuadro 3). El AC diferencia claramente 3 grupos de sitios y especies. La mayor variación, representada en el eje 1 (41%), ordena el sitio de 4 200m (Fig. 3a) junto con las especies que lo caracterizan, A. andinus, C. lepidus y P. xanthopygus en el lado positivo del eje (Fig. 3b). El eje 2 (37%) define 2 grupos de sitios y especies de las laderas orientales de las cumbres Calchaquíes. Sobre el lado positivo se ordenan los sitios y especies de bosque montano (2 300 y 2 800m), mientras que en el lado negativo se ordenan los sitios y especies de selva montana (1 700 y 920m) (Figs. 2a, b).
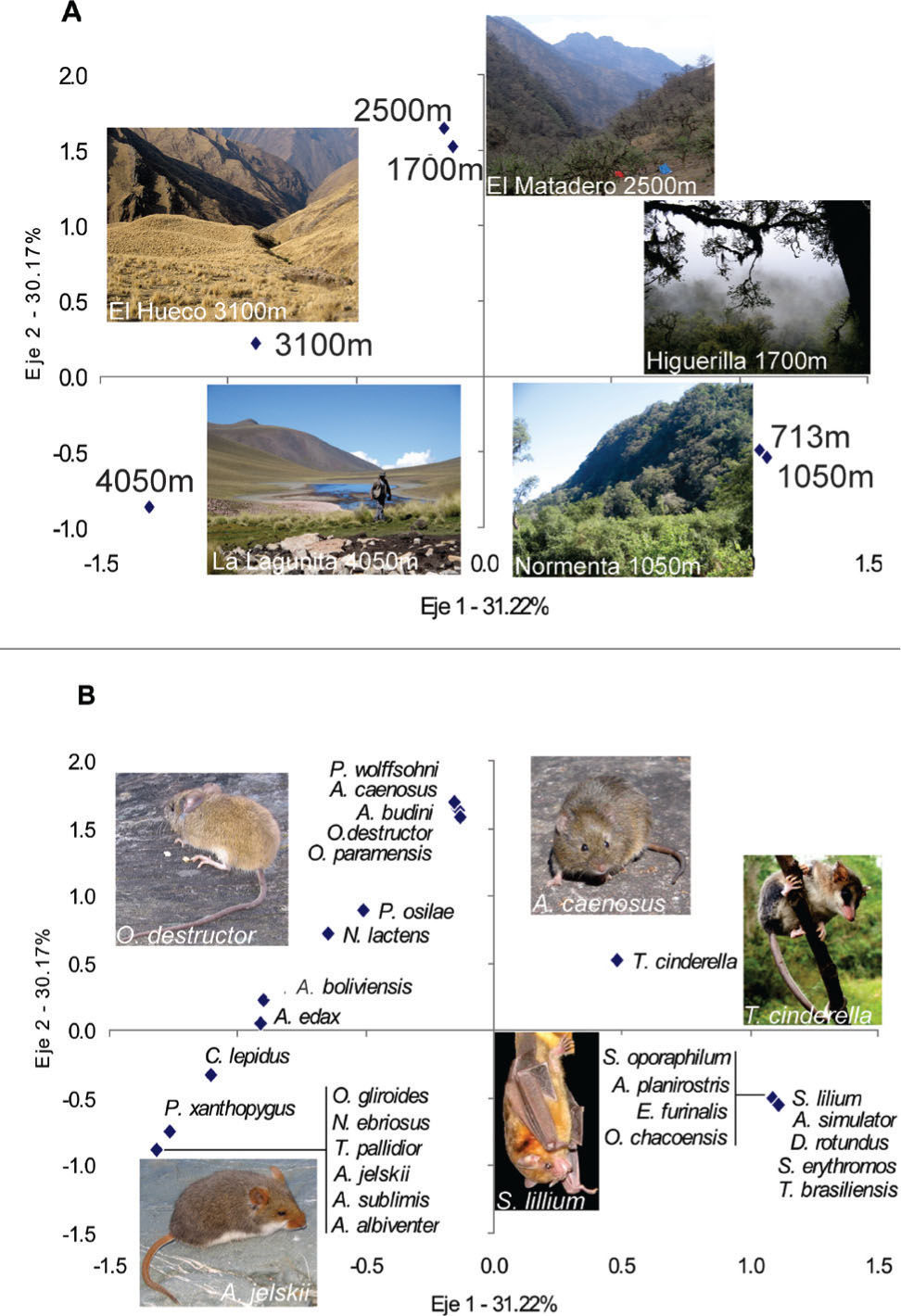
Sierras de TilcaraSe registraron 27 especies de micromamíferos (Cuadro 2). La riqueza de especies mostró 2 picos con 9 especies en los extremos del gradiente altitudinal, a 700 y 4 000m de altura. Los 2 picos difieren en la composición de especies, a 700m dominan los murciélagos, mientras que a 4 000m, el pico de riqueza está compuesto por 8 especies de roedores y 1 marsupial. Existe un pico de riqueza un poco menor (8 especies) en los bosque montano a 2 500m, compuesto principalmente por roedores. Los 2 índices de recambio de especies describen idéntica variación en la diversidad beta entre sitios a lo largo del gradiente altitudinal con sus valores más altos a 1 050 y luego a 4 050m. En el AC, el ordenamiento de los sitios sobre el eje eje 1 (31% de variación explicada) describe claramente el propio gradiente altitudinal. Sobre este eje, 2 sitios de baja altitud (713 y 1 050m) con dominancia de murciélagos se ubican en el extremo positivo (Figs. 4a, b). Dos sitios de altitudes intermedias (1 700 y 2 500m) son caracterizados por las especies de roedores típicos de bosques y selvas montanas (Figs. 4a, b). A 4 050m, en el extremo negativo del eje, 6 especies son exclusivas de las estepas altoandinas (Octodontomys gliroides, Neotomys ebriosus, Thylamys pallidior, Abrothrix jelskii, Auliscomys sublimis y Akodon albiventer). En el pastizal de neblina a 3 100m, las especies son compartidas con niveles superiores e inferiores, describiendo un claro gradiente de ocurrencia y abundancia (Fig. 4b) y ubicando al sitio en una posición intermedia (Fig. 4a).
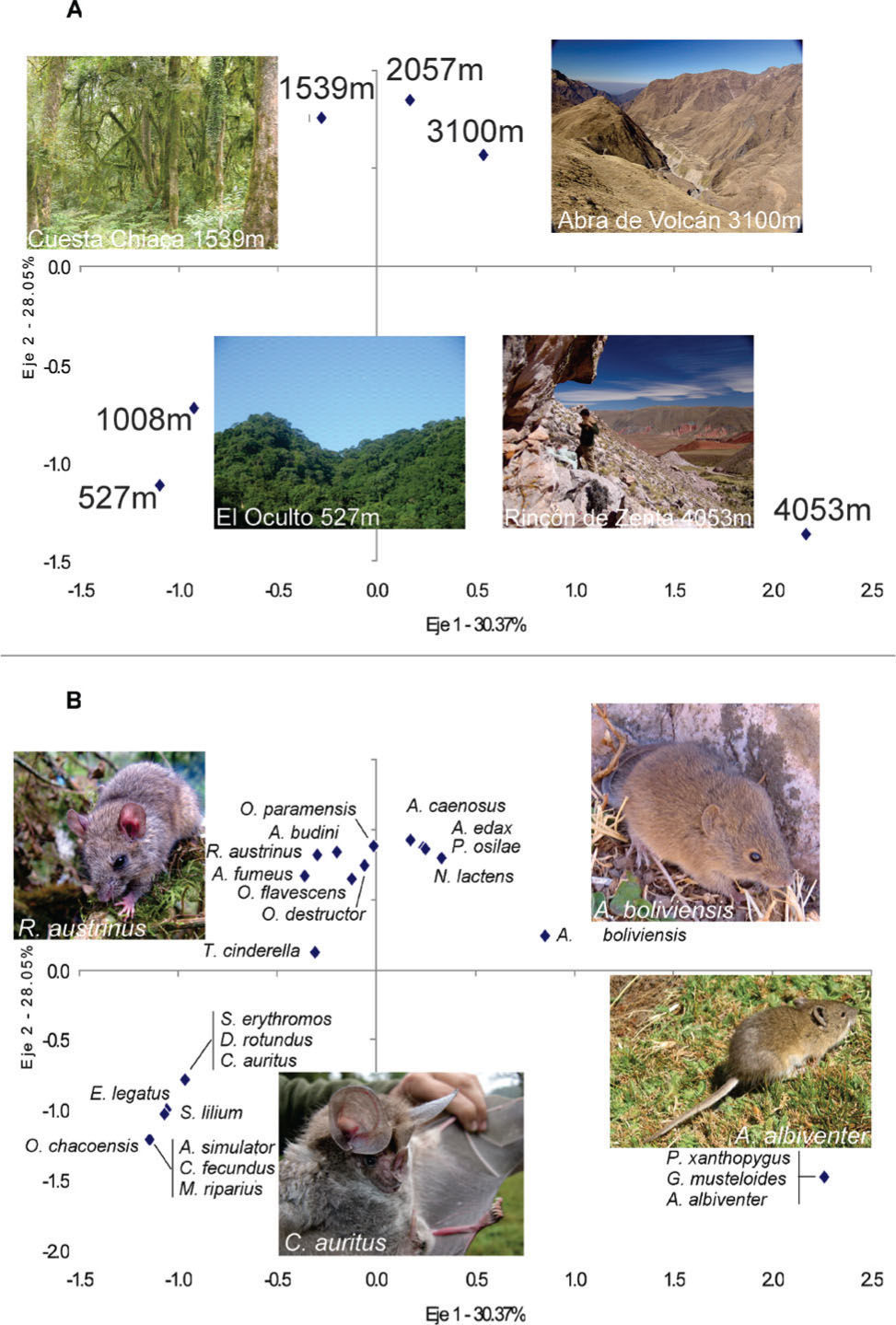
Sierras de ZentaSe registraron 24 especies en este transecto (Cuadro 2). La variación de la riqueza de especies fue bimodal con 2 picos de 10 especies, 1 a 1 008m (5 roedores, 4 murciélagos y 1 marsupial) y otro a 2 050m (9 roedores y 1 marsupial). Los 2 índices de diversidad beta tienen sus máximos entre los 2 sitios de mayor altitud, 3 100 y 4 053m (Cuadro 3). El AC muestra 3 grupos bien definidos de sitios y las especies a lo largo del eje 1 (30%) (Fig. 5). El de mayor altitud (4 050m) en el lado positivo del eje 1, los de menor altitud (527 y 1 008m) sobre el extremo negativo del eje, y los de altitudes intermedias próximos al centroide (1 539, 2 057 y 3 100m) (Figs. 5a, b). Sólo 2 especies se encuentran en posiciones intermedias: Akodon boliviensis entre el sitio a 4 053m y los sitios de elevaciones intermedias y Thylamys cinderella entre los sitios de menor e intermedias altitudes (Fig. 5b).
Los gráficos de rango-abundancia permiten visualizar la estructura comunitaria en cada sitio de estudio, así como los cambios en la riqueza, composición y dominancia de las especies entre los sitios de cada transecto altitudinal estudiada (Fig. 6). El rasgo más destacable de las comunidades de micromamíferos en los nevados del Aconquija es la dominancia de Akodon spegazzinii en cada sitio donde fue capturado en este transecto. Su abundancia relativa supera ampliamente a la de las demás especies combinadas en todos los sitios con formación boscosa, entre 850 y 2 700m. La composición de especies de roedores permanece constante entre los 850 y 1 679m. Por encima de 2 000m la composición de la comunidad de roedores se ve alterada por la aparición de especies características de los bosques montanos (e. g. A. edax, P. osilae, Oxymycterus wayku), acentuándose a 2 700m. En el pastizal de neblina a 3 165m las formaciones boscosas desaparecen y, con ellas, todas las especies características de las comunidades de roedores de las selvas montanas, exceptuando a A. spegazzinii que permanece dominante, pero con una abundancia relativa similar a la de P. osilae. A 4 300m la comunidad de micromamíferos cambia casi completamente su composición específica, empobreciéndose notablemente en el número de especies.
En cumbres Calchaquíes, a diferencia de los nevados del Aconquija, existe una clara sucesión en las especies de roedores que son dominantes en los distintos sitios altitudinales (Fig. 6). En las comunidades de los bosques montanos, a 2 300m, es notable la dominancia de A. spegazzinii, siendo raro a menor altura en las selvas montanas. De forma similar a lo que sucede en nevados del Aconquija, por encima de la línea superior del bosque, se pierden muchas especies y la comunidad de micromamíferos queda caracterizada principalmente por la dominancia conjunta de A. spegazzinii y P. osilae. Igualmente, existe un abrupto cambio de composición específica y caída en la riqueza entre los sitios de pastizales de neblina de alrededor de 3 000m y los de estepas altoandinas de alrededor de 4 000m en ambos transectos (Fig. 6).
En sierras de Tilcara las comunidades de micromamíferos de selvas pedemontanas (713 y 1 008m) están caracterizadas por la dominancia de una especie de murciélago (Sturnira lilium). Ascendiendo hacia los sitios de selva montana (1 700m) y bosque montano a 2 500m, la comunidad de micromamíferos pasa a estar dominada por los roedores Akodon budini y O. destructor (Fig. 6). Como sucede en los transectos del sur previamente descritos, muchas especies desaparecen por encima de la línea superior del bosque. Igualmente, las especies típicas de los pastizales de neblina, P. osilae, N. lactens y A. edax se encuentran presentes a 3 100m en las sierras de Tilcara, pero aquí domina A. boliviensis. Entre los pastizales de neblina a 3 100m y las estepas altoandinas a 4 000m, existe un marcado recambio de especies con dominancia de A. albiventer en la cumbre.
En sierras de Zenta, al igual que en las sierras de Tilcara, los 2 sitios de menor altitud están dominados por S. lilium. En la selva montana, superior a 1 500m existe un marcada dominancia del pequeño roedor Akodon fumeus, seguido de A. budini; ambas caracterizando el extremo norte de las yungas de Argentina. En los bosques montanos a 2 057m la comunidad es dominada por P. osilae, con cierta equitatividad en las restantes como producto de la aparición de especies típicas de los pastizales de neblina (N. lactens, A. edax y A. boliviensis) en frecuencia similar a especies características de los bosques (O. destructor, O. flavescens y Oxymycterus paramensis). Hacia los pastizales de neblina la marcada pérdida de especies con respecto a las formaciones boscosas inferiores es ya una característica general de las yungas Argentinas. A 3 100m la comunidad de los pastizales de neblina es dominada por A. boliviensis. Como ocurre en todos los transectos altitudinales estudiados, existe un abrupto cambio en la composición de especies entre pastizales de neblina y estepas altoandinas de las cumbres.
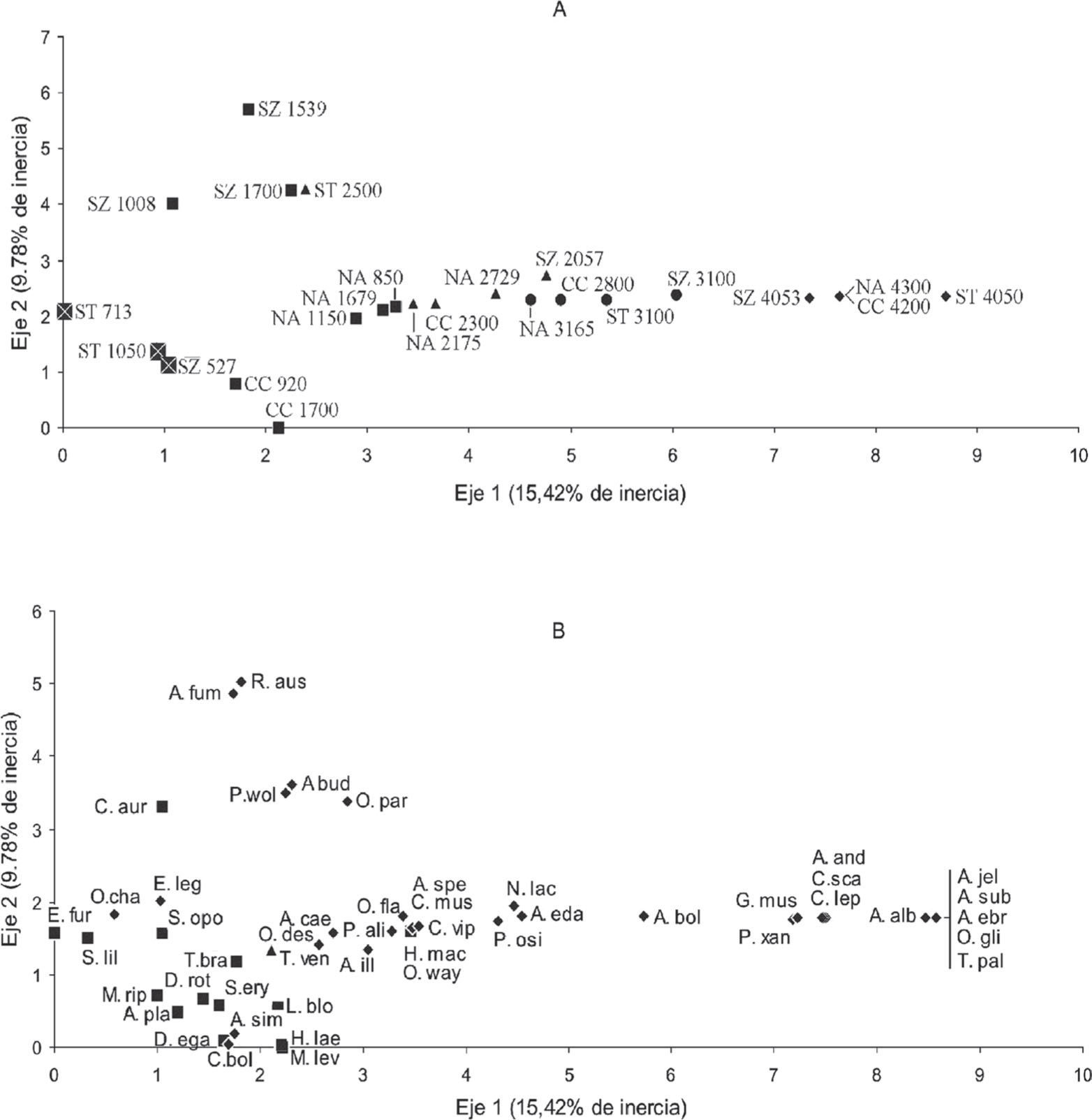
El ACD aplicado a una matriz de frecuencia de las 48 especies capturadas en los 24 sitios de estudio, indica que la altitud es la principal fuente de variación en la composición específica de las comunidades de micromamíferos, pese a las diferencias latitudinales existentes entre los transectos. El ordenamiento de los sitios y las especies en el eje 1 del ACD (15.42%), claramente reflejan el propio gradiente altitudinal (Fig. 7). Es evidente que los sitios de mayor altitud de los 4 transectos se ubican en el extremo derecho del eje 1 (Fig. 11a). El sitio a 4 050m en sierras de Tilcara (ST 4050) se diferencia de los otros sitios ubicados a más de 4 000m de altura por la presencia exclusiva de 5 especies (N. ebriosus, O. gliroides, A. sublimis, A. jelskii y T. pallidior) y por la alta abundancia de A. albiventer (Fig. 7b). Inmediatamente se observa un grupo de sitios que corresponden a los pastizales de neblina de los 4 transectos altitudinales (NA 3165, CC 2800, ST 3100 y SZ 3100) y 2 sitios correspondientes a bosques montanos, de las sierras de Zenta y de nevados del Aconquija (SZ 2057 y NA 2700) (Fig. 11a). Se encontró una estrecha asociación entre este grupo de sitios y 3 especies en particular (A. edax, P. osilae y N. lactens) (Fig. 7b). Nótese que A. boliviensis se encuentra en una posición intermedia en el grupo de especies que caracteriza a los sitios de más de 4 000m de altura y a los de pastizales de alrededor de 3 000m (Fig. 7b). Esto se debe, en parte, a que esta especie fue capturada a 4 050m en las sierras de Zenta, pero fundamentalmente a que sólo se encuentra en los transectos del sector norte del área de estudio, sierras de Tilcara y sierras de Zenta, lo que determina una leve, pero notable separación de los 2 sitios de pastizal a 3 100m de los transectos septentrionales (ST 3100 y SZ 3100), respecto al de los transectos australes (NA 3165 y CC 2800) (Fig. 7a). El siguiente grupo, prosiguiendo desde la izquierda por el eje 1, está conformado por sitios de bosque montano (triángulos) y elvas montanas (cuadrados), pero solamente de los transectos australes, es decir, nevados del Aconquija y cumbres Calchaquíes. Es en este punto donde el ACD muestra cierta segregación de sitios y especies sobre el eje 2 (9.7%). El eje 2 diferencia básicamente 2 grupos de sitios. Por un lado, los previamente mencionados de bosques y selvas de los transectos australes (NA 2175, CC 2300, NA 850, NA 1150, NA 1679), en estrecha asociación con las especies A. spegazzinii, O. wayku, Phyllotis alisosiensis, A. illuteus, Calomys musculinus, O. flavescens y Akodon caenosus (Fig. 7b). Por otro lado, se agrupan los sitios correspondientes a bosques y selvas montanas de los transectos septentrionales, sierras de Tilcara y sierras de Zenta (SZ 1539, SZ 1008, SZ 1700 y ST 2500). Este grupo de sitios se encuentra en estrecha asociación con especies más frecuentes en las regiones más septentrionales de las yungas, como Chrotopterusauritus y O. paramensis, y con roedores que habitan exclusivamente en las selvas del extremo norte de las yungas de Argentina como Rhipidomys austrinus, A. fumeus, A. budini y Phyllotis wolffsohni (Fig. 7b). Los sitios de menor altitud de los 4 transectos altitudinales, están en estrecha correspondencia con la mayor parte de las especies de murciélagos y con roedores como Akodon simulator y Calomys fecundus, frecuentes habitantes de las selvas de yungas en toda su extensión latitudinal (Fig. 7).
Diagrama de ordenamiento del Análisis de Correspondencias Detendenciado entre los 24 sitios de estudio y las 48 especies registradas en los 4 transectos altitudinales. El ordenamiento de los sitios y las especies se muestra por separado. A, ordenamiento de los sitios: los sitios de estudio se identifican mediante la abreviatura del nombre del transecto altitudinal seguida de la altitud correspondiente (SZ: Sierras de Zenta, ST: Sierras de Tilcara, CC: Cumbres Calchaquíes, NA: Nevados del Aconquija). Los rombos indican sitios de estudio ubicados en las estepas altoandinas, los círculos indican sitios en pastizales de altura, los triángulos indican bosques montanos, los cuadrados indican selvas montanas, los cuadrados con cruz indican selvas Pedemontanas; B, ordenamiento de las especies: los rombos indican especies de roedores, los cuadrados especies de murciélagos y los triángulos especies de marsupiales. El nombre de las especies se abrevia con la primera letra del nombre genérico, seguida de las 3 primeras letras del nombre específico.
El presente estudio de riqueza, abundancia, composición y recambio de especies de micromamíferos en localidades puntuales priorizó la escala espacial a costa de la escala temporal. Los sitios de estudio a lo largo de cada transecto fueron visitados sólo una vez; si bien, se intentó que en todos fuera en época invernal y minimizar el tiempo transcurrido entre los muestreos en sitios altitudinales sucesivos, al menos un sitio en cada transecto fue estudiado en una estación del año diferente a los restantes. A pesar de este esquema de muestreo, los datos de riqueza, abundancia, recambio y composición de especies obtenidos en los transectos estudiados permiten tanto la descripción, caracterización y comparación de la estructura de las comunidades de micromamíferos como la búsqueda de patrones de variación altitudinal en los diferentes parámetros comunitarios.
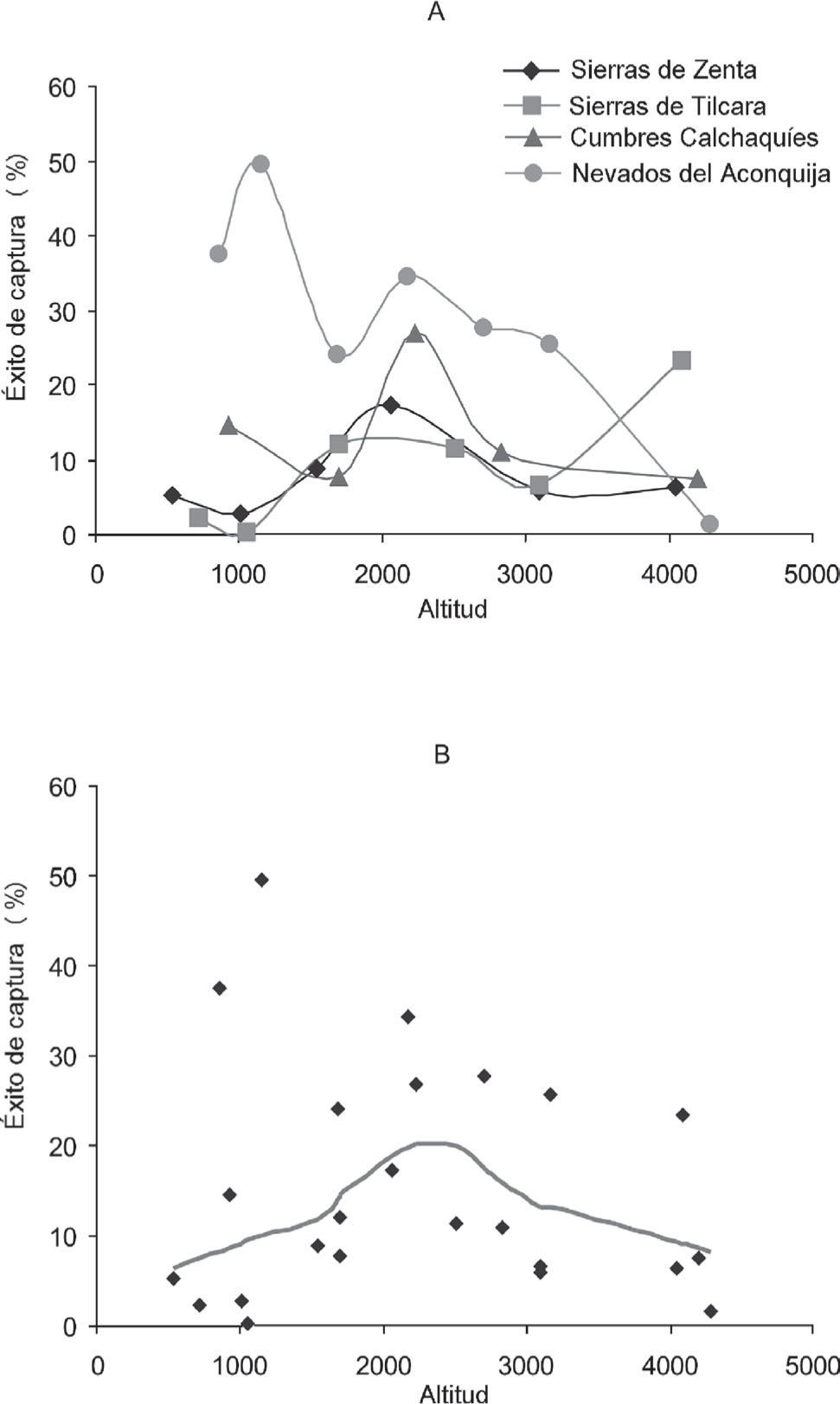
Micromamíferos terrestresÉxito de capturaLos 4 transectos altitudinales no muestran un patrón perfecto en cuanto a las altitudes en las que se registró el máximo éxito de captura. Sólo 2 de ellas, cumbres Calchaquíes y sierras de Zenta, coinciden en la ubicación altitudinal del máximo éxito de captura entre 2 000 y 2 500m. Por el contrario, los otras 2 transectos no sólo difieren en la ubicación altitudinal del máximo éxito de captura, sino que éstos se encuentran en los extremos opuestos de gradiente altitudinal (Fig. 8a). No obstante, un pico secundario de éxito de captura es evidente en altitudes intermedias de ambos transectos (Fig. 8a). Estos 2 picos secundarios se ubican en altitudes alrededor de los 2 000m, poniendo en evidencia lo que quizás es el patrón emergente más importante en cuanto a la relación entre abundancia de micromamíferos terrestres y elevación: los bosques montanos (ca. 2 000m) constituyen un área de elevada productividad en las poblaciones de micromamíferos terrestres. Este enunciado constituye una hipótesis a ser puesta a prueba mediante muestreos más prolongados que los realizados para el presente análisis, e incluyendo comparaciones interestacionales. La relación entre el éxito de captura y la altitud, queda en evidencia cuando se evalúan los datos de los transectos combinados mediante LOWESS (Fig. 8b). Sin embargo, al evaluar la significación estadística se obtiene que la tendencia no sea significativa (Cuadro 4).
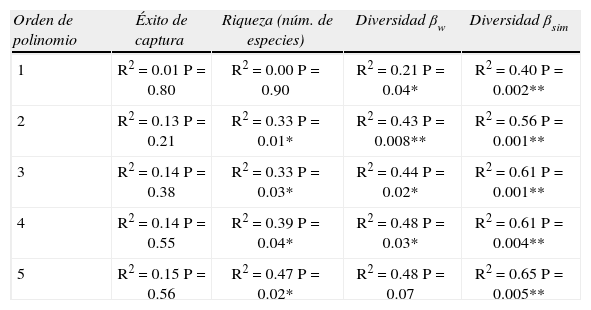
Resultado de las regresiones polimomiales de primero a quinto orden, entre altitud y éxito de captura, riqueza y recambio de especies micromamíferos terrestres. Un asterisco indica que la tendencia es significativa y 2 asteriscos indican que la tendencia es muy significativa. El éxito de captura fue trasformada (raíz cuadrada) para normalizar su distribución
| Orden de polinomio | Éxito de captura | Riqueza (núm. de especies) | Diversidad βw | Diversidad βsim |
| 1 | R2=0.01 P=0.80 | R2=0.00 P=0.90 | R2=0.21 P=0.04* | R2=0.40 P=0.002** |
| 2 | R2=0.13 P=0.21 | R2=0.33 P=0.01* | R2=0.43 P=0.008** | R2=0.56 P=0.001** |
| 3 | R2=0.14 P=0.38 | R2=0.33 P=0.03* | R2=0.44 P=0.02* | R2=0.61 P=0.001** |
| 4 | R2=0.14 P=0.55 | R2=0.39 P=0.04* | R2=0.48 P=0.03* | R2=0.61 P=0.004** |
| 5 | R2=0.15 P=0.56 | R2=0.47 P=0.02* | R2=0.48 P=0.07 | R2=0.65 P=0.005** |
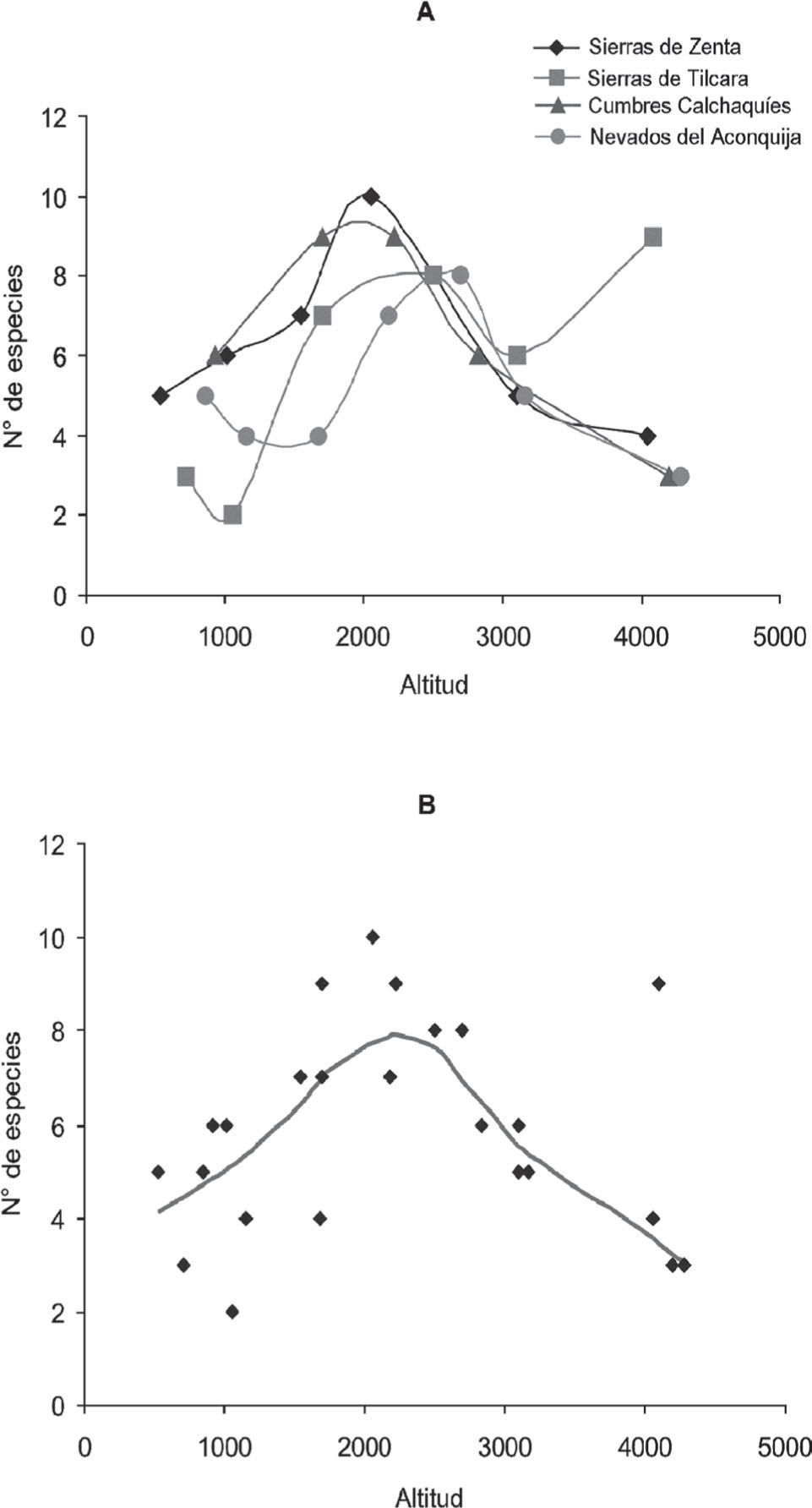
A diferencia de lo que sucede con el éxito de captura, la variación de la riqueza de micromamíferos terrestres revela un claro patrón altitudinal. En 3 de los 4 transectos estudiados, el máximo número de especies se registró en altitudes intermedias entre 1 500 y 2 500m (Fig. 9a). Las sierras de Tilcara es la única en la que la máxima riqueza específica no se observa en altitudes intermedias, sino que, sorprendentemente, el pico se encuentra en las estepas altoandinas a 4 000m de altura. Sin embargo, en este transecto existe un segundo pico de riqueza en los bosques montanos a 2 500m (Fig. 9a). El análisis con LOWESS revela un claro patrón curvilíneo en la variación altitudinal, ubicando el máximo de riqueza, aproximadamente, a 2 200m de altitud. Los resultados del análisis de significancia demuestran que la tendencia es significativa para polinomios de segundo, tercer, cuarto y quinto orden (Cuadro 4). La riqueza de los micromamíferos terrestres se encuentra en estrecha relación con la línea superior de bosque. El pico de riqueza fue vinculado a la heterogeneidad del hábitat, permitiendo la coexistencia de numerosas especies con diferentes requerimientos de hábitat en un punto altitudinal particular (Ferro y Barquez, 2009). En efecto, las especies características de los pastizales de neblina, así como de los bosques y selvas montanas se encuentran juntas en el límite entre bosque y pastizal. Adicionalmente, se registró una alta concertación de endemismos en los bosques montanos que contribuye al pico de riqueza en altitudes intermedias (Ferro, 2010; 2013).
Recambio de especiesLos 2 índices de recambio de especies mostraron un patrón muy evidente con altos valores a mayores elevaciones, cabalmente sintetizado mediante la utilización LOWESS para evaluar la tendencia general en los valores de diversidad beta en las 4 transectos combinadas (Fig. 10). La existencia innegable de un marcado incremento en la diversidad beta con la altitud, sugiere una relación lineal entre altitud y recambio de especies. De hecho. una regresión lineal simple es significativa para ambos índices, pero las regresiones polinómicas también lo son, aumento del coeficiente de regresión y del nivel de significación (Cuadro 4). Los picos de recambio de especies indican una diferenciación en composición de especies de las comunidades de micromamíferos entre un nivel altitudinal y otro. El marcado recambio de especies a 3 500m ha sido vinculado con la transición biogeográfica entre la región Neotropical y la Andina (sensuMorrone, 2002, 2006) proponiéndose los 3 500m como el límite altitudinal entre ambas regiones en los Andes del noroeste Argentino (Ferro, 2013).
Variación altitudinal en los valores de los índices de recambio de especies de micromamíferos terrestres. A, índice de Whittaker para los transectos individuales; B, índice de Simpson para los transectos altitudinales; C, índice de Whittaker para los transectos combinados, línea de tendencia ajustada mediante LOWESS; D, índice de Simpson para las transectos combinadas, línea de tendencia ajustada mediante LOWESS.
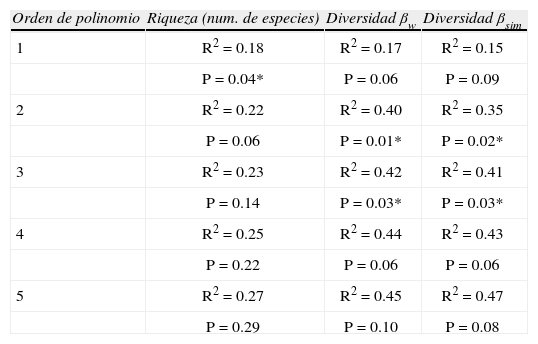
El claro patrón de máxima riqueza en altitudes intermedias obtenido para los micromamíferos terrestres es oscurecido cuando se suman los murciélagos al análisis (Fig. 11a). Tres de los 4 transectos muestran más de un pico de riqueza específica, en general, 1 en altitudes bajas y otro en altitudes medias. El análisis de los datos combinados, mediante LOWESS, revela un descenso de la riqueza específica de micromamíferos hasta 1 700m y un pico secundario, aproximadamente a 2 300m. El análisis de regresión polinomial no detecta una tendencia significativa en la variación altitudinal de la riqueza de especies para una función cuadrática o de orden superior, pero sí una caída lineal en el número de especies (Cuadro 5). Los 2 grandes grupos de micromamíferos estudiados, murciélagos y roedores, generan patrones diferentes de variación altitudinal si son tratados en conjunto o por separado. Los murciélagos muestran una caída lineal tanto de riqueza como de abundancia con la altitud, mientras en los roedores la tendencia es curvilínea con un pico en altitudes intermedias. Esto estaría indicando que la historia evolutiva de los grupos naturales tiene mayor peso en la distribución de sus especies que los factores físicos, climáticos y ambientales. Sin embargo, es importante destacar que los murciélagos sólo han sido registrados en la mitad inferior del gradiente altitudinal y los intervalos altitudinales utilizados en este estudio pueden producir una visión muy simplificada del verdadero patrón de variación altitudinal en este grupo. Para el estudio de los mismos sería necesario registrar la composición de especies en intervalos altitudinales más pequeños y utilizar mayor diversidad de métodos de registro. Por ejemplo, en todos los sitios de bosque montano (ca. 2 000m) se observaron murciélagos volando, pero fue imposible capturarlos y/o determinar su identidad especifica con los métodos empleados en este estudio.
Resultado de las regresiones polimomiales de primero (lineal) a quinto orden, entre altitud y riqueza e índices de recambio de especies de micromamíferos. Un asterisco indica una tendencia significativa
| Orden de polinomio | Riqueza (num. de especies) | Diversidad βw | Diversidad βsim |
| 1 | R2=0.18 | R2=0.17 | R2=0.15 |
| P=0.04* | P=0.06 | P=0.09 | |
| 2 | R2=0.22 | R2=0.40 | R2=0.35 |
| P=0.06 | P=0.01* | P=0.02* | |
| 3 | R2=0.23 | R2=0.42 | R2=0.41 |
| P=0.14 | P=0.03* | P=0.03* | |
| 4 | R2=0.25 | R2=0.44 | R2=0.43 |
| P=0.22 | P=0.06 | P=0.06 | |
| 5 | R2=0.27 | R2=0.45 | R2=0.47 |
| P=0.29 | P=0.10 | P=0.08 |
Los índices de recambio de especies para los micromamíferos en su conjunto no presentan cambios sustanciales respecto a lo que se describió previamente para micromamíferos terrestres (Fig. 12). Ambos índices muestran una clara tendencia a valores altos en máximas altitudes. Las diferencias con respecto a los micromamíferos terrestres ocurren en los valores de los índices, pero no en la forma en que se relacionan con la altitud. Sin embargo, los cambios en los valores de los índices determinan cambios en la significancia de sus relaciones con la altitud. Para ambos índices de diversidad beta la tendencia fue significativa para funciones cuadráticas y cúbicas (Cuadro 5). Tanto los índices de recambio como el análisis de correspondencia aplicado a los transectos altitudinales individuales, sugieren 3 ensambles de especies a lo largo de este gradiente: un conjunto de tierras bajas, un conjunto de altitudes intermedias y, con mayor diferenciación, los de tierras altas por encima de 3 500m.
Variación altitudinal en los valores de los índices de recambio de especies de micromamíferos. A, índice de Whittaker para los transectos individuales; B, índice de Simpson para los transectos altitudinales; C, índice de Whittaker para los transectos combinadas, línea de tendencia ajustada mediante LOWESS; D, índice de Simpson para los transectos combinadas, línea de tendencia ajustada mediante LOWESS.
Nuestros resultados demuestran la existencia de especies características de los sectores norte y sur del área de estudio y especies características de los diferentes niveles altitudinales. Esto permite caracterizar las faunas de los distintos niveles altitudinales y latitudinales en las yungas de Argentina.
Los rasgos en común de los niveles altitudinales inferiores, en los extremos norte y sur del área de estudio, marcan la presencia y alta frecuencia de las especies de murciélagos: S. lilium, S. erythromos, S. oporaphilum, Artibeus planirostris, Desmodus rotundus, de los roedores: A. simulator, A. caenosus, C. fecundus, O. destructor, O. flavescens y el marsupial: T. cinderella. Las especies que caracterizan a las selvas montanas del norte del área de estudio son A. fumeus, R. austrinus, Euryoryzomys legatus y Oligoryzomys chacoensis. En el sector sur A. spegazzinii y A. illuteus caracterizan tanto a las selvas montanas como a los bosques montanos.
Los bosques montanos del extremo norte de las yungas de Argentina se caracterizan por la presencia exclusiva de P. wolffsohni y A. budini, esta última con alta abundancia al igual que O. paramensis. Por su parte, los bosques montanos de las yungas australes son claramente diferenciables de los septentrionales por la presencia exclusiva de A. spegazzinii, A. illuteus, O. wayku y P. alisosiensis.
En los pastizales de neblina de los 4 transectos altitudinales las especies comunes son P. osilae, N. lactens y A. edax, pero en el extremo norte existe A. boliviensis, una especie que los singulariza por su presencia exclusiva y dominancia. En el extremo sur, como ya se mencionó, A. spegazzinii habita en todos los niveles altitudinales, pero siempre es dominante en los pastizales de neblina y en los bosques montanos del sur de las yungas, estando ausente en el extremo norte.
En las estepas altoandinas de los 2 transectos más australes es característica la presencia combinada de A. andinus, P. xanthopygus y C. lepidus. Sin embargo, ninguna de estas especies es exclusiva del extremo sur del área de estudio, por lo que la fauna altoandina de los transectos australes parece ser una versión empobrecida de las del norte, las que se caracterizan por la alta abundancia de A. albiventer, P. xanthopygus y por la presencia de especies que alcanzan su límite de distribución austral en la puna de Salta y Jujuy, como O. gliroides, A. sublimis, y A. jelskii.
Más allá de su importancia en el camino hacia la comprensión de los procesos que gobiernan la distribución y la diversidad de las especies, los patrones aquí registrados tienen valor en sí mismos. La identificación de áreas de máxima riqueza específica y de máximo recambio de especies, así como los patrones de composición y abundancia, constituyen información de base fundamental a la hora de tomar decisiones de manejo y conservación de la vida silvestre. Además, los resultados de este trabajo constituyen una base para el monitoreo de las comunidades de micromamíferos, la detección de desplazamientos en los límites de distribución altitudinal y geográfica de las especies a lo largo del tiempo.
A Diego Ortiz, David Flores, Mariano Sánchez, María Sandoval, Joaquín Brunet, Marcos Mollerach, Luz Carrizo, Miriam Morales y Valentina Segura por andar kilómetros de ásperos senderos y multiplicar manos en cada trampa instalada, en cada ejemplar colectado, en cada recolección de leña, tendida de carpa y cocina campera durante 4 años de muestreos imposibles de realizar con sólo 2 manos. También a Carlos Molineri, Patricia Capllonch, Agustina Novillo, Ramiro Ovejero, Soledad Cuello, Leonor Claps, Ana López, Mariana Iruzubieta, Lucia Krapovickas, Pablo Gaudioso, Marcos Foguet, Mariano Hevia, Mariano Riccio, José Busnelli, Mónica Díaz y Marcos Mirande, quienes participaron en alguna actividad, brindado en forma sincera y genuina una invaluable ayuda. A Ruffo Navarro, el “burro” Miguel y el “gordo” Julio por el apoyo en las cumbres Calchaquíes; a Horacio Galán, Nacho y Hugo en las sierras de Tilcara. Muy especialmente agradecidos a la Administración de Parques Nacionales, en particular a la delegación del P. N. Campo de los Alisos: Daniel Vega, Juan Santillán, Felipe Nieva y Ubacho Escudero por el gran apoyo logístico en el Aconquija. A la Agencia de Promoción Científica y Tecnológica por apoyo financiero parcial (PICT 13 280 otorgado a RMB y PICT 2011-N°223 otorgado a IF) y al Consejo Nacional de Investigaciones Científicas y Tecnológicas (Conicet) de Argentina por sendas becas doctorales; así como a la Universidad Nacional Autónoma de México (UNAM), Dirección General de Asuntos del Personal Académico (DGAPA) y al Programa de Becas Posdoctorales de la UNAM, por el actual apoyo al primer autor. A los 2 revisores anónimos que mejoraron notalmente la primera versión de este manuscrito. Agradecemos también al editor asociado Dr. Gerado Sánchez Rojas por su eficaz labor.