Se describe y compara la riqueza y composición florística de pteridobiontes del bosque mesófilo de montaña y ambientes asociados con diferentes grados de afectación humana en la loma de Santa Rita, ubicada en la sierra de Chiconquiaco del centro de Veracruz, México. Se realizó una comparación con la pteridoflora de otros bosques mesófilos del centro de Veracruz, con base en estudios disponibles en la literatura. Se establecieron 72 parcelas de muestreo de 10×10m cada uno en 6 ambientes diferentes; bosque natural, bosque secundario maduro y joven, café de sombra, plantación de Pinus patula y pastizales con árboles remanentes. Se registraron un total de 81 especies distribuidas en 18 familias y 36 géneros. Los resultados indican que el bosque natural contiene la mayor riqueza, misma que disminuye conforme aumenta el grado de perturbación del ambiente hasta en un 70%. Se destaca la importancia de los acahuales y el cafetal bajo sombra por retener y permitir el establecimiento de muchas especies compartidas con en el bosque.
We describe and compare the richness and floristic composition of ferns in natural humid montane forest and disturbed environments associated with different degrees of anthropogenic influence. The study sites were located at the Loma de Santa Rita in the Sierra de Chiconquiaco, central region of Veracruz, Mexico. Furthermore, we made a comparison with other fern inventories from humid montane forests in central Veracruz based on published studies. We established 72 sampling plots of 10×10m each in 6 different environments; natural forest, mature and young secondary forest, shade coffee, Pinus patula plantation, and pasture with remnant trees. We recorded a total of 81 species distributed in 17 families and 36 genera. The results indicate that the natural forest is most species rich, whereas fern diversity decreases with the degree of vegetation disturbance up to 70%. The study highlights the importance of fallows and shade coffee plantations to retain and allow the establishment of many species also found in the forest.
Los pteridobiontes son 2 grupos taxonómicos con elevada riqueza y abundancia en los bosques tropicales húmedos de montaña del mundo, donde pueden aportar hasta un 19% a la diversidad florística local o regional (Whitmore et al., 1985; Gentry y Dodson, 1987; Kessler, 2001a; Kessler et al., 2001; Kreft et al., 2010). Esta gran riqueza de especies se encuentra representada en su mayoría en un intervalo altitudinal entre 1 000 a 2 000m debido a variables ambientales como el clima, la temperatura y la humedad (Kessler, 2001b; Krömer et al., 2005; Kluge et al., 2006; Watkins et al., 2006; Kessler et al., 2011). El intervalo altitudinal donde se conjugan las condiciones de humedad y temperatura más adecuadas para la supervivencia de la mayoría de los helechos y licopodios, coincide con la distribución del bosque mesófilo de montaña (BMM), también llamado bosque de niebla (Challenger, 1998; Conabio, 2010; Toledo-Aceves et al., 2011).
El BMM se encuentra en la zona de transición entre los tipos de vegetación tropicales de baja altitud y los templados de mayor elevación (Challenger, 1998; Villaseñor, 2010). Este tipo de vegetación presenta en México especies de afinidades boreales y tropicales; es decir, en el estrato arbóreo del dosel dominan especies caducifolias templadas, mientras que en el sotobosque persisten especies tropicales perennifolias (Rzedowski, 1978; Conabio, 2010). Las especies del BMM representan alrededor del 10% de la riqueza florística calculada para México, haciéndolo el tipo de vegetación más diverso por unidad de área (Rzedowski, 1991), donde destacan la taxocenosis de los pteridobiontes y las plantas epífitas (cerca del 20 y 30% de las especies, respectivamente; Rzedowski, 1996). Actualmente, el BMM ocupa menos del 1% del territorio nacional, ya que son pocas las zonas del país en que se conjuga la presencia de humedad y temperatura características de estos ambientes (Palacio-Prieto et al., 2000; Conabio, 2010; Toledo-Aceves et al., 2011). Su distribución es en fragmentos aislados en donde cada uno de ellos contiene una composición florística particular, la cual está relacionada con los factores abióticos e historia de vicarianza propios de cada sitio (Ponce-Vargas et al., 2006; Villaseñor, 2010).
Los helechos representan un componente importante en la complejidad florística del BMM, donde destacan por su alta diversidad las especies de la familia Polypodiaceae (Rzedowski, 1996; Williams-Linera et al., 2005; Ponce-Vargas et al., 2006; Mehltreter, 2008), cuyos miembros son frecuentes de encontrar como epífitos de los troncos y en las primeras ramificaciones de los árboles hospederos (Hietz y Hietz-Seifert, 1995; Nieder et al., 2000; Mehltreter et al., 2005; Krömer et al., 2007).
En la sierra de Chiconquiaco, ubicada en el centro del estado de Veracruz, las abruptas laderas y cañadas le han asegurado hasta la fecha una permanencia importante de remanentes del BMM (Conabio, 2010). Estos fragmentos están integrados en un mosaico de vegetación antropizada, que incluye bosques perturbados, vegetación secundaria en diferentes etapas de regeneración, también llamadas acahuales, plantaciones de café y pino, así como pastizales inducidos con árboles remanentes, tal es el caso de la localidad conocida como loma de Santa Rita en el municipio de Yecuatla (Carvajal-Hernández, 2011).
Algunos estudios demuestran que las perturbaciones humanas reducen la riqueza y abundancia de especies de helechos en los sistemas secundarios (Paciencia y Prado, 2005; Carreño-Rocabado, 2006). Sin embargo, algunos ambientes antropizados como las plantaciones de café han demostrado ser reservorios importantes para la conservación de los helechos (Carreño-Rocabado, 2006; Mehltreter, 2008; Moorhead et al., 2010).
Con base en lo anterior y debido a la presencia del BMM en la loma de Santa Rita y la heterogeneidad paisajística que ahí prevalece, la zona representa una oportunidad para el estudio de los impactos que las actividades antropogénicas tienen en la pteridoflora. Por lo tanto, el objetivo de este estudio fue conocer la riqueza y composición de helechos y licopodios del BMM de la zona, así como de los ambientes antropizados contiguos. Además de comparar la similitud en la pteridoflora de este fragmento con otros del centro de Veracruz.
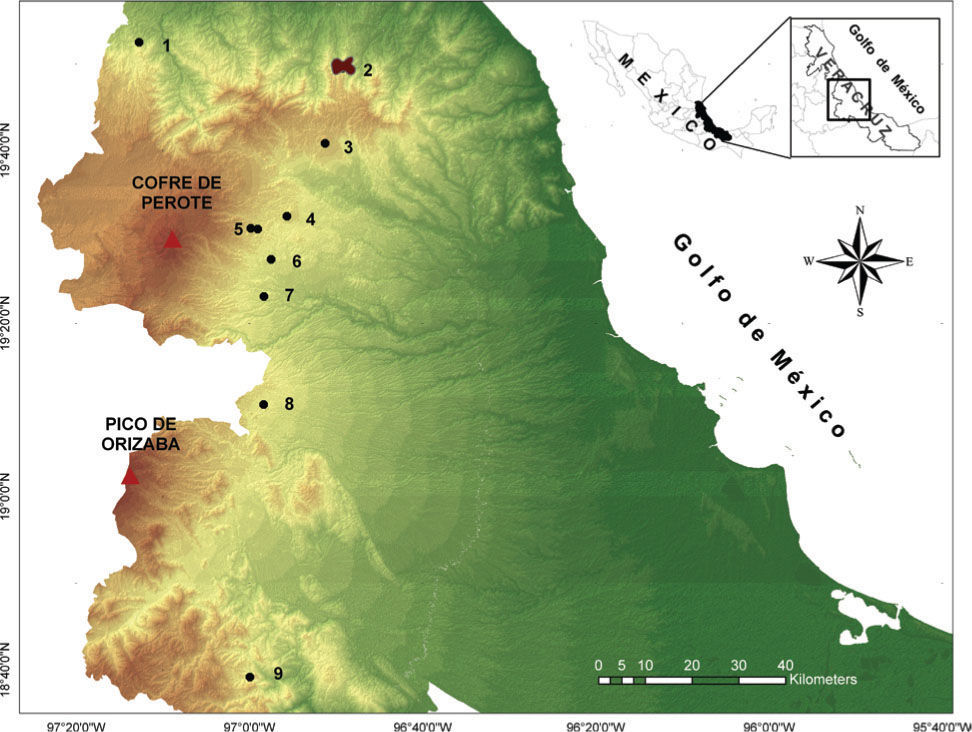
Materiales y métodosÁrea de estudioLa loma de Santa Rita es un referente importante en el complejo de montañas que conforman la sierra de Chiconquiaco en el centro de Veracruz, por su extensión y conservación del BMM. El lugar se ubica en el municipio de Yecuatla (19°49'43” N, 96°48'47” O), en un intervalo de altitud de 700 a 1 450m (Carvajal-Hernández, 2011); sin embargo, el presente estudio se realizó entre 1 000 y 1 400m (Fig. 1).
Ubicación de los municipios de los diferentes estudios realizados en BMM del centro del estado de Veracruz, México: 1, Atzalan; 2, Yecuatla (loma de Santa Rita, este estudio); 3, Acatlán; 4, Xalapa; 5, Tlalnelhuayocan; 6, Coatepec; 7, Teocelo; 8, Huatusco; 9, Zongolica (fuente: Inegi, 2000).
En la zona el clima es templado-húmedo, con una precipitación acumulada anual que fluctúa entre los 1 500 y 2 000mm, las lluvias más abundantes corresponden al verano (junio-agosto), mientras que la precipitación del mes más seco (mayo) es menor a 60mm. La temperatura mínima media anual es de 12° C, mientras que la máxima media anual es de 26° C; a lo largo del año se presentan entre 30 y 50 días con niebla (Ruíz-Barradas et al., 2010).
Trabajo de campo y gabineteSe establecieron un total de 72 parcelas no permanentes de 10×10m entre los meses de febrero de 2009 a marzo de 2010. La distribución de las mismas fue igualitaria en los 6 ambientes que componen la loma de Santa Rita: a) bosque natural (BN) con una superficie de aproximadamente 15 ha; la perturbación humana como la presencia de caminos, tala de árboles y extracción de flora y fauna o leña no es conspicua, además, se mantienen árboles de tallas grandes y epífitas vasculares notablemente abundantes; b) acahual maduro de más de 20 años (AM) en una superficie aproximada de 7 ha; c) acahual joven de menos de 10 años (AJ) y una extensión de 13 ha; d) cafetal bajo sombra con árboles remanentes del bosque mesófilo (CA) entre los que destaca Clethra mexicana y algunos individuos de los géneros Quercus e Inga, este ambiente ocupa un área de 6 ha; e) pastizal inducido con árboles remanentes que se encuentran en un área de 15 ha (PA); f) plantación de Pinus patula de más de 20 años con una superficie de 9 ha (PI). Todo este mosaico paisajístico se encuentra en una superficie que originalmente estaba ocupada con BMM y ha tenido diferentes etapas de transformación antrópica. Cada una de las parcelas se dispuso en algún sitio donde se encontró por lo menos un árbol grande, del dosel, que brindara un ambiente microclimático propicio para el establecimiento de los licopodios y helechos.
En cada parcela se registró la presencia tanto de las especies terrestres como de las epífitas. Los helechos epífitos se registraron mediante 2 procedimientos. El primero por medio de la observación directa de las especies en los tallos de todos los árboles o arbustos presentes en la parcela y por observación con binoculares de las ramas y copas de los árboles. El otro procedimiento consistió en el ascenso a 4 árboles: 2 en BN y 2 en AM, mediante el uso de cuerdas y equipo modificado de alpinismo (Perry, 1978), con la finalidad de complementar el registro de las especies no incluidas en la observación directa (Barker y Pinard, 2001; Flores-Palacios y García-Franco, 2001; Gradstein et al., 2003). En los ambientes con un mayor grado de perturbación no fue posible realizar el ascenso a los árboles, debido a su menor talla y a la escasa presencia de las especies en las copas, por lo que solamente se realizó la observación directa.
Las muestras colectadas fueronprocesadas y depositadas en el herbario CIB del Instituto de Investigaciones Biológicas de la Universidad Veracruzana en Xalapa, con duplicados depositados en el Herbario Nacional de México (MEXU) del Instituto de Biología, UNAM y el University Herbarium, University of California (UC), Berkeley, EUA. Se determinó la identidad taxonómica de los ejemplares colectados de acuerdo con Mickel y Smith (2004), además de la comparación con ejemplares correctamente curados de los herbarios CIB y XAL del Instituto de Ecología, A. C. en Xalapa.
Se utilizó el programa EstimateS Win8.00 para obtener los valores de los estimadores no paramétricos de riqueza potencial de especies ICE y Chao 2 (Colwell, 2009), los cuales están basados en datos de presencia-ausencia y toman en cuenta las especies raras; únicas y duplicadas; éstos son estimadores confiables por tener una menor sensibilidad a la agregación de especies en la etapa inicial del muestreo cuando la distribución de especies es al azar, tal como ocurrió en el presente trabajo (López-Gómez y Williams-Linera, 2006). Con dichos estimadores como referencia se realizaron las curvas de acumulación de especies para evaluar el esfuerzo del muestreo (Colwell et al., 2004).
Se aplicó el índice de Sørensen para conocer la similitud florística de los diferentes ambientes que componen el paisaje de la zona de estudio (Mostacedo y Fridericksen, 2000; Chao et al., 2005). Se realizó, además, un análisis de conglomerados con el programa XL-STAT® para agrupar a los ambientes de estudio con base en la composición pteridoflorística.
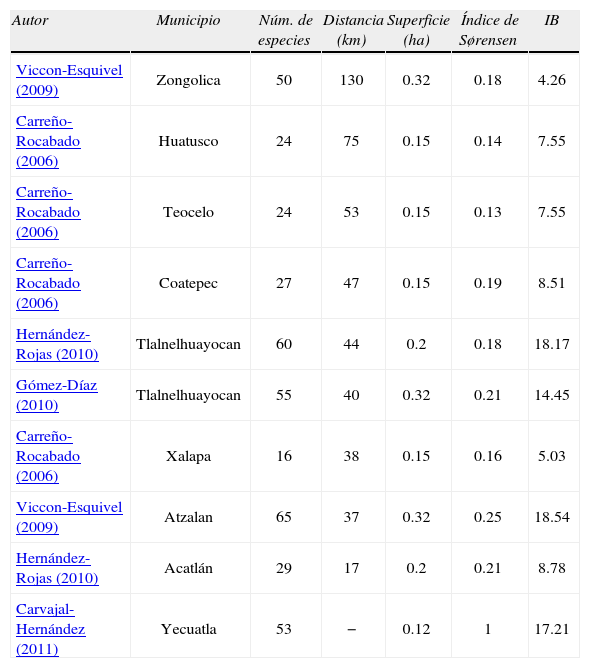
Se comparó la riqueza de especies obtenidas en este estudio, únicamente con los datos registrados en el bosque natural, con los resultados de trabajos previamente desarrollados en el estado de Veracruz por diferentes autores (Carreño-Rocabado, 2006; Viccon-Esquivel, 2009; Gómez-Díaz, 2010; Hernández-Rojas, 2010; Fig. 1). Se aplicó el índice de Sørensen y el índice de biodiversidad taxonómica, este último resulta de la división del número de especies registradas entre el logaritmo natural de la superficie estudiada en cada caso (Ponce et al., 2002; Tejero-Diez et al., 2011). Los trabajos incluidos en esta comparación fueron elegidos por lo siguiente: a) se conoce el método empleado y las unidades de muestreo son similares a las utilizadas en este estudio; b) están realizados en zonas con fragmentos de BMM con superficies similares y en la misma región fisiográfica y; c) presentan afinidades climáticas y topográficas.
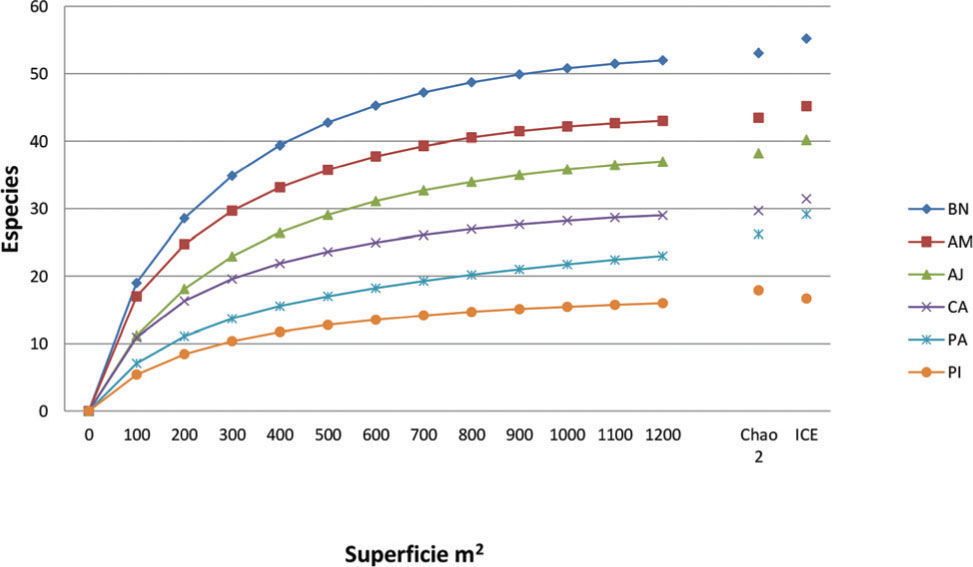
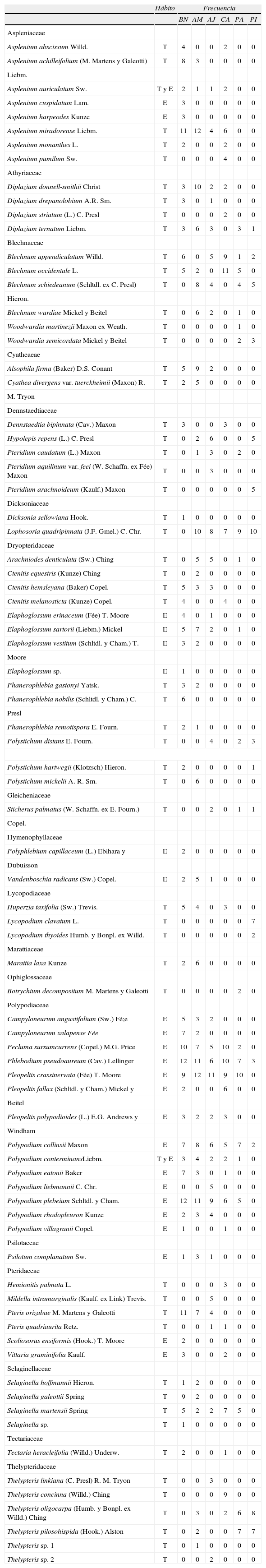
ResultadosRiqueza y composición de especiesEn las 72 parcelas (7 200m2) se encontraron 81 especies: 7 spp. de licopodios y 74 spp. de helechos, distribuidas en 36 géneros y 18 familias (Apéndice). La riqueza observada varió entre 79 y 98% de la riqueza pronosticada por los estimadores ICE y Chao 2, misma que se ve reflejada en las curvas de acumulación de especies (Fig. 2). El sitio con mayor riqueza fue el bosque natural, seguido del acahual maduro, acahual joven, cafetal bajo sombra, pastizal y, por último, la plantación de pino (Cuadro 1).
Curva de acumulación de especies y valores estimados de riqueza potencial de especies por Chao 2 e ICE por cada ambiente muestreado (BN, bosque natural; AM, acahual maduro; AJ, acahual joven; CA, cafetal bajo sombra; PA, pastizal con árboles remanentes; PI, pinar cultivado) en el sitio de estudio.
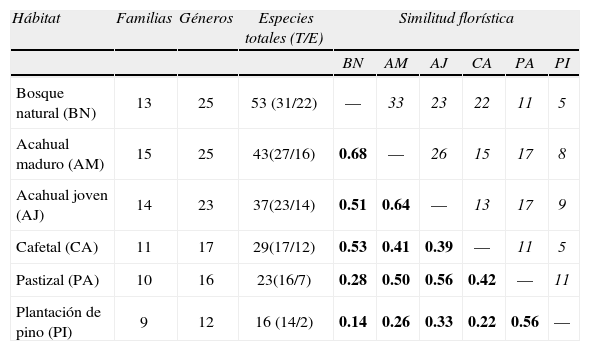
Número de familias, géneros y especies (terrestres y epífitas) registrados en los diferentes ambientes estudiados en la loma de Santa Rita, así como la similitud florística de los diferentes ambientes expresada con el índice de Sørensen (en negrillas), donde 1= completamente similar; 0= totalmente distinto; las cantidades en cursivas corresponden al número de especies compartidas
| Hábitat | Familias | Géneros | Especies totales (T/E) | Similitud florística | |||||
| BN | AM | AJ | CA | PA | PI | ||||
| Bosque natural (BN) | 13 | 25 | 53 (31/22) | — | 33 | 23 | 22 | 11 | 5 |
| Acahual maduro (AM) | 15 | 25 | 43(27/16) | 0.68 | — | 26 | 15 | 17 | 8 |
| Acahual joven (AJ) | 14 | 23 | 37(23/14) | 0.51 | 0.64 | — | 13 | 17 | 9 |
| Cafetal (CA) | 11 | 17 | 29(17/12) | 0.53 | 0.41 | 0.39 | — | 11 | 5 |
| Pastizal (PA) | 10 | 16 | 23(16/7) | 0.28 | 0.50 | 0.56 | 0.42 | — | 11 |
| Plantación de pino (PI) | 9 | 12 | 16 (14/2) | 0.14 | 0.26 | 0.33 | 0.22 | 0.56 | — |
Los géneros mejor representados fueron Asplenium y Polypodium con 8 especies cada uno, seguido de Thelypteris con 6. Las familias más ricas en el número de especies fueron Dryopteridaceae (15 spp.), Polypodiaceae (14) y Aspleniaceae (8); 2 especies de esta última familia mostraron preferencia por habitar en el bosque natural, Asplenium cuspidatum y A. harpeodes, mismas que fueron exclusivas de este ambiente. En cambio, las especies de Theypteridaceae se encontraron exclusivamente en los sitios con mayor perturbación (Apéndice).
Se registraron 5 especies que se encuentran protegidas por la ley mexicana dentro de la Nom-059-Semarnat-2010: Alsophila firma, Dicksonia sellowiana, Cyathea divergens var. tuerckheimii, Psilotum complanatum y Marattia laxa.
Del total de especies registradas, 65% son terrestres y 31% epífitas. En el bosque natural se registró el más alto número de especies (22); en contraste, en la plantación de pinos únicamente se registraron 2 especies de helechos epífitos. El número de epífitas disminuyó de forma gradual conforme avanza el nivel de perturbación del sitio (Cuadro 1).
Similitud florísticaEl índice de Sørensen muestra que la similitud florística es mayor entre el bosque natural y el acahual maduro. Se destaca que el cafetal bajo sombra, a pesar de estar sometido a intervención humana constante, muestra una semejanza florística con el bosque, incluso mayor a la que presenta el acahual joven, mismo que contiene una mayor riqueza, mientras que la plantación de pino es el sitio que menor número de especies comparte con el bosque (Cuadro 1).
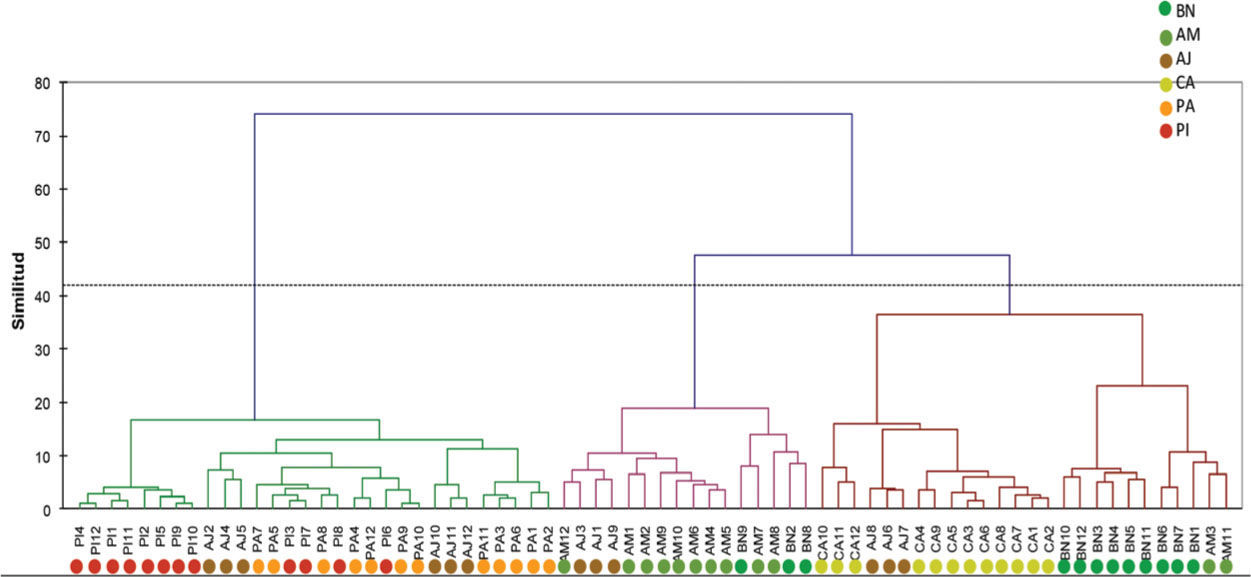
El análisis de conglomerados mostró una tendencia de agrupar la composición de especies en los sitios que conservan un estrato arbóreo y arbustivo bien definidos; tal es el caso del acahual maduro y el cafetal bajo sombra. Por otro lado, se agruparon en un clado diferente los sitios que no mantienen los estratos bien definidos, tal es el caso del pastizal con árboles remanentes y el pinar. El acahual joven se relacionó con todos los ambientes estudiados, con un 50% de presencia tanto en el primer clado como en el segundo (Fig. 3).
Dendrograma de similitud de las 12 parcelas de cada uno de los 6 ambientes de muestreo, abreviaturas ver figura 2, basado en una matriz de presencia-ausencia.
Los datos obtenidos de estudios previos realizados en diferentes fragmentos de BMM de la zona centro de Veracruz, indican una similitud florística muy baja con respecto a la composición de helechos registrados en el presente estudio (Cuadro 2). Los valores obtenidos por el índice de Sørensen no muestran una relación clara con la distancia entre los diferentes sitios de estudio y de acuerdo con el índice de biodiversidad taxonómica, se encontró que los fragmentos de los municipios de Atzalan y Tlalnelhuayocan (Viccon-Esquivel, 2009) son los que presentan los valores más altos, mientras que la zona de estudio del presente trabajo ocupó el tercer lugar con un valor cercano (Cuadro 2).
Comparación florística entre los diferentes municipios con fragmentos de bosque mesófilo conservado del centro de Veracruz. Los sitios están ordenados de acuerdo con la distancia que se encuentra respecto al área de estudio del presente trabajo, del más lejano al más cercano. IB= Índice de biodiversidad taxonómica. Similitud florística expresada con el índice de Sørensen (1= completamente similar; 0= totalmente distinto)
| Autor | Municipio | Núm. de especies | Distancia (km) | Superficie (ha) | Índice de Sørensen | IB |
| Viccon-Esquivel (2009) | Zongolica | 50 | 130 | 0.32 | 0.18 | 4.26 |
| Carreño-Rocabado (2006) | Huatusco | 24 | 75 | 0.15 | 0.14 | 7.55 |
| Carreño-Rocabado (2006) | Teocelo | 24 | 53 | 0.15 | 0.13 | 7.55 |
| Carreño-Rocabado (2006) | Coatepec | 27 | 47 | 0.15 | 0.19 | 8.51 |
| Hernández-Rojas (2010) | Tlalnelhuayocan | 60 | 44 | 0.2 | 0.18 | 18.17 |
| Gómez-Díaz (2010) | Tlalnelhuayocan | 55 | 40 | 0.32 | 0.21 | 14.45 |
| Carreño-Rocabado (2006) | Xalapa | 16 | 38 | 0.15 | 0.16 | 5.03 |
| Viccon-Esquivel (2009) | Atzalan | 65 | 37 | 0.32 | 0.25 | 18.54 |
| Hernández-Rojas (2010) | Acatlán | 29 | 17 | 0.2 | 0.21 | 8.78 |
| Carvajal-Hernández (2011) | Yecuatla | 53 | − | 0.12 | 1 | 17.21 |
La riqueza de especies de helechos en Veracruz oscila entre 550–565 (Mickel y Smith, 2004; Tejero-Diez et al., 2011; Krömer et al., 2013), por lo tanto, las 81 especies registradas en este estudio representan aproximadamente el 14% de la riqueza total del estado. Este número de especies puede relacionarse con la heterogeneidad ambiental del sitio, al incluir los diferentes ambientes que conforman el paisaje de la loma de Santa Rita, desde ambientes menos perturbados hasta los completamente transformados. De igual forma se presentan diferentes condiciones microclimáticas de humedad y temperatura, debido a que con la pérdida de árboles, la exposición solar se incrementa y la humedad ambiental contenida en un fragmento de bosque se pierde, lo que propicia el aumento de aire seco y cálido, por lo tanto, aumenta la temperatura y disminuye la humedad (Acebey et al., 2003; Zotz y Bader, 2009). Dicha heterogeneidad permite la presencia de especies de helechos adaptadas a diferentes condiciones climáticas o de perturbación, tal es el caso de los helechos con afinidad a los ambientes xéricos encontrados en los sitios con mayor perturbación. Estos presentan una mayor eficiencia en su conductividad hídrica, en el consumo de agua y la regulación de la pérdida de ésta, además de adaptaciones morfológicas como la presencia de tricomas o escamas que reflejan la luz directa, reducen la temperatura de la hoja y, por consecuencia, la transpiración (Hietz, 2010). Como ejemplo de estas especies se encuentran: Hypolepis repens, Pleopeltis crassinervata, Polypodium collinsii y Pteridium spp. Por otro lado, existen especies que se ven afectadas con los disturbios antrópicos, debido a la sensibilidad a los cambios en la humedad, la exposición solar y el aumento de la temperatura, tal es el caso de las especies de la familia Hymenophyllaceae (Krömer y Gradstein, 2003; Werner et al., 2005; Flores-Palacios y García-Franco, 2008; Gehrig-Downie et al., 2012).
Paciencia y Prado (2005) analizaron un gradiente de perturbación antrópica que incluye sistemas de cultivo en la Amazonia de Brasil, encontraron que los sistemas con un alto grado de disturbio presentaban una diminución de especies de helechos, de entre 40 y 70% de los taxa registrados en el ecosistema primario. La misma situación es registrada con las especies de helechos epífitos en regiones andinas de Bolivia, Ecuador y Venezuela, cuya disminución de la riqueza está relacionada con la transformación de los ecosistemas originales para diversas actividades antrópicas (Barthlott et al., 2001; Krömer y Gradstein, 2003; Werner et al., 2005; Köster et al., 2009). En el presente estudio se observó que la disminución en el número de especies contenidas en el bosque natural comparado con el sitio con mayor perturbación es de casi 70%. Por lo tanto, los cambios en el uso del suelo afectan de igual forma a las especies tanto en regiones tropicales cercanas al Ecuador como en regiones subtropicales como México.
Respecto a las especies epífitas, se registró que la riqueza disminuye conforme los ambientes presentan una influencia antropogénica mayor. Además de la disminución de forofítos, con la pérdida de árboles ocurre una mayor incidencia de luz que incrementa la temperatura y disminuye la humedad ambiental, situación que provoca estrés hídrico a las especies epífitas (Andrade y Nobel, 1997; Barthlott et al., 2001; Flores-Palacios y García-Franco, 2004; Köster et al., 2009; Zotz y Bader, 2009). Por tal razón, los ambientes antropizados tienen una menor riqueza de especies de helechos epífitos.
Similitud florística entre ambientesEstudios realizados en Oaxaca y Veracruz (Williams-Linera et al., 1998; Romero-Romero et al., 2000) demuestran que la vegetación secundaria puede mantener una buena representación de la flora original. Los sitios con mayor similitud en este estudio son el bosque natural y el acahual maduro (43%), lo cual se explica porque los acahuales con un mayor estado de madurez presentan una composición de especies que incluyen tanto las de hábitat ruderal y cosmopolita, hasta las propias de vegetación primaria (Romero-Romero et al., 2000). El bosque natural, acahual maduro y cafetal bajo sombra tienen una similitud mayor en la composición de especies de helechos, debido a que presentan una estratificación vegetal parecida que mantiene las condiciones microclimáticas y la disponibilidad de microambientes semejantes que favorecen la presencia de una mayor cantidad de especies compartidas (Moreno et al., 2009).
Por otro lado, el acahual joven comparte 50% de la riqueza de especies con los sitios que conservan la estructura del bosque (BC, AM y CA) y la otra mitad con los sitios completamente transformados (PA, PI). Lo cual evidencia que es un estado transicional en la sucesión ecológica y que existe un gradual establecimiento de las especies encontradas en el ambiente con menor perturbación, aunque esto depende del tamaño del fragmento y del tiempo y distancia de su aislamiento del bosque natural (Romero-Romero et al., 2000; Köster et al., 2009).
El cafetal bajo sombra es valorado por su papel en la conservación de especies vegetales tanto leñosas como herbáceas (Bandeira et al., 2005; Espejo-Serna et al., 2005; Hietz, 2005; Carreño-Rocabado, 2006; López-Gómez y Williams-Linera, 2006; Mehltreter, 2008; Köster et al., 2009; Moorhead et al., 2010). A pesar de ello, y de acuerdo con la riqueza encontrada en el cafetal, únicamente se registraron el 55% de las especies presentes en el bosque, lo que indica que existen algunos helechos susceptibles a los cambios ambientales y no sobreviven en el cafetal, algo similar ocurre con otros grupos taxonómicos como, por ejemplo, las orquídeas (Toledo-Aceves et al., 2012). La mayoría de los helechos encontrados en este ambiente corresponden a especies xerotolerantes adaptadas a condiciones de estacionalidad anual, como ejemplo de ello algunas especies de la familia Polypodiaceae (Hietz y Briones, 1998) y se pierden algunas otras que presentan sensibilidad a los cambios en el ambiente, como ocurrió con las especies de Hymenophyllaceae (Krömer y Gradstein, 2003; Gehrig-Downie et al., 2012).
Riqueza de helechos en los sistemas antropizadosLos helechos son plantas con preferencias a habitar en zonas de montaña con clima húmedo-templado y la mayoría de las especies están relacionadas con condiciones de alta humedad y sombra (Mickel, 1979; Kessler, 2001a; Kluge et al., 2006; Watkins et al., 2006). Por lo anterior, el pastizal y la plantación de pino son los sitios con menor riqueza de helechos y ambos comparten una similitud florística alta. El pinar cultivado tiene una riqueza de especies menor comparado con el pastizal, debido a que las especies del género Pinus no representan forofítos adecuados para el establecimiento de epífitas, lo que se explica por la inestabilidad de sus cortezas, ramas delgadas y la poca capacidad de retención de agua (Callaway et al., 2002). Además, se ha demostrado que los pinos tienen una alta eficiencia en la absorción de nitrógeno del suelo y su hojarasca provoca cambios en la composición de la materia orgánica alterando el ciclo de nutrientes (Van Wesenbeeck et al., 2003), lo que podría limitar a algunas especies de helechos terrestres. En este ambiente sólo proliferan especies resistentes como Blechnum appendiculatum, Hypolepis repens, Sticherus palmatus y el género Pteridium, mismas que están adaptadas también a condiciones xéricas (Hietz, 2010).
En el pastizal, los árboles remanentes, principalmente de Clethra mexicana y Quercus sp., mantienen parte de la riqueza de epífitas, además, debido a su cobertura permiten el establecimiento de especies terrestres (Guevara et al., 2005). A pesar de lo anterior, la riqueza que resguardan no es comparable con la de los árboles del interior del bosque, esto se debe a que se reduce al mínimo la unidad del hábitat para ciertas especies, además de que el árbol expuesto recibe una mayor radiación y ocurre un aumento en la evaporación, dichas condiciones cambian radicalmente el microclima y conllevan al estrés hídrico de las plantas (Williams-Linera et al., 1995; Hietz-Seifert et al., 1996; Flores-Palacios y García-Franco, 2004; Werner et al, 2005; Köster et al., 2009). A pesar de las desventajas que tienen los helechos en términos de supervivencia en el pastizal, un árbol remanente y aislado alberga mayor riqueza que toda la plantación de Pinus.
El número de taxa de helechos y licopodios encontrados en los acahuales manifiesta la importancia de dichos ambientes para su conservación, ya que, además de las especies secundarias arraigadas sobre los sitios sometidos a las nuevas condiciones ambientales, también se observa que el establecimiento de las especies típicas de los ambientes menos perturbados, sucede en medida que las condiciones del fragmento son las adecuadas para su establecimiento.
Diferencias en la pteridoflora del bosque mesófiloLos BMM de México son diferentes entre sí en cuanto a su composición de especies (Villaseñor, 2010) y el caso de la taxocenosis de los licopodios y helechos no es ajeno a dicha aseveración. A partir de la comparación de los listados obtenidos en estudios previos en diferentes puntos de la región montañosa del centro de Veracruz se comprobó lo anterior. En Zongolica (Viccon-Esquivel, 2009) se encontraron 50 especies de helechos, de las cuales únicamente 52% fueron registradas en la loma de Santa Rita. Algunas especies consideradas como frecuentes en Zongolica (Niphidium crassifolium y Pleopeltis angusta) no fueron encontradas en el presente estudio. Para el caso de lo registrado en Acatlán (Hernández-Rojas, 2010) y Tlalnelhuayocan (Gómez-Díaz, 2010), de manera similar al anterior caso, cerca del 50% de las especies de helechos fueron compartidas con la loma de Santa Rita y en Atzalan (Viccon-Esquivel, 2009) se compartieron 45%. No se encontró un patrón que indicara que a mayor cercanía del sitio hubiese una mayor similitud de especies expresada por el índice de Sørensen, ya que ni el sitio más cercano tuvo mayor similitud ni el más lejano tuvo la menor (Cuadro 2). Cabe destacar que los sitios mencionados tienen unidades de muestreo similares, se encuentran en un intervalo altitudinal que va de 1 250 a 1 500m y la temperatura y precipitación son semejantes.
Lo anterior manifiesta la vulnerabilidad del BMM, ya que si ocurre un disturbio en un área con este tipo de vegetación, no se asegura la permanencia de todas sus especies en otro sitio con características similares. Cuando ocurren cambios en el ambiente natural del bosque ocasionados por las actividades antrópicas, la riqueza puede disminuir hasta en 70%, como se mostró con los datos de este estudio, pero la situación empeora si al menos el 50% de las especies en ese fragmento muy probablemente no se encuentran en otro, lo que deja al BMM como un ecosistema de gran fragilidad y dificultad para su conservación y manejo adecuado.
Los autores agradecemos a la familia Castillo, especialmente al Sr. Camilo y su hijo Carlos por el apoyo otorgado en la realización del trabajo de campo en la loma de Santa Rita. A la M. en C. Samaria Armenta-Montero por su valiosa colaboración en el trabajo de campo y ayuda en el procesamiento de los datos. Al Dr. Jürgen Kluge por sus valiosos comentarios. Por último, al Conacyt por la beca otorgada (Núm. 27836) para la realización del estudio de maestría del primer autor.
Lista florística de las especies de helechos y licofítos encontradas en el bosque mesófilo y ecosistemas transformados por la acción antrópica (BN, bosque natural; AM, acahual maduro; AJ, acahual joven; CA, cafetal bajo sombra; PA, pastizal con árboles remanentes; PI, pinar cultivado en la loma de Santa Rita. Habito: T= terrestre; E= epifito, E. La frecuencia se refiere al número de parcelas donde la especie fue registrada.
| Hábito | Frecuencia | ||||||
| BN | AM | AJ | CA | PA | PI | ||
| Aspleniaceae | |||||||
| Asplenium abscissum Willd. | T | 4 | 0 | 0 | 2 | 0 | 0 |
| Asplenium achilleifolium (M. Martens y Galeotti) | T | 8 | 3 | 0 | 0 | 0 | 0 |
| Liebm. | |||||||
| Asplenium auriculatum Sw. | T y E | 2 | 1 | 1 | 2 | 0 | 0 |
| Asplenium cuspidatum Lam. | E | 3 | 0 | 0 | 0 | 0 | 0 |
| Asplenium harpeodes Kunze | E | 3 | 0 | 0 | 0 | 0 | 0 |
| Asplenium miradorense Liebm. | T | 11 | 12 | 4 | 6 | 0 | 0 |
| Asplenium monanthes L. | T | 2 | 0 | 0 | 2 | 0 | 0 |
| Asplenium pumilum Sw. | T | 0 | 0 | 0 | 4 | 0 | 0 |
| Athyriaceae | |||||||
| Diplazium donnell-smithii Christ | T | 3 | 10 | 2 | 2 | 0 | 0 |
| Diplazium drepanolobium A.R. Sm. | T | 3 | 0 | 1 | 0 | 0 | 0 |
| Diplazium striatum (L.) C. Presl | T | 0 | 0 | 0 | 2 | 0 | 0 |
| Diplazium ternatum Liebm. | T | 3 | 6 | 3 | 0 | 3 | 1 |
| Blechnaceae | |||||||
| Blechnum appendiculatum Willd. | T | 6 | 0 | 5 | 9 | 1 | 2 |
| Blechnum occidentale L. | T | 5 | 2 | 0 | 11 | 5 | 0 |
| Blechnum schiedeanum (Schltdl. ex C. Presl) | T | 0 | 8 | 4 | 0 | 4 | 5 |
| Hieron. | |||||||
| Blechnum wardiae Mickel y Beitel | T | 0 | 6 | 2 | 0 | 1 | 0 |
| Woodwardia martinezii Maxon ex Weath. | T | 0 | 0 | 0 | 0 | 1 | 0 |
| Woodwardia semicordata Mickel y Beitel | T | 0 | 0 | 0 | 0 | 2 | 3 |
| Cyatheaeae | |||||||
| Alsophila firma (Baker) D.S. Conant | T | 5 | 9 | 2 | 0 | 0 | 0 |
| Cyathea divergens var. tuerckheimii (Maxon) R. | T | 2 | 5 | 0 | 0 | 0 | 0 |
| M. Tryon | |||||||
| Dennstaedtiaceae | |||||||
| Dennstaedtia bipinnata (Cav.) Maxon | T | 3 | 0 | 0 | 3 | 0 | 0 |
| Hypolepis repens (L.) C. Presl | T | 0 | 2 | 6 | 0 | 0 | 5 |
| Pteridium caudatum (L.) Maxon | T | 0 | 1 | 3 | 0 | 2 | 0 |
| Pteridium aquilinum var. feei (W. Schaffn. ex Fée) Maxon | T | 0 | 0 | 3 | 0 | 0 | 0 |
| Pteridium arachnoideum (Kaulf.) Maxon | T | 0 | 0 | 0 | 0 | 0 | 5 |
| Dicksoniaceae | |||||||
| Dicksonia sellowiana Hook. | T | 1 | 0 | 0 | 0 | 0 | 0 |
| Lophosoria quadripinnata (J.F. Gmel.) C. Chr. | T | 0 | 10 | 8 | 7 | 9 | 10 |
| Dryopteridaceae | |||||||
| Arachniodes denticulata (Sw.) Ching | T | 0 | 5 | 5 | 0 | 1 | 0 |
| Ctenitis equestris (Kunze) Ching | T | 0 | 2 | 0 | 0 | 0 | 0 |
| Ctenitis hemsleyana (Baker) Copel. | T | 5 | 3 | 3 | 0 | 0 | 0 |
| Ctenitis melanosticta (Kunze) Copel. | T | 4 | 0 | 0 | 4 | 0 | 0 |
| Elaphoglossum erinaceum (Fée) T. Moore | E | 4 | 0 | 1 | 0 | 0 | 0 |
| Elaphoglossum sartorii (Liebm.) Mickel | E | 5 | 7 | 2 | 0 | 1 | 0 |
| Elaphoglossum vestitum (Schltdl. y Cham.) T. | E | 3 | 2 | 0 | 0 | 0 | 0 |
| Moore | |||||||
| Elaphoglossum sp. | E | 1 | 0 | 0 | 0 | 0 | 0 |
| Phanerophlebia gastonyi Yatsk. | T | 3 | 2 | 0 | 0 | 0 | 0 |
| Phanerophlebia nobilis (Schltdl. y Cham.) C. | T | 6 | 0 | 0 | 0 | 0 | 0 |
| Presl | |||||||
| Phanerophlebia remotispora E. Fourn. | T | 2 | 1 | 0 | 0 | 0 | 0 |
| Polystichum distans E. Fourn. | T | 0 | 0 | 4 | 0 | 2 | 3 |
| Polystichum hartwegii (Klotzsch) Hieron. | T | 2 | 0 | 0 | 0 | 0 | 1 |
| Polystichum mickelii A. R. Sm. | T | 0 | 6 | 0 | 0 | 0 | 0 |
| Gleicheniaceae | |||||||
| Sticherus palmatus (W. Schaffn. ex E. Fourn.) | T | 0 | 0 | 2 | 0 | 1 | 1 |
| Copel. | |||||||
| Hymenophyllaceae | |||||||
| Polyphlebium capillaceum (L.) Ebihara y | E | 2 | 0 | 0 | 0 | 0 | 0 |
| Dubuisson | |||||||
| Vandenboschia radicans (Sw.) Copel. | E | 2 | 5 | 1 | 0 | 0 | 0 |
| Lycopodiaceae | |||||||
| Huperzia taxifolia (Sw.) Trevis. | T | 5 | 4 | 0 | 3 | 0 | 0 |
| Lycopodium clavatum L. | T | 0 | 0 | 0 | 0 | 0 | 7 |
| Lycopodium thyoides Humb. y Bonpl. ex Willd. | T | 0 | 0 | 0 | 0 | 0 | 2 |
| Marattiaceae | |||||||
| Marattia laxa Kunze | T | 2 | 6 | 0 | 0 | 0 | 0 |
| Ophiglossaceae | |||||||
| Botrychium decompositum M. Martens y Galeotti | T | 0 | 0 | 0 | 0 | 2 | 0 |
| Polypodiaceae | |||||||
| Campyloneurum angustifolium (Sw.) Fé;e | E | 5 | 3 | 2 | 0 | 0 | 0 |
| Campyloneurum xalapense Fée | E | 7 | 2 | 0 | 0 | 0 | 0 |
| Pecluma sursumcurrens (Copel.) M.G. Price | E | 10 | 7 | 5 | 10 | 2 | 0 |
| Phlebodium pseudoaureum (Cav.) Lellinger | E | 12 | 11 | 6 | 10 | 7 | 3 |
| Pleopeltis crassinervata (Fée) T. Moore | E | 9 | 12 | 11 | 9 | 10 | 0 |
| Pleopeltis fallax (Schltdl. y Cham.) Mickel y | E | 2 | 0 | 0 | 6 | 0 | 0 |
| Beitel | |||||||
| Pleopeltis polypodioides (L.) E.G. Andrews y | E | 3 | 2 | 2 | 3 | 0 | 0 |
| Windham | |||||||
| Polypodium collinsii Maxon | E | 7 | 8 | 6 | 5 | 7 | 2 |
| Polypodium conterminansLiebm. | T y E | 3 | 4 | 2 | 2 | 1 | 0 |
| Polypodium eatonii Baker | E | 7 | 3 | 0 | 1 | 0 | 0 |
| Polypodium liebmannii C. Chr. | E | 0 | 0 | 5 | 0 | 0 | 0 |
| Polypodium plebeium Schltdl. y Cham. | E | 12 | 11 | 9 | 6 | 5 | 0 |
| Polypodium rhodopleuron Kunze | E | 2 | 3 | 4 | 0 | 0 | 0 |
| Polypodium villagranii Copel. | E | 1 | 0 | 0 | 1 | 0 | 0 |
| Psilotaceae | |||||||
| Psilotum complanatum Sw. | E | 1 | 3 | 1 | 0 | 0 | 0 |
| Pteridaceae | |||||||
| Hemionitis palmata L. | T | 0 | 0 | 0 | 3 | 0 | 0 |
| Mildella intramarginalis (Kaulf. ex Link) Trevis. | T | 0 | 0 | 5 | 0 | 0 | 0 |
| Pteris orizabae M. Martens y Galeotti | T | 11 | 7 | 4 | 0 | 0 | 0 |
| Pteris quadriaurita Retz. | T | 0 | 0 | 1 | 1 | 0 | 0 |
| Scoliosorus ensiformis (Hook.) T. Moore | E | 2 | 0 | 0 | 0 | 0 | 0 |
| Vittaria graminifolia Kaulf. | E | 3 | 0 | 0 | 2 | 0 | 0 |
| Selaginellaceae | |||||||
| Selaginella hoffmannii Hieron. | T | 1 | 2 | 0 | 0 | 0 | 0 |
| Selaginella galeottii Spring | T | 9 | 2 | 0 | 0 | 0 | 0 |
| Selaginella martensii Spring | T | 5 | 2 | 2 | 7 | 5 | 0 |
| Selaginella sp. | T | 1 | 0 | 0 | 0 | 0 | 0 |
| Tectariaceae | |||||||
| Tectaria heracleifolia (Willd.) Underw. | T | 2 | 0 | 0 | 1 | 0 | 0 |
| Thelypteridaceae | |||||||
| Thelypteris linkiana (C. Presl) R. M. Tryon | T | 0 | 0 | 3 | 0 | 0 | 0 |
| Thelypteris concinna (Willd.) Ching | T | 0 | 0 | 0 | 9 | 0 | 0 |
| Thelypteris oligocarpa (Humb. y Bonpl. ex Willd.) Ching | T | 0 | 3 | 0 | 2 | 6 | 8 |
| Thelypteris pilosohispida (Hook.) Alston | T | 0 | 2 | 0 | 0 | 7 | 7 |
| Thelypteris sp. 1 | T | 0 | 1 | 0 | 0 | 0 | 0 |
| Thelypteris sp. 2 | T | 0 | 0 | 2 | 0 | 0 | 0 |