Se describen los patrones de actividad de los visitantes a las inflorescencias de 3 especies de Agave: Agave difformis, A. garciae-mendozae y A. striata en distintas localidades de la Barranca de Metztitlán, Hidalgo, México. Se define el posible papel de estos visitantes en el proceso de polinización, ya sea como ladrones de polen o néctar, o como polinizadores primarios o secundarios, estos últimos visitan menos flores y/o lo hacen de manera ineficiente. Se filmó la actividad de visitantes durante 24h continuas en 5 inflorescencias. Se encontraron los siguientes grupos de visitantes: esfíngidos, murciélagos, abejas y colibríes. Los horarios de mayor actividad en las 3 especies de Agave se registraron durante la noche, entre las 21:00 y 03:00h. La presencia de visitantes diurnos (abejas y colibríes) en las inflorescencias abre la posibilidad de que estos también actúen como polinizadores. Los polinizadores clasificados como primarios fueron los murciélagos nectarívoros Leptonycteris yerbabuenae, L. nivalis y Choeronycteris mexicana. El polinizador secundario más común fue el esfíngidos Erinnyis ello. El principal ladrón de polen y néctar fue la abeja europea, Apis mellifera, en A. striata, aunque tiene las flores más pequeñas; A. mellifera podría ser considerada como polinizador secundario.
Activity patterns of inflorescence visitors are described for 3 species of Agave: Agave difformis, A. garciae-mendozae and A. striata from different sites at Barranca de Metztitlán, Hidalgo, Mexico. The potential role of the visitors in the pollination process was defined: pollen or nectar robbers, or as primary or secondary pollinators, secondary if they visit less flowers or do so in an inefficient way. Visitor's activity was recorded for 24 consecutive hours on 5 inflorescences. The visitors were from the following groups: hawkmoths, bats, bees and hummingbirds. The peak of the activity in the 3 Agave species was registered between 21:00 to 03:00h. In some cases, diurnal visitors (bees and hummingbirds) could also be pollinators. The primary pollinators were the nectar feeding bats Leptonycteris yerbabuenae, L. nivalis, and Choeronycteris mexicana. The most common secondary pollinator was the hawkmoth Erinnyis ello. The main pollen and nectar robber was the European honey bee, Apis mellifera, however, A. mellifera could also be considered as a secondary pollinator for A. striata, because this species has smaller flowers.
Tradicionalmente, la relación planta-polinizador ha sido considerada una interacción primordialmente mutualista, ya que en la mayoría de los casos los visitantes florales obtienen un recurso, usualmente alimento: néctar, polen, aceites, o a veces fragancias, y, por otra parte, las plantas aseguran su fecundación (Faegri y Van der Pijl, 1979; Proctor, Yeo y Lack, 1996). Sin embargo, actualmente se sabe que los visitantes florales pueden desempeñar distintos papeles, ya que pueden ser desde polinizadores primarios, legítimos y eficientes, hasta ladrones de néctar o polen. El papel de los visitantes florales dependerá tanto de la naturaleza del visitante y su comportamiento, como de las características de la flor que visitan (Eguiarte y Búrquez, 1987; Fenster, Armbruster, Wilson, Dudash y Thomson, 2004; Gómez, 2002; Irwin y Brody, 1999; Navarro, 2000). Además, las interacciones entre diferentes visitantes puede cambiar su papel; por ejemplo, dejando de ser polinizadores primarios, debido a interacciones agresivas que desplazan a los visitantes más pequeños o débiles (Fumero-Cabán y Meléndez-Ackerman, 2007).
Stebbins (1970) propuso que la evolución de los sistemas de polinización ha sido fundamentalmente determinada por el comportamiento del polinizador primario. Sin embargo, las interacciones que presentan un grado de especialización, en el cual las plantas dependen solamente de un grupo de animales polinizadores, o solo de una especie específica, son vulnerables evolutivamente, porque la fluctuación en el número de visitantes, el comportamiento de estos o el cambio de condiciones ambientales puede afectar de manera negativa las tasas de fertilización de la flor (Howell y Roth, 1981; Valiente-Baunet, 2002). La identificación de los polinizadores primarios o de los robadores de néctar dentro de la vasta comunidad de visitantes florales, así como la identificación de las conductas relacionadas con el proceso de visita, constituyen un elemento fundamental para avanzar en el conocimiento y la comprensión de los procesos ecológicos y evolutivos relacionados con la polinización, así como de la futura conservación de las especies.
Agave es un género sumamente diverso, constituido por más de 280 especies que producen una espectacular inflorescencia que constituye un importante recurso para los visitantes florales (Eguiarte et al., 2013; Gentry, 1998; Rocha, Valera y Eguiarte, 2005). El proceso de polinización del género Agave fue inicialmente descrito señalando a los murciélagos nectarívoros (quiropterofilia) como sus principales polinizadores (Eguiarte, Silva y Souza, 2000; Eguiarte et al., 2013; Faegri y Van der Pijl, 1979; Rocha et al., 2005, 2006; Slauson, 2001). Sin embargo, la lista de visitantes florales asociados a los agaves es usualmente amplia y no siempre incluye a los murciélagos. Dentro de los visitantes nocturnos de los agaves, generalmente se incluyen abundantes visitas de esfíngidos, pero su papel como polinizadores no ha sido estudiado en detalle. En otros trabajos se ha demostrado que los visitantes diurnos a las flores de agave son comunes, incluyendo himenópteros (abejas sociales y solitarias, abejorros y avispas), lepidópteros y aves (colibríes y aves percheras) (Arizaga, Ezcurra, Peters, Ramírez y Vega, 2000; Eguiarte et al., 2000; Howell y Roth, 1981; Martínez-del Río y Eguiarte, 1987; Molina-Freaner y Eguiarte, 2003; Ornelas et al., 2002; Rocha et al., 2005, 2006; Schaffer y Schaffer, 1977; Silva-Montellano y Eguiarte, 2003; Slauson, 2000, 2001).
Los agaves de inflorescencia espigada (del subgénero Littaea sensu Gentry, 1982) en la Barranca de Metztitlán, Hidalgo, en la República mexicana, sugieren un sistema de polinización nocturno, debido a que la producción de néctar y polen se presentan a partir de las 18:00h hasta las primeras horas de sol, entre las 6:00 y 8:00h del día siguiente. Las flores usualmente son receptivas al polen varios días y noches, y la totalidad de la inflorescencia puede tardar hasta 2 semanas en florecer (González-González, 2004; Rocha et al., 2005). En la Barranca de Metztitlán los visitantes florales fueron estudiados a partir de observaciones directas: en los años 2001 y 2003 para Agave difformis; 2001 y 2002 en A. striata por Rocha et al. (2005) y en 2002-2003 en A. garciae-mendozae por González-González (2004). En estos estudios encontraron que los visitantes más abundantes son nocturnos, destacando los murciélagos nectarívoros Leptonycteris yerbabuenae, Choeronycteris mexicana y Glossophaga spp. Sin embargo, aunque ambos estudios mencionan abundantes visitas por esfíngidos, colibríes, abejas europeas (Apis mellifera) y otros himenópteros, hasta el momento han sido tratados como «polinizadores potenciales», sin determinar su papel real ni describir la dinámica durante el proceso de visita. Conocer en detalle la dinámica de los visitantes permite establecer con certeza el polinizador primario, corroborando y enriqueciendo registros anteriores en estas y otras especies de Agave.
En el presente trabajo se analiza con detalle la comunidad de visitantes de las inflorescencias de A. garciae-mendozae, A. striata y A. difformis en la Barranca de Metzitlán, mediante análisis de videograbaciones de noches completas, permitiendo determinar mejor el papel que cumple cada uno de ellos como polinizadores o robadores.
Materiales y métodosLa Reserva de la Biosfera Barranca de Metztitlán se ubica en el estado de Hidalgo, México (fig. 1), entre los paralelos 98°23’00” y 98°57’08” O y 20°14’15” y 20°45’26” N, con elevaciones entre los 1,000 y 2,300 m snm. El área tiene clima estepario, con temperatura promedio anual de 20.2°C y precipitación pluvial de 437mm por año. El periodo de lluvias es de junio a septiembre. La vegetación es, principalmente, matorral espinoso (Arzate, 2009; Ortiz, 1980; Rocha et al., 2005; Sánchez, 1978).
Se realizaron observaciones y muestreos en julio del 2007, época en la que florecen sincrónicamente A. garciae-mendozae, A. striata y A. difformis (González-González, 2004; Rocha et al., 2005). En esta existe la mayor sobreposición de floración entre las especies de agave en la Barranca de Metztitlán (Rocha et al., 2005). El género Agave se caracteriza por sus espectaculares inflorescencias paniculadas o espigadas: una por cada planta, que miden desde 2 hasta más de 10 m de altura. Cada inflorescencia desarrolla cientos de flores perfectas triloculadas, con pétalos, generalmente, color blancuzco de 6 tépalos, en 1 o 2 series usualmente unidas en un tubo largo (Eguiarte et al., 2000; Gentry, 1998). El néctar y el polen se producen en la noche, aunque cada flor se mantiene activa por varias noches (véanse detalles en González-González, 2004 y Rocha et al., 2005); una inflorescencia ofrece recursos (néctar y polen), por lo menos durante una semana. Se eligieron 5 sitios de estudio que tuvieran presencia de alguna de las especies que fueran accesibles y que tuvieran un mínimo de entre 20 y 25 inflorescencias activas en etapas medias (flores activas en la mitad de la inflorescencia), de forma que la población fuese atractiva para los visitantes (véase Eguiarte y Búrquez, 1987; Thompson, 2001).
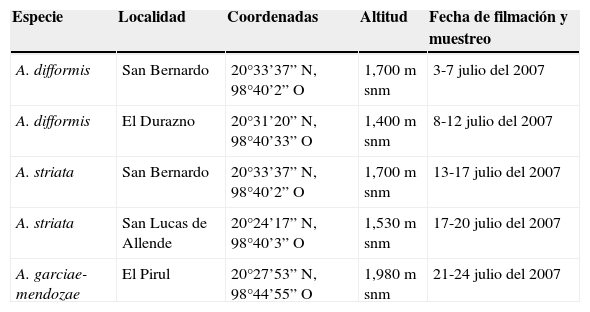
FilmaciónDebido a la capacidad del equipo de video —4h por cada cassette—, en cada una de las poblaciones (tabla 1) se seleccionó una planta/inflorescencia por especie para ser filmada y que cumpliera con 3 criterios: a) que la inflorescencia se encontrara a la vista de los visitantes; b) que se encontrara en etapa media de floración, y c) que el individuo estuviera sano, por ejemplo, color verde en las hojas centrales, la inflorescencia no tuviera apariencia seca y que tuviera flores funcionales y bien formadas. La única población que presentaba más de una especie fue San Bernardo con A. difformis y A. striata. Se colocó una cámara de video Sony Handycam; night shot-vision nocturna (modelo CCD-TRV318; zoom óptico de 20×, digital de 560×, formato Hi8) por inflorescencia a 1 m de distancia de las flores, cambiando las baterías y la cinta cada 4h hasta completar 24h. En el caso de la localidad de San Bernardo (con presencia de 2 especies de A. difformis y A. striata), se usaron cámaras Sony Handycam formato miniDV (modelo DCR-HC21; zoom óptico 12×; digital 480×), en las que el cambio de batería y cinta se realizó cada 1:30h hasta completar las 24h. Cada inflorescencia se filmó en días distintos.
Ubicación geográfica de las inflorescencias seleccionadas para este estudio.
| Especie | Localidad | Coordenadas | Altitud | Fecha de filmación y muestreo |
|---|---|---|---|---|
| A. difformis | San Bernardo | 20°33’37” N, 98°40’2” O | 1,700 m snm | 3-7 julio del 2007 |
| A. difformis | El Durazno | 20°31’20” N, 98°40’33” O | 1,400 m snm | 8-12 julio del 2007 |
| A. striata | San Bernardo | 20°33’37” N, 98°40’2” O | 1,700 m snm | 13-17 julio del 2007 |
| A. striata | San Lucas de Allende | 20°24’17” N, 98°40’3” O | 1,530 m snm | 17-20 julio del 2007 |
| A. garciae-mendozae | El Pirul | 20°27’53” N, 98°44’55” O | 1,980 m snm | 21-24 julio del 2007 |
Concluido el periodo de filmación, se utilizaron redes entomológicas y de niebla para capturar a los visitantes en las inflorescencias e identificarlos posteriormente. En cada población se colocaron 3 redes de niebla durante 5 días, a una distancia de, al menos, 30 m entre ellas y a una distancia máxima de 1 m de los agaves con inflorescencias activas y sanas. Las redes fueron revisadas en periodos de media hora durante la noche y 1 h durante la mañana, procurando en todo momento interferir lo menos posible con las visitas. Los murciélagos y colibríes se identificaron a nivel de especie mediante claves (Medellín, Arita y Sánchez, 1997; Peterson y Chalif, 1976) y se liberaron posteriormente. Los insectos fueron capturados con redes entomológicas cuando visitaban inflorescencias dentro de la misma población y montados para su posterior identificación por los especialistas M. en C. Olivia Yáñez, de la colección entomológica del Museo de Zoología Alfonso L. Herrera, Facultad de Ciencias, UNAM, México, y el Dr. Jorge León Cortés de EcoSur, San Cristóbal de las Casas, Chiapas, México.
Criterios de identificación en videoSe obtuvo un total de 120h continuas de grabación de las 5 inflorescencias observadas, 24h por cada inflorescencia. Para identificar a los visitantes a través del video, se consideraron las siguientes características: tamaño, morfología y patrones de coloración para asignar a una especie potencial. Debido a que las cámaras se encontraban fijas y a la misma distancia, se pudieron utilizar criterios de tamaño (Medellín et al., 1997) y de comportamiento durante el forrajeo para identificar a los murciélagos. Leptonycteris nivalis es alrededor de una tercera parte más grande que L. yerbabuenae (Dr. Alberto Rojas, com. pers.) y C. mexicana, gracias a su larga lengua, no toca la inflorescencia con su cuerpo de manera violenta, a diferencia de L. yerbabuenae, que debe meter el hocico en la flor, entrando en contacto cabeza, vientre y patas con la inflorescencia, particularmente con el estilo y estambre de las flores. Para contabilizar los insectos, se consideraron el tamaño y el patrón de coloración, tomando como referencia los ejemplares capturados e identificados posteriormente. En la cuantificación de las visitas y la determinación del papel de los visitantes, se analizaron los organismos que tuvieron contacto directo con flores con anteras funcionales y/o con el estigma receptivo, ya que las flores no secretan néctar antes de su etapa funcional, aunque se encuentren abiertas. Se registraron el número de visitas y el horario de la actividad. Cada visita se consideró como concluida cuando el organismo salía del campo de visión del lente de la cámara.
Riqueza y diversidad de especies visitantes y comparación entre localidadesSe calcularon 2 índices de diversidad que combinan riqueza y uniformidad: el índice de Shannon-Wiener y la expresión inversa del índice de diversidad de Simpson (Krebs, 1989). El índice de Simpson se calculó con la fórmula S = 1 –∑ (pi)2, donde pi es la proporción de cada especie; el inverso de este mismo índice se calculó con la fórmula Sinversa= 1/D (Krebs, 1978). El índice Shannon-Wiener se calculó con la fórmula (Krebs, 1989):
donde pi es la abundancia relativa de cada visitante a partir de las visitas registradas (Begon, Harper y Townsend, 1996).Se realizó un análisis de rarefacción con el programa EcoSim 700 (Gotelli y Entsminger, 2004) para proyectar la curva de acumulación de especies sobre la base de los muestreos realizados en las localidades, y así estimar la cantidad probable de especies que componen la comunidad de visitantes florales (Hughes y Bohannan, 2004). El índice de similitud de Sorensen mide la distancia en composición de especies entre 2 muestras; se calculó con la fórmula Ss = 2a / (2a + b + c) (Krebs, 1989), donde a son las especies comunes a las 2 muestras, b las especies solo registradas en la primera muestra excluyendo las comunes y c las especies que solo se encuentran en la segunda muestra. Los resultados finales de este índice se graficaron mediante un dendograma aglomerativo de medias pareadas (UPGMA) de las inflorescencias construido con el programa PHYLIP versión 3.2 (Felsenstein, 1989). Relacionado con el índice anterior, se calculó el índice de especificidad, es decir, índice de similitud proporcional con la fórmula de Kay y Schemske (2003), que considera tanto la tasa relativa de visitas como la identidad de los mismos. La fórmula del índice de especificidad utilizada para este trabajo fue:
donde Pai es la proporción de visitas por especie en la inflorescencia A y Pbi es la proporción de visitas por especie en la inflorescencia B. Este índice toma valores de 0 a 1 y brinda una idea clara de las similitudes de recursos florales entre las diferentes especies de visitantes.Los datos obtenidos de las observaciones por inflorescencia se analizaron mediante un análisis de correspondencias, el cual se basa en una prueba de la χ2 para contrastar las frecuencias de visitas e inferir si presentan diferencias significativas con el programa estadístico JMP (SAS Institute, 1997), para corroborar las relaciones mostradas por el árbol con el método de agrupamiento jerárquico, UPGMA.
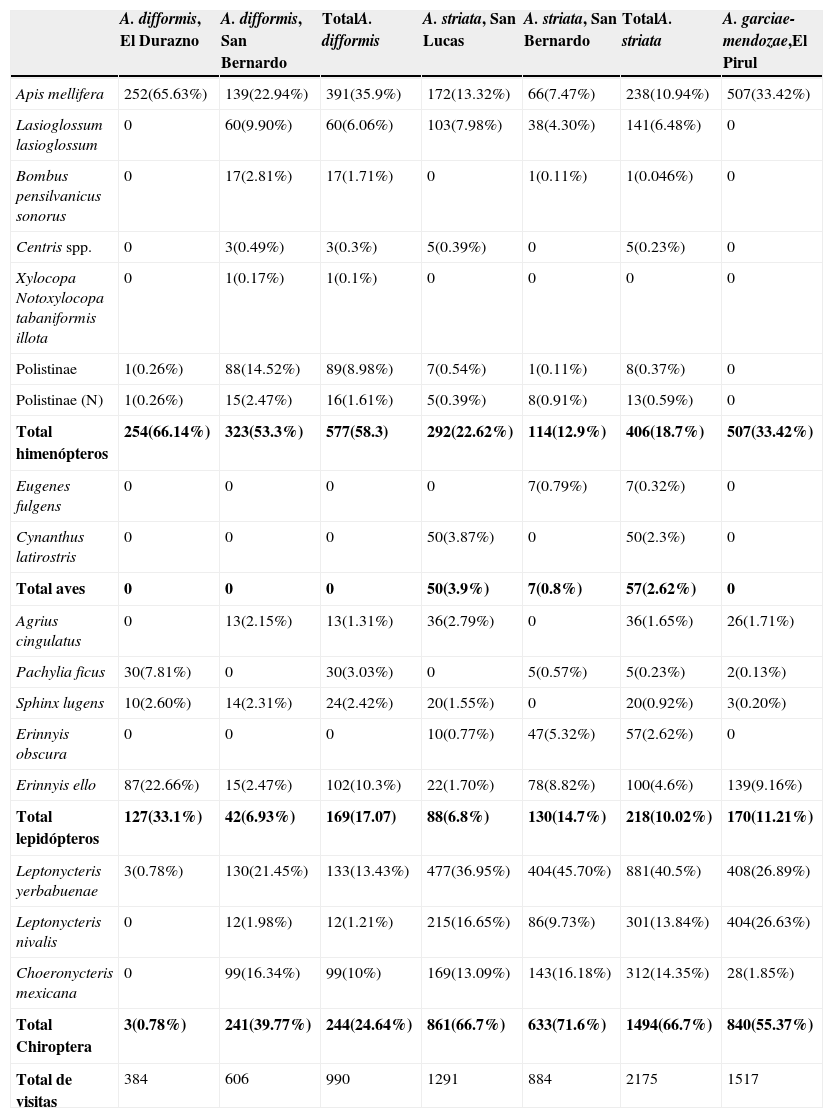
ResultadosEn la tabla 2 se resumen los datos de visitantes por especie y localidad. A partir del análisis de composición de los visitantes florales de las distintas especies observadas, se determinaron 3 principales grupos de visitantes de las inflorescencias de Agave spp.: murciélagos, aves e insectos. Dentro de estos grupos se identificaron 3 especies de murciélagos Phyllostomidae (C. mexicana, L. nivalis y L. yerbabuenae), 2 especies de colibríes (Eugenes fulgens y Cyanthus latirostris), 5 de esfíngidos (Agrius cingulatus, Pachylia ficus, Sphinx lugens, Erinnyis obscura y E. ello) y 8 de himenópteros (Lasioglossum lasioglossum, Bombus pensilvanicus, Centris spp., Xylocopa Notoxylocopa, así como miembros de la tribu Polistinae) (tabla 2).
Número y porcentaje de visitas de las especies filmadas realizando alguna actividad sobre las inflorescencias.
| A. difformis, El Durazno | A. difformis, San Bernardo | TotalA. difformis | A. striata, San Lucas | A. striata, San Bernardo | TotalA. striata | A. garciae-mendozae,El Pirul | |
|---|---|---|---|---|---|---|---|
| Apis mellifera | 252(65.63%) | 139(22.94%) | 391(35.9%) | 172(13.32%) | 66(7.47%) | 238(10.94%) | 507(33.42%) |
| Lasioglossum lasioglossum | 0 | 60(9.90%) | 60(6.06%) | 103(7.98%) | 38(4.30%) | 141(6.48%) | 0 |
| Bombus pensilvanicus sonorus | 0 | 17(2.81%) | 17(1.71%) | 0 | 1(0.11%) | 1(0.046%) | 0 |
| Centris spp. | 0 | 3(0.49%) | 3(0.3%) | 5(0.39%) | 0 | 5(0.23%) | 0 |
| Xylocopa Notoxylocopa tabaniformis illota | 0 | 1(0.17%) | 1(0.1%) | 0 | 0 | 0 | 0 |
| Polistinae | 1(0.26%) | 88(14.52%) | 89(8.98%) | 7(0.54%) | 1(0.11%) | 8(0.37%) | 0 |
| Polistinae (N) | 1(0.26%) | 15(2.47%) | 16(1.61%) | 5(0.39%) | 8(0.91%) | 13(0.59%) | 0 |
| Total himenópteros | 254(66.14%) | 323(53.3%) | 577(58.3) | 292(22.62%) | 114(12.9%) | 406(18.7%) | 507(33.42%) |
| Eugenes fulgens | 0 | 0 | 0 | 0 | 7(0.79%) | 7(0.32%) | 0 |
| Cynanthus latirostris | 0 | 0 | 0 | 50(3.87%) | 0 | 50(2.3%) | 0 |
| Total aves | 0 | 0 | 0 | 50(3.9%) | 7(0.8%) | 57(2.62%) | 0 |
| Agrius cingulatus | 0 | 13(2.15%) | 13(1.31%) | 36(2.79%) | 0 | 36(1.65%) | 26(1.71%) |
| Pachylia ficus | 30(7.81%) | 0 | 30(3.03%) | 0 | 5(0.57%) | 5(0.23%) | 2(0.13%) |
| Sphinx lugens | 10(2.60%) | 14(2.31%) | 24(2.42%) | 20(1.55%) | 0 | 20(0.92%) | 3(0.20%) |
| Erinnyis obscura | 0 | 0 | 0 | 10(0.77%) | 47(5.32%) | 57(2.62%) | 0 |
| Erinnyis ello | 87(22.66%) | 15(2.47%) | 102(10.3%) | 22(1.70%) | 78(8.82%) | 100(4.6%) | 139(9.16%) |
| Total lepidópteros | 127(33.1%) | 42(6.93%) | 169(17.07) | 88(6.8%) | 130(14.7%) | 218(10.02%) | 170(11.21%) |
| Leptonycteris yerbabuenae | 3(0.78%) | 130(21.45%) | 133(13.43%) | 477(36.95%) | 404(45.70%) | 881(40.5%) | 408(26.89%) |
| Leptonycteris nivalis | 0 | 12(1.98%) | 12(1.21%) | 215(16.65%) | 86(9.73%) | 301(13.84%) | 404(26.63%) |
| Choeronycteris mexicana | 0 | 99(16.34%) | 99(10%) | 169(13.09%) | 143(16.18%) | 312(14.35%) | 28(1.85%) |
| Total Chiroptera | 3(0.78%) | 241(39.77%) | 244(24.64%) | 861(66.7%) | 633(71.6%) | 1494(66.7%) | 840(55.37%) |
| Total de visitas | 384 | 606 | 990 | 1291 | 884 | 2175 | 1517 |
Las negritas indican el total de visitas y su porcentaje por grupos y de manera global.
Generalmente, los murciélagos dominan las visitas nocturnas (fig. 2), excepto en la inflorescencia de A. difformis de la población El Durazno, donde son más comunes los esfíngidos (33.1% del total de visitas). Los esfíngidos visitaron todas las inflorescencias estudiadas, representando entre el 6.8 y el 17.1% del total de las visitas. Entre los visitantes diurnos, el más importante es A. mellifera, con porcentajes de visita entre el 7.5 y el 65.6%. L. lasioglossum y diversas avispas también fueron importantes en algunas poblaciones. Otras abejas, como Xylocopa, Bombus y Centris solo se encontraron en algunas inflorescencias, y su contribución a la polinización parece ser actualmente limitada. Los colibríes solo se grabaron en las 2 localidades de A. striata (véase adelante).
El total de visitas por especie durante las 24h se presenta en la figura 3. En las 3 especies de agave se encontraron representados al menos 3 de los 4 grupos de visitantes: himenópteros, esfíngidos (lepidópteros), quirópteros o aves (tabla 2). Se observa diferenciación en las especies de visitantes dependiendo de la hora del día y se distinguen 2 picos de actividad muy claros: durante el día y en la noche.
Agave difformisEn esta especie, el número de visitas por abejas y esfíngidos fue mayor que las realizadas por murciélagos (figs. 2 y 3; tabla 2). En El Durazno solo se contaron 3 visitas de murciélagos, todas por L. yerbabuenae, mientras que en la población de San Bernardo los murciélagos fueron más abundantes, en total el 39.8%. La especie de esfíngido más común en El Durazno fue E. ello (22.6%), mientras que en San Bernardo fueron casi igual de abundantes las visitas por 3 especies de esfíngido: E. ello (2.47%), S. lugens (2.31%) y A. cingulatus (2.15%).
Agave garcia-mendozaeEn esta inflorescencia los visitantes dominantes fueron las 3 especies de murciélagos y nuevamente la especie más abundante fue L. yerbabuenae (26.89%), junto a L. nivalis (26.63%), mientras que las visitas por C. mexicana (1.85%) fueron raras. Respecto a los esfíngidos, la especie dominante fue de nuevo E. ello (9.16%), iniciando su actividad antes que los murciélagos. La única abeja registrada fue A. mellifera (33.42%).
Agave striataEn contraste con las 2 especies anteriores, en este agave se observa actividad de visitantes de manera prácticamente continua. L. yerbabuenae (45.7%) fue el visitante más numeroso. En San Lucas, el segundo murciélago más abundante fue L. nivalis (16.6%), mientras que en San Bernardo fue C. mexicana (14.3%). En este agave en particular se pudo constatar que los individuos de L. nivalis (9.73%) «perchaban» en la inflorescencia, entrando en contacto con la totalidad de su cuerpo y la sección de la inflorescencia con flores activas, lo cual los hace eficientes polinizadores. En A. striata los esfíngidos solo realizaron el 10.02% de las visitas, siendo el más importante A. cingulatus en San Lucas (2.79%) y E. ello en San Bernardo (8.8%). Los registros de colibríes en A. striata fueron escasos, E. fulgens en San Bernardo (0.79%) y C. latirostris en San Lucas (3.87%). En relación con los himenópteros, A. mellifera es el visitante más importante, seguido de L. lasioglossum (6.48%).
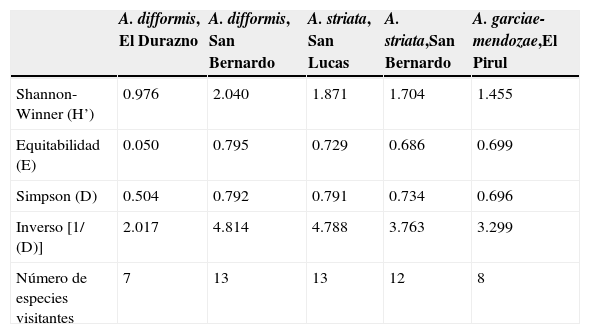
Índices de diversidadEl índice Shannon-Wiener (tabla 3) muestra que la inflorescencia con mayor diversidad de visitantes fue A. difformis en San Bernardo, donde se registraron 13 especies de visitantes. A. striata en San Lucas también fue visitada por 13 especies de animales. La menor diversidad se registró en la localidad El Durazno en A. difformis, con 7 especies, y donde claramente dominaron las visitas de A. mellifera y el esfíngido E. ello (tabla 2). Según el índice de Simpson (tabla 3), el valor más elevado de diversidad fue de A. difformis en San Bernardo, que de nuevo fue muy similar al obtenido para A. striata en la localidad de San Lucas. El valor más bajo se registró en A. difformis en la localidad de El Durazno. Una forma más intuitiva de interpretar el índice de Simpson es usando el valor 1/ (1-índice de Simpson), que se puede entender como el «número de especies efectivas». Las inflorescencias de A. difformis en San Bernardo y A. striata en San Lucas presentaron un número de «especies efectivas» cercano a 5, aunque en total eran 13 especies visitantes. Para la inflorescencia de A. difformis en la comunidad de El Durazno, el número de especies efectivas fue solo de 2.
Índices de diversidad (véase texto para fórmulas y referencias) obtenidos a partir del número de visitas a las inflorescencias.
| A. difformis, El Durazno | A. difformis, San Bernardo | A. striata, San Lucas | A. striata,San Bernardo | A. garciae-mendozae,El Pirul | |
|---|---|---|---|---|---|
| Shannon-Winner (H’) | 0.976 | 2.040 | 1.871 | 1.704 | 1.455 |
| Equitabilidad (E) | 0.050 | 0.795 | 0.729 | 0.686 | 0.699 |
| Simpson (D) | 0.504 | 0.792 | 0.791 | 0.734 | 0.696 |
| Inverso [1/ (D)] | 2.017 | 4.814 | 4.788 | 3.763 | 3.299 |
| Número de especies visitantes | 7 | 13 | 13 | 12 | 8 |
El análisis de rarefacción (fig. 4) muestra que las curvas de acumulación de especies de A. garciae-mendozae y A. difformis en la localidad de El Durazno resultaron más parecidas y menos diversas; se sobreponen sin mostrar grandes diferencias y las curvas alcanzan la asíntota en una diversidad de visitantes florales de 8 especies. La inflorescencia de A. striata en la localidad de San Bernardo es un poco más diversa y se encuentra en un punto muy cercano a la asíntota, que podría llegar a 13 especies de visitantes florales. Las inflorescencias con mayor cantidad de especies de visitantes fueron A. striata en San Lucas y A. difformis en San Bernardo, las cuales no mostraron diferencias entre ellas y llegan rápidamente a la asíntota, con 13 especies en unas 500 visitas.
El índice de similitud de Sorensen (fig. 5), calculado sobre la base de los visitantes, mostró que las inflorescencias comparten la mayoría de las especies. La mayor similitud se observó entre las inflorescencias de A. difformis. Las siguientes 2 inflorescencias con visitantes más parecidos fueron A. striata en la localidad de San Bernardo y la inflorescencia de A. garciae-mendozae. La mayor diferencia en los visitantes se observó entre las inflorescencias de A. difformis, A. garciae-mendozae y A. striata en la localidad de San Bernardo, respecto de la inflorescencia de A. striata en la localidad de San Lucas, aunque estas fueron las más cercanas entre sí (3.69km).
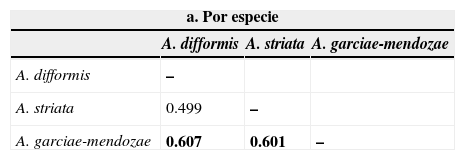
El índice de especificidad propuesto por Kay y Schemske (2003) (tabla 4a) a nivel especie indica que A. garciae-mendozae comparte en mayor grado las especies visitantes con A. difformis, seguido de manera muy cercana por A. striata, mientras que la mayor diferencia se encontró entre las especies A. difformis y A. striata. Sin embargo, el mismo índice aplicado para comparar cada una de las localidades (tabla 4b) muestra que la mayor sobreposición se encuentra entre los 2 sitios de la especie A. striata. La sobreposición de A. striata en San Lucas respecto de A. garciae-mendozae y la sobreposición entre esta última con A. striata en la localidad de San Bernardo son altas. El grado de similitud más bajo resultó entre las inflorescencias que corresponden a la misma especie en A. difformis en El Durazno y San Bernardo, y entre A. difformis en El Durazno y A. striata en San Lucas, y entre A. difformis en El Durazno y A. striata en San Bernardo.
Índice especificidad (similitud proporcional) de Kay y Schemske (2003) aplicado: a) por especie y b) por sitio (inflorescencia).
| a. Por especie | |||
|---|---|---|---|
| A. difformis | A. striata | A. garciae-mendozae | |
| A. difformis | – | ||
| A. striata | 0.499 | – | |
| A. garciae-mendozae | 0.607 | 0.601 | – |
| b. Por sitio | |||||
|---|---|---|---|---|---|
| A. difformis, El Durazno | A. difformis, San Bernardo | A. striata, San Lucas | A. striata,San Bernardo | A. garciae-mendozae,El Pirul | |
| A. difformis, El Durazno | – | ||||
| A. difformis, San Bernardo | 0.164 | – | |||
| A. striata, San Lucas | 0.178 | 0.508 | – | ||
| A. striata, San Bernardo | 0.180 | 0.469 | 0.730 | – | |
| A. garciae-mendozae, El Pirul | 0.437 | 0.399 | 0.623 | 0.549 | – |
Se señalan con negritas los valores mayores a la media.
De acuerdo con el análisis de correspondencia (fig. 6), algunas especies de visitantes florales tuvieron mayor «afinidad» por una o más inflorescencias. Las especies visitantes que se observan más céntricas en la figura se encontraron en la mayoría de las poblaciones, mientras que los visitantes más lejanos al centro tienen mayor «afinidad» por la población que se encuentre más cercana a su ubicación. Así, quedan cerca del centro las 2 especies de Leptonycteris, A. mellifera y 3 especies de esfíngido, A. cingulatus, E. ello y S. lugens, mientras que se alejan las que solo se encontraron en pocas o en una especie/localidad, especialmente los colibríes, que solo visitaron A. striata. Por otra parte, las abejas y las avispas, a excepción de A. mellifera, se encuentran más cercanas a las A. striata y a la localidad con menor cantidad de visitantes nocturnos, A. difformis en la localidad de El Durazno.
DiscusiónComo un primer paso para entender el papel ecológico que desempeñan los visitantes florales y los procesos evolutivos que han acompañado a las interacciones entre estos y las plantas que visitan, se requieren observaciones detalladas. En el presente trabajo se analizaron, durante 24h continuas, diferentes aspectos de esta interacción, comparando 3 especies cercanas de un género (Agave). En el estudio obtuvimos datos del número de visitas y el tamaño de los organismos, siendo este último un criterio para estimar la posibilidad de carga de polen y contacto con estructuras reproductoras. Todos los datos anteriores son útiles para definir el papel de cada visitante floral en la polinización de la planta (Eguiarte y Búrquez, 1987; Fenster et al., 2004; Quesada, Stoner, Rosas-Guerrero, Palacios-Guevara y Lobo, 2003; Stoner, Quesada, Rosas-Guerrero y Lobo, 2002; Thompson, 2001; Waser, Chittka, Price, Williams y Ollerton, 1996).
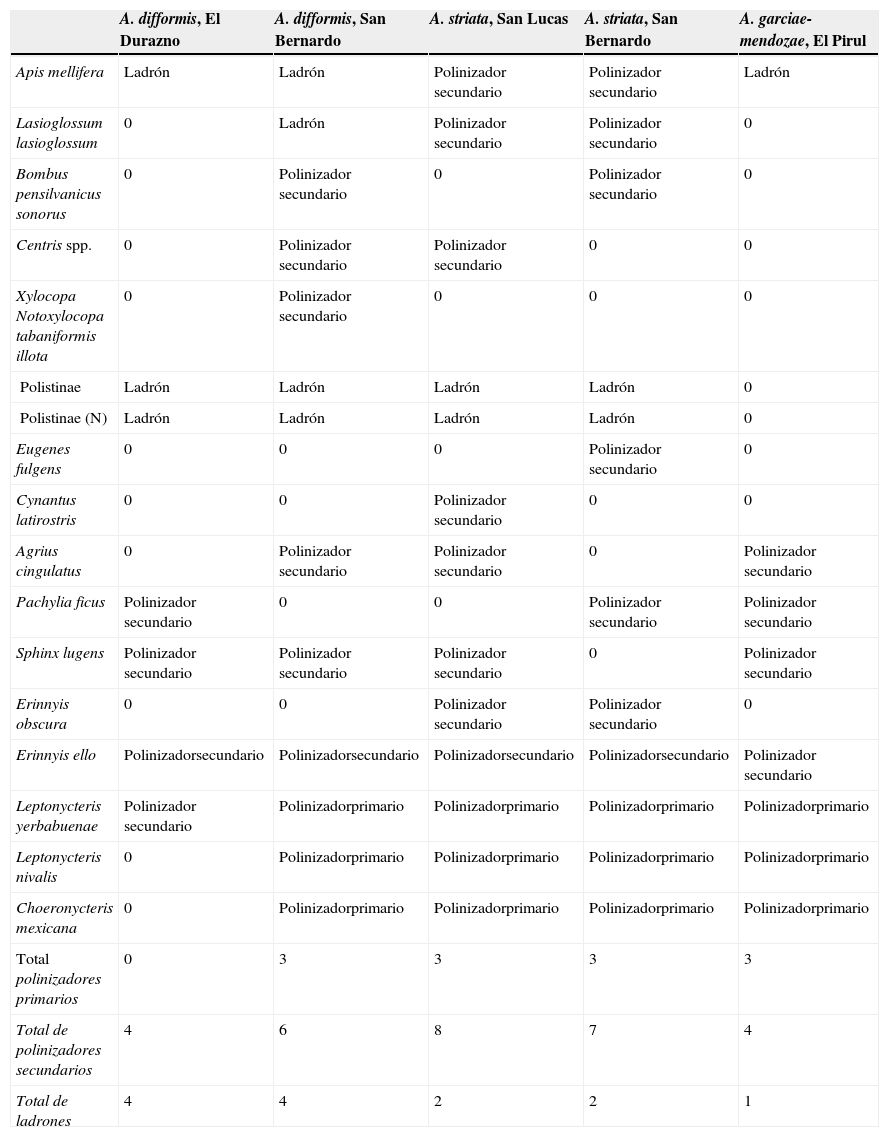
En la tabla 5 proponemos una clasificación de los visitantes registrados en este estudio en función de su abundancia, patrón de visita, conducta, tamaño y morfología. Se clasifican como polinizadores primarios cuando sus visitas son numerosas en una especie de planta y localidad, así como cuando el contacto con estigmas y anteras sucede con alta frecuencia y las visitas ocurren a las horas de liberación del polen; como polinizadores secundarios si son visitantes más raros y su presencia y contacto con estigmas sucede con menor frecuencia y durante las horas de producción escasa o nula de polen, o como ladrones si rara vez o nunca toca los estambres y anteras, pero colectan polen o néctar. Estudios posteriores, analizando experimentalmente el tamaño de la carga polínica y las tasas de deposición de polen de la propia especie (Dafni, 1992), confirmarán o no nuestra propuesta de clasificación.
El posible papel de cada especie de visitante, por inflorescencias por especie, inferido a partir de su abundancia, patrón de visita, conducta, tamaño y morfología.
| A. difformis, El Durazno | A. difformis, San Bernardo | A. striata, San Lucas | A. striata, San Bernardo | A. garciae-mendozae, El Pirul | |
|---|---|---|---|---|---|
| Apis mellifera | Ladrón | Ladrón | Polinizador secundario | Polinizador secundario | Ladrón |
| Lasioglossum lasioglossum | 0 | Ladrón | Polinizador secundario | Polinizador secundario | 0 |
| Bombus pensilvanicus sonorus | 0 | Polinizador secundario | 0 | Polinizador secundario | 0 |
| Centris spp. | 0 | Polinizador secundario | Polinizador secundario | 0 | 0 |
| Xylocopa Notoxylocopa tabaniformis illota | 0 | Polinizador secundario | 0 | 0 | 0 |
| Polistinae | Ladrón | Ladrón | Ladrón | Ladrón | 0 |
| Polistinae (N) | Ladrón | Ladrón | Ladrón | Ladrón | 0 |
| Eugenes fulgens | 0 | 0 | 0 | Polinizador secundario | 0 |
| Cynantus latirostris | 0 | 0 | Polinizador secundario | 0 | 0 |
| Agrius cingulatus | 0 | Polinizador secundario | Polinizador secundario | 0 | Polinizador secundario |
| Pachylia ficus | Polinizador secundario | 0 | 0 | Polinizador secundario | Polinizador secundario |
| Sphinx lugens | Polinizador secundario | Polinizador secundario | Polinizador secundario | 0 | Polinizador secundario |
| Erinnyis obscura | 0 | 0 | Polinizador secundario | Polinizador secundario | 0 |
| Erinnyis ello | Polinizadorsecundario | Polinizadorsecundario | Polinizadorsecundario | Polinizadorsecundario | Polinizador secundario |
| Leptonycteris yerbabuenae | Polinizador secundario | Polinizadorprimario | Polinizadorprimario | Polinizadorprimario | Polinizadorprimario |
| Leptonycteris nivalis | 0 | Polinizadorprimario | Polinizadorprimario | Polinizadorprimario | Polinizadorprimario |
| Choeronycteris mexicana | 0 | Polinizadorprimario | Polinizadorprimario | Polinizadorprimario | Polinizadorprimario |
| Total polinizadores primarios | 0 | 3 | 3 | 3 | 3 |
| Total de polinizadores secundarios | 4 | 6 | 8 | 7 | 4 |
| Total de ladrones | 4 | 4 | 2 | 2 | 1 |
0: indica que no hubo visitas por esa especie en esa localidad/especie de Agave.
Para describir y evaluar adecuadamente el papel de todos los visitantes florales durante el proceso de polinización se requiere de observaciones durante todo el tiempo que estén abiertas las flores, como hicimos en este estudio. Además, para tener un panorama más claro, es importante contar con observaciones en distintas localidades o épocas del año cuando haya flores y entre diferentes años (Fenster et al., 2004; Silva-Montellano y Eguiarte, 2003; Thompson, 2001; Waser et al., 1996). Los datos previos de González-González (2004) y Rocha et al. (2005) nos dan datos de otros años y localidades. Recientemente, se ha utilizado, como en este estudio, el análisis en video para revisar con mejor detalle la dinámica de visitas (Quesada et al., 2003 y Stoner et al., 2002).
Los agaves de la Barranca de Metztitlán muestran síndromes de polinización nocturnos, con diferencias menores en la hora en la que producen mayor cantidad de néctar, con excepción de A. striata, que inicia la producción de néctar durante la tarde y la mantiene hasta la mañana siguiente (Rocha et al., 2005). En el presente trabajo se confirma la presencia de murciélagos en agaves con inflorescencias espigadas, como habían documentado González-González (2004) y Rocha et al. (2005, 2006). Es indudable la participación de los murciélagos nectarívoros en la polinización de las flores de estos agaves, debido a que su presencia coincide con los momentos de mayor producción de néctar, con la liberación de polen viable, así como por su abundancia y porque en sus visitas toca tanto las anteras como los estigmas de las flores. Anteriormente se pensaba que los agaves de inflorescencias espigadas eran visitados solo por insectos nocturnos y visitantes diurnos, los cuales llevaban a cabo la polinización (véanse revisiones en Eguiarte et al., 2000 y Slauson, 2001).
Los polinizadores primarios de las 3 especies de Agave estudiadas, tanto por su abundancia como por su conducta, son murciélagos nectarívoros. En primer lugar, tenemos a L. yerbabuenae, en segundo a L. nivalis y, por último, C. mexicana. Sin embargo, C. mexicana tal vez no sea un polinizador tan eficiente, ya que los registros indican que debido a su larga lengua no contacta los estigmas tanto como Leptonycteris. Además, C. mexicana realizó considerablemente menos visitas que las otras especies quirópteras. Aunque Rocha et al. (2005) también documentan visitas por Glossophaga spp. a agaves en la Barranca de Metztitlán, esta especie no fue registrada en el presente trabajo. Los murciélagos son los polinizadores primarios, los más abundantes y más efectivos para los agaves estudiados, pero los esfíngidos son otros visitantes comunes en las flores de Agave. Sin embargo, nuestras observaciones indican que no son tan efectivos en la polinización como los murciélagos, ya que, además de ser generalmente menos numerosos, usualmente no tocan los estigmas y las anteras, gracias a sus largas lenguas y menor tamaño corporal que les permiten extraer el néctar revoloteando sin acercarse tanto a las flores y, por eso, los clasificamos en la tabla 5 como polinizadores secundarios.
En términos generales, los esfíngidos y los murciélagos al anochecer primero visitan a A. striata, que produce néctar más temprano; luego se pasan a A. difformis y, por último, antes del amanecer, visitan A. garciae-mendozae. Si no hay o llegan pocos murciélagos que consuman los recursos en la noche, estos son utilizados por otros visitantes tanto nocturnos, como los esfíngidos, como diurnos, en particular por A. mellifera. En este estudio detectamos 5 especies de esfíngidos, dominando en muchos casos E. ello. Estos datos detallados son importantes, ya que en los estudios previos sobre polinización de Agave solo se mencionan visitas de esfíngidos, sin mencionar la especie, o únicamente registra una (Hyles lineata en Silva-Montellano y Eguiarte, 2003 y en Rocha et al., 2005).
En general, las abejas A. mellifera son importantes visitantes florales (ver, por ejemplo, Campos-Navarrete, Parra-Tabla, Ramos-Zapata, Díaz-Castelazo y Reyes-Novelo, 2013 y Osorio-Berenstein, Domínguez, Eguiarte y Benrey, 1997) y los agaves de Metztitlán no son una excepción. En esta barranca, son las principales ladrones de néctar y polen, ya que por su tamaño rara vez llevan a cabo polinización. Sin embargo, en A. striata por tener flores pequeñas, y por tocar en pocas ocasiones los estigmas consideramos A. mellifera como polinizador secundario. El impacto de esta especie puede limitar el papel de otros posibles polinizadores, como los colibríes, al remover todo el polen disponible. Las otras especies de abejas usualmente fueron minoritarias, con excepción de L. lasioglossum, que llegó a ser casi el 10% de las visitas en una población de A. difformis y el 8% en otra de A. striata. Solo se registraron 2 especies de colibríes en estos agaves, E. fulgens y C. latirostris, que son, en general, abundantes en el centro de México (Peterson y Chalif, 1976), y solo visitó la especie más «diurna» de agave: A. striata. Los patrones de visitas se corresponden, en general, con los registrados en otros muestreos con otras metodologías en años anteriores. Sin embargo, en A. striata, Rocha et al. (2005) encontraron que los murciélagos solo representaron el 20% de las visitas, mientras que los visitantes diurnos, A. mellifera, abejorros y colibríes, constituyeron más del 70% de las visitas. González-González (2004) menciona pocas visitas por esfíngidos, aunque no las cuantifica, a A. garciae-mendozae, mientras que en este estudio llegaron a constituir el 11.20% de las visitas. También es interesante que mientras que en el estudio de Rocha et al. (2005) las comunidades de polinizadores más diferentes fueron entre A. striata y las otras especies, en este estudio A. garciae-mendozae resultó muy parecido a A. striata. Las diferencias encontradas entre estos estudios y el presente se atribuyen a que las comparaciones que se llevaron a cabo en el trabajo de Rocha et al. (2005) no tomaron en cuenta a A. garciae-mendozae y a que el esfuerzo y el objetivo de muestreo enfocado hacia los visitantes en este trabajo fue mucho mayor que en los previos, además de diferencias entre años y sitios en los patrones de vista.
Las inflorescencias de A. striata mostraron sobreposición de nicho y similitud de visitantes floreales (valores por encima de 0.5; ambos índices tienen una escala que va de 0 a 1) como se esperaba, mientras que las 2 poblaciones de A. difformis fueron muy diferentes entre sí, principalmente debido a la ausencia casi total de murciélagos en El Durazno.
En trabajos anteriores se enfatizaba la diferencia en los subgéneros de Agave sobre la base de la dinámica de su polinización, haciendo énfasis en que los agaves paniculados eran principalmente polinizados por murciélagos (Arizaga et al., 2000; Howell y Roth, 1981), aunque en áreas extratropicales, cerca del límite norte de la distribución de los murciélagos nectarívoros, los insectos polinizadores se vuelven muy importantes (Molina-Freaner y Eguiarte, 2003; Slauson, 2001). En agaves con inflorescencia espigada solo se tenían datos de visitas por insectos y colibríes (Schaffer y Schaffer, 1977; Silva-Montellano y Eguiarte, 2003), aunque en un género muy cercano, Manfreda (Flores, 2007; Good-Ávila, Souza, Gaut y Eguiarte, 2006), ya se había registrado a los murciélagos como principales polinizadores en algunas poblaciones (Eguiarte y Búrquez, 1987). Hay estudios que muestran un síndrome de polinización nocturno en A. chrysantha y A. palmeri en Arizona; sin embargo, las tasas de visitas diurnas son mayores en comparación con los visitantes nocturnos (Slauson, 2000). En algunos casos, se menciona la polinización exclusivamente por visitantes diurnos, como en A. schottii, A. parviflora, A. toumeyana (con inflorescencia espigada) y A. palmeri (de inflorescencia ramificada), todas en Arizona (Schaffer y Schaffer, 1977). En cuanto a A. lechuguilla, que presenta inflorescencia espigada, muchas poblaciones son principalmente visitadas por animales diurnos, y no se registraron visitas por murciélagos en un amplio rango latitudinal involucrando numerosas poblaciones (Silva-Montellano y Eguiarte, 2003), aunque en ambos estudios la mayoría de las características florales apuntaban a una polinización nocturna. Sin embargo, la presencia de aves en las inflorescencias abre la posibilidad de que estos visitantes cubran los requisitos para realizar la polinización. Los parámetros de los diferentes índices de diversidad, similitud y sobreposición de nicho muestran que las inflorescencias de especies de Agave ofrecen sus recursos a cualquier visitante que sea capaz de obtenerlos. La mayor parte de las flores, especialmente de las especies más exitosas en su polinización, son visitadas y utilizadas por una miríada de visitantes, que pueden o no ser polinizadores (Bascompte, Jordano, Melián y Olesen, 2003; Fenster et al., 2004; Rosas-Guerrero et al., 2014; Waser et al., 1996).
Podemos concluir que la relación entre los visitantes florales y los agaves es compleja, es decir, cada visitante puede desempeñar distintos roles de acuerdo con el horario de actividad y los recursos disponibles. Las características florales de los agaves estudiados muestran una tendencia hacia la polinización nocturna y cercana a la quiropterofilia, con cierta variación entre especies, pero sus visitantes florales son comunidades diversas y de explotación mutua, que varían en el espacio y en el tiempo debido a la gran cantidad de recursos que representan, y a la relativa accesibilidad con las que lo ofrecen. Hay visitantes que pueden actuar de manera mutualista, como polinizadores primarios o secundarios, pero también hay otros visitantes florales que actúan de manera antagonista, como ladrones de néctar y/o polen, sin polinizar, y estos papeles pueden cambiar en distintas circunstancias (Gómez, 2002; Maloof e Inouye, 2000; Rosas-Guerrero et al., 2014; Tschapka y Dressler, 2002). Esta diversidad puede «flexibilizar» el sistema de polinización en los agaves, manteniéndolo como un sistema generalista, pero altamente eficiente, ya que el número de especies de polinizadores primarios y secundarios es relativamente extensa (Rocha et al., 2005, 2006; Waser et al., 1996). Retomando nuestra pregunta inicial, los polinizadores de los agaves estudiados en la Barranca de Metztitlán fueron, en orden decreciente, los murciélagos nectarívoros L. yerbabuenae, L. nivalis y C. mexicana como polinizadores primarios, mientras que el polinizador secundario más común fue el esfíngido E. ello.
La investigación se realizó como parte de la tesis de licenciatura del primer autor con apoyo de los proyectos Semarnat-Conacyt 2002 C01-0246, Conacyt SEP-2004-C01-46475-Q y Papiit UNAM IN224309-3, y se escribió durante un sabático del Dr. Luis E. Eguiarte en el laboratorio del Dr. Brandon Gaut en UCI, con apoyo de UC-Mexus Conacyt y un complemento de beca y año sabático de la DGAPA, UNAM. Las abejas se identificaron en el Museo de Zoología de la Facultad de Ciencias, UNAM, bajo la asesoría de la M. en C. Olivia Yáñez. Los esfíngidos fueron identificados por el Dr. Jorge León-Cortés de EcoSur, San Cristóbal de las Casas, Chiapas. Se agradece al MVZ Manuel Gabriel Rosas-Barrera, quien ayudó con aspectos de la logística del proyecto, así como el manejo de los animales en campo. Se le agradece de manera especial al señor Erasto Badillo y a las autoridades de la Reserva de la Biosfera Barranca de Metztitlán, por el apoyo brindado durante la estancia en la reserva, así como al biólogo Aldo Valera-Vázquez y a la Dra. Martha Rocha por su apoyo en el trabajo de campo, diseño y desarrollo del proyecto. A la Dra. Irma González, por su revisión y crítica al presente manuscrito.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.