Se amplía la información sobre distribución, hábitat y medidas somáticas y craneales de las 6 especies de felinos que se distribuyen en nuestro país y que se encuentran en Guerrero. La presencia de estas especies se obtuvo a través de métodos directos y registros indirectos. Lynx rufus está representado por la piel y el cráneo de un joven y es el segundo registro para el estado; mientras que Puma concolor, Puma yagouaroundi, Leopardus pardalis, Leopardus wiedii y Panthera onca incrementan su área de distribución en el estado. Las principales amenazas para estos felinos son la fragmentación del hábitat y la cacería furtiva.
Information on distribution, habitat and measurements of the 6 species of cats found in Mexico and in Guerrero is provided. The specimens were recorded through direct and indirect methods. Lynx rufus is represented by the skin and skull of a young specimen and it is the second record for the state, while Puma concolor, Puma yagouaroundi, Leopardus pardalis, Leopardus wiedii and Panthera onca increase its distribution range in the state. The main threats to cats are habitat fragmentation and poaching.
En el estado de Guerrero se distribuyen las 6 especies de felinos que se encuentran en México (Hall, 1981) y a pesar de su tamaño y de que se consideran trofeos de cacería (Leopold, 1959), hay muy pocos registros en la literatura para la entidad. Tres de las 6 especies se han citado de 5 localidades: el tigrillo (Leopardus wiedii), de Acahuizotla, 853-1 219m; 3.2 km O de Omiltemi, 2 408m (Davis y Lukens, 1958); puente de Los Lugardos, Filo de Caballo (León y Romo, 1991) y Omiltemi (León y Romo, 1991; Jiménez-Almaraz et al., 1993). El jaguar (Panthera onca) de Atoyac (Neumann, 1906), Acapulco, Papayo (Nelson y Goldman, 1933), Chapolapa, 305m (Davis y Lukens, 1958) y de 3 km S Puerto del Gallo (León y Romo, 1991; Jiménez-Almaraz et al., 1993). El ocelote (Leopardus pardalis) de Acapulco, Coyuca, Papayo (Goldman, 1925), Omiltemi (Goldman, 1925; Hall, 1981) y Huamustitlán (Álvarez y Ocaña, 1999). Mientras que el puma o león de montaña (Puma concolor) se ha encontrado a 3 km E de Acahuizotla, 853m; Xaltianguis, 488m (Davis y Lukens, 1958) y Omiltemi (Jiménez-Almaraz et al., 1993). La onza o yaguarundi (Puma yagouaroundi); de 45 y 48 km NO de Tecpan de Galeana (Ramírez-Pulido et al., 1977) y 2.5 km N de El Mirador, 50m (Almazán-Catalán et al., 2005). Por su parte, el gato montés (Lynx rufus) sólo se ha registrado en Omiltemi (Leopold y Hérnandez, 1944).
Los felinos ejercen una gran atracción y fascinación sobre los humanos por su belleza, fuerza y habilidad para cazar a sus presas, razón por la cual son ampliamente reconocidos y perseguidos por los pobladores de las comunidades rurales, quienes los cazan o atrapan con fines comerciales o cuando son pequeños para mantenerlos o venderlos como mascotas.
En general su ámbito hogareño es muy amplio y puede ir desde 1 hasta los 168 km2, dependiendo de la especie (Crawshaw y Quigley, 1989; Konecny, 1989; Núñez et al., 2002), la edad, el sexo, la condición reproductora, la abundancia de presas en el área y la época del año (Núñez et al., 2002). El crecimiento de las poblaciones humanas y la fragmentación del hábitat se encuentran entre las causas principales que amenazan a las poblaciones de felinos, debido a los requerimientos de hábitat, alimentación y ámbito hogareño que necesitan (Hernández-Huerta, 1992). No obstante, especies como el puma y el jaguar aparentemente se adaptan con facilidad a la fragmentación y cambian sus presas naturales por especies domésticas (Crawshaw y Quigley, 2002; Oliveira, 2002) o de menor tamaño (Núñez et al., 2000). Diversos autores han señalado que la cacería ilegal es la primera causa de mortalidad para los felinos en general (Leopold, 1959; Núñez et al., 2002), y de los jaguares y pumas en México y Sudamérica (Crawshaw y Quigley, 2002; Polisar, 2002) en particular, con el pretexto de que atacan y se alimentan del ganado.
Debido a las amenazas que sufren los felinos y a su bajo número poblacional, la Norma Oficial Mexicana NOM-059 (SEMARNAT, 2010) incluye al ocelote, tigrillo y jaguar como especies en peligro de extinción, y al yaguarundi como amenazado. Mientras que la Unión Internacional para la Conservación de la Naturaleza (IUCN, 2010), consideran al lince, puma, ocelote y yaguarundi como de preocupación menor, y al tigrillo y al jaguar como casi amenazados. Por su parte, la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES, 2010) incluye a 4 especies dentro del apéndice I, yaguarundi, ocelote, tigrillo y jaguar; y las considera como especies en peligro de extinción. El propósito de este estudio es el de presentar observaciones sobre el hábitat y distribución actual de las 6 especies de felinos que habitan en el estado de Guerrero.
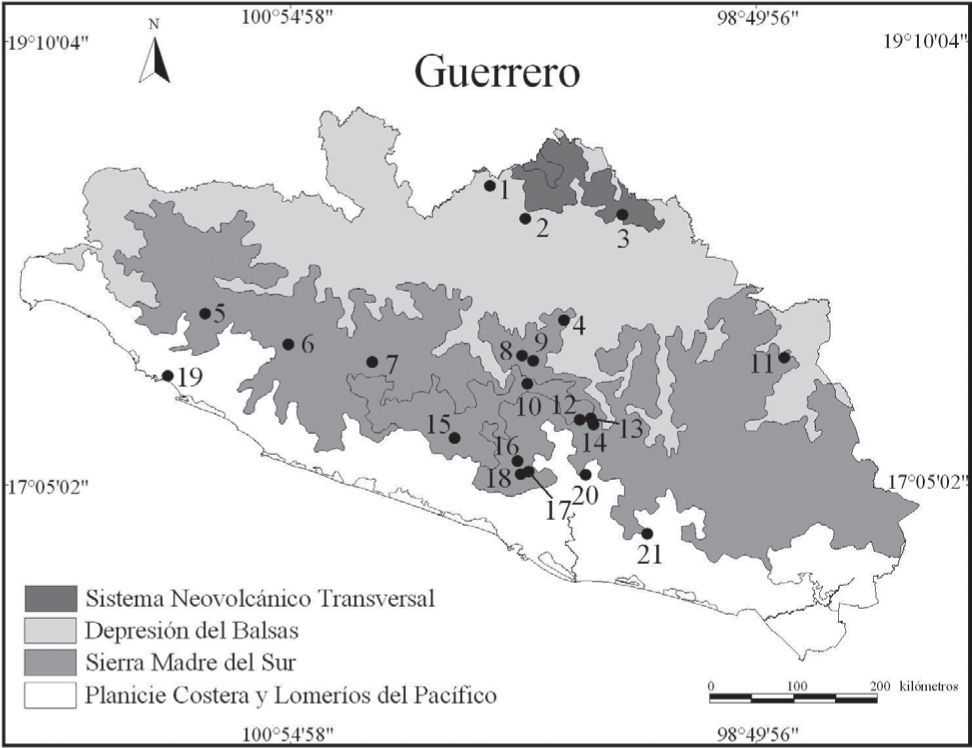
Materiales y métodosEl estado de Guerrero se encuentra en el centro sur de la República Mexicana entre los paralelos 16° y 18° de latitud norte y 102° y 96° de longitud oeste. Las 21 localidades de recolecta y registro de los ejemplares examinados se encuentran localizadas en 3 de las 4 ecorregiones terrestres del estado: Depresión del Balsas, Sierra Madre del Sur, así como Planicie Costera y Lomeríos del Pacífico (INEGI, 2008; Fig. 1, Cuadro 1). Las localidades de la Depresión del Balsas se caracterizan por tener una topografía accidentada, con alturas desde los 1 260 a los 1 600m. Tienen un clima cálido-seco y en su mayor extensión la vegetación es bosque tropical caducifolio con cactáceas. Las localidades de la Sierra Madre del Sur tienen una topografía accidentada, con una altitud entre los 545 y 2 509m.
Lista de localidades de los ejemplares examinados
Depresión del Balsas
|
Presentan una gran variedad de climas, pero predominan los templados-húmedos. Mientras que los tipos de vegetación dominantes son el bosque tropical caducifolio, bosque de pino-encino, pino y mesófilo de montaña. La topografía de las localidades de la Planicie Costera y Lomeríos del Pacífico es accidentada y la altitud varía de los 14 a los 361m. Tienen un clima cálido-húmedo y la vegetación original es bosque tropical caducifolio, pero ha sido sustituida en una gran extensión por huertos de palma de coco (Cocos nucifera).
Entre septiembre del 2002 y noviembre del 2010 se examinaron 24 especímenes procedentes de 21 localidades (Cuadro 2). De algunos ejemplares fueron donados la piel, cráneo o restos del esqueleto que se encuentran depositados en la Colección Nacional de Mamíferos (IBUNAM); o bien, sólo se fotografiaron cuando los pobladores no quisieron donarlos; mientras que otros se encontraron atropellados sobre la carretera o en el campo. Para ampliar la información, se entrevistó de manera informal a las personas que conservaban las pieles o restos de esqueletos y cuando fue posible se registró el sexo, edad, condición reproductiva y hábitat en el que se les capturó. Asimismo, se obtuvieron medidas somáticas y craneales (Cuadro 3), cuyos límites corresponden a lo citado por Romero-Almaraz et al. (2007), con excepción de las siguientes medidas: longitud del rostro (LRO): distancia mayor entre el orificio preorbitario y la parte anterior de los nasales; longitud de los nasales a través de la sutura internasal (LNS): distancia de la parte anterior de los nasales a la parte más posterior en el punto de unión; longitud de los nasales (LN): distancia mayor entre la parte anterior de los nasales y la parte más posterior; anchura de los nasales (AN): distancia mayor de la parte más ancha del nasal; longitud del carnasial superior o PM4 (LCarS); anchura máxima del carnasial superior o PM4 (ACarS); longitud máxima del carnasial inferior o m1 (LCarI); anchura máxima del carnasial inferior o m1 (ACarI); anchura a través de los incisivos superiores (AI-I): distancia máxima entre los bordes a la base de la corona de I3; anchura a través de los caninos superiores (AC-C): distancia máxima en la base del cingulum externo de los caninos; hilera de dientes superiores (HDS): longitud de la hilera de dientes, incluyendo los incisivos al último molar.
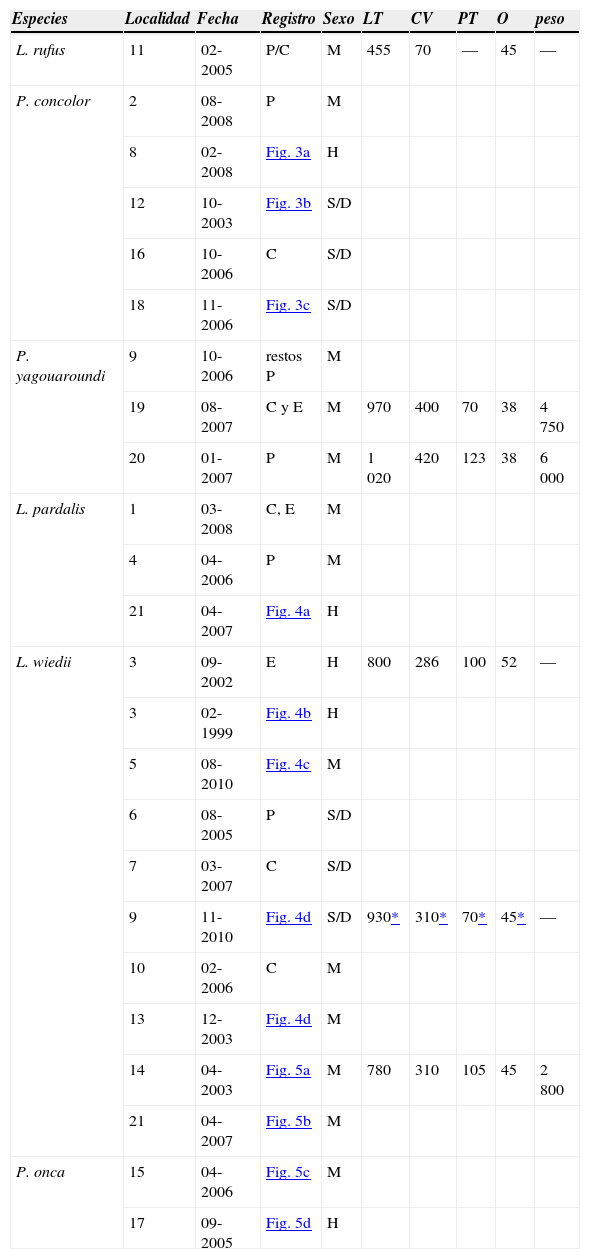
Tipo de registro y medidas somáticas de los felinos examinados
| Especies | Localidad | Fecha | Registro | Sexo | LT | CV | PT | O | peso |
|---|---|---|---|---|---|---|---|---|---|
| L. rufus | 11 | 02-2005 | P/C | M | 455 | 70 | — | 45 | — |
| P. concolor | 2 | 08-2008 | P | M | |||||
| 8 | 02-2008 | Fig. 3a | H | ||||||
| 12 | 10-2003 | Fig. 3b | S/D | ||||||
| 16 | 10-2006 | C | S/D | ||||||
| 18 | 11-2006 | Fig. 3c | S/D | ||||||
| P. yagouaroundi | 9 | 10-2006 | restos P | M | |||||
| 19 | 08-2007 | C y E | M | 970 | 400 | 70 | 38 | 4 750 | |
| 20 | 01-2007 | P | M | 1 020 | 420 | 123 | 38 | 6 000 | |
| L. pardalis | 1 | 03-2008 | C, E | M | |||||
| 4 | 04-2006 | P | M | ||||||
| 21 | 04-2007 | Fig. 4a | H | ||||||
| L. wiedii | 3 | 09-2002 | E | H | 800 | 286 | 100 | 52 | — |
| 3 | 02-1999 | Fig. 4b | H | ||||||
| 5 | 08-2010 | Fig. 4c | M | ||||||
| 6 | 08-2005 | P | S/D | ||||||
| 7 | 03-2007 | C | S/D | ||||||
| 9 | 11-2010 | Fig. 4d | S/D | 930* | 310* | 70* | 45* | — | |
| 10 | 02-2006 | C | M | ||||||
| 13 | 12-2003 | Fig. 4d | M | ||||||
| 14 | 04-2003 | Fig. 5a | M | 780 | 310 | 105 | 45 | 2 800 | |
| 21 | 04-2007 | Fig. 5b | M | ||||||
| P. onca | 15 | 04-2006 | Fig. 5c | M | |||||
| 17 | 09-2005 | Fig. 5d | H |
P= piel; C= cráneo; E= esqueleto; M= macho; H= hembra; S/D= sin determinar. Longitud total (LT); cola vertebral (CV); pata trasera (PT); oreja (O);
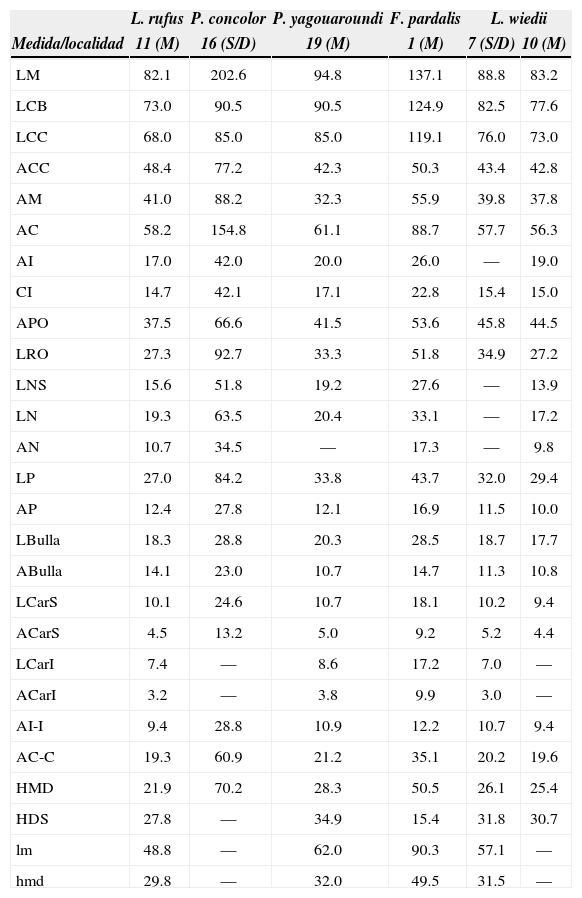
Medidas craneales de los ejemplares examinados
| L. rufus | P. concolor | P. yagouaroundi | F. pardalis | L. wiedii | ||
|---|---|---|---|---|---|---|
| Medida/localidad | 11 (M) | 16 (S/D) | 19 (M) | 1 (M) | 7 (S/D) | 10 (M) |
| LM | 82.1 | 202.6 | 94.8 | 137.1 | 88.8 | 83.2 |
| LCB | 73.0 | 90.5 | 90.5 | 124.9 | 82.5 | 77.6 |
| LCC | 68.0 | 85.0 | 85.0 | 119.1 | 76.0 | 73.0 |
| ACC | 48.4 | 77.2 | 42.3 | 50.3 | 43.4 | 42.8 |
| AM | 41.0 | 88.2 | 32.3 | 55.9 | 39.8 | 37.8 |
| AC | 58.2 | 154.8 | 61.1 | 88.7 | 57.7 | 56.3 |
| AI | 17.0 | 42.0 | 20.0 | 26.0 | — | 19.0 |
| CI | 14.7 | 42.1 | 17.1 | 22.8 | 15.4 | 15.0 |
| APO | 37.5 | 66.6 | 41.5 | 53.6 | 45.8 | 44.5 |
| LRO | 27.3 | 92.7 | 33.3 | 51.8 | 34.9 | 27.2 |
| LNS | 15.6 | 51.8 | 19.2 | 27.6 | — | 13.9 |
| LN | 19.3 | 63.5 | 20.4 | 33.1 | — | 17.2 |
| AN | 10.7 | 34.5 | — | 17.3 | — | 9.8 |
| LP | 27.0 | 84.2 | 33.8 | 43.7 | 32.0 | 29.4 |
| AP | 12.4 | 27.8 | 12.1 | 16.9 | 11.5 | 10.0 |
| LBulla | 18.3 | 28.8 | 20.3 | 28.5 | 18.7 | 17.7 |
| ABulla | 14.1 | 23.0 | 10.7 | 14.7 | 11.3 | 10.8 |
| LCarS | 10.1 | 24.6 | 10.7 | 18.1 | 10.2 | 9.4 |
| ACarS | 4.5 | 13.2 | 5.0 | 9.2 | 5.2 | 4.4 |
| LCarI | 7.4 | — | 8.6 | 17.2 | 7.0 | — |
| ACarI | 3.2 | — | 3.8 | 9.9 | 3.0 | — |
| AI-I | 9.4 | 28.8 | 10.9 | 12.2 | 10.7 | 9.4 |
| AC-C | 19.3 | 60.9 | 21.2 | 35.1 | 20.2 | 19.6 |
| HMD | 21.9 | 70.2 | 28.3 | 50.5 | 26.1 | 25.4 |
| HDS | 27.8 | — | 34.9 | 15.4 | 31.8 | 30.7 |
| lm | 48.8 | — | 62.0 | 90.3 | 57.1 | — |
| hmd | 29.8 | — | 32.0 | 49.5 | 31.5 | — |
Macho (M); sexo sin determinar (S/D); longitud mayor (LM); longitud cóndilo basal (LCB); longitud cóndilo canino (LCC); anchura a través de la caja craneana (ACC); anchura mastoidea (AM); anchura cigomática (AC); anchura interorbitaria (AI); construcción interorbitaria (CI); anchura al proceso orbitario (APO); longitud del rostro (LRO); longitud de los nasales a través de la sutura internasal (LNS); longitud de los nasales (LN); anchura de los nasales (AN); longitud palatal (LP); anchura palatal (AP); longitud de la bulla auditiva (LBulla); anchura de la bulla auditiva (ABulla); longitud del carnasial superior (LCarS); anchura del carnasial superior (ACarS); longitud del carnasial inferior (LCarI); anchura del carnasial inferior (ACarI); anchura a través de los incisivos (AI-I); anchura a través de los caninos (AC-C); hilera maxilar de dientes (HMD); hilera de dientes superiores (HDS); longitud de la mandíbula (lm); hilera mandibular de dientes (hmd).
Lynx rufus (Schreber, 1777). De la localidad 11, en bosque de encino fragmentado, se examinó la piel y el cráneo de un gato montés macho joven que se encontraba junto a una hembra adulta y a otro espécimen joven. Los felinos fueron acorralados en un árbol por unos perros, y 1 de ellos murió al intentar huir. Por tratarse de un espécimen juvenil el tamaño y la coloración de adulto no están totalmente definidos, pero la región de la cabeza y frente es color café grisáceo y en el centro hay 2 líneas más oscuras que salen de la parte superior de la nariz a la frente. Los ojos tienen un antifaz blanco amplio y en su borde tiene una línea negra más ancha en la parte anterior, que se proyecta hacia los lados de la nariz. La nariz está cubierta por pelo corto de color café canela, a los lados de ésta y paralelo a la boca hay 4 líneas negras alternando con espacios blancos o crema que terminan en la base de las vibrisas, algunas de las cuales son blancas y otras negras. Las mejillas están cubiertas de pelo corto café grisáceo. El labio inferior y el cuello son blancos y tiene un collar negro. La parte interior de las orejas está desnuda, pero en la punta hay pelo corto en una franja de 1.5 cm de ancho; en la parte posterior la coloración es negro con café canela; cerca de la punta hay una mancha blanca y no hay pelos largos en la punta.
El dorso del cuerpo, a partir de la nuca y las escápulas es color café canela mezclado con pelo negro; posteriormente es café grisáceo mezclado con negro y en la línea media dorsal el pelo negro es más abundante. El pecho y el vientre tienen pelo largo color blanco mezclado con mechones negros o café; la cola es café con la punta más negra. En general, la coloración es similar a la citada por Larivière y Walton (1977).
Por otro lado, el cráneo está roto y en el paladar se encuentra 1 par de rebordes que en conjunto integran el perfil de una copa, la parte estrecha termina detrás de los forámenes incisivos; se amplía posteriormente hacia los lados y termina antes de la fosa palatal. La dentición permanente no está completa; tiene 5 incisivos superiores, le falta el I1 izquierdo; el I1 derecho es más delgado que los otros y está dirigido ligeramente al interior de la boca; presenta un diastema entre los incisivos y el canino. Posterior al canino hay otro diastema y sigue el carnasial (PM4); el M1 es de forma triangular (4.4 x 4.9mm) y al final, antes de terminar la maxila, se encuentra un espacio. En la mandíbula hay 5 incisivos, falta el i1 derecho; después del i3 sigue un diastema; el canino, otro diastema, 1 premolar y el m1 o carnasial. Después del m1 hay un espacio de 1.5mm y le sigue una oquedad alargada de 4.5 x 0.9mm, que no se sabe si se deba a la pérdida de un molar supernumerario o al espacio de brote de otro diente (Fig. 2); porque de acuerdo con Larivière y Walton (1977) la fórmula dentaria es: I3/3; C1/1; PM2/2; M1/1= 28 piezas; es decir, sólo hay un molar permanente y éste termina al borde del maxilar, y en la dentición difiodonta no se presentan otros molares. En la dentición del joven falta el PM3 y el m1; la fórmula dentaria es: I3/3; C1/1; PM1/2; M1/0= 24 piezas; debido a que esta fórmula se ha citado sólo para los especímenes adultos, no se sabe si estas características son comunes o si existe alguna variación en su desarrollo (Fig. 2).
Puma concolor mayensis (Nelson y Goldman, 1929). Se examinaron 5 ejemplares. De la localidad 2, donaron la piel curtida de un macho adulto capturado en bosque tropical caducifolio fragmentado. De la localidad 8, se obtuvo la fotografía de la piel de una hembra joven (Fig. 3a) capturada en bosque de pino-encino fragmentado. De la localidad 12, se obtuvo la fotografía de la piel de un individuo adulto (Fig. 3b), capturado en bosque tropical caducifolio. En la localidad 16, en una brecha con vegetación de bosque de pino-encino se recolectó un cráneo casi completo de un espécimen, sólo tiene rota la parte posterior del arco cigomático izquierdo, pero le faltan casi todas las piezas dentales, con excepción de los PM3 (16.4 x 8.9mm) y PM4 o carnasial; tampoco se encontró la mandíbula. De la localidad 18, se fotografió la piel de otro individuo adulto (Fig. 3c) capturado en bosque de pino-encino.
La piel del organismo de la localidad 2 tiene el rostro de color café negruzco, con una máscara grisácea que se proyecta hacia los carrillos. La base de los bigotes es negra y la parte superior y lados de la nariz son negruzcos; la sección superior de los labios y lados de la boca son color crema. A las orejas les falta la punta y la parte media basal posterior es negra. El dorso es café negruzco, los laterales son más claros, de color café rojizo con negro. La parte anterior de las piernas tiene algunas manchas negruzcas. La cola conserva el color del cuerpo hacia los lados, el área del vientre es grisácea y la punta negra.
Puma yagouaroundi tolteca (Thomas, 1898). Se examinaron 3 especímenes. El primero proviene de la localidad 9, es un macho joven representado por la piel, su pelaje es de color café castaño mezclado con pelos negros; se capturó cerca a un arroyo cuando se encontraba junto con un individuo adulto. La topografía de esta localidad es accidentada con pendientes superiores a 50° y la vegetación es de bosque de pino-encino con árboles de hasta 25m de altura, entre los que destacan Pinus oaxacana, P. pringlei, P. chiapensis, Quercus glaucoides y Q. obtusata. Otro macho adulto se encontró atropellado en la localidad 19, donde la vegetación corresponde a huertos de palma de coco (C. nucifera) con fragmentos de bosque tropical caducifolio. De este espécimen se preservó el cráneo y el esqueleto, no se conservó la piel, pero su coloración era café rojiza. El tercer espécimen es un macho adulto procedente de la localidad 20, cuya vegetación es bosque tropical caducifolio y cultivos de maíz. Se encontró atropellado y se preservó la piel que tiene una coloración café rojizo. También se conservaron partes del esqueleto y cráneo, pero se encuentra muy fragmentado; la mandíbula tiene una longitud de 60.5mm y la hilera mandibular es de 32.7mm.
Leopardus pardalis nelsoni (Goldman, 1925). Se examinaron 3 organismos de ocelote. El primero es un macho adulto que se capturó en la localidad 1, en una cañada con bosque tropical caducifolio con cactáceas, los pobladores lo fijaron con formol y lo dejaron secar sin eliminar la carne; por lo que se encontraba muy deteriorado a consecuencia de los derméstidos y polillas; se conservó el cráneo y el esqueleto; en el estómago se encontraron restos de una iguana negra (Ctenosaura pectinata). El segundo ocelote proviene de la localidad 4, es un macho adulto preservado en piel sin curtir en buenas condiciones, fue capturado en una barranca muy rocosa con bosque tropical caducifolio. La piel es de color café canela con líneas negras sobre el rostro, el dorso de la cabeza y el cuello. El rostro es café canela y tiene 2 líneas oscuras anteriores que salen de la parte superior de la comisura interna del ojo, y otras 2 líneas posteriores e internas a las primeras. De la nuca nace una línea media dorsal negra ancha que recorre el cuello. Las mejillas y la base de las orejas son café grisáceo; tiene 2 líneas oscuras, una de ellas sale de la comisura lateral del ojo, a 3 cm por debajo de la base posterior de la oreja y llega hasta la mitad del rostro; la parte superior de la línea es café pálido y la inferior es blanquecina. La línea inferior es más corta y de color blanquecino, con algunas manchas oscuras; posterior a las líneas principales hay 2 manchas oscuras que delimitan el rostro. El dorso del cuerpo es café canela con manchas alargadas de color oscuro. Las partes laterales son café pálido, con manchas alargadas circulares oscuras con el interior café pálido. Hacia el vientre el color es más pálido o blanquecino y tiene manchas circulares o alargadas negruzcas con el centro pálido. Las patas tienen pelo corto de color igual al dorso y vientre. La cola tiene anillos negruzcos alternados con café pálido en el dorso y café grisáceo por la parte ventral. De la localidad 21 se tiene la fotografía de una hembra adulta, capturada en bosque tropical caducifolio (Fig. 4a). De acuerdo con los pobladores los ocelotes buscan a las aves de corral, razón por lo cual son cazados.
a), piel de una hembra adulta de Leopardus pardalis proveniente de la localidad 21; b), piel de una hembra de Leopardus wiedii de la localidad 3; c), individuo macho de L. wiedii, mantenido en cautiverio, proveniente de la localidad 5; d), piel de un L. wiedii de la localidad 9; e), piel de un macho de L. wiedii de la localidad 13.
Leopardus wiedii glaucula (Thomas 1903). Se examinaron 10 especímenes, el primero es una hembra adulta preservada por el esqueleto que proviene de la localidad 3, los pobladores lo donaron en septiembre del 2002. Este ejemplar se capturó en una barranca muy rocosa cuando perseguía a un conejo cerca de una poza de agua; en el estómago tenía restos de una lagartija del género Sceloporus. La vegetación dominante fue bosque tropical caducifolio con árboles de Jacaratia mexicana, Ipomoea arborescens y diversas especies del género Bursera (B. fagaroides, B. bicolor, B. bipinnata, B. copallifera). Para la misma localidad los pobladores permitieron tomar la fotografía de la piel de una hembra que habían capturado en febrero de 1999 (Fig. 4b), en el mismo tipo de vegetación. En la localidad 5 los pobladores capturaron un macho joven en bosque de encino-pino (Fig. 4c); lo tenían atado con un collar y lo mantenían como mascota desde junio del 2010 (el equipo de investigación lo observó en el mes de agosto). Otro organismo adulto se capturó en bosque de pino-encino en la localidad 6 y se encuentra preservado en piel. El quinto ejemplar es un adulto del que se conserva el cráneo y proviene de la localidad 7, se capturó en bosque de pino-encino. De la localidad 9 se examinó un macho adulto, que de acuerdo con los pobladores se cazó mientras perseguía una presa. La vegetación fue bosque tropical caducifolio. El espécimen se encuentra en piel sin curtir, conservaba la cabeza, la cola y las patas; inicialmente se preservó con formol y rellenó con tela (Fig. 4d). De la localidad 10 se conservó el cráneo de un macho adulto que se encontró muerto junto al arroyo Las Truchas, donde la vegetación corresponde a bosque mesófilo de montaña con árboles de más de 20m de altura, entre los que destacan Chiranthodendron pentadactylon, Persea americana y Alnus acuminata. De la localidad 13 se fotografió la piel de un macho que fue capturado en bosque de pino (Fig. 4e). En la localidad 14, estudiantes de biología de la Universidad Autónoma de Guerrero capturaron un macho adulto con una trampa Havahart que se colocó en bosque de pino, posteriormente fue liberado (Fig. 5a). El último ejemplar es un macho capturado en la localidad 21, en bosque tropical caducifolio (Fig. 5b), en enero del 2007. Los pobladores lo mantenían en cautiverio en una jaula de madera. Se observó y fotografió en abril del mismo año.
a), ejemplar macho en cautiverio de Leopardus wiedii proveniente de la localidad 14; b), individuo macho de L. wiedii, mantenido en cautiverio proveniente de la localidad 21; c), piel de un macho de Panthera onca de la localidad 15; d), hembra adulta de P. onca recién cazada de la localidad 17.
Panthera onca hernandesii (Gray, 1857). Se examinaron las pieles de un macho y una hembra adultos, provenientes de las localidades 15 y 17, respectivamente (Figs. 5c, d). Los especímenes fueron cazados durante el día, con 7meses de diferencia en bosque de pino-encino. De acuerdo con los pobladores la hembra se encontraba lactando. La coloración de ambos es amarillo ocráceo, con manchas desde el rostro y cabeza hasta los hombros. Las extremidades anteriores hasta la altura del codo son de color café oscuro, excepto en las partes laterales y del hombro hasta el codo en donde son más pálidas. Desde el codo hasta las manos, las manchas son ovaladas. A partir de la escápula y sobre la columna vertebral hay una línea de manchas, las 3 primeras tienen forma de roseta pero están cerradas y son de color negro, posteriormente y hasta la cadera hay 14 manchas circulares que se sobreponen parcialmente y dan la impresión de ser manchas alargadas. A partir de la cadera y hasta donde empieza la cola, hay 1 línea de 6 manchas dobles que se continúa con 1 línea de manchas alargadas que se van haciendo redondas y terminan en círculos alrededor de la cola, cuya punta es totalmente negra. A partir de la línea media del cuerpo y hacia los lados, las manchas tienen forma de roseta abierta con 1 a 3 manchas negras en su interior; mientras que las manchas laterales de la cola son alargadas. En toda la parte ventral, tanto del cuerpo como de las extremidades anteriores y posteriores, el pelo es largo y de color blanquecino con manchas grandes circulares de color negro, siendo más pequeñas las de las extremidades.
DiscusiónDe acuerdo con los pobladores, L. rufus fue capturado en febrero y formaba parte de un grupo familiar; por su tamaño, era un cachorro que estaba próximo a ser destetado, lo que ocurre alrededor de los 3 meses de edad (Bailey, 1979). Se sabe que la reproducción de los linces puede ocurrir en cualquier época del año y en este caso, el nacimiento debió haber sido entre noviembre y diciembre.
El registro de L. rufus es el primero que se documenta con material examinado en Guerrero y llena un espacio de 67 años de haber sido referido por primera vez para el estado por Leopold y Hernández (1944), quienes señalaron que “El Sr. Mauro Adame de Omiltemi habló del gato montés que se encuentra rara vez en los bosques del Picacho de Oro”.
Los registros de P. concolor de Teloloapan y Leonardo Bravo se encuentran en el noroeste del estado y amplían la distribución en 91 y 26 km, respectivamente, a partir de Omiltemi, municipio de Chilpancingo de Los Bravo (Jiménez-Almaraz et al., 1993). Los pobladores señalaron que cazaron a estos ejemplares por el peligro y daño que representan para el ganado y para ellos mismos. Sin embargo, se ha señalado que la depredación de ganado por parte de este felino en el centro de México es más reducida de lo que se cree. En un análisis de 104 excretas se encontró que sólo 5 de 151 presas correspondieron a ganado vacuno y que prefirieron a los armadillos, coatíes y venados sobre los animales domésticos (Monroy-Vilchis et al., 2009). Mientras que en el este de los Estados Unidos, los venados de la especie Odocoileus hemionus pueden representar entre 60 y 75% de su dieta (Robinette et al., 1959), por lo que la cacería de esta especie es injustificada. Las condiciones de captura coinciden con lo citado por Oliveira (2002) y Núñez et al. (2002), con respecto a que este felino tolera la fragmentación del ambiente y se encuentra en diversos tipos de hábitats. El organismo de la localidad 8 (Leonardo Bravo, 800m NO Coatepec de La Escalera) capturado en febrero, fue un joven, pero no se podría precisar su periodo de nacimiento porque aunque las crías son destetadas aproximadamente a los 2 meses de edad, permanecen con la madre alrededor de 2 años y adquieren el peso del adulto entre los 2 y 4 años (Currier, 1983).
Los 2 especímenes de P. yagouaroundi de las localidades 19 (2.5 km E de Zihuatanejo) y 20 (3 km NO de Tierra Colorada), se encontraron atropellados en un tipo de vegetación similar a la citada por Almazán-Catalán et al. (2005). Esta especie se asocia a lugares fragmentados y es común verlos cruzando o caminando por las orillas de las carreteras, por lo que con frecuencia son atropellados, su piel no es apreciada comercialmente. Pero como se ha citado (Leopold, 1959), en algunas regiones los cazan cuando salen a matar a otros animales, lo que pone en peligro sus poblaciones. El ejemplar de Leonardo Bravo, barranca Coapalote, aumenta su distribución en alrededor de 136 km al noreste con respecto a la localidad más próxima (45-48 km al NO de Tecpan de Galeana; Ramírez-Pulido et al., 1977) y en 133 km al suroeste, a partir de Palos Prietos, en el Estado de México (Sánchez et al., 2002). El de Juan. R. Escudero, 3 km NO Tierra Colorada, incrementa su distribución en 148 km al este de Tecpan de Galeana (Ramírez-Pulido et al., 1977). Las medidas somáticas y craneales de los especímenes estudiados están dentro de la variación citada por Hall (1981), Oliveira (1998) y Almazán-Catalán et al. (2005). Mientras que la coloración rojiza corresponde a una de las 2 fases de color citadas por Hall (1981). El organismo de la localidad 9 (Leonardo Bravo, Barranca Coapalote, 3 km N de Los Morros) es un individuo joven y se capturó en el mes de octubre cuando se encontraba con un adulto; probablemente el destete y crecimiento postnatal en esta especie es más rápido que en otros felinos, porque se ha citado que las crías comienzan a salir del refugio alrededor de los 28 días y que a los 42 días son capaces de alimentarse por sí mismos (Oliveira, 1998); es posible que este ejemplar no tuviera más de 2 o 3 meses de edad.
Leopardus pardalis se registró hace 87 años por Goldman (1925) cuando describió la subespecie L. p. nelsoni de 4 localidades de Guerrero: Acapulco, Coyuca, Omilteme[i] y Papayo [El]. La localidad de Teloloapan, 1 km N de Tlalpexco, se encuentra a 60 km al noreste de la localidad más cercana: Huajintlán, municipio de Amacuzac en el estado de Morelos (Vargas et al., 1992) y a 112 km al noroeste de Omilteme[i] (Goldman, 1925), o bien, a 155 km al noreste de un registro fósil de ocelote en el ejido Huamuxtitlán, municipio de Huamuxtitlán en la depresión del Balsas (Álvarez y Ocaña, 1999). Las medidas del cráneo están dentro de los límites citados por Murray y Gardner (1997), excepto por la anchura del proceso orbitario que es más grande en nuestro espécimen (53.6), incluso que la medida más grande (36.0) citada por estos autores. Las presas principales en su dieta son los mamíferos terrestres, pero los reptiles y especialmente las iguanas (Iguana iguana), son comunes en la época seca (Murray y Gardner, 1997), que fue la temporada (marzo) cuando se capturó el ejemplar en el que se encontraron restos de la iguana C. pectinata.
El registro de L. wiedii de Huitzuco de Los Figueroa, aumenta su distribución en 95 km al noreste de Filo de Caballo (León y Romo, 1991), la localidad más cercana. Como Davis y Lukens (1958) citaron, se asocia preferentemente a bosques de pino y pino-encino; de las 8 localidades de donde provienen los ejemplares estudiados, sólo 2 tuvieron vegetación de bosque tropical caducifolio y una de bosque mesófilo circundada por bosque de pino-encino. Su alimentación consiste principalmente de mamíferos arbóreos y aves, pero también puede consumir reptiles (Oliveira, 1994). Para Chiapas, se ha citado que se alimenta entre otras presas de conejos (Álvarez del Toro, 1977); por lo que la presencia de una lagartija del género Sceloporus en el espécimen de la localidad 3 (Huitzuco de Los Figueroa, El Huzicuate, 3 km NE de Tlaxmalac) y su captura cuando perseguía a un conejo, confirma la diversidad de presas que consume. Por otra parte, el organismo de la localidad 5 (José Azueta, Vallecitos de Zaragoza) se capturó en junio y el equipo de investigación lo observó en agosto en estado juvenil. Se ha reportado que las hembras y los machos alcanzan 90% del peso del adulto a los 8 y 10 meses de edad, respectivamente (Petersen y Petersen, 1978).
Goldman (1943) notó que el tigrillo es poco común y que en el transcurso de 12 años de recolectas intensas que realizaron en México en donde capturaron más de 15 000 especímenes de mamíferos, sólo 2 correspondieron a esta especie. Esta aseveración fue confirmada por Ramírez-Pulido et al. (2005) para el estado de Puebla. Sin embargo, contrario a lo citado, 10 de los 24 felinos examinados por el equipo de investigación son tigrillos, lo que demuestra que en Guerrero son abundantes y se observan con frecuencia; como lo refieren los pobladores quienes lo consideran un trofeo en la cacería local o lo mantienen en cautiverio como mascota.
Por otra parte, Davis y Lukens (1958) señalaron que en la revisión taxonómica realizada por Goldman (1943) sobre L. wiedii, se examinaron sólo 2 especímenes del oeste de México (Jalisco); de manera que los 4 examinados por ellos tuvieron algunas medidas que coincidían con la subespecie glaucula y otras con oaxacensis, por lo que asignaron a sus especímenes el nombre de L. w. glaucula para conservar el nombre más antiguo. Comparando las medidas somáticas y craneales de los ejemplares de estudio con las citadas por estos autores (Goldman, 1943; Davis y Lukens, 1958), se confirma que coinciden con las de la subespecie glaucula.
Los 2 registros de P. onca aumentan a 7 las localidades conocidas para el jaguar en Guerrero. Contrario a lo citado por Davis y Lukens (1958) de que la distribución de esta especie se encontraba en Guerrero por debajo de los 610m, los organismos de este estudio provienen de 2 localidades situadas a los 1 070m. Ambas localidades se encuentran separadas por 34 km en línea recta y de acuerdo con Leopold (1959), en México el ámbito hogareño varía entre 2 y 5 km2, por lo que la cercanía entre los 2 registros no es una situación extraña. Por otra parte, la indicación de los pobladores de que la hembra estaba lactando concuerda con lo citado de que en México los nacimientos ocurren de julio a septiembre (Leopold, 1959). Ambos especímenes se sacrificaron con el pretexto de prevenir que mataran y se alimentaran del ganado, aunque como algunos autores confirman, prefieren las presas naturales y sólo cuando éstas disminuyen se alimentan de animales domésticos (Dalponte, 2002; Sáenz y Carrillo, 2002). La coloración descrita para los organismos de esta investigación sigue el patrón general conocido, aunque se sabe que existe una gran variación en el número, forma y tamaño de las manchas entre los individuos (Seymour, 1989).
El registro en Guerrero de las 6 especies de felinos que se distribuyen en México es indicador de que el ambiente se encuentra aún en condiciones óptimas para soportar sus poblaciones, pues como citan Chapman y Feldhamer (2003), los felinos son buenos indicadores del estado de conservación de un sitio por sus requerimientos en ámbito hogareño, hábitat y tipo de presas que consumen. De acuerdo con las observaciones realizadas durante el trabajo de campo y a que 19 de los 24 registros que se reportan fueron especímenes capturados o cazados por los pobladores, es claro que la cacería es una de las amenazas principales para los felinos en el estado de Guerrero. El registro de ejemplares en localidades cercanas a poblaciones como Teloloapan y Tierra Colorada manifiesta su adaptación para vivir cerca de comunidades urbanas, donde la vegetación original ha sido fragmentada o eliminada por la expansión de la población humana y sus actividades agrícolas. Por lo que se cree que todavía es momento de establecer medidas que favorezcan y garanticen las condiciones óptimas para la presencia de los felinos que habitan en Guerrero.
A los pobladores de las comunidades referidas, quienes proporcionaron información y donaron algunos de los ejemplares; a M. A. Hernández por la donación de la piel de un P. concolor; E. Guerrero-Ibarra, L. López-Damián y Norberto-Casados por las fotografías 4c, 5a y 5c, respectivamente. A los estudiantes de la carrera de Biología de la Universidad Autónoma de Guerrero que participaron en los recorridos de campo. Al Instituto Nacional de Ecología quien otorgó el permiso de colector científico (Dirección General de Vida Silvestre FAUT.0103 a Cornelio Sánchez-Hernández).