El cambio en las condiciones ambientales y el grado de perturbación antropogénica afectan las comunidades de visitadores florales. Así, se identificó y caracterizó la comunidad de visitadores florales de Bursera copallifera, en Jolalpan, Puebla, México, considerando cambios en variables ambientales (temperatura, humedad y altitud) y factores asociados con un gradiente de perturbación. Se usó un índice multimétrico cuantitativo para medir la perturbación en 13 zonas de la localidad. Se seleccionaron 3 sitios en un gradiente de perturbación, donde se recolectaron los visitantes florales. Se registró un total de 66 especies, pertenecientes a 25 familias, repartidas en 5 órdenes. Los órdenes con mayor abundancia fueron Hymenoptera y Coleoptera. La temperatura y la humedad fueron significativamente diferentes entre horarios y sitios, y en conjunto con los factores de perturbación, afectaron la estructura y dinámica de la comunidad de visitadores florales. El sitio más perturbado fue significativamente menos diverso, pero más abundante en insectos. Apis mellifera fue la especie más abundante en el sitio más perturbado, aunque debido a la variación de altitud entre sitios, el efecto de la perturbación no fue claramente establecido. La gran diversidad de insectos encontrados mostraron la importancia de Bursera copallifera en este tipo de ecosistemas.
The change in environmental conditions and the level of anthropogenic disturbance affect the communities of floral visitors. Therefore, the community of floral visitors of Bursera copallifera in Jolalpan, Puebla, Mexico was identified and characterized, considering changes in some environmental variables (temperature, humidity and altitude) and the factors associated with a disturbance gradient. A multivariate quantitative index was used in order to calculate the disturbance in 13 zones of the locality. Three sites with different levels of disturbance were selected, and in each one, the floral visitors were collected. A total of 66 species were collected, belonging to 25 families, distributed in 5 insect orders. Hymenoptera and Coleoptera were the most abundant orders. Temperature and humidity were significantly different among hours and sites, and together with the disturbance factors, affected the community floral visitors structure and dynamics. The high-disturbance site had the lowest diversity, but the highest insect abundance. Apis mellifera was the most abundant species at the most disturbed site, but the disturbance effect was not clearly established due to the altitude variations among sites. The high diversity of insects found showed the importance of Bursera copallifera for this kind of ecosystems.
Los cambios en las condiciones microclimáticas pueden influir de manera importante en el comportamiento y la actividad de forrajeo de los insectos visitadores florales (Herrera, 1995; Rozzi, Arroyo y Armesto, 1997). Estos son especialmente sensibles a cambios en la temperatura, la velocidad del viento y la nubosidad, debido a la incapacidad física de volar bajo la lluvia o el viento, al tiempo empleado para su termorregulación (Kjøhl, Nielsen y Stenseth, 2011), algunos son intolerantes a temperaturas extremas o a que deben realizar cambios en la administración del gasto energético (Arroyo, Armesto y Primack, 1985). Una causa importante de modificación de las condiciones microclimáticas es la perturbación antropogénica, que puede causar incrementos en la intensidad lumínica, la temperatura, la evaporación y la exposición al viento y a diversos contaminantes, así como una disminución de la humedad (Bustamante y Grez, 1995; Santos y Tellería, 2006; Saunders, Hobbs y Margules, 1991). Por otro lado, se sabe también que los recursos florales son determinantes en la estructuración de las comunidades de visitadores, de manera que, si los cambios ambientales alteran la distribución espacial y temporal de los recursos florales, también se afectará la conducta de forrajeo individual, la dinámica poblacional y la composición de la comunidad de visitadores (Haddad et al., 2003; Kremen et al., 2007). Los cambios en la estructura, diversidad y abundancia de la comunidad de visitadores florales debidos a la perturbación, han sido documentados en numerosos estudios (Aizen y Feinsinger, 1994a, b; Aizen, Morales y Morales, 2008; Cuéllar, 1999; Galetto et al., 2007; Morales y Aizen, 2002, 2006; Quintero, Morales y Aizen, 2010). Por ejemplo, se ha demostrado que el cambio de uso de suelo a zonas de cultivo causa una disminución de la frecuencia y riqueza de los polinizadores, principalmente de las especies nativas (Chacoff y Aizen, 2004). Por su parte, la fragmentación del hábitat puede disminuir la abundancia y diversidad de insectos visitantes nativos (Aizen y Feinsinger, 1994a; Cuéllar, 1999; Ferrari, 2011; Foo y Norzagaray, 2009; Galetto et al., 2007; Steffan-Dewenter, Potts y Packer, 2005). Sin embargo, en estos estudios la perturbación se ha determinado de manera general o cualitativa, por lo que resulta difícil identificar qué factores afectan a las diferentes especies de visitantes florales y, más aún, si el recurso floral pertenece a plantas con importancia económica y cultural, como es el caso de Bursera copallifera, dónde su explotación intensiva se suma a los diversos factores de degradación del hábitat (Purata, Chibnik, Brossi y López, 2004).
Bursera copallifera (Sessé y Moc. Ex DC. Bullock) es una especie que se distribuye en sitios relativamente templados, con temperaturas mínimas de entre 5° y 7 °C y con menor especificidad climática que otras especies del género Bursera (Hernández- Pérez, González-Espinosa, Trejo y Bonfil, 2011), por lo que presenta una distribución amplia, siendo una especie conspicua en las selvas bajas caducifolias. A pesar de que en México este ecosistema cubre gran parte del territorio (Flores y Gerez, 1994) presentando una alta diversidad de flora y fauna, así como un gran número de endemismos (Trejo y Dirzo, 2002), extensas áreas de este ecosistema se han visto transformadas en zonas agrícolas y ganaderas (López et al., 2006; Trejo y Dirzo, 2000). Por otro lado, B. copallifera tiene importancia religiosa, comercial y medicinal, ya que la resina (copal) es usada como incienso para hacer ritos o ceremonias, y la corteza se usa para tratar golpes internos y aliviar los bronquios, o para hacer limpias (Conabio, 2008). Desde el punto de vista ecológico, esta resina le confiere protección contra herbívoros, parásitos y patógenos; además de que es empleada como refugio por algunos gorgojos, hormigas y arañas. Asimismo, las abejas del género Apis L. colectan la resina y la utilizan para hacer el propóleo con el que recubren sus colmenas contra hongos y termitas (Conabio, 2008).
A pesar de la importancia de B. copallifera, se conoce poco sobre su biología reproductiva y sobre la comunidad de visitadores florales con la que está asociada. Aunque se ha registrado que es visitada por abejas, avispas y escarabajos (Velázquez, 2011), no hay otros estudios al respecto ni tampoco sobre el efecto que la perturbación puede tener sobre sus visitadores florales. Este estudio tiene por objetivo identificar y establecer cómo varía la comunidad de visitantes florales de B. copallifera en función de los cambios en algunas variables ambientales (temperatura, humedad y altitud), así como en función de diferentes factores de perturbación antropogénica, mediante el establecimiento de un gradiente de perturbación calculado a partir de un índice cuantitativo multiparamétrico.
Materiales y métodosDescripciónLa especie B. copallifera se ubica en la sección Bullockia, es un árbol con hojas dispuestas en espiral imparipinnadas, sus hojas son tetrámeras, su fruto es una drupa bivalvada ovoide y sus semillas están cubiertas por un pseudoarilo de color rojo pálido en 2 terceras partes. La especie florece de mayo a junio, y fructifica de julio a septiembre (Rzedowski, Medina y Calderón, 2004).
Área de estudioEl estudio se llevó a cabo en la localidad rancho El Salado, ubicada en el municipio de Jolalpan, Puebla, que se localiza en las coordenadas 18°20’13” N, 98°58’0” O; con un intervalo altitudinal de 800 m–1,800 m snm. La localidad se encuentra en la provincia fisiográfica de la sierra Madre del Sur y tiene una superficie de 3,125 ha, que en su mayoría son propiedades ejidales. El clima es cálido subhúmedo con lluvias en verano (Aw), con menos del 5% de lluvia invernal. La temperatura media anual es de 25.6 °C. El mes de mayo presenta la temperatura más alta del año (29.1 °C), mientras que enero es el mes más frío (22.4 °C). El principal tipo de vegetación es selva baja caducifolia con vegetación secundaria, pero se ha ido modificando por la agricultura nómada y los pastizales inducidos (Inegi, 1987).
Índice de perturbación y selección de sitios de estudioDentro del área de estudio, se seleccionaron 13 zonas al azar, utilizando fotografías aéreas (Inegi SINFA 1:75,000, 1995 ZONA E14-5 LÍNEA 166:009, 010, 011) que fueron importadas al programa Arc view 3.1 para poder estimar si las zonas seleccionadas presentaban características similares de vegetación y tipo de suelo. Las zonas seleccionadas se ubicaron entre 836 m y 1,289 m snm (tabla 1). En cada zona se confirmó la presencia de B. copallifera y se trazaron 2 transectos perpendiculares, de 50 m cada uno, donde se cuantificaron los indicadores de perturbación, según lo indica en el método propuesto por Martorell y Peters (2005). Este método permite obtener un índice de disturbio (ID) que se basa en la cuantificación de 15 parámetros, los cuales están comprendidos en una de 3 categorías: 1) cría de ganado (frecuencia de excrementos de cabra, frecuencia de excremento de vaca, ramoneo, caminos para el ganado y compactación del suelo); 2) actividades humanas (extracción de leña, número de caminos, superficie de senderos, proximidad de asentamientos humanos, cercanía a núcleos de actividad humana, porcentaje de uso de la tierra y evidencia de incendios forestales); y 3) degradación de la tierra (porcentaje de erosión, presencia de islas de erosión y superficie totalmente modificada). Una vez que se estimó el índice de perturbación en cada zona, se establecieron 3 categorías de perturbación: alto (índice de perturbación entre 10 y 15), medio (2.1 y 5) y bajo (0 y 2; tabla 1). Así, se seleccionaron 3 sitios con diferente nivel de perturbación (tabla 1).
Altitud, índice (Martorell y Peters, 2005) y categoría de perturbación de 13 zonas seleccionadas al azar en el rancho El Salado, Jolalpan, Puebla
| Zona | Altitud (m) | Índice de perturbación | Categoría de perturbación |
|---|---|---|---|
| 6* | 1,095* | 0.77* | baja* |
| 1 | 1,158 | 0.79 | baja |
| 3 | 1,016 | 0.81 | baja |
| 5 | 1,289 | 0.82 | baja |
| 2 | 947 | 2.21 | media |
| 11* | 996* | 2.32* | media* |
| 4 | 996 | 2.54 | media |
| 10 | 998 | 4.59 | media |
| 7 | 961 | 10.32 | alta |
| 8 | 944 | 11.33 | alta |
| 12 | 941 | 12.66 | alta |
| 9 | 994 | 15.23 | alta |
| 13* | 836* | 15.51* | alta* |
Se ordenan por índice de perturbación y los sitos seleccionados para la recolecta de visitadores florales se marcan con asterisco (*).
En cada uno de los 3 sitios seleccionados, se eligieron 3 individuos (indistintos del sexo) de B. copallifera. En cada individuo se marcaron 3 inflorescencias para realizar el registro y recolecta de visitadores florales. Esto último se llevó a cabo en todos los insectos que se posaban sobre las flores, se realizó a partir de la antesis hasta completar un periodo continuo de 48 h. Posteriormente, se establecieron 3 periodos de muestreo (9:00- 12:00, 12:00-15:00 y 15:00-18:00 h), de 3 h cada uno, con intervalos de 15 min de observación y 15 min de descanso; para cada inflorescencia, entonces se tuvo un total de 30 min por periodo y 90 min por día, hasta completar un total de 8 días. Así, se completó un total de 720 min de observación por inflorescencia. Considerando que se muestrearon 3 inflorescencias en cada individuo de B. copallifera, se tuvo un total de 2 160 min (36 h) de observación, que multiplicado por 3 individuos en cada sitio hizo un total de 6 480 min, que multiplicado por 3 sitios de observación hace un total de 19 440 min (324 h). El monitoreo de visitadores florales se realizó en los 3 sitios simultáneamente. Los insectos recolectados se sacrificaron in situ con acetato de etilo y se llevaron al laboratorio para su montaje e identificación. Durante las observaciones y recolectas de visitadores florales, también se registró la altitud, utilizando un GPS (Garmin, eTrex 30), la temperatura y la humedad (usando, en cada sitio, un dispositivo Hobo Data Loggers U12 Temp/RH/Light, 2010). Los sensores Hobos fueron ubicados, aproximadamente, a 1 m de altura, y sobre una de las ramas de los individuos de B. copallifera muestreados. Así, la temperatura y la humedad se registraron cada hora, simultáneamente en los 3 sitios, durante el periodo de estudio.
Análisis de los datosPara el análisis de la perturbación, se construyó una matriz con los 15 parámetros medidos en cada una de las 13 zonas seleccionadas en la localidad de estudio. La matriz fue estandarizada y se aplicó un análisis de componentes principales (ACP), usando el programa MVSP v. 3.12g (Kovach, 2004). A partir de la suma de los puntajes de cada agente, del primer componente extraído, se obtuvo el índice de disturbio (ID) para cada zona, tal y como lo proponen Martorell y Peters (2005). En cada sitio se calculó la diversidad alfa de los visitadores florales, mediante el índice de diversidad de Simpson. Para determinar la existencia de diferencias significativas en la diversidad entre sitios, se usó un análisis Kruskal-Wallis, usando el índice Simpson por inflorescencia (9 inflorescencias por sitio). Este análisis se realizó con ayuda del programa NCSS 2000 (Hintze, 2008). Para evaluar similitudes en la composición de insectos entre sitios y dentro de los sitios (horarios), a lo largo de los 8 días de muestreo (diversidad beta), se aplicó un análisis de similitud (Anosim, Clarke, 1993). La prueba de Anosim se utiliza para mostrar si existen diferencias significativas entre grupos (sitios y horarios) de muestras multivariadas, usando una matriz de similitud de Jaccard. La matriz fue construida con todas las muestras (inflorescencias por horario y por sitio) de todos los días de muestreo. Este análisis se realizó con el software estadístico PAST ver. 1.15 (Hammer y Harper, 2003). A través de un análisis de varianza (Anova) factorial de 333 (2 factores: horario y sitio, cada uno con 3 niveles) se comparó la abundancia y la riqueza, utilizando para ambos análisis una transformación logarítmica de los datos (Ln x) y considerando cada inflorescencias como repetición. Las comparaciones múltiples se realizaron aplicando pruebas de Bonferroni. Asimismo, se compararon las variables ambientales (temperatura y humedad) entre sitios y entre horarios, usando también un análisis de varianza (Anova) y pruebas de Fisher's LSD para las comparaciones múltiples. Estos análisis se realizaron en el programa NCSS 2000 (Hintze, 2008). Para analizar la dinámica de la comunidad de visitadores florales (matriz de abundancias, a nivel de orden y de especies), con respecto a los factores ambientales y con respecto a los 15 factores de perturbación (matriz ambiental), se realizó un análisis canónico de correspondencia (ACC), utilizando el programa MVSP 3.2. (Kovach, 2004).
ResultadosÍndice de perturbación y selección de sitios de estudioEl análisis de componentes principales, para las 13 zonas seleccionadas, mostró que el número de veredas y caminos de ganado fueron los factores que tuvieron el mayor impacto (fig. 1). Se encontró un índice promedio de perturbación de 6.25±1.21 (± e. e.), donde el valor mínimo fue de 0.77 y el máximo de 15.51. De acuerdo con estos valores, se eligieron 3 sitios de muestreo en un gradiente: bajo (ID=0.776, 1,095 m snm), intermedio (ID=2.32, 996 m snm) y alto (ID=15.51, 836 m snm; tabla 1).
Abundancia de visitadores floralesSe recolectaron un total de 337 individuos, pertenecientes a 66 especies, agrupadas en 5 órdenes: Coleoptera, Diptera, Hemiptera, Hymenoptera y Lepidoptera (tabla 2). El orden Hymenoptera tuvo el mayor número de especies (31 ssp=41%), así como la mayor abundancia (228 individuos). En segundo lugar se encontró al orden Coleoptera, con 13 especies y 55 organismos recolectados. El orden con menor número de especies y con la menor abundancia fue Diptera (3 especies y 5 organismos). Apis mellifera L. (Hymenoptera) fue la especie más abundante con 110 individuos, seguida de Bleparida flavocostata Jacoby (Coleoptera) con 27 individuos e Hypanthidium sp. Cockerell (Hymenoptera) con 26 individuos (tabla 2).
Abundancias de las especies de visitadores florales de los 3 sitios de Bursera copallifera en el rancho El Salado, Jolalpan, Puebla
| Orden | Familia | Especie | C | I | P | Abundanciatotal |
|---|---|---|---|---|---|---|
| Coleoptera | Cerambicidae | Chrysoprasis hypocrita (Erichson) | 1 | 0 | 0 | 1 |
| Rhopalophora serripennis (Giesbert y Chemsak) | 0 | 3 | 0 | 3 | ||
| Euderces sp. (LeConte) | 0 | 1 | 1 | 2 | ||
| Chrysomelidae | Blepharida flavocostata (Jacoby) | 5 | 3 | 19 | 27 | |
| Stilodes virgulata(Achard) | 0 | 1 | 0 | 1 | ||
| Pentispa sallaei (Baly) | 1 | 0 | 0 | 1 | ||
| Curculionidae | Epicaerus sp. (Schönherr) | 0 | 1 | 0 | 1 | |
| Dermestidae | Cryptorhopalum sp. (Guérin-Méneville) | 1 | 0 | 0 | 1 | |
| Melolonthidae | Euphoria pulchella (Gory y Percheron) | 7 | 0 | 3 | 10 | |
| Melyridae | Listropsis sp. (Blaisdell) | 0 | 1 | 0 | 1 | |
| Mordellidae | Mordellistena sp. (Costa) | 1 | 0 | 0 | 1 | |
| Mordella sp. 1 (Linnaeus) | 1 | 0 | 0 | 1 | Mordella sp. 1 (Linnaeus) | |
| Mordela sp. 2 (Linnaeus) | 5 | 0 | 0 | 5 | Mordela sp. 2 (Linnaeus) | |
| Scarabaeidae | Strigoderma vestita (Burm) | 3 | 0 | 0 | 3 | |
| Diptera | Asilidae | Diogmites sp. (Hanging-thieves) | 1 | 0 | 0 | 1 |
| Syrphidae | Ocyptamus sp. (Macquart) | 0 | 1 | 0 | 1 | |
| Hemiptera | Alydidae | Hyalymenus subinermis (Van Duzee) | 0 | 2 | 3 | 5 |
| Apidarus conspersus (Stal) | 0 | 2 | 15 | 17 | ||
| Coreidae | Chariesterus sp. (Laporte) | 1 | 0 | 0 | 1 | |
| Catorhintha elongatula (Brailovsky) | 0 | 1 | 0 | 1 | ||
| Lygaeidae | Lygaeus enolis (Dallas) | 0 | 1 | 0 | 1 | |
| Hymenoptera | Andrenidae | Perdita sp. (Michener) | 0 | 1 | 0 | 1 |
| Apidae | Apis mellifera (Linnaeus) | 2 | 25 | 83 | 110 | |
| Ceratina sp. 1 (Latreielle) | 0 | 5 | 0 | 5 | Ceratina sp. 1 (Latreielle) | |
| Ceratina sp. 2 | 1 | 7 | 0 | 8 | Ceratina sp. 2 | |
| Trigona nigra (Cresson) | 0 | 6 | 1 | 7 | Trigona nigra (Cresson) | |
| Ceratina sp. 3 | 0 | 1 | 0 | 1 | Ceratina sp. 3 | |
| Plebeia mexicana (Ayala) | 0 | 1 | 0 | 1 | Plebeia mexicana (Ayala) | |
| Formicidae | Camponotus rectangularis (Emery) | 1 | 2 | 0 | 3 | |
| Pseudomyrmex cubaensis (Forel) | 7 | 0 | 0 | 7 | ||
| Pseudomyrmex gracilis (Fabricius) | 3 | 1 | 0 | 4 | ||
| Brachymyrmex sp. (Mayr) | 18 | 0 | 0 | 18 | ||
| Myrmelachista sp.(Roger) | 0 | 1 | 0 | 1 | ||
| Pheidole sp. (Westwood) | 3 | 0 | 0 | 3 | ||
| Halictidae | Lassioglossum sp. 1 (Curtis) | 0 | 1 | 0 | 1 | |
| Lassioglossum sp. 2 | 2 | 0 | 0 | 2 | ||
| Pseudaugochlora graminea (Fabricius) | 2 | 0 | 0 | 2 | ||
| Augochlora sp. (Say) | 2 | 2 | 0 | 4 | ||
| Augochlora sp. 2 | 0 | 1 | 0 | 1 | ||
| Augochlora sp. 3 | 1 | 0 | 0 | 1 | ||
| Megachilidae | Ashmeadiella sp. (Cockerell) | 2 | 2 | 0 | 4 | |
| Megachile sp. (Latreille) | 1 | 0 | 1 | 2 | ||
| Hypanthidium sp. (Cockerell) | 19 | 6 | 1 | 26 | ||
| Sphecidae | Isodontia sp. (Patton) | 0 | 1 | 0 | 1 | |
| Vespidae | Brachygastra sp. (Perty) | 0 | 1 | 0 | 1 | |
| Polistes sp. 1 (Latreille) | 0 | 1 | 2 | 3 | ||
| Zethus sp. (Fabricius) | 0 | 1 | 0 | 1 | ||
| Hypalastoroides sp. (Saussure) | 1 | 2 | 0 | 3 | ||
| Santamenes sp. | 1 | 1 | 0 | 2 | ||
| Mischocyttarus sp. (Saussure) | 3 | 0 | 0 | 3 | ||
| Pachodynerus sp. (Saussure) | 0 | 1 | 0 | 1 | ||
| Clypearia sp. (Saussure) | 1 | 0 | 0 | 1 | ||
| Lepidoptera | Arctiidae | Harrisina americana (Guérin-Méneville) | 0 | 1 | 0 | 1 |
| Lycomorpha pholus (Drury) | 1 | 0 | 0 | 1 | ||
| Atolmis sp. (Hubner) | 5 | 0 | 0 | 5 | ||
| Hesperiidae | Cogia hippalus (W.H. Edwards) | 2 | 0 | 0 | 2 | |
| Urbanus dorantes (Stoll) | 1 | 1 | 0 | 2 | ||
| Chiomara asychis (Stoll) | 1 | 0 | 0 | 1 | ||
| Erynnis horatius (Scudder y Burgess) | 2 | 0 | 0 | 2 | Erynnis horatius (Scudder y Burgess) | |
| Lycaenidae | Calydna sturnula (Geyer) | 0 | 1 | 0 | 1 | |
| Kisutam sp. (K. Johnson y Kroenlein) | 1 | 0 | 0 | 1 | ||
| Nymphalidae | Siproeta stelenes (Linnaeus) | 0 | 1 | 0 | 1 | |
| Microtia elva (H. W. Bates) | 3 | 0 | 0 | 3 | ||
| Texola elada (Hewitson) | 1 | 0 | 0 | 1 | ||
| Morfo 3 | 1 | 0 | 0 | 1 | ||
| Gelechidae | Morfo 55 | 2 | 0 | 0 | Gelechidae | |
| Total | 25 | 66 | 117 | 91 | 129 | 337 |
C: conservado; I: intermedio; P: perturbado.
Comparando cada horario entre sitios, encontramos que el sitio conservado tuvo una temperatura significativamente más alta en la mañana (30 °C±1.3) y el mediodía (37.2 °C±1.1) de la que se registró en los sitios intermedio (26.9 °C±0.9 y 31.2 °C±1.2) y perturbado (26.2 °C±1.4 y 34.4 °C±0.8). La temperatura registrada en el tercer periodo de observación (15:00 a 16:00 h) no fue significativamente diferente entre sitios. Respecto a la humedad, se encontraron diferencias significativas entre sitios (F5, 30=34.1, p=0.0001). El sitio con índice de perturbación intermedio tuvo un porcentaje de humedad significativamente mayor (73.11%±3.4) al de los otros 2 sitios (63.01%±2.9 y 65.48%±3.0 conservado y perturbado, respectivamente) en el periodo de observación matutino (p< 0.05). Comparando entre horarios, todos los sitios mostraron un porcentaje de humedad significativamente diferente en el periodo de 9:00 a 12:00 (p< 0.05).
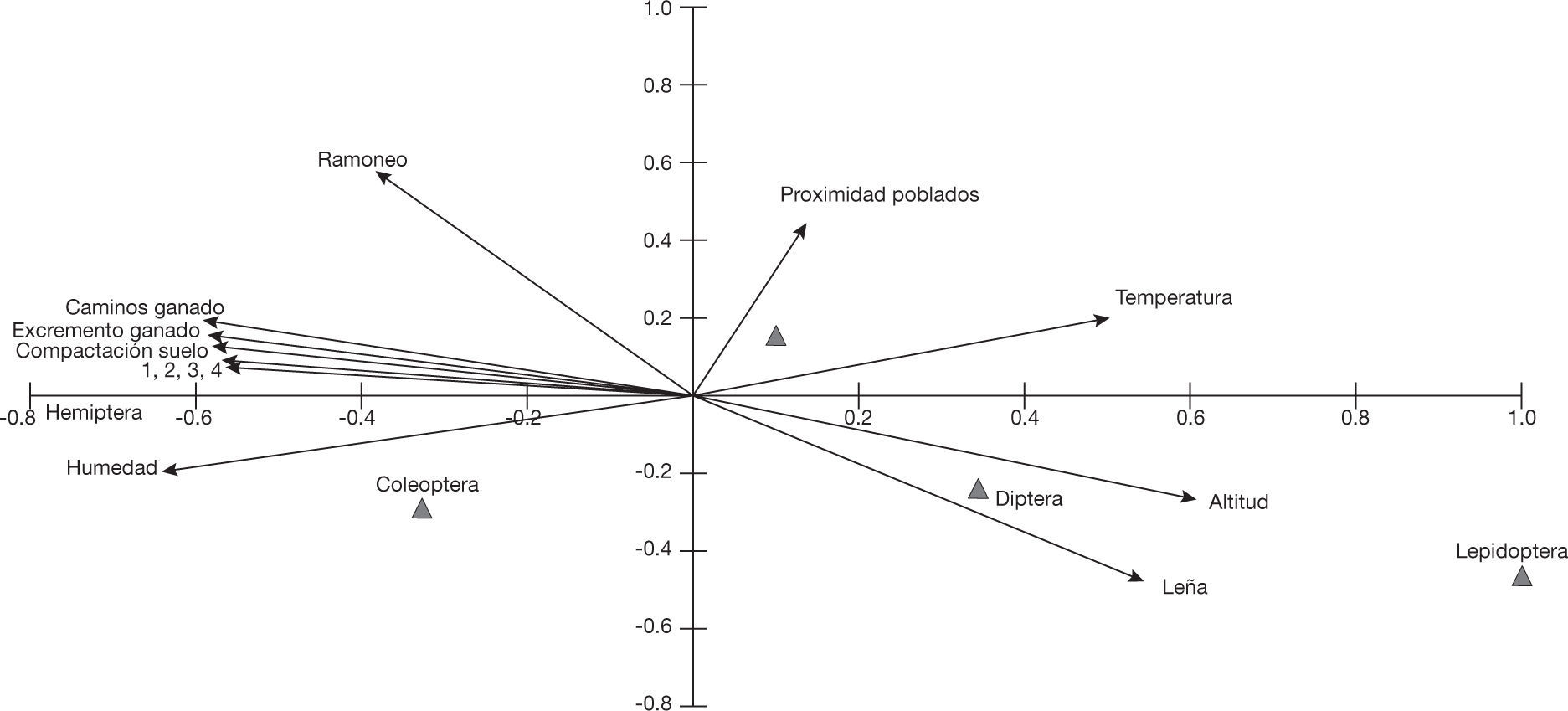
Efecto de los factores ambientales sobre los visitadores floralesLos resultados del ACC mostraron que Lepidoptera y Diptera incrementaron su abundancia a mayor altitud y temperatura, pero con menor humedad (fig. 2). Por el contrario, Hemiptera y Coleoptera fueron más abundantes a una menor altitud y temperatura, pero a mayor humedad. Este análisis explicó en un 49.8% y un 17.2% (primer y segundo eje de ordenación, respectivamente) la variación en abundancia de los órdenes de insectos de B. copallifera. Respecto a los factores de perturbación, el ACC mostró que Lepidoptera es el orden cuya abundancia podría encontrarse más afectada por los factores de perturbación (mayor desplazamiento en dirección opuesta a la de los vectores de perturbación) y Hemiptera el orden menos afectado (fig. 2).
Proporción (expresada como porcentaje) de especies sensibles y tolerantes a Gráfico del análisis canónico de correspondencia (ACC) que muestra la dinámica de la comunidad de visitadores florales a nivel de orden (triángulos) con respecto a los factores ambientales y de perturbación (vectores; 1, 2, 3 y 4 representan superficie de senderos, número de caminos, evidencia incendios y porcentaje erosión, respectivamente).
El ACC a nivel específico mostró gran variabilidad en el comportamiento de las especies en función de los factores ambientales y de perturbación. La variación en abundancia de las especies de visitadores florales en cada sitio fue explicada en un 51 y 16.5% (primer y segundo eje de ordenación, respectivamente) respecto a los factores ambientales considerados. Solo las especies más abundantes: Apis mellifera, Hypanthidium sp. y Blepharida flavocostata fueron recolectadas en los 3 sitios. El análisis de varianza mostró que A. mellifera incrementó significativamente (p< 0.01) su abundancia al aumentar el índice de perturbación, aunque hay que considerar que también en este sitio la altitud fue menor. Por el contrario, Hypanthidium sp. fue significativamente más abundante (p< 0.05) en el sitio conservado, disminuyendo su abundancia cuando se incrementa la perturbación y disminuye la altitud. La abundancia de B. flavocostata no se vio afectada por el nivel de perturbación, ni por variaciones en las variables ambientales consideradas. Al comparar la abundancia total de organismos, entre periodos de observación y sitios, el análisis factorial mostró que la abundancia fue significativamente diferente entre horarios (F2,18=203.9, p=0.00001) y sitios (F2,18=414.4, p=0.00001). Asimismo, la interacción entre sitios y horarios también fue significativa (F4,18=162.8, p=0.00001). Las pruebas de Bonferroni mostraron que el sitio con mayor grado de perturbación, en el periodo de observación de 3:00 a 6:00, tuvo significativamente más organismos (p< 0.01). El Anova factorial, considerando la riqueza de especies por sitio y horario, mostro que hubo diferencias significativas de acuerdo con el horario (F2,18=44.1, p=0.00001), de acuerdo con el sitio (F2,18=25.7, p=0.00005) y también considerando la interacción de ambos factores (F4,18=59.2, p=0.00001); donde las pruebas de Bonferroni mostraron que el sitio más conservado y con mayor altitud fue significativamente más numeroso en especies (p< 0.01), en todos los horarios.
Por otro lado también, a partir de la tabla 2, se calculó la proporción de especies sensible (ausentes en el sitio perturbado) y tolerantes (presentes y abundantes en el sitio perturbado; fig. 1), encontrando que para todos los órdenes la proporción de especies sensibles fue mayor, respecto a las tolerantes.
El análisis de Kruskal-Wallis, usado para comparar la diversidad de la comunidad de visitadores florales (índice de Simpson) entre sitios, mostró que el sitio perturbado fue significativamente menos diverso (X2=5.6, g.l.=2, p=0.0495) que los otros 2 sitios (tabla 3). Mientras que el análisis de similitud (Anosim) mostró que hubo diferencias en la composición de insectos entre sitios (R=0.057, p=0.004, 9,999 permutaciones) y dentro de los sitios (horarios) a lo largo del tiempo (Conservado: R=0.37, p< 0.001; Intermedio: R=0.31, p=0.005; Perturbado: R=0.35, p=0.002).
Abundancia, riqueza y diversidad de los 3 sitios analizados, en un gradiente de perturbación, en el rancho El Salado, Jolalpan, Puebla
| Sitio | Riqueza | Abundancia | Diversidad (índice de Simpson) |
|---|---|---|---|
| Conservado | 40 | 116 | 0.93a |
| Medianamente conservado | 37 | 92 | 0.899a |
| Perturbado | 31 | 161 | 0.706b |
Los superíndices “a” y “b” señalan diferencias significativas entre ellos (p< 0.05).
Las flores de B. copallifera atraen una gran riqueza de visitadores florales (66 especies), considerando que su periodo de floración es corto y que este recurso se encuentra restringido en el tiempo (Velázquez, 2011). Respecto a otras especies, Vidal y Ramírez (2005) registraron 7 especies de visitadores florales para Bursera linanoe y para B. simaruba; sin embargo, ambas especies fueron estudiadas en un bosque deciduo en Venezuela, por lo que la diferencia en las condiciones ambientales puede ser determinante en la riqueza de visitantes florales. El gran número de insectos visitadores florales de B. copallifera puede ser favorable, ya que aumenta la probabilidad de que existan polinizadores efectivos. Las 66 especies de visitadores florales pertenecen a 5 órdenes de insectos; lo cual contrasta con lo publicado por Velázquez (2011), quien solo registró a Hymenoptera y Coleoptera como visitadores florales de B. copallifera. Aunque también en nuestro estudio estos órdenes fueron los más abundantes (42 y 28%, respectivamente).
Variación de los factores ambientalesLos factores ambientales mostraron patrones opuestos a lo esperado, ya que a mayor altitud se esperaría un aumento de la humedad y una disminución de la temperatura. Esto puede estar relacionado con la ubicación de los sitios. El sitio de menor altitud se ubicó al pie de una cañada, con orientación Noroeste, por lo que la humedad fue mayor y la temperatura menor a la de los otros sitios. Lo opuesto ocurrió con el sitio conservado, ubicado cerca de la cima de un cerro, con orientación Suroeste. Estas diferencias en las condiciones ambientales, impidieron discernir la contribución relativa de cada variable de perturbación en la comunidad de visitadores florales. Así, en el ACC se consideraron los factores de perturbación como variables ambientales, que junto con la temperatura, humedad y altitud ayudan a explicar la variación de la comunidad de insectos. En nuestro estudio, los factores ambientales (ACC) explicaron en un 49.8% la variación en la abundancia de los visitadores florales, por lo que las variables consideradas (ambientales y de perturbación) son importantes en la dinámica de la comunidad de visitadores florales; lo cual era de esperarse según Lewis (2006), Torres-Díaz, Cavieres, Muñoz-Ramírez y Arroyo (2007) y Régnière (2009).
Efecto de los factores ambientales en los órdenes y especies de visitadores floralesEl orden Lepidoptera aumentó significativamente su abundancia a una mayor altitud y temperatura, pero también se encuentra desplazada en dirección opuesta a la mayoría de los vectores de perturbación. Asimismo, mostró ser el único orden que no presenta especies tolerantes a la perturbación (fig. 1). Aunque los sitios de estudio no solo varían en el grado de perturbación, sino también en altitud (el comportamiento de Lepidoptera podría deberse al cambio de altitud y no necesariamente a la perturbación) coincide con los estudios previos de Foo y Norzagaray (2009), donde Lepidoptera fue un grupo susceptible a la pérdida y fragmentación del hábitat; particularmente en nuestra zona de estudio, la agricultura nómada y los pastizales inducidos han fragmentado el hábitat, por lo que este orden podría ser un indicador de perturbación antropogénica en esta región. Los órdenes Hemiptera y Coleoptera fueron el caso opuesto al anterior, incrementaron su abundancia a menor altitud y temperatura, pero a mayor humedad, y simultáneamente se ubicaron en la misma dirección de la mayoría de los vectores de perturbación. Asimismo, Hemiptera presentó la más alta proporción de especies tolerantes (fig. 1). Existen estudios que han mostrado que algunos hemípteros (Nickel y Hildebrandt, 2003; Parisi, Menta, Gardi, Jacomini y Mozzanica, 2005; Tooby y Macey, 1977) pueden ser resistentes a determinados tipos de perturbación, al igual que los coleópteros (Castillo, 2004; Cobb, Langor y Spence, 2007; Da Silva, Aguiar, Niemelä, Sousa y Serrano, 2008; Kaila, Martikainen y Punttila, 1997; Scheffler, 2005; Werner, 2002), por lo que no se descarta una influencia importante de la perturbación en el comportamiento de estos órdenes. Hymenoptera y Diptera no presentaron un patrón claro como los otros órdenes. Sin embargo, Hymenoptera se encontró cercano al vector de proximidad de poblados y Diptera cercano al vector de presencia de leña.
Se ha registrado a A. mellifera como una especie invasora, abundante en hábitats perturbados (Aizen y Feinsinger, 1994a; Aizen, Vázquez y Smith-Ramírez, 2002; Quintero et al., 2010; Riveros, 1991; Torres y Galetto, 2008). Por ejemplo, Aizen et al., (2002) registraron un incremento de casi el 300% de esta especie en sitios altamente perturbados. De manera similar, nuestros resultados mostraron que A. mellifera aumentó su abundancia más de un 300%, al comparar el sitio conservado e intermedio (2 y 25 individuos, respectivamente) con el sitio perturbado (83 individuos). Los trabajos sobre especies invasoras (Traveset y Richardson, 2006; Vidal y Ramírez, 2005) han mostrado que una vez se establecen, aumentan su abundancia y dominan una comunidad desplazando a los competidores nativos; así, pueden alterar la estructura de las redes mutualistas (Aizen et al., 2008). Sin embargo, a pesar de que en nuestro estudio, en el sitio más perturbado se registró la menor diversidad, son necesarios mayores estudios para poder determinar si A. mellifera está desplazando a los visitadores nativos.
Otra de las especies con mayor abundancia fue Hypanthidium sp. y, al contrario que A. mellifera, su abundancia se incrementó conforme disminuyó la perturbación y aumentó la altitud. Bosch, Vicens y Blas (1993) registraron que tanto Hypanthidium sp. como A. mellifera consumen el mismo recurso (polen y néctar), por lo que estos cambios de abundancia en Hypanthidium sp., podrían atribuirse a su sensibilidad a los factores de perturbación y/o a que este organismo podría estar siendo desplazado por un visitador exótico (por ejemplo, A. mellifera). Sin embargo, Scott (1984) reportó que las especies del género Hypanthidium utilizan la resina de B. copallifera para construir sus nidos, por lo que las variaciones de abundancia también podrían estar relacionadas con variaciones en la densidad de plantas de B. copallifera. En nuestro estudio no se contabilizó la densidad de individuos de B. copallifera, por lo que no se puede determinar la influencia de este factor sobre la abundancia de Hypanthidium sp.
La especie B. flavocostata se presentó en los 3 sitios y también fue de las más abundantes. De acuerdo con Becerra, Venable, Evans y Bowersamer (2001), esta especie es depredadora (herbívoro) de B. copallifera y utiliza la resina de esta última como defensa contra sus propios depredadores. Aunque se sabe que la perturbación puede afectar también las interacciones de depredación (Bustamante y Grez, 1995), en nuestro estudio, B. flavocostata también incrementó su abundancia en el sitio perturbado. Su presencia y abundancia en los 3 sitios indica que esta especie podría tener también amplios intervalos de requerimientos ambientales, por lo que su abundancia no se vio afectada por la variación en las condiciones ambientales ni de perturbación.
Por su parte, los resultados dentro de cada orden, así como la proporción de especies calculada a partir de las abundancias (fig. 1) mostraron que en la mayoría de los grupos existen más especies sensibles a la perturbación que especies tolerantes. Solo el orden Coleoptera mostró un número similar de especies tolerantes que sensibles. Castillo (2004) encontró que las especies de este orden abundan en sitios con perturbación media, lo cual significaría un mayor número de especies con amplios intervalos de requerimientos ambientales. Dentro del orden Hymenoptera se encontró que más del 50% de las especies mostraron ser sensibles a la perturbación, tal como lo mencionan Aizen y Feinsinger (2003). Esto podría deberse a que la fragmentación del hábitat disminuye la densidad y calidad de los sitios de anidación de algunos insectos, como es el caso de muchas abejas (Cuéllar, 1999; Ferrari, 2011; Galetto et al., 2007). Sin embargo, también se ha mencionado (Castillo, 2004; Quintero et al., 2010) que hay un mayor número de especies de abejas en hábitats perturbados, aunque estos resultados son contradictorios; Winfree, Aguilar y Vázquez (2009) mostraron que la escala juega un papel importante ya que en “parches” pequeños hay una permanente migración de himenópteros provenientes de parches conservados. En este mismo orden, llama la atención la presencia de la familia Formicidae (segunda más abundante; tabla 2), ya que debido a su tamaño bien podrían ser polinizadores de las pequeñas flores de B. copallifera. Aunque se ha registrado (Beattie, Turnbull, Hough, Jobson y Knox, 1984; Delabie, Ospina y Zavala, 2003; Ness, Mooney y Lach, 2010) que, en general, las hormigas no son buenos agentes polinizadores, Kaiser-Bunbury, Memmott y Müller (2009) han considerado a Brachymyrmex el género más abundante en nuestro estudio, y a Pheidole como polinizadores, ya que son considerados como integrantes de las redes de polinizadores en una zona tropical de la isla Mauricio. Por otro lado, Brachymyrmex, Pseudomyrmex y Myrmelachista han sido asociados a un incremento en el tamaño de los frutos de café (Philpot, Uno y Maldonado, 2006); sin embargo, no se pudo determinar si fue debido a la polinización por hormigas o más bien a un efecto indirecto (interacción con polinizadores voladores). Como sea, Beattie et al. (1984) demostraron claramente el efecto adverso sobre el polen por exposición al tegumento en los géneros Myrmecia y Camponotus, este último presente en nuestro estudio; así entonces, el papel de algunos géneros de hormigas como polinizadores sigue siendo poco claro.
Para el caso de las especies del orden Hemiptera, Castillo (2004) encontró menor diversidad en sitios conservados, lo cual difiere con nuestro estudio, ya que la comunidad de hemípteros fue más diversa en el sitio conservado. También hay que considerar, que el estudio de Castillo (2004) fue realizado en un desierto. Por último, para en el orden Diptera 2 especies fueron sensibles y 2 fueron tolerantes a la perturbación. Esto podría estar relacionado con lo registrado por Castillo (2004), donde los miembros del orden Diptera son más abundantes en sitios con perturbación intermedia.
Efecto de los factores ambientales en la comunidad de visitadores floralesSe encontró que el sitio conservado mostró el mayor número de especies. Lo cual coincide con Aizen y Feinsinger (1994b), Ferrari (2011) y Steffan-Dewenter et al. (2005) quienes documentaron que ocurre una pérdida de diversidad cuando la perturbación aumenta. Esto fue contrario a lo mencionado por Cuéllar (1999), quien no encontró diferencias en el número de especies, pero sí en la composición de especies entre sitios fragmentados y de vegetación natural continua. Aunque existen estudios donde esta tendencia no es clara, o incluso la tendencia es contraria (Castillo, 2004; Galetto et al., 2007; Quintero et al., 2010). Sin embargo, cabe aclarar que todos estos estudios consideraron únicamente a los polinizadores y no a toda la comunidad de visitantes florales; además de que los estudios se han realizado en diferentes hábitats, donde la respuesta a la perturbación podría variar. Por otro lado no hay que perder de vista que en nuestro estudio la altitud, temperatura y humedad varían simultáneamente con la perturbación.
En conclusión, las flores de B. copallifera atraen una gran riqueza de especies visitantes florales; donde todos los órdenes de visitadores florales tuvieron especies tolerantes a la perturbación, pero fue mayor el número de especies sensibles, patrón que ya ha sido documentado en la literatura (Samways, 1994; Traveset, 1999). Consideramos que existen distintas variables relacionadas con la interacción planta-polinizador (i. e., densidad de flores, producción de frutos y semillas, viabilidad de las semillas, etc.) que pueden mostrar respuestas diferentes para un mismo tipo de perturbación antropogénica (Aizen y Feinsinger, 2003; Chacoff y Morales, 2007). Finalmente, aunque la abundancia y la riqueza de la comunidad de visitadores florales mostró una tendencia hacia la pérdida de riqueza y diversidad, y un aumento significativo en la abundancia de las especies más tolerantes, es importante aclarar que las diferencias de altitud entre los sitios, son un obstáculo para poder demostrar claramente que la perturbación es la única causa de estas variaciones en la comunidad de insectos; por lo que estos resultados no son concluyentes. Desafortunadamente los efectos de la fragmentación no son lineales, sino que se multiplican al llegar a un cierto porcentaje de hábitat destruido, el umbral crítico, a partir del cual las extinciones locales aumentan exponencialmente (Santos y Tellería, 2006). Por lo que es urgente realizar mayores estudios, que permitan estimar claramente el efecto de la perturbación en B. copallifera, especie de gran importancia económica, medicinal y cultural en México.
AgradecimientosAgradecemos a las autoridades municipales y a los habitantes de la localidad rancho El Salado, Jolalpan, Puebla, por el apoyo y facilidades para la realización de este estudio. Nuestra gratitud a los Doctores Miguel Ángel Morón, Felipe A. Noguera, Luis Leonardo Delgado, Ma. Magdalena Ordóñez, David Furth, Mauro Daccordi, Charles Staines, Luis Cervantes, Jorge Valenzuela, Carlos Hernán Vergara y Sergio Ibáñez, miembros de distintas instituciones, quienes apoyaron en la identificación de los organismos.