Conocer las características anatómicas (queratometría simulada promedio y paquimetría corneal), biomecánicas (histéresis corneal y factor de resistencia corneal) y aberrométricas (aberraciones corneales representadas por los polinomios de Zernike) de la córnea de pacientes con síndrome de Marfan.
Material y métodosEstudio prospectivo, transversal y observacional. Se estudiaron pacientes con diagnóstico confirmado de síndrome de Marfan. Las características anatómicas y aberrométricas fueron medidas con una cámara rotatoria de Scheimpflug (Pentacam, Oculus) y las características biomecánicas con el analizador de respuesta ocular (Reicher). Las mediciones con el analizador de respuesta ocular se realizaron en 4 ocasiones y se representaron por su promedio; todos los estudios fueron realizados por un mismo examinador.
ResultadosSe estudiaron 20 ojos de 10 pacientes con diagnóstico de síndrome de Marfan, el 60% fueron hombres, con una edad promedio de 24±10.79 años (rango, 11-39). Tres ojos de 2 pacientes fueron afacos debido a luxación espontánea del cristalino al segmento posterior; de los otros 17 pacientes, el 100% presentó una subluxación del cristalino. La queratometría simulada promedio fue de 40.49±1.54D (rango, 38.7-42.7), el 80% de los ojos tuvieron queratometría menor de 42D. EL grosor corneal central promedio fue de 562±37.23μm (rango 506-626μm). Todos los pacientes tuvieron un coeficiente de aberraciones patológico de 1.55±0.37 (rango, 1.1-2.5). La histéresis corneal fue 9.13±1.49mmHg (rango, 7.1-12) y el factor de resistencia corneal fue de 9.09±2.41mmHg (rango, 4.8-13.6).
ConclusionesEn nuestro grupo estudiado, la córnea de pacientes con síndrome de Marfan presenta córneas plana, con una paquimetría y propiedades biomecánicas normales pero con un coeficiente de aberraciones anormal.
To know the anatomical (mean keratometry, central pachimetry), optic (corneal aberrations represented by Zernike polynomials) and biomechanical (corneal hysteresis, and corneal resistance factor) characteristics in patients with Marfan syndrome.
Material and methodsProspective, transversal and observational study. We study patients with confirmed diagnosis of Marfan syndrome. The anatomical and aberrometrical characteristics was measured with otating Scheimpflug Camera (Pentacam, Oculus) and the biomechanical characteristics with ocular response analyzer (Reichert). The ocular response analyzer measures was made 4 times and represented by his average. All the studies was made by the same examiner.
ResultsTwenty eyes of 10 patients with confirmed diagnosis of Marfan syndrome was studied. 60% was male with an average age of 24±10.79 years (range, 11-39). Three eyes of 2 patients was aphakic because a spontaneous posterior lens dislocation, of the other 17 eyes 100% subluxation of the lens. Mean simK was 40.49±1.54D (range, 38.7-42.7) 80% had less than 42D. Average central corneal thickness was 562±37.23μm (range 506-626μm). All the patients had a patological aberration coefficient 1.55±0.37 (range, 1.1-2.5). Corneal hysteresis was 9.13±1.49mmHg (range, 7.1-12) and corneal resistance factor 9.09±2.41mmHg (range, 4.8-13.6).
ConclusionsIn our studied group, the corneas of Marfan syndrome patients presents a flat corneas with a normal pachymetry and biomechanical properties but with a abnormal aberration coefficient values
El síndrome de Marfan (SM) es una enfermedad del tejido conectivo que se hereda de forma autosómica dominante y tiene una incidencia de 1:10,000. La fibrilina-1 es una glucoproteína ácida que se codifica en el gen de la fibrilina (FBN1) que está localizado en el cromosoma 15q15-211,2.
El SM afecta distintos órganos y sistemas, entre los más importantes está en esquelético, el cardiovascular y el pulmonar, además afecta la piel y sus tegumentos, la duramadre y el globo ocular. Los criterios más recientes para el diagnóstico de la enfermedad son los proporcionados por la Nosología de Ghent en 1996, que se basan en la historia familiar-genética y el compromiso de los diferentes órganos o sistemas afectados. Para evaluar los criterios de Ghent se debe considerar 2 conceptos: uno es el criterio mayor, como evidencia de signo de alta especificidad de la enfermedad porque es infrecuente en otras condiciones o en la población general, y otro es el compromiso de órgano o sistema, que indica afección pero con menor trascendencia en el diagnóstico. A nivel oftalmológico el único criterio mayor es la ectopia lentis, además, existen 3 criterios menores que son: córnea plana, aumento del eje axial del globo ocular e hipoplasia del iris o disfunción del músculo ciliar3.
La ectopia lentis es la anormalidad ocular predominante y ocurre en el 50-80% de los pacientes, otras alteraciones oculares que han sido reportadas en la literatura incluyen la miopía axial y/o lenticular, desprendimiento de retina, cataratas preseniles, glaucoma, estrabismo, anormalidades del iris y córnea plana4–6.
La fibrilina está ampliamente distribuida en tejidos conectivos del globo ocular, incluyendo la cápsula del cristalino y zónulas, el iris, el epitelio corneal, la membrana de Bowman y la conjuntiva, además ha sido encontrada en la esclera, coroides, membrana de Bruch y la lámina cribosa; toda esta distribución en el globo ocular puede explicar algunas de las patologías oculares asociadas al SM7.
Como mencionamos previamente, la córnea plana de los pacientes con SM es uno de los criterios menores de Ghent3; Sultan et al.8 reportaron una disminución significativa de la queratometría simulada promedio en pacientes con SM (Qs 40.8±1.4D), hallazgos también encontrado por Maumenee4 en su grupo de pacientes con SM (Qs 41.38±2.04D). Otras alteraciones corneales reportadas son guttas endoteliales9,10, córnea delgada8 y megalocórnea11.
A nivel histopatológico, estudios con microscopia confocal han encontrado alteraciones mayormente en el estroma corneal; Sultan et al. hallaron que el adelgazamiento de la córnea era dependiente del estroma corneal, reportando perfiles de escaneo anormales con un aumento en la dispersión de la luz8; además, el grupo de Iordanidou et al.12 encontró que la matriz extraceular tanto del estroma anterior como posterior era visible claramente de una forma inusual, apareciendo como líneas de reflectividad muy alta que se conectaban entre los queratocitos, por lo que ellos sugirieron que estos hallazgos de líneas hiperreflécticas brillosas de matriz extracelular podrían indicar la presencia de abundante fibrillina anormal en el estroma corneal. Además, a nivel endotelial en 12 de 24 ojos de pacientes con SM se encontró la presencia de partículas reflectivas muy delgadas y brillantes que no se observaron en el grupo control.
Las características biomecánicas de un tejido están determinadas por la manera en que este tejido responde a la deformación cuando es aplicado estrés. La histéresis corneal (HC) y el factor de resistencia corneal (FRC), ambos valores derivados del análisis con el analizador de respuesta ocular (Reichart), son indicadores de las propiedades biomecánicas de la córnea13. La HC es un fenómeno que es el resultado de la amortiguación viscosa inherente de la córnea que se evalúa mediante la aplicación directa de un pulso de aire en la córnea, lo que causa una deformación momentánea. El FRC es un parámetro calculado empíricamente que refleja la resistencia en general de la córnea13.
Las propiedades biomecánicas de la córnea han sido estudiadas en varias dolencias oculares; se ha encontrado que la HC está disminuida significativamente en pacientes con queratocono, distrofia de Fuchs, glaucoma y en pacientes postoperados de cirugía refractiva con excímer láser (LASIK)14–16.
Hasta el momento, existe solo un estudio que evalúa las características biomecánicas de la córnea de pacientes con SM. Kara et al.17 encontraron que la HC y el FRC estaban disminuidos en pacientes con SM, y esto era más importante en los pacientes que tuvieron subluxación del cristalino.
Material y métodosEntre enero y diciembre del 2009 recibimos a 3 pacientes de 3 familias diferentes con diagnóstico confirmado de SM en la Fundación Destellos de Luz. De estos casos índice, realizamos una evaluación de sus familiares y encontramos a 11 pacientes de 14 evaluados con manifestaciones clínicas de SM; a todos ellos se les envió a valoración genética y cardiológica para confirmar el diagnóstico de SM y evaluar la presencia de complicaciones cardiovasculares que pudieran poner en riesgo su vida. Un paciente de 4 años fue excluido debido a la poca cooperación para la realización de los estudios, por lo que estudiamos 20 ojos de 10 pacientes con diagnóstico confirmado de SM.
Antes de iniciar el estudio, todos los pacientes fueron informados de la naturaleza del mismo y se obtuvo un consentimiento informado; todos los procedimientos fueron hechos según la Declaración de Helsinski para la investigación en seres humanos.
Se realizó una evaluación oftalmológica completa que incluyó la medición de la agudeza visual, la presión intraocular, evaluación con biomicroscopio de la córnea y el segmento anterior, presencia y localización del cristalino, y una evaluación bajo dilatación farmacológica de la retina así como la presencia y localización de la subluxación del cristalino.
Las características anatómicas y aberrométricas de la córnea fueron evaluadas con un tomógrafo con cámara rotatoria de Scheimpflu (Pentacam, Oculus) y las características biomecánicas se estudiaron con el analizador de respuesta ocular (Reichert). Todos los estudios fueron realizados por un experto en el uso de los equipos y siempre por el mismo.
Las mediciones del Pentacam fueron tomadas en el modo automático de acuerdo a la guía de instrucciones de la compañía vendedora; solo se utilizaron para el análisis los estudios que tuvieran una calidad aceptable (OK) en las especificaciones de calidad del examen. Las aberraciones de frente de onda corneal fueron calculadas mediante el análisis Zernicke, además se tomó el valor del coeficiente de aberraciones que es un coeficiente que el sistema Oculus Pentacam calcula a partir del análisis de Zernike con valores normales menores que 1.
Las mediciones con el analizador de respuesta ocular (Reichert) se realizaron en 4 ocasiones y sus valores fueron la representación del promedio de las mismas.
ResultadosSe estudiaron 20 ojos de 10 pacientes con diagnóstico confirmado de SM. Seis de ellos (60%) fueron hombre, la edad promedio fue de 24±10.79 años (rango, 11-39). El rango de la agudeza visual fue de percepción de movimiento de manos a 20/30.
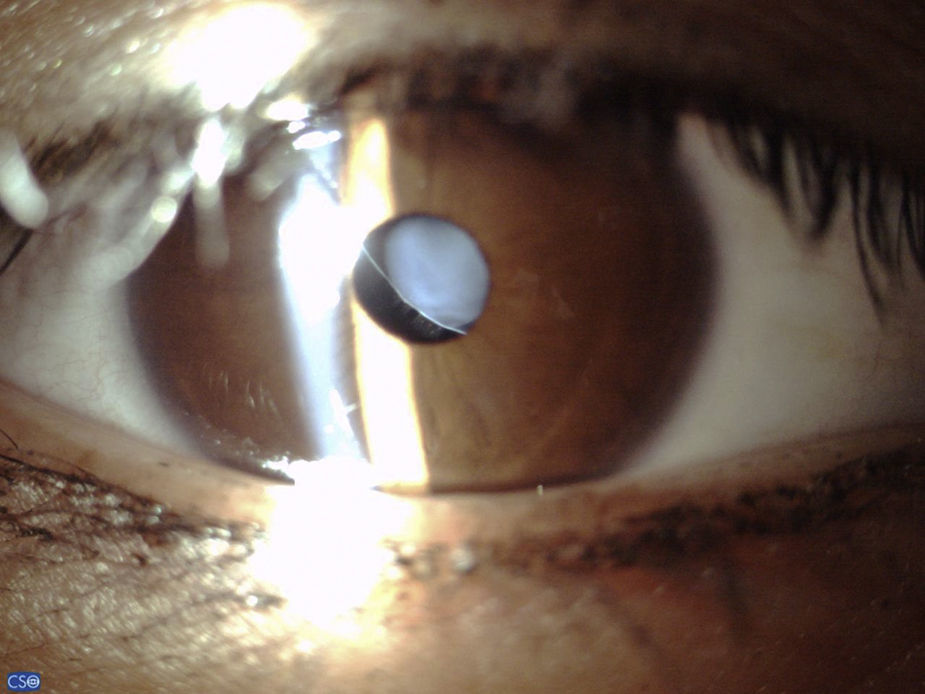
Tres ojos de 2 pacientes fueron afacos debido a luxación espontánea del cristalino al segmento posterior; de los otros 17 ojos, el 100% presentó facodonesis y subluxación del cristalino, la subluxación del cristalino se detecto sin necesidad de dilatar la pupila en 15 de 17 casos (88.24%) (fig. 1). En 7 de 17 ojos (41.2%), la dirección de la subluxación fue superonasal, seguida de la inferior en 6 pacientes (35.29%), y en los otros 4 pacientes (23.53) la subluxación fue superotemporal. La iridodonesis se detectó en 18 de 20 ojos (80%).
El grosor corneal central promedio fue de 562±37.23μm (rango 506-626μm). Todos los pacientes tuvieron un coeficiente de aberraciones patológico 1.55±0.37 (rango, 1.1-2.5). La HC fue de 9.13±1.49mmHg (rango, 7.1-12) y el FRC fue de 9.09±2.41mmHg (rango, 4.8-13.6).
En relación con las características anatómicas de la córnea, la queratometría simulada promedio fue de 40.49±1.54D (rango, 38.7-42.7D), 4 ojos de 2 pacientes (20%) tuvieron más de 42D. La queratometría simulada promedio más plana fue de 39.45±1.55D (rango, 37.7-41.9D). Solo 4 ojos de 2 pacientes tuvieron una queratometría más curva mayor a 42D (promedio 41.52±1.62D; rango, 39.2-43.7).
Todos los pacientes tuvieron un coeficiente de aberraciones patológico con un promedio de 1.55±0.37 (rango, 1.1-2.5). Las aberraciones más importantes fueron el trefoil 0.000852±0.000299 (rango, 0.00064-0.001064), la coma 0.00197±0.00016 (rango, 0.00186-0.00209) y el tetrafoil 0.00068±0.00042 (rango, 0.00037-0.00098).
La HC promedio fue de 9.13±1.49mmHg (rango, 7.1-12) y el FRC fue de 9.09±2.41mmHg (rango, 4.8-13.6).
DiscusiónLas características demográficas de nuestros pacientes son similares a las encontradas por otros estudios, ya que al ser una enfermedad de herencia autosómica dominante, ambos géneros están afectados. Aunque la luxación del cristalino a la cavidad vítrea o la cámara anterior ha sido reportada en solo un 2-3% de los ojos de pacientes con SM18, nuestro número de pacientes con afaquia por luxación a la cavidad vítrea es mayor (15%), quizá debido a que nuestros pacientes provienen de una práctica oftalmológica. De los otros 17 ojos, todos presentaron facodonesis y subluxación del cristalino, resultados similares a lo reportado por Sultan et al.8 que encontraron estos hallazgos en el 86% de sus pacientes.
Aunque la subluxación fue posible detectarla sin necesidad de la dilatación farmacológica de la pupila en la mayoría de nuestros pacientes (15/17 ojos), es importante realizar una evaluación bajo dilatación farmacológica para confirmar la subluxación así como revisar la periferia de la retina en busca de lesiones predisponentes de desprendimiento de retina.
Clásicamente se ha descrito que la subluxación del cristalino ocurre hacia la región superotemporal, sin embargo, se puede presentar en cualquier dirección. En una serie de 280 ojos Cross et al.11 reportaron un 67% de subluxación superior, también Sultan et al8 reportan que casi siempre la subluxación ocurre en el sector superotemporal; nosotros también encontramos que en el 64.7% (11/17 ojos) la subluxación fue hacia el sector superior, sin embargo, la subluxación más frecuentemente encontrada fue hacia la región superonasal en un 41.2% de los casos.
La córnea plana es uno de los criterios menores de Genth; en nuestro estudio encontramos que el 80% de los pacientes tuvieron una queratometría promedio menor de 42D, esto es similar a lo reportado por Heur et al.19 quienes encontraron que el 74.5% (82 de 110 ojos) tuvieron una queratometría promedio menor de 42D. Con relación al grosor corneal central, nosotros encontramos valores normales para nuestra población de 562±37.23micras (rango, 506-626μm), esto es similar a lo encontrado por Heur et al.19 quienes utilizaron un paquímetro ultrasónico y no encontraron diferencias importantes entre el grupo control y los pacientes con SM con un grosor corneal promedio de 543.5 ±37.3μm. Pero esto difiere de lo reportado por Sultan et al8 quienes encontraron una disminución significativa de la paquimetría corneal en pacientes con SM en comparación con un grupo control (502±41.9μm en pacientes con SM) utilizando un paquímetro de Orbscan al igual que Konradsen et al.20 quienes también utilizaron el Orbscan para medir el grosor corneal y encontraron una paquimetría disminuida en pacientes con SM en comparación con un grupo control (485±54.5 versus 514±37.3μm), estas diferencias podrían explicarse por la variación en el grosor corneal entre diferentes razas así como por los distintos equipos utilizado para medirla.
Cuando analizamos las características ópticas y aberrométricas de la córnea a través del coeficiente de aberración, todos los pacientes tuvieron valores anormales del mismo 1.55±0.37 (rango, 1.1-2.5). Estos resultados podrían explicarse con los hallazgos en la microscopia confocal reportados por los grupos de Sultan et al. y Iordaniou et al.8,12quienes encontraron alteraciones de la matriz extracelular del estroma corneal además de un aumento en la difracción de la luz; todos estos cambios podrían producir irregularidades a nivel histológico que puedan manifestarse clínicamente como aberraciones corneales.
Nuestros resultados en la biomecánica corneal están dentro de lo reportado en la literatura para personas sanas14,15. En un estudio de 165 ojos, Ortiz et al.15 encontraron valores de HC de 10.8±1.5mmHg y de FRC de 11.0±1.6mmHg; en nuestro grupo, la HC promedio fue de 9.13±1.49mmHg (rango, 7.1-12mmHg) y el FRC fue de 9.09±2.41mmHg (rango, 4.8-13.6mmHg), valores muy similares a lo reportado por Kara et al.17 en pacientes con subluxación del cristalino. Además, estos autores tampoco encontraron diferencias estadísticamente significativas en la HC y el FRC entre el grupo control y los pacientes con SM, sin embargo, estudiaron tanto a pacientes con subluxación del cristalino (CH 9.9±1.2mmHg, FRC 8.2±1.8mmHg) como sin ella (CH 11.2±1.5mmHg, FRC 11.3±1.9mmHg); al comparar a los pacientes con SM con subluxación del cristalino y sin subluxación del cristalino, sí hubo una diferencia estadísticamente significativa; ya que en nuestro grupo todos los pacientes tuvieron subluxación o luxación del cristalino no es posible realizar esta comparación.
Entre las debilidades de este estudio, la más importante es la ausencia de un grupo control para su comparación, por lo que se tuvo que recurrir a una comparación histórica con lo reportado en la literatura, además de la cantidad pequeña de pacientes y finalmente que estos pertenecen únicamente a 3 familias; y debido a que el SM presenta una penetrancia incompleta con expresibilidad variable21, lo que se requiere es un amplio grupo de pacientes y con características genéticas diferentes para poder tener datos más homogéneos.
ConclusionesEn nuestro grupo estudiado, la córnea de pacientes con SM presenta córneas plana, con una paquimetría y propiedades biomecánicas normales pero con un coeficiente de aberraciones anormal.
FinanciamientoEl autor no recibió patrocinio para llevar a cabo este artículo.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.