Las células madre son aquellas células poco diferenciadas capaces de autorrenovarse y diferenciarse hacia células especializadas en el cuerpo. Se encuentran en todos los tejidos autorrenovables como son los epitelios. En el caso del epitelio corneal se ha encontrado que las células madre están alojadas en la región límbica, y más concentradas en la región superior e inferior. Algunos de los marcadores que se utilizan para identificarlas son: p63, ABCG2, C/EBPd, Bmi1, Notch1, K19, vimentina, entro otros. Actualmente se ha estudiado la utilización de células madre límbicas en padecimientos que involucran deficiencia de las mismas: como daño químico o térmico a la superficie ocular, síndrome de Stevens-Johnson y aniridia. Para cultivar las células madre es necesario tomar una biopsia de limbo esclerocorneal de 1-2mm2 la cual puede sembrarse directamente o ser tratada previamente con tripsina y dispasa para crear una suspensión de células. Se han utilizado capas alimentadoras de soporte como: fibroblastos 3T3, membrana amniótica, matrices extracelulares matrigel, colágeno, polímeros de gelificación termosensible y cápsula anterior de cristalino. Los medios de cultivo utilizados también varían, siendo los más utilizados el medio de Eagle modificado por Dulbecco, Ham F12, MCDB151, medio EpiLife, PCT, entre otros. Para transportar las células madre a la superficie ocular han sido estudiados diversos sustratos o medios de soporte. El que más se utiliza actualmente es la membrana amniótica, pero otros como lentes de contacto, geles de fibrina y biopolímeros termosensibles están también reportados.
Stem cells are those poorly differentiated bodily cells capable of self-renewing and differentiating into specialized cells in the human body. They can be found in all self-renewing tissues like epithelia. It is well known that in corneal epithelium stem cells are housed in the limbal region, more concentrated in the upper and lower corneal limbus. Some of the markers that have been used to identify them are: p63, ABCG2, C/EBPd, Bmi1, Notch1, K19, vimentin, among others. Currently, research has been made on the use of limbal stem cells to treat conditions that involve their deficiency, such as: chemical or thermal damage to the ocular surface, Stevens-Johnson syndrome, and aniridia. To culture stem cells it is necessary to take a 1-2 mm2 biopsy from the sclerocorneal limbus which can be directly seeded or previously treated with trypsin and dispase to create a cell suspension. Feeder layers have been used as scaffold based on 3T3 fibroblasts, amniotic membrane, matrigel extracellular matrix, collagen, thermosensible gelation polymers, and anterior lens capsule. Culture media also vary, being the following the most used: Dulbecco's modified Eagle medium, Ham F12, MCDB151, EpiLife medium, PCT, etc. Various substrates have been studied to transport stem cells to the ocular surface. Amniotic membrane has been the most used to date, but others such as contact lenses, fibrin gels, and thermosensible biopolymers have also been reported
Las células madre son aquellas células poco diferenciadas, capaces de dividirse de manera indefinida y con potencial de diferenciación hacia distintos tipos de células especializadas con funciones específicas en el cuerpo1–5. Las células madre pueden clasificarse según su potencial de diferenciación en: totipotenciales, pluripotenciales y células madre adultas o multipotenciales. Las totipotenciales derivan directamente de la fecundación y son capaces de generar tejido embrionario y extraembrionario. Las pluripotenciales son capaces de dar lugar a todas las células somáticas. Las células madre adultas se encuentran en todo tejido autorrenovable y son las responsables de la regeneración tisular3. Al igual que las células madre embrionarias, las células madre adultas poseen una gran capacidad de renovación, que se mantiene a lo largo de la vida, y son capaces de originar células especializadas; sin embargo, estas últimas únicamente procedentes de la misma capa embrionaria (ectodermo, mesodermo o endodermo) 2,4. Trabajos publicados recientemente han expresado la posibilidad de que existan células madre adultas pluripotenciales, sin embargo esto aún continúa en estudio5,6.
El proceso por el cual una célula madre adulta se divide y da lugar a células especializadas es de gran importancia para comprender su funcionamiento. En condiciones normales una célula madre permanece en estado de reposo, raramente sufre una división celular6,7. Cuando lo hacen dan lugar a 2 células hijas: una célula de amplificación transitoria (CAT) y otra que permanecerá como célula madre. Una CAT sufrirá varios ciclos de mitosis con el propósito de expandir la población celular. Eventualmente, las CAT se diferencian hacia células posmitóticas, las cuales ya no sufrirán mitosis y se encargarán únicamente de terminar el proceso de diferenciación hacia células terminalmente diferenciadas. Este método de replicación le permite a las células madre protegerse de errores que pudieran resultar de una división celular continua; es por ello que otorgan este papel a las CAT7. Por otro lado, se ha visto que en condiciones especiales, como daño o cultivo, las células madre pueden abandonar su estado de reposo y mostrar una alta capacidad de proliferación.
Las células madre límbicas: localización y características especialesComo ya se ha mencionado, las células madre se encuentran en todos los tejidos que comúnmente conocemos como autorrenovables en el cuerpo, es decir: tejido hematopoyético, gastrointestinal, epidermis, etc.4. Sin embargo, hoy se sabe que existen células madre en la mayor parte de los tejidos adultos, incluidos el tejido nervioso y muscular. El conocimiento de las células madre en general ha abierto en el mundo un gran arsenal de posibles aplicaciones clínicas y terapéuticas que se les podría dar a estas. Hoy en día se realizan en el mundo cientos de estudios de investigación y ensayos clínicos con diferentes células madre adultas, lo que nos lleva al tema central de esta investigación: las células madre límbicas8.
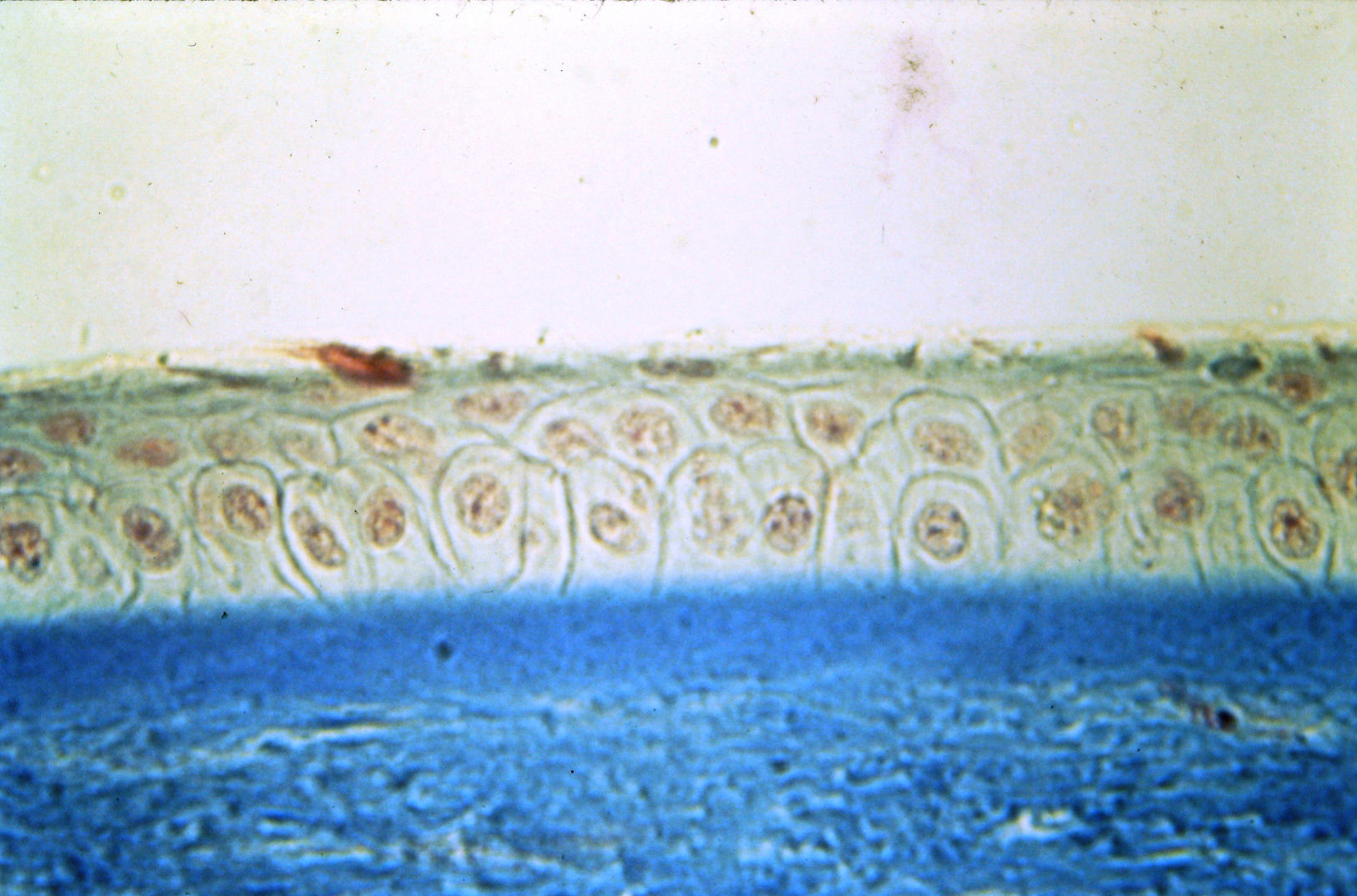
La córnea es una estructura transparente en la parte anterior del ojo, con un alto poder refractivo, que tiene la función de transmitir rayos de luz hacia la retina. Esta estructura consta de 5 capas: el epitelio, la capa de Bowman, el estroma, la membrana de Descemet y el endotelio9. Para fines de este estudio nos centraremos en el epitelio corneal. El tipo histológico de este epitelio es escamoso estratificado no queratinizado, formado por 4-6 capas de células (fig. 1).
En su periferia, el epitelio corneal se continúa con una zona de transición que tiene la función, entre otras, de separarlo de la conjuntiva. Esta zona se conoce como limbo. Histológicamente, el epitelio límbico consta de 10-12 capas de células. La conjuntiva, por otro lado, tiene un epitelio formado por 1-2 capas de células, y se caracteriza por tener células caliciformes. Juntos, el epitelio corneal, el límbico y la conjuntiva conforman el epitelio de superficie ocular8,9 (fig. 2).
En 1971, Davanger y Evensen observaron que en el proceso de reparación del epitelio corneal las células avanzaban desde el área límbica hacia el centro10. Hoy en día, numerosos experimentos y observaciones clínicas han conducido a la conclusión de que las células madre corneales se encuentran alojadas en el limbo. Así, se ha propuesto un esquema de proliferación celular epitelial centrípeto en la córnea: las células madre localizadas en la región basal límbica, células CAT en el epitelio corneal basal y las células terminalmente diferenciadas en el epitelio corneal suprabasal9,11.
Algunos estudios han mostrado que las células madre están más concentradas en las regiones superior e inferior del limbo, sitios en donde se encuentran crestas fibrovasculares orientadas radialmente entrelazadas con criptas de epitelio límbico, conocidas como empalizada de Vogt. Esta zona se encuentra desprovista de la capa de Bowman, lo cual permite un contacto más íntimo del epitelio con los fibroblastos del estroma y el tejido vascular. Esta organización morfológica permite crear un microambiente con componentes especiales en la matriz extracelular ideales para la modulación de las células madre, llamado nicho11.
Marcadores moleculares y métodos de identificaciónA pesar de la evidencia clínica y experimental sobre la localización de las células madre limbocorneales en la región límbica, aún no se ha logrado establecer marcadores directos para identificarlas. Sin embargo, se han utilizado varios métodos indirectos para intentar aislarlas12. Arpitha et al. han sugerido que fenotípicamente las células madre son indiferenciadas, y se caracterizan por ser pequeñas y tener un cociente núcleo/citoplasma elevado12. Se ha propuesto, además, que contienen altos niveles de la proteína celular nuclear p63, la cual es un factor de transcripción con 6 diferentes isoformas (TAp64 α, β, γ; y ΔNp63 α, β, γ)13–16. Se le han atribuido varias funciones a este factor de transcripción entre los que se encuentran iniciar la estratificación epitelial y mantener el potencial proliferativo; pero no es específico de las células madre limbocorneales, sino que se encuentra en diversos epitelios derivados de ectodermo con diferentes niveles de expresión de sus isoformas. Actualmente, la isoforma ΔNp63 α ha mostrado ser un marcador celular fiable para identificar células madre límbicas en reposo y activas13,14,16. El oncogén Bmi1 y el factor de transcripción C/EBPδ se han utilizado como marcadores, en conjunto con el ΔNp63 α, para identificar células madre en reposo9,12.
Otro grupo de marcadores moleculares que se han investigado son las proteínas de membrana celular transmembrana. A continuación se describen aspectos importantes de algunas de las proteínas incluidas dentro de este vasto grupo. ABCG2 es una proteína transportadora de membrana que se expresa en una subpoblación celular rica en células madre que se conoce como Side Population o células con fenotipo SP, presente en varios tejidos como hematopoyético, piel, músculo y córnea. La expresión de ABCG2 les da la capacidad de captar la tinción Hoechst33342 en una citometría de flujo. En la actualidad es uno de los marcadores más útiles en la identificación y aislamiento de células madre limbocorneales. Sin embargo, este marcador también se expresa en algunas CAT15. Otras proteínas que también se han estudiado como marcadores moleculares son: Notch-1, integrinas (β1, α6), K19, citoqueratinas 14 y 159,15.
También se han estudiado marcadores negativos. Estos, contrario a los otros marcadores que hemos discutido, van dirigidos a identificar células con cierto grado de diferenciación. Algunos ejemplos de estos marcadores son: las citoqueratinas 3, 12 (K3/K12) y las conexinas (Cx43)17. Estas citoqueratinas se expresan en el epitelio corneal completo, pero no en el epitelio basal del limbo. Asimismo, las células corneales presentan conexinas y proteínas de unión tipo gap, contrario a lo que ocurre en las células límbicas basales12,15.
Aplicaciones terapéuticas de las células madre limbocorneales en la actualidadDesde que se empezaron a estudiar, las células madre han llamado la atención de muchos especialistas en el ramo de la medicina, no siendo la excepción las células madre limbocorneales que han sido investigadas por su potencial para tratar padecimientos de la superficie ocular. Hoy en día, los esfuerzos se han enfocado en utilizarlas para el manejo de un grupo de padecimientos que tienen en común la deficiencia de células madre límbicas18. Las causas son variadas pero en general pueden dividirse en 2 grupos: aquellas cuya causa de la deficiencia es por aplasia y aquellas en las que es por hipofunción de las células madre. La aplasia de células madre puede ser de origen traumático, como daño químico o térmico directo a la superficie ocular o inducido por lentes de contacto; iatrogénicas, como cirugías límbicas múltiples; o autoinmunes, como ocurre en el síndrome de Stevens-Johnson, penfigoide ocular cicatricial y queratoconjuntivitis atópica. La hipofunción de células madre límbicas puede deberse a causas congénitas como la aniridia o la displasia ectodérmica; causas inflamatorias, como una limbitis crónica o queratitis ulcerativa corneal periférica; u otras causas diversas como el pterigión19,20.
El explicar los mecanismos por los cuales cada uno de estos padecimientos conduce a la deficiencia de superficie ocular queda fuera de los alcances de esta revisión. Sin embargo, las manifestaciones serán muy parecidas entre ellas. Al haber una deficiencia de células madre límbicas aparecerán defectos epiteliales corneales los cuales no podrán sanar normalmente. Estos producirán malestar crónico y dolor de la superficie ocular. A su vez, fallará la función de barrera del limbo, resultando en invasión del epitelio conjuntival, fenotípicamente diferente al corneal, y de sus vasos sanguíneos asociados a la superficie corneal. A esto se le denomina «conjuntivalización» o metaplasia del epitelio corneal, y conduce en última instancia a ceguera incapacitante. Esto se puede evidenciar con una tinción anómala y tardía con fluoresceína, debido a que el epitelio conjuntival permite su paso, a diferencia del corneal. Otros signos clínicos que ayudan en el diagnóstico son: reflejo corneal irregular, córnea de grosor variable y pérdida de la empalizada de Vogt18–20.
El tratamiento conservador disponible actualmente para los pacientes con deficiencia de células madre límbicas incluye: lubricantes oculares, lentes de contacto terapéuticos, y suero autógeno tópico. Durante la fase aguda, en pacientes con deficiencia de células madre límbicas, se ha utilizado la epitelectomía conjuntival secuencial para intentar reducir la reepitelización conjuntival. Sin embargo, ninguno de estos métodos ha logrado curar por completo esta enfermedad. Con los avances que ha habido sobre el conocimiento y entendimiento de las células madre límbicas en los últimos años, surge la idea de utilizarlas específicamente para dar tratamiento a los múltiples padecimientos ya mencionados. La idea principal consiste en la toma de muestra de una porción de epitelio límbico para su cultivo y posterior trasplante, ya sea autógeno o alogénico, a la córnea del paciente por medio de un sustrato que funcione como medio de transporte de las células madre cultivadas18–21. En las siguientes secciones se darán detalles sobre los medios de cultivo utilizados actualmente, así como de los métodos o sustratos utilizados para transportarlas a la superficie ocular.
Técnicas de cultivo de células madre limbocornealesPreviamente se ha comentado acerca del nicho de las células madre. El microambiente que les da la capacidad de conservar todas sus características está influido por las células vecinas, señales moleculares, matriz extracelular, entre otras interacciones celulares. Para poder cultivarlas y que quede intacta su capacidad de autorrenovación, ciclo celular lento y su estado pobremente diferenciado, es necesario reproducir lo más posible las características del nicho en donde se encuentran22,23. Debido a que el uso de células madre con fines terapéuticos aún continúa en estudio, muchos son los métodos que se han utilizado para cultivarlas; sin embargo, no hay estudios en los que se comparen y se demuestre cuál de estos es el más efectivo24.
Al igual que en cultivos de otros tejidos epiteliales, se ha utilizado una capa alimentadora de fibroblastos 3T325. Se usa mitomicina C para detener el crecimiento de estas células, y posteriormente son sembradas en cajas de cultivo con un medio hormonal epitelial suplementado. El cultivo de células epiteliales límbicas ha dado buenos resultados con este método, pero el inconveniente es que el medio utilizado incluye suero fetal bovino entre otros componentes de origen animal que podrían propiciar la transmisión de antígenos o virus si se utilizara con fines terapéuticos. Por lo tanto, la mayoría de los estudios han utilizado este método de cultivo únicamente para fines de investigación de las células madre. No obstante, se ha intentado utilizar diferentes medios de cultivo que no incluyan componentes de origen animal para darle un mayor uso a esta técnica26,27.
El uso de membrana amniótica como capa alimentadora de soporte, en lugar de o aunada a la capa de fibroblastos 3T3, ha sido el método de cultivo más estudiado para el uso de células madre límbicas con fines terapéuticos28. Se propuso el uso de membrana amniótica debido a que contiene algunas propiedades especiales: factores de crecimiento en su membrana basal como NGF, KGF, HGF, bFGF, integrinas β1 y 4, además de propiedades antiinflamatorias y antiapoptóticas. Muchas de estas propiedades están presentes en el epitelio y estroma límbico29,30.
El concepto principal de esta técnica es el siguiente: se coloca la muestra sobre la membrana amniótica y posteriormente este conjunto es sumergido en un medio de cultivo que estimula el crecimiento de las células epiteliales límbicas las cuales migran y cubren, en un lapso de 14-28 días, la superficie de membrana amniótica22,30. Manteniendo este concepto principal, se ha utilizado esta técnica con algunas variaciones con el objetivo de crear un microambiente lo más parecido al limbo corneal. Algunos estudios de investigación han utilizado la membrana amniótica intacta como capa de soporte, mientras otros utilizan una membrana amniótica pretratada, en la cual se remueven las células epiteliales de dicha membrana22. Se ha visto que con la membrana amniótica pretratada se obtiene una confluencia más rápida de las células cultivadas y una mayor diferenciación, mientras que en la intacta se consiguen más células que conservan el fenotipo de células madre28,30.
Ahora, el método por el cual las células son sembradas sobre la membrana amniótica también tiene algunas variaciones. Una forma de hacerlo es obtener una biopsia de tejido límbico (generalmente superior) de 2-3mm2 mediante queratectomía lamelar, la cual es colocada directamente sobre el medio de soporte, en este caso membrana amniótica. A esta técnica se le llama sistema de cultivo explante. La otra opción es utilizar lo que se conoce como sistema de cultivo en suspensión. En este se utilizan enzimas con el objetivo de digerir el colágeno de la membrana basal y separar acúmulos de células para obtener células individuales suspendidas. Algunas enzimas utilizadas son la dispasa y la tripsina. Una vez conseguida, esta suspensión es sembrada en alguna membrana de soporte. Aún no está claro cuál de estas técnicas es la mejor22,30,31.
Además de la membrana amniótica como membrana de soporte, también se han estudiado recientemente algunos biomateriales para su utilización con el mismo propósito. Algunos de los que han demostrado eficacia en el cultivo de células madre límbicas son: matrices extracelulares matrigel, colágeno, polímeros de gelificación termosensible (Mebiolgel) y material biodegradable sellante de fibrina. En los cultivos con estos materiales se encontró que las células cultivadas expresaban tanto marcadores de indiferenciación como ABCG2 y p63, como marcadores de diferenciación de tejido corneal32,33.
Otro medio de soporte utilizado para cultivo es la cápsula anterior del cristalino obtenida de cadáveres. Este método se ha estudiado utilizando suero humano como único suplemento de crecimiento y se ha visto crecimiento viable en 2 semanas desde el cultivo. A pesar de ello, aún está por verse la eficacia clínica que se le pueda dar a esta técnica34,35.
Muchos han sido los intentos por reproducir exactamente las condiciones del microambiente en el nicho de las células madre límbicas. Algunos de los medios de cultivo que se han usado para fines terapéuticos son: medio de Eagle Modificado por Dulbecco, Ham F12, MCDB151, medio EpiLife, Progenitor Cell Targeted, entre otros22. Cada uno de estos medios tiene componentes y propiedades diferentes. Se han utilizado también diversos suplementos de crecimiento agregados a los medios de cultivo, que incluyen factores de crecimiento (como el TGFα, KGF, PDGF-BB, HGF, SCF, IGF-1, FGF-2), suero humano autógeno o alogénico, corticosteroides, insulina, calcio, toxina de cólera, etc.; todo esto en diferentes concentraciones. Sin embargo, por falta del conocimiento exacto de las condiciones del nicho y al no haber estudios que comparen todos los métodos de cultivo entre sí, aún no se ha llegado a la conclusión de cuál es el método más adecuado para cultivar las células madre limbocorneales24–35.
Sustratos y métodos de transporte de células madre límbicas a la superficie ocularEn 1989, Kenyon y Tseng propusieron inicialmente el uso de autoinjerto de tejido límbico y conjuntival tomado de un ojo sano en un paciente con deficiencia unilateral de células madre limbocorneales. Se trasplantaron 2 injertos de 5-7mm en el ojo enfermo. Complicaciones reportadas con este procedimiento incluyeron: opacidad corneal en el ojo donador, seudopterigión, microperforación durante la cirugía, epitelio anormal y depresión corneal36. A partir de entonces ha ido evolucionando este procedimiento para intentar disminuir al máximo los efectos secundarios y complicaciones presentadas inicialmente, utilizando para ello el trasplante de células madre previamente cultivadas. De esta manera se compensaría el inconveniente de tomar una muestra de tejido tan grande, reduciéndose a tan solo 1-2 mm2 de biopsia ya sea autógena, de donante vivo o cadáver37,38. Para que un trasplante de células madre limbocorneales sea exitoso es necesario contar con un «portador» o sustrato que sostenga las células que serán trasplantadas. A su vez, es necesario remover quirúrgicamente el tejido fibrovascular que se encuentre invadiendo la superficie corneal; y en caso de que el estroma también se encuentre invadido se deberá extirpar un segmento lamelar o de espesor total. De esta forma se expondrá el estroma corneal sano para que las células que sean trasplantadas entren en contacto directo con el mismo38,39. Se han utilizado diferentes materiales y estructuras como portadores, algunos de ellos se describen a continuación.
Con diferencia, el sustrato más estudiado para transporte de células madre cultivadas a la superficie ocular es la membrana amniótica humana, siendo Tsai et al. los pioneros en reportar su utilización en el año 200040. Gracias a todas las propiedades de la membrana amniótica como factores de crecimiento, colágeno y propiedades antiinflamatorias, el uso de esta ha hecho posible que la epitelización de la córnea sea más rápida41,42. Tsai et al. documentaron reepitelización completa en un lapso de 2-4 días en el 100% de los pacientes estudiados. Además, estas mismas propiedades hacen que se reduzca la inflamación, vascularización y cicatrización corneal42. El utilizar la membrana amniótica como portador tiene también la ventaja de que sobre ella misma se cultivan las células madre. Por lo tanto, una vez cultivadas, sobre la membrana amniótica se forma una hoja epitelial de células corneales que entrarán en contacto directo con el estroma corneal, sin necesidad de retirarlas de la membrana de soporte de cultivo. La proporción de células madre que se encuentra en esta hoja epitelial a la hora de trasplantarla a la superficie ocular se desconoce, ya que no se estudian marcadores moleculares antes del trasplante43–45.
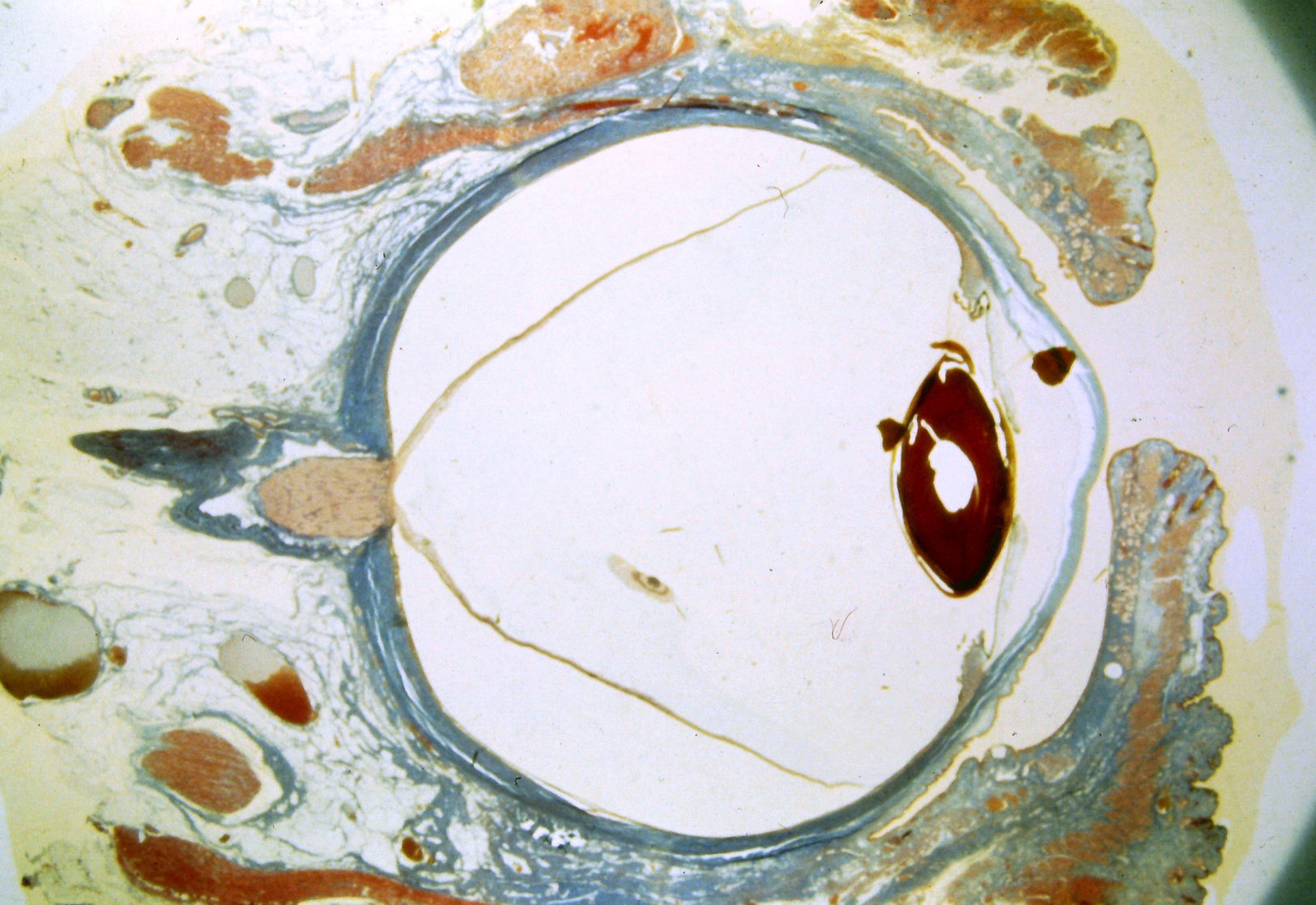
Si bien la membrana amniótica como sustrato de transporte de células madre límbicas a la superficie ocular ha dado buenos resultados, algunos factores, como lo complejo del procedimiento y la falta de transparencia de la membrana amniótica, han contribuido a que se busquen otras alternativas. Algunos de los materiales que se han estudiado como portadores de células madre son: lentes de contacto, escudos de colágeno, biopolímeros termosensibles, geles de fibrina y cápsula anterior del cristalino46,47 (fig. 3).
Para el uso de lentes de contacto, ha sido posible cultivar las células madre y posteriormente expandir la población de progenitoras sobre el lente de contacto exponiéndolo a suero autógeno. Posteriormente este es transferido a la superficie ocular del paciente sin necesidad de suturas48. De una forma semejante, se han expandido las poblaciones celulares derivadas de explante límbico sobre membranas de biopolímeros a base de chitosan y gelatina, en una proporción CH-G 20:80, utilizando medios de cultivo libres de componentes de origen animal49. Un estudio realizado en 2007 por Di Girolamo et al. demostró que es posible hacer proliferar células de tejido límbico sobre lentes de contacto a base de lotrafilcon A, cultivándolas utilizando suero autógeno50.
Conclusión y consideraciones finalesLa investigación sobre células madre limbocorneales ha tenido grandes avances en los últimos años. Sin embargo, la búsqueda para encontrar marcadores moleculares específicos y los nichos de las células madre, así como las mejores técnicas para cultivarlas, aún continúa. Con esta revisión damos cabida al inicio de nuevos protocolos de investigación con la intención de continuar perfeccionando el uso de células madre limbocorneales con fines terapéuticos. Asimismo se abre posibilidad para su aplicación en otros padecimientos tanto oftalmológicos como no oftalmológicos.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.