Introducción: El glaucoma neovascular (GNV) es un glaucoma agresivo de difícil manejo. Los procesos ciclodestructivos son una opción de tratamiento y la ciclodiodo-ablación, ha sido propuesta como un método seguro y efectivo. El objetivo del presente estudio, es evaluar la efectividad y seguridad de la ciclodiodo-ablación, en el GNV diabético.
Métodos: Se realizó un estudio ambispectivo de 38 ojos (n=19 grupo control GC, n=19 grupo terapéutico GT). Se definió éxito como una presión intraocular (PIO) < 22 mmHg, o una reducción del 30% de la PIO basal. Se describió la PIO, número de medicamentos antiglaucoma, agudeza visual y presencia/ausencia de dolor, al inicio y final del seguimiento.
Resultados: Los grupos fueron similares en edad, sexo y PIO inicial. El tiempo de seguimiento fue 11 meses (GT) y siete meses (GC). Se aplicó ciclodiodo-ablación en 19 ojos del GT (100J/sesión). La PIO disminuyó de 38.7 mmHg a 13 mmHg, en el GT (p<0.001) vs 42.6 mmHg a 47.3 mmHg en el GC (p=0.23). Se obtuvo éxito en 73.6% del GT. Se presentaron cinco casos (26%) de hipotonía (< 5 mmHg) en GT.
Conclusiones: La ciclodiodo-ablación es efectiva en la disminución de la PIO, en el GNV diabético. Es recomendable aplicar un tratamiento conservador (40-80J/sesión), para disminuir el riesgo de hipotonía ocular.
Introduction: Neovascular glaucoma (NVG) is an aggressive glaucoma subtype of difficult management. Cyclodestructive procedures are a viable treatment option and diode láser ablation has been reported to be effective and safe. The purpose of this study was to evaluate the effectiveness and safety profile of diode láser cyclophotocoagulation in diabetic NVG.
Methods: Ambispective case-control study of 38 eyes (19 control group CG, 19 study group TG). Success was defined as intraocular pressure (IOP) < 22 mmHg or a 30% reduction from baseline. Intraocular pressure, number of antiglaucoma drugs, visual acuity and pain were documented.
Results: Both groups were similar in age, sex and initial IOP. Follow-up time was 11 months (TG) and seven months (CG). Cyclophotocoagulation was carried out in 19 eyes of TG (100J/session). IOP decreased from 38.7 mmHg to 13 mmHg in TG (p<0.001) vs 42.6 mmHg to 47.3 mmHg in the CG (p=0.23). Success was achieved in 73.6% of the TG. Only 5 cases (26%) developed hypotony (< 5 mmHg) pos treatment.
Conclusion: Diode láser cyclophotocoagulation is an effective IOP lowering procedure in diabetic NVG. Láser treatment energy per session should be lowered to 40-80J in order to reduce the risk of ocular hypotony.
¿Introducción
El glaucoma neovascular (GNV) es una forma severa, de glaucoma secundario de ángulo cerrado. El GNV es el resultado de la proliferación de tejido fibro-vascular en el ángulo de la cámara anterior (CA) que ocasiona obstrucción de la malla trabecular y produce sinequias anteriores periféricas del iris, que ocasionan cierre angular progresivo.1 En un gran porcentaje de los casos, el aumento en la presión intraocular (PIO) es refractaria al tratamiento médico convencional, y no es raro que ésta lleve a pérdida visual significativa.2
La neovascularización del iris o rubeosis iridis, fue descrita inicialmente por Coats en 1906. Desde su descripción original, se ha asociado a múltiples patologías, el 97% de ellas relacionadas con isquemia retiniana1 y el 3% restante, a inflamación intraocular. Las entidades isquémicas responsables de la mayoría de los casos de GNV, son la retinopatía diabética, la obstrucción de la vena central de la retina (OVCR) y el síndrome ocular isquémico.2,3
La isquemia intraocular que caracteriza estas patologías, desencadena la liberación de factores que inhiben y promueven el crecimiento de neovasos. La neovascularización surge cuando predominan los factores promotores.4 Para que esto suceda, es importante la presencia de tejido retiniano viable, una tensión de oxígeno disminuida y un drenaje venoso adecuado.5 El factor de crecimiento del endotelio vascular (Vascular Endothelial Growth Factor, VEGF), es el componente más estudiado y descrito de la vía de angiogénesis ocular.6-8 Se han detectado niveles elevados de este factor en pacientes con rubeosis iridis y GNV,9 así como en pacientes con retinopatía diabética proliferativa (RDP) y GNV.10 En condiciones de isquemia ocular, la fuente primaria de VEGF son las células de Müller. Una vez liberado, el VEGF debe viajar a la CA para ocasionar la neovascularización del iris. Por esa razón, la ruptura de la cápsula posterior en cirugía de extracción de catarata, se asocia a una mayor incidencia de rubeosis.11,12 Otras sustancias que podrían estar involucradas en la angiogénesis ocular, son los factores de crecimiento similares a la insulina I y II (insulin-like growth factors, ILGF), las proteínas de unión de factores de ILGF 2 y 3, el factor de crecimiento de fibroblastos, el factor de crecimiento derivado de las plaquetas y la IL-6.13,14
En la actualidad, los procedimientos ciclodestructivos tienen un papel importante en el manejo del glaucoma refractario, al tratamiento convencional.15-24 En los últimos años, la terapia trans-escleral con láser de diodo, ha ganado popularidad sobre las alternativas quirúrgicas (trabeculectomía con antimetabolitos y válvulas de derivación), debido a su efectividad, su perfil de seguridad y el costo-beneficio, que implica para el paciente. Asimismo, la ciclo-ablación con diodo ha demostrado mayor seguridad que los otros procedimientos ciclo-destructivos disponibles, tales como la crioterapia y el láser de neodiniumitrio (Nd:YAG). Estos últimos, han sido asociados a un riesgo aumentado de hipotonía ocular y ptisis bulbi postratamiento.25-28
En 1972, Beckman y Waeltermann realizaron el primer procedimiento ciclo-ablativo transescleral con el láser ruby,29 obteniendo una tasa de éxito del 62%. Desde entonces, se han utilizado el Nd:YAG y el láser de diodo, en la ciclo-destrucción trans-escleral. En 1994, Oguri y colaboradores compararon la efectividad de estas dos modalidades, encontrando que el láser de diodo era más efectivo que el Nd:YAG de onda continua, y equivalente al Nd:YAG de modo libre.30 Estudios más recientes han reportado tasas de éxito, definiendo como PIO < 22 mmHg o disminución del 20% a 30% de la PIO base, que van del 60% al 90%, en un tiempo de seguimiento promedio de 10 a 30 meses, en las diferentes técnicas de ciclo-ablación (crioterapia, ND-YAG y láser diodo).25-28
Las complicaciones más frecuentes de la cicloablación con láser, tanto Nd:YAG como diodo, son la hipotonía ocular y la ptisis bulbi. La hipotonía ocular, definida como PIO < 5 mmHg, se ha reportado en 3% a 18% de los pacientes tratados con ciclodiodo-ablación.20,21,24,31 Por otro lado, la ptisis ocular (atrofia del tejido ocular), se ha encontrado en hasta 3% de los ojos postratamiento.22,28,32-35 En el estudio de Oguri,30 se reportó una tasa de ptisis del 10%, en los ojos tratados con Nd:YAG y del 0%, en aquellos tratados con diodo, sugiriendo un mejor perfil de seguridad con la segunda modalidad de láser.
A pesar de que los procedimientos ciclo-destructivos, han tenido resultados alentadores en el control de la PIO de casos refractarios, su efectividad a largo plazo aún no ha sido reportada. Eid y colaboradores realizaron un estudio comparativo, entre la cirugía de derivación y la ciclo-ablación con Nd:YAG, encontrando una tasa de falla similar inicial entre ambos grupos. Sin embargo, a tres años de seguimiento, el 71.2% del grupo de láser, presentó falla frente al 43.3% del grupo de derivación.36
El objetivo del presente estudio, es evaluar la efectividad y el perfil de seguridad de la ciclodiodo-ablación, en el manejo del GNV diabético, en la población mexicana del noreste del país.
¿ Materiales y métodos
Se realizó un estudio ambispectivo, constituido por pacientes con diagnóstico de GNV diabético, atendidos por el servicio de retina del Instituto de Oftalmología y Ciencias Visuales, de la Escuela de Biotecnología y Salud del Tecnológico de Monterrey, en el periodo de septiembre 2009 a junio 2011.
Se asignaron los pacientes al grupo terapéutico (GT) y grupo control (GC), dependiendo de las características de presentación, si el médico tratante indicó el procedimiento y si el paciente aceptó o rehusó dicho tratamiento. Los pacientes fueron asignados al GT, si se les aplicó ciclodiodoablación y además, tenían una PIO > 21 mmHg, a pesar de estar bajo tratamiento hipotensor con terapia máxima (definida como el uso de las cuatro familias de medicamentos antiglaucomatosos tópicos).
Los criterios de inclusión para el GT fueron: pacientes de edad ≥ 18 años de edad, diagnóstico de GNV secundario a retinopatía diabética proliferativa, GNV refractario (PIO > 21 mmHg) al tratamiento convencional (panfotocoagulación más terapia médica máxima), pacientes con antecedente de tratamiento de ciclodiodo-ablación en nuestra institución. Los criterios de exclusión para el GT fueron: pacientes con GNV secundario a otra patología (OVCR, patología inflamatoria, síndrome de isquemia ocular), pacientes con PIO < 21 mmHg.
Los criterios de inclusión para el GC fueron: pacientes de edad ≥ 18 años de edad, diagnóstico de GNV secundario a retinopatía diabética proliferativa, GNV refractario al tratamiento convencional (panfotocoagulación más terapia médica máxima); pacientes que no recibieron ciclodiodoablación, ya sea por el pobre pronóstico visual o por haberse negado a recibir el tratamiento. Los criterios de exclusión del GC fueron: pacientes con GNV secundario a otra patología (OVCR, patología inflamatoria, síndrome de isquemia ocular), pacientes con PIO < 21 mmHg.
Se analizaron los datos demográficos de los pacientes, incluyendo edad, género y raza. Se registraron los medicamentos antiglaucoma utilizados, PIO con tonometría de Goldmann y agudeza visual pre y postratamiento (categorizada de 0 a 5, 0 no percepción de luz, 1 percepción de luz, 2 movimiento de manos, 3 cuenta dedos, 4 agudeza visual > 20/400). También se revisó el grado de inflamación y complicaciones posteriores a la aplicación del láser, incluyendo hipotonía ocular (≤ 5 mmHg) y ptisis bulbi. Por último, se valoró la presencia de dolor postratamiento. Se definió "control de PIO" como presión < 22 mmHg o una disminución del 30% de la PIO inicial, al final del seguimiento.
El tratamiento se llevó a cabo bajo anestesia tópica (tetracaína 0.5%) y local (inyección retrobulbar con 3 mL de xylocaína simple al 2%). Se aplicó la ciclo-ablación utilizando el láser de diodo (810 nm) semiconductor de onda continua, y la sonda-G de Iridex (OcuLight Slx®, IRIS Medical Instruments, Mountain View, CA). La base de la sonda se colocó a 5 mm del limbo esclero-corneal, ejerciendo presión moderada. En todos los casos, se aplicó un tratamiento de 20 disparos de láser en 360°. La duración del pulso se mantuvo fija en 2.5 segundos, empleando un poder de 2 000 mW a lo largo del tratamiento, sin importar que hubiera o no un "trueno" audible. Se esperó escuchar un trueno en 30% de los disparos. En caso de escuchar dos truenos audibles seguidos, se redujo el poder a 1 800 mW. Se calculó la energía total utilizada, multiplicando el número de disparos por la duración de cada disparo(s), por el poder (watts).
Al finalizar el tratamiento, se aplicó ungüento de antibiótico/esteroide y se dejó un parche oclusivo, hasta el día siguiente. El primer día postratamiento, se indicó un antibiótico/esteroide en solución oftálmica cinco veces al día por una semana, y se reiniciaron los medicamentos antiglaucomatosos. El seguimiento posoperatorio se llevó a cabo a la semana y a las cuatro semanas. Las visitas subsecuentes fueron determinadas de acuerdo a la evolución y el cuadro clínico de cada uno de los casos. En cada visita se registró: Agudeza Visual Mejor Corregida (AVMC), medicamentos antiglaucomatosos en uso, PIO, grado de inflamación, complicaciones asociadas al tratamiento y presencia o ausencia de dolor ocular. Los medicamentos antiglaucomatosos fueron retirados de manera paulatina e individualizada, de acuerdo al grado de disminución de la PIO. Se consideró la repetición del tratamiento, si no se obtuvo una reducción adecuada de la PIO, en un mínimo de cuatro semanas de seguimiento.
El resultado fue evaluado con los siguientes parámetros: tasa de éxito, tasa de hipotonía y tasa de retratamiento. El análisis estadístico se llevó a cabo empleando el SPSS (Statistical Package for the Social Sciences) para Windows. Los resultados se expresaron como medias con desviaciones estándar (DE) o medianas, con sus respectivos rangos. Las medias entre los grupos fueron comparadas mediante la prueba "t de student". Los datos categóricos fueron evaluados, mediante la prueba exacta de Fisher o la ji cuadrada en tablas de contingencia. La significancia estadística se definió cuando el valor de p era menor a 0.05 y todos los valores fueron de dos colas. También se midieron diferencias de riesgo, con sus respectivos intervalos de confianza (IC) 95%.
¿ Resultados
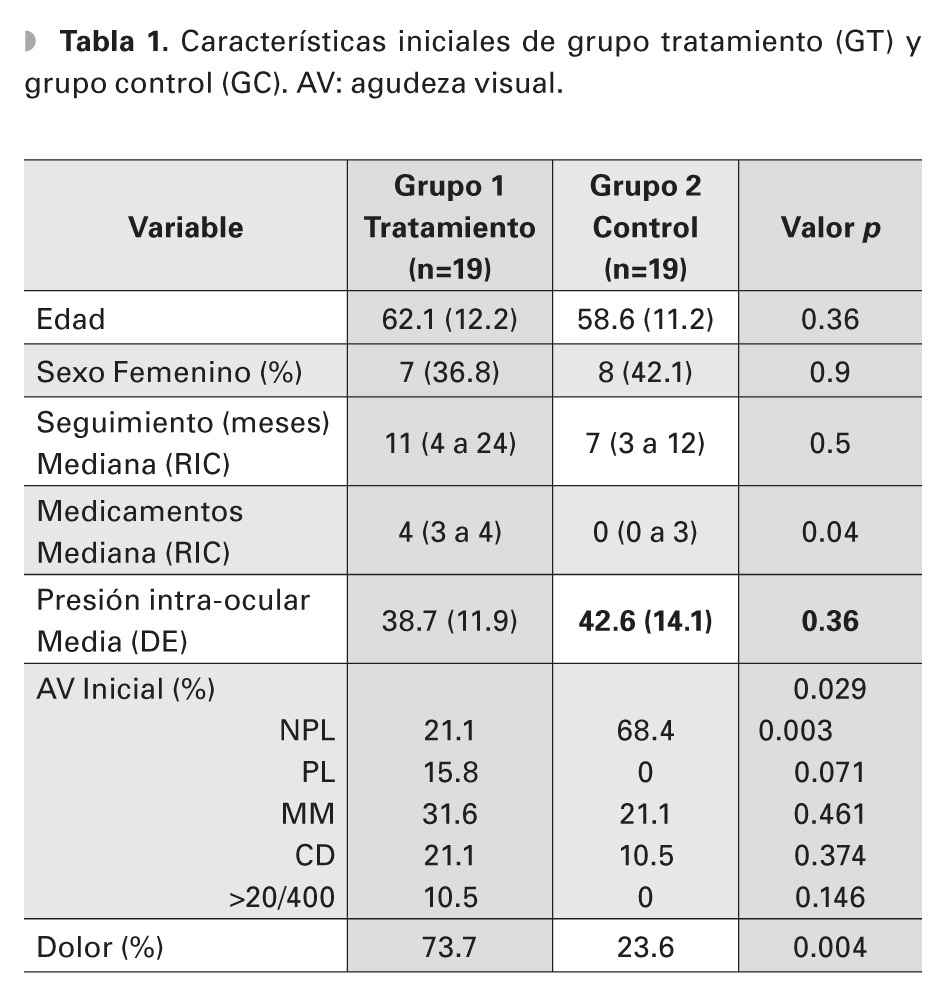
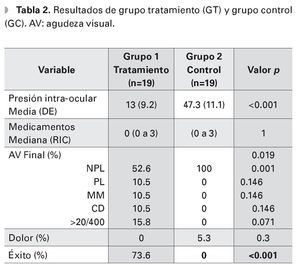
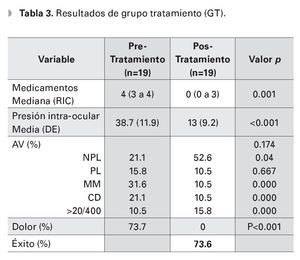
Un total de 38 ojos de 38 pacientes fueron evaluados, 19 ojos en el grupo experimental y 19 ojos en el grupo de observación, de los cuales 23 (60.5%) eran hombres y 15 mujeres (38.5%). Ambos grupos fueron similares en edad, distribución por sexos, tiempo de seguimiento y PIO inicial (p=0.36, p=0.9, p=0.5, p=0.36, respectivamente) (Tabla 1). La edad media de los grupos fue de 62.1 y 58.6 años, GT y GC, respectivamente. El tiempo de seguimiento promedio fue de 11 meses en el grupo de ciclodiodo-ablación y de siete meses en el GC. La PIO inicial media fue de 38.7 mmHg y 42.6 mmHg, respectivamente. El número de medicamentos hipotensores que los pacientes estaban utilizando al inicio del seguimiento, fue de una mediana de cuatro medicamentos (RIC tres a cuatro) en el grupo del láser y de cero (cero a tres) en el GC, (p=0.04). Al final del seguimiento, el número de medicamentos hipotensores fue similar en ambos grupos (p=1).
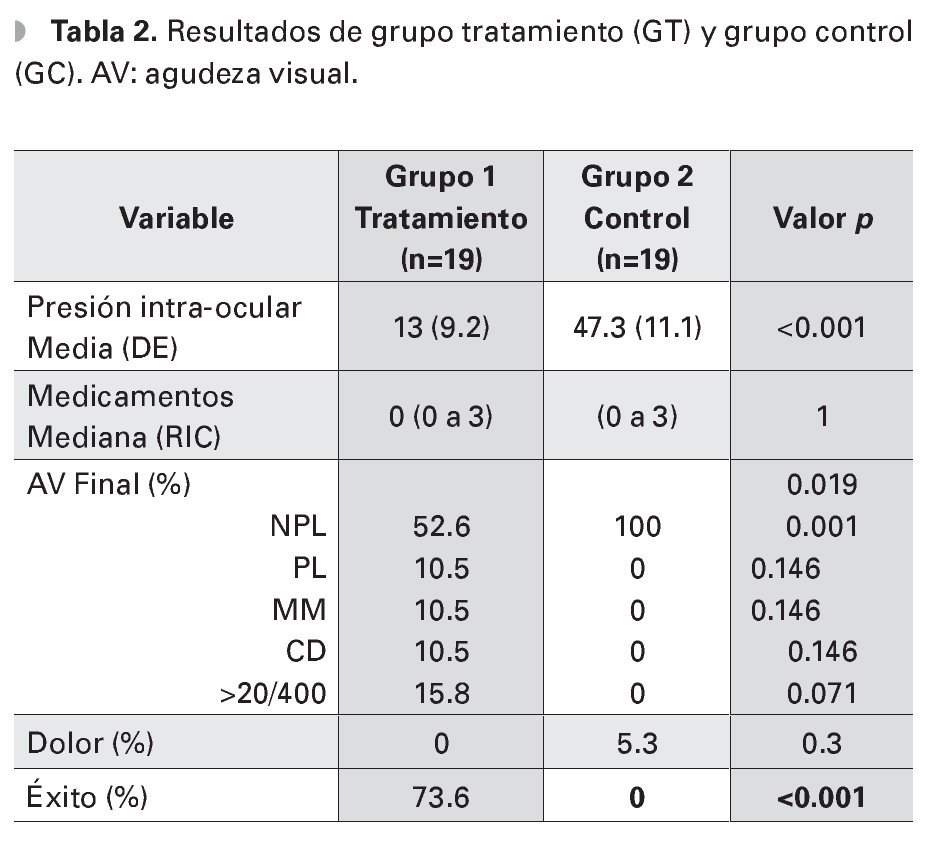
La agudeza visual inicial fue diferente entre ambos grupos, (p=0.29). Sin embargo, al analizar la agudeza visual inicial por grupo categórico (0=NPL, 1=PL, 2=MM, 3=CD y 4=>20/400), la diferencia sólo fue significativa en el grupo de no percepción de luz (p=0.003). El resto de los grupos no mostraron diferencias estadísticamente significativas (p=0.071, p=0.46, p=0.37, p=0.14) (Tabla 2). La cantidad de ojos con NPL al inicio del seguimiento fue de tres (16% de 19 ojos) en el GT y 14 (74% de 19 ojos) en el GC. La agudeza visual final también fue diferente entre ambos grupos (p=0.019), todos los pacientes en el GC terminaron con NPL. Al inicio del seguimiento, 14 pacientes del GT referían dolor moderado a severo, sólo un paciente del GC (p=0.004). Al final del seguimiento, no hubo diferencia en la presencia de dolor entre ambos grupos (p=0.3).
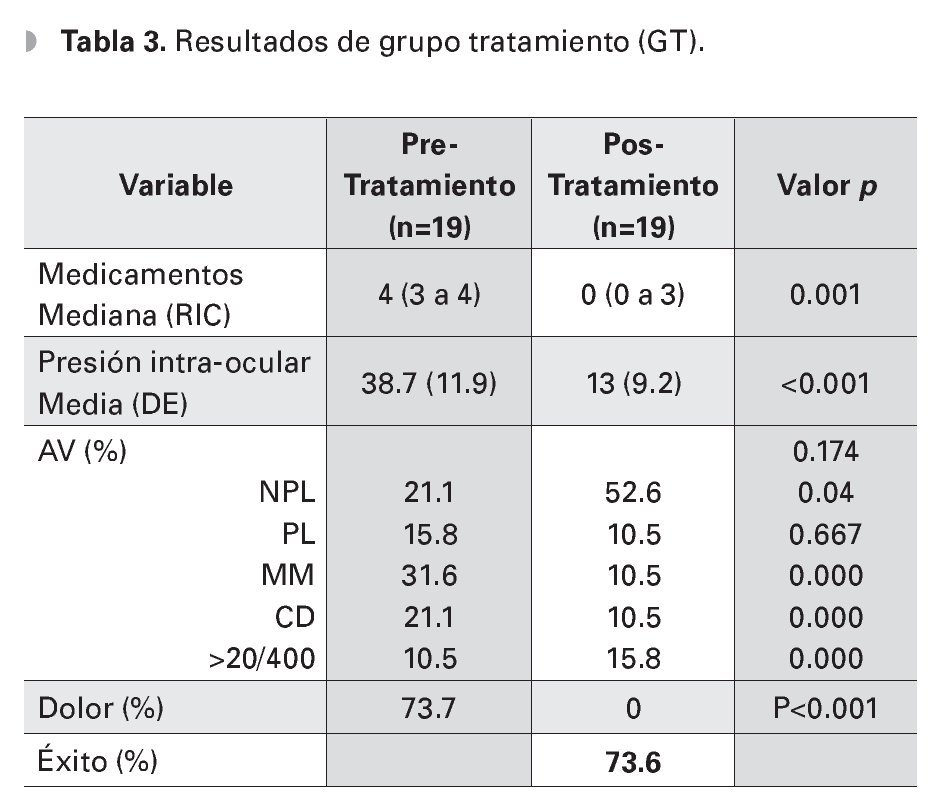
La PIO media final fue de 13 mmHg (DE 9.3) en el grupo de ciclodiodo-ablación y de 47.3 mmHg (DE 11.1) en el GC, (p<0.01). El 73.6% de los ojos del GT, logró obtener un control adecuado de la PIO, ningún paciente del GC logró control de la PIO, (p<0.001). Analizando el grupo con ciclodiodoablación, la PIO media disminuyó de 38.7 mmHg (DE 11.9) pretratamiento a 13 mmHg (DE 9.2), al final del seguimiento, (p<0.001). El número de medicamentos utilizados disminuyó de una mediana de cuatro gotas (RIC tres a cuatro) preoperatorio, a cero gotas (RIC cero a cuatro gotas) posoperatorio, teniendo una diferencia estadísticamente significativa (p< 0.01) (Tabla 3).
En el grupo de tratamiento, el total de energía aplicada por sesión fue 100 000 mW (100J) y el número de sesiones promedio fue de 1.2 sesiones (DE 0.4). Se usó un máximo de dos aplicaciones de ciclodiodo-ablación, con sólo 21% de ojos requiriendo más de una aplicación del láser. La tasa de retratamiento fue de uno de cada 4.75 ojos y el tiempo promedio entre aplicaciones, fue de cuatro meses (rango uno a nueve meses). Un total de 57.9% de ojos, obtuvo una disminución exitosa de la PIO después del primer tratamiento, y esta tasa aumentó a 73.6% después de la segunda aplicación. En todos los casos, la tasa de éxito se definió por el parámetro de PIO final < 22mmHg. De los ojos restantes, dos terminaron con una PIO de 0 mmHg y tres (15.8%), permanecieron con una PIO mayor a 21 mmHg (PIO promedio 27 mmHg).
En el grupo de la ciclodiodo-ablación, la agudeza visual se mantuvo igual en el 53% de los pacientes postratamiento y disminuyó en nueve pacientes, un promedio de 1.6 líneas (rango uno a tres líneas), ninguno de ellos con agudeza visual mejor de cuenta dedos. De estos pacientes, tres tenían una visión de cuenta dedos al inicio del tratamiento, tres se encontraba en movimiento de manos y uno en percepción de luz.
Se observó la presencia de uveítis leve postratamiento, en una gran parte de los ojos tratados con láser de diodo, ésta se catalogó como reacción posoperatoria y no como complicación. La única complicación que se encontró en el estudio, fue la presencia de hipotonía postratamiento. Ésta se presentó en 26.3% de nuestros pacientes (cinco ojos), de los cuales dos tenían una PIO de 0 mmHg, considerándolos en un estado pre ptisis bulbi. Todos los ojos que presentaron hipotonía, tenían una agudeza visual pretratamiento de percepción de luz o peor. La hipotonía se registró en un promedio de 14.6 meses, a partir de la última aplicación del láser (DE 14.7, rango tres a 40 meses) y en dos de estos ojos, se presentó después de la segunda aplicación de ciclodiodo-ablación. No se observaron casos de oftalmía simpática o endoftalmitis.
¿ Discusión
El manejo del GNV consta de dos aspectos claves. En primer lugar, se encuentra el tratamiento de la patología de base y en segundo lugar, la disminución de la PIO. El manejo se enfoca en el tratamiento de la retina isquémica, la panfotocoagulación retiniana continúa siendo el tratamiento de elección,37-40 presentando regresión de la rubeosis en 68% de los pacientes y normalización de la PIO, en 42% de los casos.41 A pesar de que la panfotocoagulación, se considera el tratamiento más efectivo para la isquemia retiniana, su aplicación puede estar limitada en pacientes con opacidades en los medios oculares, incluyendo edema corneal, catarata, hifema o hemovítreo y pobre dilatación pupilar. Por lo tanto, cuando no se logra aplicar una panfotocoagulación adecuada (1 200 a 1 600 disparos) y/o el tratamiento hipotensor es insuficiente, es importante considerar alternativas para el control de la PIO.
La destrucción parcial y controlada del cuerpo ciliar disminuye la producción del humor acuoso, y disminuye de forma secundaria la PIO. La fotocoagulación, la crioterapia, la destrucción por ultrasonido y la excisión quirúrgica de parte del cuerpo ciliar, han sido utilizadas con el fin de lograr esta meta. Es en este conjunto de técnicas terapéuticas, la ciclo-ablación trans-escleral con láser de diodo, se ha convertido en el procedimiento ciclo-destructivo de elección.
En el presente estudio, 19 ojos de 19 pacientes con GNV refractario a tratamiento convencional, fueron tratados por medio de ciclo-ablación con láser diodo. Los 19 ojos restantes fueron asignados a un GC, para comparar la efectividad del tratamiento con el láser diodo. Ambos grupos fueron similares en las variables de sexo, edad, tiempo de seguimiento y PIO inicial, sin embargo, fueron diferentes en la agudeza visual inicial. Esta diferencia se debe, a que un mayor porcentaje de los ojos en el GC tenían una visión de no percepción de luz (68.4% vs 21.2%, p<0.003), razón por la cual el médico tratante no indicó la ciclodiodo-ablación, para obtener una reducción de la PIO.
Confirmando los hallazgos de reportes previos, el tratamiento con láser diodo fue altamente efectivo en la disminución de la PIO de nuestros pacientes. La PIO media presentó una reducción de 38.8 mmHg antes del tratamiento, a un valor medio de 13 mmHg al final del seguimiento, (p<0.001). Asimismo esta reducción en la PIO fue altamente significativa, en comparación al GC que terminó con una media de 47 mmHg al final del seguimiento, (p<0.001). Se obtuvo una tasa de éxito final en el GT del 73.7%, similar al 60% a 90% previamente reportado en la literatura.25,28 De los cuatro ojos que recibieron una segunda aplicación de láser, tres lograron control de la PIO y sólo uno, persistió con una PIO > 22 mmHg. El hecho que la tasa de respuesta permaneciera superior al 50% en la segunda aplicación de láser, implica que es adecuado repetir el procedimiento, si no se obtiene la respuesta esperada después de la primera aplicación. Por otro lado, se ha reportado que la tasa de éxito disminuye considerablemente, inclusive 20% a 25%, después de múltiples aplicaciones (> 4).42
Es importante mencionar, que el control de la PIO obtenido por medio de la ciclodiodo-ablación, permitió la reducción en el número de medicamentos antiglaucomatosos utilizados por nuestros pacientes. Se encontró una reducción de cuatro (RIC tres a cuatro) medicamentos antiglaucomatosos a cero (RIC cero a tres) medicamentos posablación, (p<0.01). Asimismo, previo al tratamiento, el 26% de los pacientes tenían indicado el uso de acetazolamida oral (dosis promedio = 575 mg/día), para el control de la PIO. Ésta pudo ser suspendida por completo, posterior a la ciclodiodo-ablación en todos los casos, eliminando de esta manera el riesgo de efectos secundarios relacionados a los inhibidores de la anhidrasa carbónica, por vía sistémica. Por último, una indicación importante de la ciclodiodo-ablación en nuestra serie de casos, fue el control del dolor ocular. El 74% de los pacientes con dolor ocular pretratamiento, refirió la desaparición del mismo al final del seguimiento.
A pesar de la efectividad y la alta tasa de éxito obtenido, es importante recordar que el 15.8% de los pacientes no logró un control adecuado de la PIO, y el 26% presentó hipotonía ocular. Aunque, el número de casos en el presente estudio no permitió un análisis de factores predictivos de falla en el tratamiento, reportes previos la han asociado al sexo masculino (p=0.008), a una tasa baja de energía por sesión (p=0.016),42 y al diagnóstico de GNV.43
Las complicaciones más comunes y serias de la ciclo-ablación con láser diodo, fueron la hipotonía ocular y la ptisis bulbi. En el presente estudio, cinco ojos (26.3%) presentaron hipotonía y dos de estos ojos, tuvieron una PIO final de 0 mmHg. La PIO media inicial de estos casos fue de 52 mmHg, la PIO final de 1.4 mmHg y ninguno de ellos tenía una visión mejor, a percepción de luz, previo al tratamiento. La tasa de hipotonía en estudios previos es muy variable y va del 0 al 18%.20,21,24,31 El subtipo de glaucoma, así como la cantidad de energía utilizada se han mencionado como factores responsables de esta variación. El GNV se ha asociado a un riesgo aumentado de hipotonía ocular posciclo-ablación.44 Iliev y colaboradores encontraron en su serie de 263 ojos, que los grupos con mayor incidencia de hipotonía ocular eran el glaucoma uveítico (18.8%), el GNV (15.6%) y el glaucoma poscirugía vítreo-retiniana (14.4%). Ninguno de los pacientes con glaucoma primario de ángulo abierto, presentó esta complicación.24 Asimismo, encontraron que la PIO preoperatoria elevada y la cantidad de energía utilizada por sesión, eran las únicas variables significativamente asociadas a un aumento, en el riesgo de desarrollar hipotonía. Plantearon que la PIO preoperatoria alta puede ocasionar isquemia del cuerpo ciliar, que a su vez trae como consecuencia el cese de la producción de humor acuoso, posterior a la aplicación del láser. Sugirieron que la aplicación de un máximo de 60-80 mJ de energía por sesión, podría ser un abordaje más seguro, en relación al desarrollo de hipotonía y ptisis. Murphy y colaboradores reportaron una tasa de hipotonía del 9.5% en 263 ojos, asimismo encontraron que 76% de los pacientes con hipotonía, tenían GNV. Al igual que los hallazgos de Iliev, Murphy reportó que la PIO inicial y el total de energía utilizado en el tratamiento, fueron los únicos factores asociados a un riesgo aumentado de hipotonía ocular.42 Los autores sugirieron disminuir la energía aplicada por sesión a 60-70 J en pacientes con PIO elevada pretratamiento, particularmente con diagnóstico de GNV o glaucoma uveítico. Por lo tanto, consideramos que los factores asociados a la alta incidencia de hipotonía (26.3%) en nuestro estudio, fueron la inclusión de casos con GNV y el número limitado de ojos estudiados. Cabe mencionar, que la hipotonía se presentó en un promedio de 14 meses posablación. No obstante, uno de los casos presentó esta complicación hasta los 40 meses de seguimiento. Esto podría indicar que la hipotonía puede presentarse hasta tres años postratamiento, y que al aumentar el tiempo de seguimiento, sería posible ver un aumento en la incidencia de esta complicación. En nuestra serie, dos ojos desarrollaron hipotonía tras la segunda aplicación de láser. A pesar de que no se pueden generar conclusiones, debido al número limitado casos incluidos, valdría la pena investigar y considerar si la reaplicación de la ciclo-ablación, aumenta el riesgo de hipotonía ocular y ptisis bulbi. En la actualidad, no existen reportes en la literatura médica, que analicen la relación entre las reaplicaciones de láser y la tasa de hipotonía/ptisis ocular.
La complicación más seria de la ciclo-ablación es la atrofia ocular o ptisis bulbi. Es alentador que la mayoría de los estudios reporta una incidencia baja de esta complicación (0-3%).22,28,32-35 Goldberg-Cohen y colaboradores reportaron la incidencia máxima de ptisis bulbi en 3.1% de sus 32 ojos.28 Por otro lado, la serie con mayor número de casos (210 ojos de 195 pacientes), reportó tan solo un ojo con esta complicación (0.5%).35 En el presente estudio, ninguno de los ojos se encontraba en estado de ptisis bulbi.
En conclusión, la ciclodiodo-ablación es un procedimiento efectivo y seguro en el manejo del GNV diabético, logrando una reducción de la PIO en hasta 76% de los casos tratados. La hipotonía ocular es la complicación más frecuente de este procedimiento, reportada en hasta 26% de ojos tratados. El GNV aumenta significativamente el riesgo de desarrollar esta complicación, por lo cual se sugiere limitar la cantidad de energía utilizada por sesión a 40-80 J. Es importante aclarar que el desarrollo de ptisis bulbi es raro, reportado en un máximo de 3% de casos. Por lo tanto, la ciclodiodo-ablación es una buena alternativa en el manejo de pacientes con glaucoma refractario, en el manejo agudo del GNV, en aquellos pacientes en los cuáles no se pueden realizar procedimientos invasivos (válvulas o derivaciones) y en casos con pobre potencial visual, asociado a dolor ocular. Asimismo, es un procedimiento no invasivo, de aplicación sencilla y con un perfil costo-beneficio adecuado, para este grupo de pacientes.
Correspondencia: Dr. Alejandro Rodríguez-García.
Instituto de Oftalmología, S.C. Río San Juan No. 103 (1er piso), Col. Miravalle. C.P. 64660. Monterrey, Nuevo León. México.
Teléfono: (81) 8356 3310. Fax: (81) 8356 1799.
Correo electrónico: arodri@itesm.mx