Introducción: La cámara anterior plana (CAP) es una complicación común, en el implante de válvula de Ahmed (IVA), para el manejo del glaucoma neovascular (GNV).
Métodos: Realizamos un análisis retrospectivo de las cirugías de 155 ojos, de 134 pacientes operados en el periodo de estudio, encontrando 49 casos de CAP (31.6% de los ojos). Se analizaron 54 factores de riesgo pre y transquirúrgicos de manera univariada, luego se construyeron modelos multivariados para determinar su efecto sobre la CAP, usando ecuaciones estimativas generalizadas (EEG), para ajustar dependencias por incluir ambos ojos de algunos pacientes.
Resultados: Las variables que afectaron la aparición de CAP fueron la presión intraocular inicial (5% por cada mmHg por encima de 37 mmHg, p=0.001), láser retinal (coeficiente de riesgo (CR) 1.48, p=0.021), IVA combinada con facoemulsificación (con respecto a vitrectomía simultánea CR -3.49, p=0.019), IVA no combinada (CR -1.89, p=0.064) e IVA en ojo fáquico (CR 3.14, p<0.001).
Conclusiones: Se logró identificar varios factores de riesgo potencialmente modificables, que pueden cambiar el curso posoperatorio del IVA. En particular llama la atención, cómo la ausencia de cristalino afecta el riesgo de CAP, de manera que su extracción, cuando presente alguna opacidad al tiempo del implante, podría estar más justificada.
Introduction: Flat-anterior chamber (FAC) is one of the most common complications of Ahmed Valve Implant (AVI) for neovascular glaucoma (NVG).
Methods: A retrospective analysis of 155 eyes of 134 patients operated during the study period, finding 49 cases of FAC (31.6% of eyes). Fifty-four risk-factors were incorporated, initially analyzed in a univariate manner, then using the best for constructing multivariate models to determine the effect on FAC, using Generalized Estimating Equations (GEE) to adjust for dependencies due to the fact of using both eyes of some patients for the analysis.
Results: We found that variables that affected the risk of FAC were: initial IOP (5% per mmHg over 37 mmHg, p=0.001), previous retinal laser (Risk coefficient (RC) 1.48, p=0.021), combined AVI and phacoemulsification (as compared to simultaneous vitrectomy RC -3.49, p=0.019), not-combined AVI (RC -1.89, p=0.064) and AVI performed in a phakic eye (RC 3.14, p<0.001).
Conclusions: We were able to identify several potentially modifiable risk factors that could change the postoperative course of Ahmed valve Implant. Since FAC risk is so low in eyes without the crystalline lens, its extraction for any kind of opacity at the same time of the implant could be more easily justified.
¿ Introducción
El glaucoma neovascular (GNV) es un tipo de glaucoma secundario, donde un ángulo inicialmente abierto, se va cubriendo por un tejido fibrovascular, que prolifera como consecuencia de hipoxia-isquemia retinal. Con el tiempo, el tejido anormal desarrolla sinequias anteriores, que progresivamente cierran el ángulo.
El tratamiento del GNV es todo un reto. La panfotocoagulación retinal, la cirugía filtrante, los implantes de drenaje y últimamente los antiangiogénicos, mejoran el pronóstico, combinados o no con cirugía de vítreo.
Los procedimientos ciclodestructivos para los casos refractarios, han pasado a usarse sólo para los ojos de pésimo pronóstico visual o ciegos, sobretodo para manejar el dolor.1 Los implantes de drenaje se consideran hoy en día, como la mejor manera de lograr el control de la presión intraocular (PIO) y preservar la visión en estos difíciles casos.2-6
La cámara anterior plana (CAP) es una de las complicaciones más comunes, del posoperatorio de los implantes de drenaje. Usualmente es de duración corta, pero tiene el potencial de producir pérdida de células endoteliales, edema corneal y opacidad del cristalino.7,8 Nuestro objetivo fue identificar los factores de riesgo, que pudieran permitirnos predecir los pacientes y ojos, con mayor riesgo de tener cámara plana, y posiblemente tomar medidas preventivas según los resultados.
¿ Métodos
Realizamos un estudio retrospectivo de los casos de GNV tratados con implante de válvula de Ahmed (IVA), en la Asociación para evitar la Ceguera en México, en el periodo comprendido entre enero de 2004 a noviembre de 2005. Los pacientes o acudientes firmaron el consentimiento informado para las cirugías, el Comité de Ética del hospital aprobó realizar el estudio de manera retrospectiva.
Las variables estudiadas fueron: edad, sexo, enfermedades sistémicas asociadas y sus complicaciones, niveles de creatinina, urea, glicemia, colesterol, albuminuria y glucosuria, causa del GNV, cirugías previas, fotocoagulación previa, medicamentos usados antes del IVA, PIO medida con Goldmann antes de la cirugía, examen completo de segmentos anterior y posterior, y complicaciones posoperatorias tempranas.
Las CAP fueron clasificadas en tres grados: grado I, si sólo había contacto endotelial con el iris periférico; grado II, si el borde pupilar tenía contacto endotelial y grado III, si el cristalino o el lente intraocular tenían contacto con el endotelio.
La técnica de IVA fue la siguiente: colgajo conjuntival base fornix en el cuadrante supero temporal, fijación de cuerpo de válvula de Ahmed modelo S2, previamente purgada con solución salina balanceada, con seda 7-0 entre 8 y 10 mm del limbo. Posteriormente, se construye un túnel epiescleral largo, empezando al menos a 4 mm del limbo, con aguja 22G o 23G. Al llegar al limbo, se cambia su dirección hasta hacer el túnel paralelo al iris. Luego se recorta el tubo de manera biselada y se inserta por el túnel, hasta la cámara anterior. No se usó tejido adicional para cubrir el tubo, seguidamente la conjuntiva se cierra con puntos de seda 7-0, separados o en colchonero.
El análisis estadístico fue realizado con SPSS versión 16 para Windows. Los promedios de las variables continuas, fueron analizadas de manera univariada con ANOVA. Las variables categóricas fueron analizadas de manera univariada, usando el ji cuadrada de pearson o el test exacto de Fisher, con respecto a su impacto sobre el resultado final, obteniendo odds ratio (OD) con intervalos de confianza (IC) del 95%, para cada variable. Posteriormente, se construyeron modelos multivariados para analizar la presencia o no de cámara plana (regresión logística binaria) y el grado de cámara plana (regresión logística ordinal, siendo tres la peor), usando el procedimiento con ecuaciones estimativas generalizadas (GEE, por sus siglas en inglés), de manera que se pudieran ajustar las dependencias, por el hecho de haber incluido los dos ojos de 21 pacientes. Se realizó selección progresiva, por pasos de los factores y covariables significativos en el análisis simple, para construir el modelo multivariado final. Finalmente, al encontrar el nivel de PIO preoperatoria como una variable que afectaba el riesgo de cámara plana, se realizó análisis de conglomerados en dos fases para encontrar un punto de corte útil clínicamente, que permita predecir los ojos de mayor riesgo y se aplicó como variable binomial, al modelo multivariado nuevamente como confirmación.
¿ Resultados
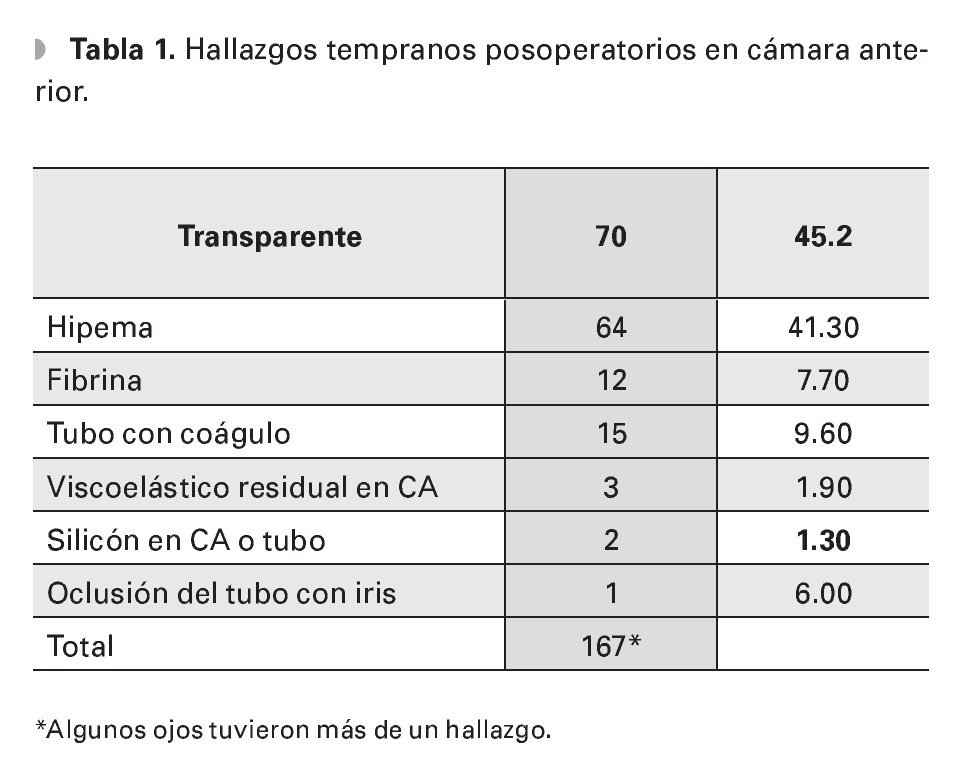
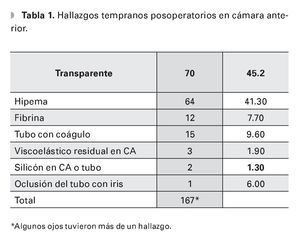
Se incluyeron 155 ojos de 134 pacientes (73 hombres, 54.5%) que fueron operados de IVA por GNV, durante el periodo de estudio. Se presentaron 49 casos de cámara plana (31.6% de los ojos), 13 con grado I (26.5%), 28 grado II (57.1%) y ocho grado III (16.4%), empezando la mayoría al primer día (23, 46.9%). Casi todos los demás antes de siete días (22, 44.9%), que se resolvieron en su totalidad con terapia médica (42, 85.7%) y algunos con reformación de cámara (siete, 14.3%) en promedio a los 7.5 días (Desviación Estándar DE 4.3 días, rango 1 a 18), independiente del grado.
La edad promedio fue 59 años (DE 10.4 años, rango 31 a 84 años), la mayoría diabéticos (114, 85.1%) con 15 años de evolución en promedio (rango tres meses a 51.6 años), los cuales fueron significativamente más jóvenes que los de otras causas vasculares (57.6 vs 66.9 años, p<0.001), como era de esperarse, pero sin impacto sobre la tasa de cámaras planas. También encontramos asociada la hipertensión arterial en 61 pacientes (45.5%).
Además fue muy común encontrar un pobre estado metabólico, especialmente en los diabéticos: 87 (65.9%) tenían niveles de glicemia arriba de 117 mg/dL; también fue común encontrar signos de nefropatía como microalbuminuria (55.6%), glucosuria (42.1%), hiperuricemia (48.5%), creatinina arriba de 1.5 mg/dL (24.4%), y además el colesterol estaba elevado en el 56.5% de los pacientes. De todos los datos metabólicos preoperatorios, el único que afectó de manera significativa en el análisis uni y multivariado el riesgo de CAP, fue la hiperuricemia, que resultó ser un factor protector no muy robusto (coeficiente de riesgo CR de CAP -1.09, p=0.024), puesto que en el modelo multivariado construido con respecto al grado de CAP, ya no resultó crítico. Aunque los demás factores de riesgo coincidieron con el modelo binomial, reportaremos sólo estos últimos resultados por simplicidad.
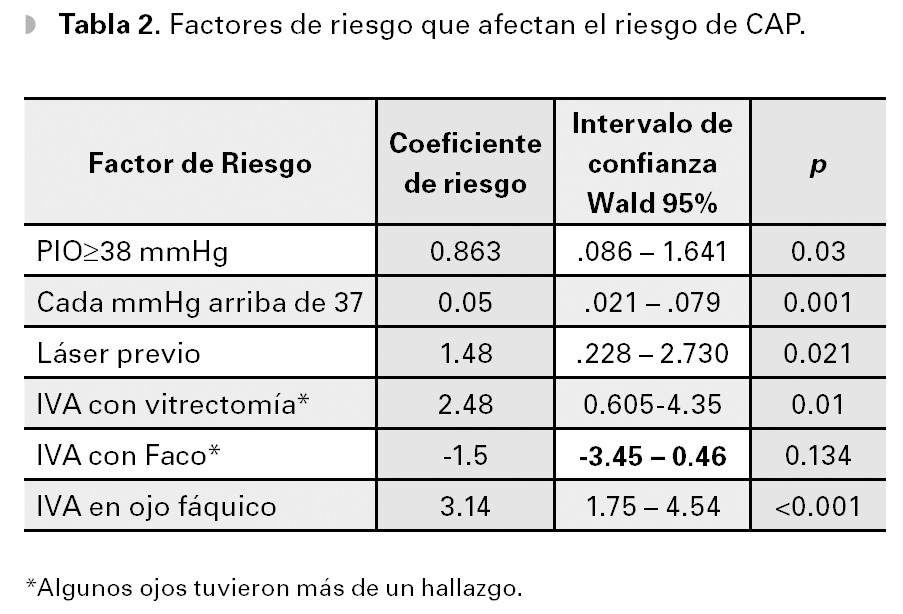
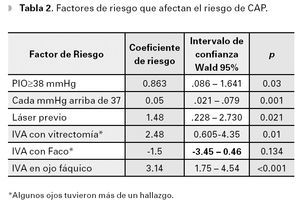
La PIO prequirúrgica promedio fue 36.7 mmHg (DE 13.5 mmHg), y fue un factor determinante para predecir la presencia de CAP, aumentando un 5% el riesgo por cada mmHg, por encima de 37 mmHg (p=0.001).
El otro factor preoperatorio que aumentó el riesgo de peor CAP, fue el láser previo a la cirugía, cuyo CR fue de 1.48 (p=0.021), a pesar de que los ojos que recibieron láser antes del implante, tuvieron una PIO inicial menor (34.97 vs 42.18 mmHg, p=0.004). Esta diferencia de PIO inicial no es sorprendente, ya que aplicar el láser requiere de córnea transparente y el edema es más frecuente, mientras más alta esté la PIO.
Por otro lado, la aplicación de fibroquel (colágena-polivinilpirrolidona), un medicamento que estuvimos probando como antifibrótico, también aumentó el riesgo de peor CAP 1.77 veces (p=0.034), sin embargo al corregir por PIO promedio prequirúrgica, su efecto desapareció, ya que fue mayor en estos pacientes (43.9 vs 35.8 mmHg, p=0.016), es decir que tendimos a usarlo, cuando peor estaba el paciente y que su efecto no era directo.
Otro factor de riesgo para CAP analizado (y que no interactuó con la PIO prequirúrgica), fue el tipo de cirugía combinada realizada al tiempo del IVA: ninguna cirugía (135 ojos), facoemulsificación (11 ojos) o vitrectomía (nueve ojos). La realización de IVA al tiempo de vitrectomía anterior o posterior, tuvo el mayor riesgo de CAP. Cuando se realizó IVA sola, el CR fue 1.9 veces menor (p=0.064), y al realizarla combinada con faco, tuvo un coeficiente de riesgo 3.49 veces menor de tener CAP (p=0.019), comparado con los ojos vitrectomizados.
Para completar el cuadro de factores de riesgo del modelo, analizamos la presencia de cristalino (127 ojos) vs afaquia o pseudofaquia (28 ojos), antes de la cirugía. De los ojos sin cristalino, sólo uno presentó CAP, lo que arrojó un riesgo en el análisis multivariado de 3.14 veces mayor para los ojos fáquicos (p<0.001).
Los demás factores de riesgo analizados (cirugías previas, uso de medicamentos tópicos u orales, uso de manitol, esteroides tópicos o cicloplégicos), no afectaron de manera significativa el riesgo de CAP en el modelo multivariado, aunque parecían ser importantes de manera univariada. Un buen ejemplo de esto es el uso de Acetazolamida, el cual aumentó el riesgo de CAP 2.01 veces (p=0.001), pero su uso dependió a su vez de la PIO inicial (43.5 vs 35.5 mmHg, p=0.007).
Los hallazgos posoperatorios tampoco afectaron significativamente la presencia de CAP (Tabla 1).
¿ Discusión y conclusiones
La CAP es una de las complicaciones más frecuentes, en cirugía de válvula de Ahmed. La situación puede resolverse espontáneamente, con tratamiento médico o con reformación de la cámara anterior con viscoelástico. Sus secuelas, aunque raras, pueden ser permanentes y potencialmente afectar la visión.
En este trabajo encontramos que los factores de riesgo principales, son la PIO arriba de 37 mmHg antes de la cirugía, la presencia de cristalino y la aplicación previa de láser. El uso del modulador de cicatrización Fibroquel, pudiera potencialmente aumentar el riesgo de CAP, por tener menor resistencia la vesícula. Sin embargo, no lo pudimos demostrar con nuestro trabajo, ya que lo usamos con más frecuencia en pacientes que venían con la PIO muy elevada, y por lo tanto mayor riesgo de CAP.
La aplicación previa de láser probablemente redujo el riesgo de hipema (36.8% con láser vs 55.3% sin láser, p=0.035), pero aumentó el de CAP. No pudimos elucidar el por qué de esta relación y, aunque no diferenciamos las causas de CAP, una posibilidad es que el mayor riesgo de hipema sin láser, aumente el número de tubos tapados por coágulo, protegiendo de CAP. Además los futuros trabajos tendrán que tener en cuenta, el uso previo de antiangiogénicos, los cuales no estaban aún disponibles en el momento de la cirugía, de esta serie de pacientes.
La presencia de cristalino es un factor de riesgo que si puede cambiar nuestros criterios quirúrgicos, al menos como prevención de CAP. Tanto los pacientes fáquicos que se operaron de catarata al tiempo de la IVA, como los que ya tenían afaquia o pseudofaquia antes del implante, tuvieron menor riesgo de CAP (Tabla 2).
Entonces una recomendación lógica de esto sería a los pacientes que presenten cristalino transparente y PIO muy elevada, deben ser tratados con precauciones especiales. Lo más sencillo y práctico, sería dejarles viscoelástico al final de la cirugía.
Por otro lado, se podría justificar realizar cirugía combinada de facoemulsificación e IVA, si el cristalino ya presenta algo de opacidad y la PIO está muy elevada.
Como no tenemos el registro de uso de viscoelástico durante la IVA y no se usa de rutina, existe la posibilidad de que el efecto protector de realizar cirugía combinada con facoemulsificación, se deba al viscoelástico más que a un posible efecto de férula por parte del lente intraocular. Esto se estudiaría mejor de manera prospectiva, pero nuestra experiencia es que dejar viscoelástico al final de la cirugía de implante, es algo favorable para el posoperatorio temprano.
Otra limitación del estudio, por su naturaleza retrospectiva, fue no poder obtener el dato exacto del calibre de la aguja usado para el túnel epiescleral, si bien es cierto que de rutina usamos aguja 23, en algunos ojos pudo usarse un calibre 22, con la posibilidad de que haya filtración alrededor del tubo. Tampoco analizamos la experiencia del cirujano como factor de riesgo, y esto también podría incidir en la presencia de CAP, aunque en nuestra serie de válvulas en niños, esta variable no afectó el resultado final del control de la PIO.9
Finalmente, valorando si el uso de GEE permite compensar el hecho de tener incluidos dos ojos de algunos pacientes, exploramos nuestra base de datos encontrando que sólo tres pacientes presentaron CAP en ambos ojos, sólo un ojo tuvo vitrectomía, los otros cinco ojos eran fáquicos, un ojo tenía la PIO preoperatoria en 19 mmHg, los demás tenían cifras superiores a 36 mmHg. Repetimos el análisis multivariado excluyendo estos tres pacientes, y se mantuvieron los mismos factores de riesgo dentro del modelo, sólo que con mayor CR.
En conclusión, debemos tomar precauciones adicionales y medidas preventivas en todos los casos de IVA para GNV, pero en especial cuando la PIO está por encima de 37 mmHg, indica que el paciente requiere vitrectomía y/o el paciente es fáquico.
Correspondencia: Dr. Oscar Albis-Donado.
Vicente García Torres N° 46. Col. San Lucas, Coyoacán. C.P. 04030. México D.F., México.
Teléfono: (55) 1084 1400. Fax. (55) 1084 1404.
Correo electrónico: oalbis@msn.com