Comparar el uso del ganciclovir con el del aciclovir, usados de forma tópica, para la curación de la queratitis epitelial herpética en menos de 7 días.
Materiales y métodosSe diseñó un ensayo clínico aleatorizado comparativo de pacientes con queratitis epitelial herpética del Centro de Oftalmología de la Fundación Santos y de la Garza Evia. Se establecieron 2 grupos de tratamiento: gel de ganciclovir 0.15% y ungüento de aciclovir 3%; aplicados 5 veces al día hasta el cierre de la dendrita y después 3 veces al día durante 3 días más. Se evaluó diariamente a los pacientes hasta el cierre de la úlcera y se aplicó un cuestionario de síntomas con una escala validada.
ResultadosSe reclutaron 23 pacientes: 13 tratados con ganciclovir (56.5%) y 10 (43.4%) con aciclovir (p=0.94); la edad promedio fue de 47.69 años (DE±18.6) para el primer grupo y de 56.8 años (DE±9.6) para el segundo (p=0.17). El tamaño de la úlcera inicial fue similar en ambos grupos: 2.3mm (±1.85) en aciclovir y 3.0mm (±0.94) en ganciclovir. En el primer día la mediana del tamaño de la úlcera en aciclovir fue de 1.5mm (RIC=1.8) y en ganciclovir 1mm (RIC=1.9) (p=0.257), lo cual no muestra una diferencia clínicamente significativa. Al día 7, la úlcera había cerrado a 0mm (RIC=0) en todos los casos de ganciclovir comparado con 1mm promedio en el grupo de aciclovir (RIC=1.7) (p=0.000).
ConclusionesEl ganciclovir demostró una curación de la queratitis epitelial en menos de 7 días, comparado con aciclovir.
To compare the healing rate in less than 7 days with the use of ganciclovir or acyclovir in patients with epithelial herpetic keratitis.
Materials and methodsWe designed a randomized clinical trial including patients with epithelial herpetic keratitis seen at Centro de Oftalmología de la Fundación Santos y de la Garza Evia. There were 2 treatment groups: 0.15% ganciclovir gel and acyclovir 3% ointment, applied 5 times a day until the dendrite closed, and then 3 times a day for 3 days. We evaluated patients daily until the ulcer healed. A validated symptom scale was provided in each visit.
ResultsWe recruited 23 patients: 13 treated with ganciclovir (56.5%) and 10 (43.4%) with acyclovir (P=.94), the mean age was 47.69 years (SD±18.6) for the first group, and 56.8 years (SD±9.6) for the second (P=.17). The initial ulcer size was similar in both groups: 2.3mm (±1.85) in acyclovir and 3.0mm (±0.94) in ganciclovir. On the first day the median ulcer size was 1.5mm acyclovir (IQR=1.8) and ganciclovir 1mm (IQR=1.9) (P=0.257), which does not show a clinically significant difference. At day 7, the ulcer had closed to 0mm (IQR=0) in all cases of ganciclovir compared with acyclovir 1mm (IQR=1.7) (P=.000).
ConclusionsThe healing rate of ganciclovir in less than 7 days for EK was superior compared with acyclovir.
La queratitis epitelial es la forma más común de infección ocular por virus del herpes simple (HSV) ya que constituye el 50-80% de los casos1,2. La incidencia calculada es de 12 a 22 personas por 100,000 personas año y mundialmente se estima que cada año ocurren un millón de episodios nuevos o recurrentes de queratitis por HSV. Globalmente, existen cerca de 10 millones de personas que han tenido la enfermedad y de ellos 2 millones presentaron algún tipo de pérdida visual. La morbilidad ocular causada por la queratitis herpética la coloca como la causa más común de ceguera por causas corneales3.
La manifestación habitual de las reactivaciones del HSV es la queratitis epitelial dendrítica, que se caracteriza por ser dolorosa y adopta patrones de ramas (dendritas) con bulbos terminales4, a diferencia de la geográfica, la cual es una forma macroulcerosa de infección corneal. En la mayoría de los casos se presenta de forma unilateral, excepto en pacientes con atopia o desviación inmune en los que puede presentarse simultáneamente en ambos ojos5. La evolución natural de la enfermedad es que sin tratamiento antiviral tan solo la mitad de las infecciones herpéticas no complicadas se resuelven en 2 semanas, lo cual corresponde al ciclo viral del HSV.
Existen varios tratamientos que van desde la administración de fármacos hasta el desbridamiento superficial, cuyo objetivo es acortar el curso de la infección y así evitar la pérdida de transparencia del tejido corneal. Dentro de las publicaciones con mejores niveles de evidencia, se han llevado a cabo revisiones sistemáticas (RS) que han comparado diversos ensayos clínicos que evalúan la efectividad comparativa de las intervenciones para la queratitis epitelial por HSV. La RS más actualizada es la realizada por Wilhelmus et al. en 2010 en donde, de 152 estudios elegibles, se analizaron 106 ensayos de tratamiento que incluían 5,872 ojos con formas dendríticas o geográficas; cuyo resultado principal fue la restitución del epitelio de la córnea durante 2 semanas.
En los estudios de la RS de Wilhelmus et al. se analizaron las tasas de restitución del epitelio corneal durante el tratamiento con antivirales, interferón o desbridamiento de la superficie corneal. Los resultados obtenidos demuestran que los primeros fármacos antivirales nucleósidos tópicos (la idoxiuridina y vidarabina) fueron moderadamente efectivos, aunque los más nuevos como la trifluridina y aciclovir (ACV) fueron mejores. Las preparaciones oftálmicas de trifluridina, ACV, ganciclovir (GCV) y brivudina tuvieron una efectividad casi equivalente entre sí y permitieron curar aproximadamente el 90% de los ojos tratados a las 2 semanas. La relevancia de esta RS tiene como implicaciones para la práctica clínica que las formulaciones oftálmicas de trifluridina, ACV y GCV son efectivas y seguras en el tratamiento agudo de la queratitis por HSV. La combinación de un antiviral con interferón puede acelerar la restitución y podría ser apropiada para los casos clínicamente recalcitrantes. El desbridamiento puede ser una opción cuando deben evitarse los fármacos, aunque es más efectivo cuando se combina con un agente antiviral.
Teniendo en cuenta los antecedentes anteriores, la elección del antiviral ideal depende de su efectividad en contra del virus, los efectos tóxicos en los tejidos oculares y la comodidad de uso para el paciente. La mayoría de los agentes desarrollados presentan algún grado de toxicidad manifestada como conjuntivitis folicular, erosiones epiteliales u oclusión de los puntos lagrimales6,7. El ACV tiene un potencial bajo de efectos secundarios y una gran efectividad sobre el HSV8,9; su mecanismo de acción es la inhibición de la ADN polimerasa, inactivada por la fosforilación del fármaco a través de la timidin-cinasa viral, que es altamente selectiva para las células infectadas10,11. Sin embargo, la presentación en ungüento contiene vaselina, la cual causa incomodidad en la aplicación y visión borrosa después de su uso.
La otra alternativa de tratamiento es el GCV, análogo nucleósido acíclico, estructuralmente relacionado al ACV, y que constituye un inhibidor potente de la replicación del HSV12. También se activa por la timidin-cinasa viral para fosforilarse a formas activas, que son las que inhiben a la ADN polimerasa viral. La actividad antiviral del GCV ha sido descrita frente a adenovirus13, virus de Epstein-Barr14, y herpes zóster15, además del citomegalovirus en pacientes inmunocomprometidos16. Su eficacia, tolerancia y penetración intraocular ha sido estudiada en modelos de queratitis herpética en conejos17. La presentación en gel (carbómero) 0.15% tiene como ventaja que causa menor visión borrosa al aplicarlo, ya que es transparente e hidrosoluble, lo cual se traduce en mayor comodidad de uso para el paciente.
A pesar de que existe suficiente evidencia para sustentar que el GCV y el ACV son igualmente efectivos en el tratamiento de la queratitis por HSV a las 2 semanas, no existen estudios que demuestren que la tasa de restitución epitelial en pocos días (menor de 7) es mejor con el GCV comparado con el ACV. El presente ensayo se realizó con la intención de analizar si el GCV puede constituir una mejor alternativa al ACV en términos de velocidad de curación, mejoría de síntomas y menor visión borrosa causada después de la aplicación del fármaco.
MetodologíaSe diseñó un ensayo clínico aleatorizado cuyo objetivo primario fue demostrar si el GCV tópico es más efectivo que el ACV para lograr la restitución del epitelio corneal en menos de 7 días. Como objetivos secundarios se analizaron los síntomas durante el tratamiento mediante una escala validada, la visión borrosa postaplicación y la toxicidad generada por los antivirales. El estudio se llevó a cabo con pacientes de la Clínica de atención Médica de la Fundación Santos y de la Garza Evia.
Se ingresaron pacientes de ambos sexos mayores de 18 años y menores de 80 con queratitis epitelial herpética. Se excluyeron del estudio los sujetos que habían recibido terapia tópica u oral con esteroides, antivirales o inmunosupresores en los 14 días previos; alérgicos a cualquiera de los antivirales; otras formas de queratitis; embarazadas y lactantes y pacientes con agudezas visuales menores de 20/30 en ojo contralateral. Los casos de suspensión de la participación en el ensayo se debieron a: no mejoría al día 5 de tratamiento, aparición de nueva úlcera, inflamación estromal o reacción en cámara anterior y evidencia de toxicidad medicamentosa. Para el cálculo del tamaño de la muestra se tomó en cuenta la revisión sistemática de Wilhelmus et al. Considerando que el 65% de los pacientes tratados con ACV y el 90% de los tratados con GCV presentan éxito clínico a los 7 días de tratamiento, con un poder (1-beta) de 0.8 y un nivel alfa de 0.05 en una prueba bilateral se calculó 20 pacientes por brazo experimental para un total de 40 pacientes en el estudio.
Una vez incluido el paciente en el estudio y previo consentimiento informado se distribuyó al paciente de forma aleatoria a 2 grupos de tratamiento: grupo A (ACV ungüento 3%) y grupo B (GCV 0.15% gel); en ambos grupos se prescribió el uso de antiviral aplicado de forma tópica 5 veces al día hasta el cierre de la úlcera y después 3 veces al día durante 3 días más. La evaluación del tamaño de la úlcera y de la escala de síntomas se realizó diariamente en los primeros 7 días de tratamiento o antes si es que la úlcera estaba cerrada. Posteriormente, se llevó a cabo una evaluación al día 10 y 14.
La medición del objetivo primario se realizó mediante el desenlace dicotómico (curación vs. no curación) antes de los 7 días. La curación se definió cuando la ulceración corneal estaba totalmente cerrada: epitelio íntegro y ausencia de tinción con fluoresceína. Los síntomas (lagrimeo, sensación de cuerpo extraño, fotofobia, visión borrosa, dolor y prurito) fueron medidos mediante una escala: leve 1, moderado 2 y severo 3. La visión borrosa se evaluó como presente o ausente.
Se determinó la distribución normal de las variables continuas mediante la prueba de Shapiro. Los resultados fueron expresados como medias con desviaciones estándar (DE) o medianas y sus respectivos rangos. Las medias entre grupos se compararon mediante la prueba t de Student y las medianas mediante la prueba de U de Mann-Whitney. Se recogieron los datos categóricos mediante la prueba de ji-cuadrado en tablas de contingencia. La significación estadística se definió cuando p<0.05 y todos los valores fueron de 2 colas. Para la estadística descriptiva se utilizó el paquete estadístico para las ciencias sociales de Windows® (SPSS Inc., Chicago, Il, versión 13.0) y el programa Excel de Windows®. El protocolo fue aceptado por la Comisión de Ética e Investigación de la Escuela de Medicina del Tecnológico de Monterrey.
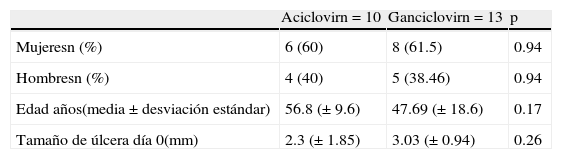
ResultadosCaracterísticas demográficasSe reclutaron un total de 23 pacientes, los cuales fueron aleatorizados en 2 grupos de acuerdo a los métodos previamente descritos. En el primer brazo de tratamiento con GCV se incluyeron a 13 pacientes: 8 mujeres (61.5%) y 5 hombres (38.46%) (p=0.94). En el segundo grupo de tratamiento con ACV se trataron un total de 10 pacientes: 6 mujeres (60%) y 4 hombres (40%) (p=0.94).
La edad promedio fue de 47.69 años para el grupo GCV con una DE de ±18.6 y de 56.8 años (DE±9.6) para el grupo ACV con una p=0.17 para ambos grupos (tabla 1).
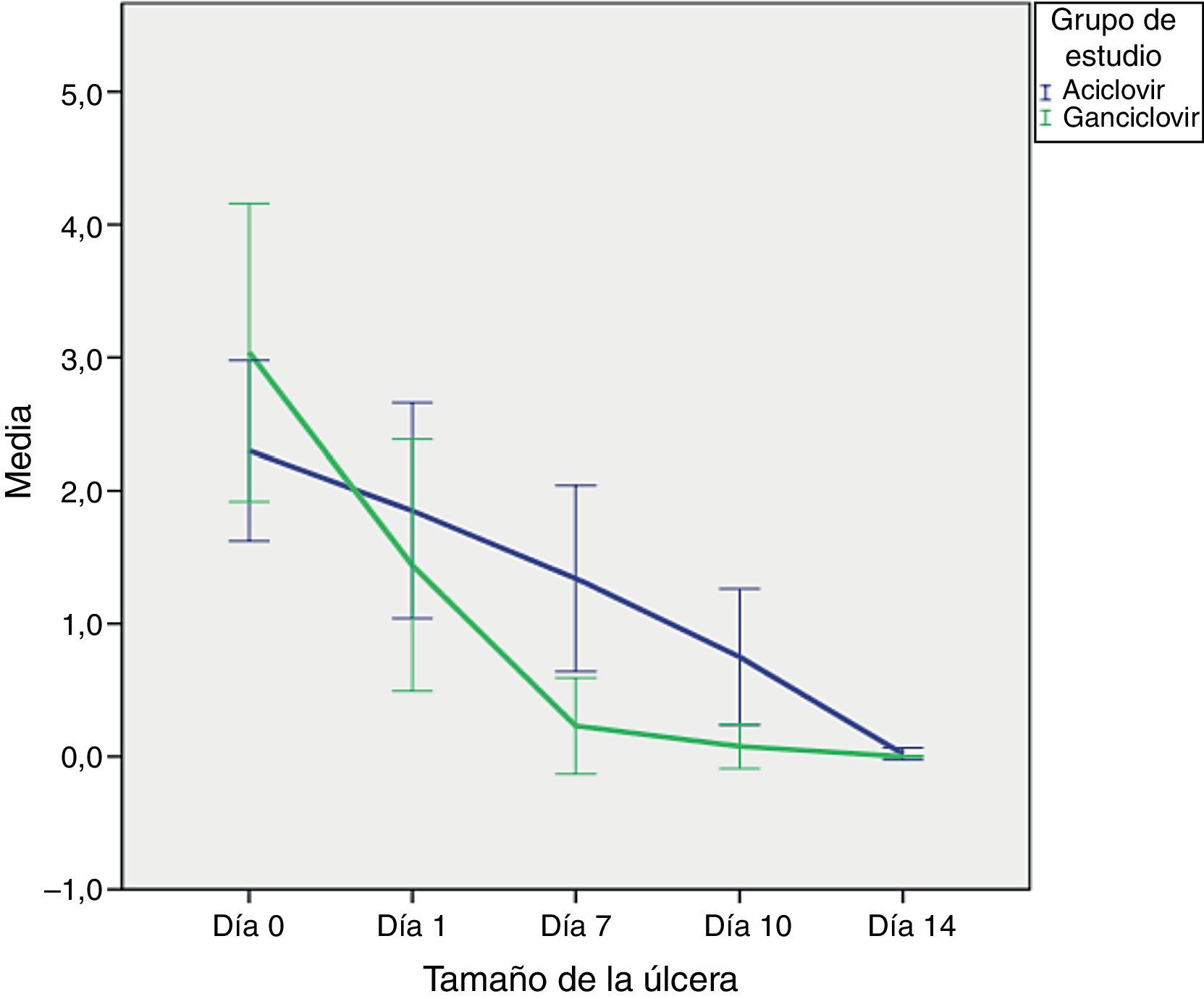
Tamaño de la úlceraEl tamaño de la úlcera inicial, es decir antes de recibir tratamiento, fue similar en ambos grupos. En el grupo ACV la media fue de 2.3mm (DE±1.85) y en el grupo GCV de 3.03mm (DE±0.94) (p=0.26); no existe significación estadística ya que es una variable independiente (tabla 1).
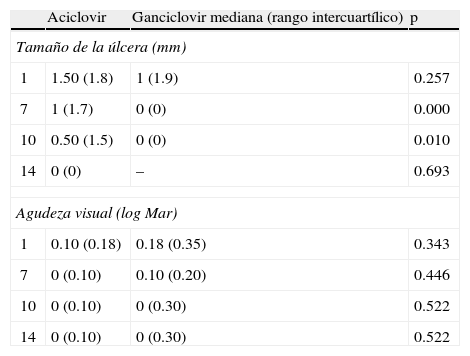
Las evaluaciones del tamaño de la úlcera se realizaron en ambos brazos en los días: 1, 7, 10 y 14 del tratamiento. En las primeras 24h en el grupo ACV la mediana del tamaño del la úlcera fue de 1.50mm, con rango intercuartílico (RIC) de 1.8. En el grupo GCV la media fue de 1mm (RIC1.9) (p=0.257), lo cual no muestra una diferencia estadísticamente significativa. Sin embargo, en el día 7 de tratamiento, en el grupo ACV se obtuvo un tamaño de 1mm (RIC1.7) y en GCV de 0mm (RIC0), lo cual demuestra que la curación entre el día 1 y 7 se obtuvo en la totalidad de los casos en el grupo de GCV (p=0.000). En el décimo día de tratamiento la media del tamaño de la úlcera en ACV fue de 0.50mm (RIC1.5) (p=0.010) y para el día 14 todos los casos estaban curados en ambos grupos (tabla 2).
Tamaño de la úlcera y agudeza visual de los grupos de estudio
| Aciclovir | Ganciclovir mediana (rango intercuartílico) | p | |
| Tamaño de la úlcera (mm) | |||
| 1 | 1.50 (1.8) | 1 (1.9) | 0.257 |
| 7 | 1 (1.7) | 0 (0) | 0.000 |
| 10 | 0.50 (1.5) | 0 (0) | 0.010 |
| 14 | 0 (0) | – | 0.693 |
| Agudeza visual (log Mar) | |||
| 1 | 0.10 (0.18) | 0.18 (0.35) | 0.343 |
| 7 | 0 (0.10) | 0.10 (0.20) | 0.446 |
| 10 | 0 (0.10) | 0 (0.30) | 0.522 |
| 14 | 0 (0.10) | 0 (0.30) | 0.522 |
En la figura 1 se observa la media del tamaño de la úlcera durante los días de tratamiento. Se puede observar cómo en el día 0 el grupo destacado en verde (GCV) tiene un tamaño mayor de la úlcera inicial comparado con el ACV en azul. Entre el día 0 y 1, aunque se observa un cierre más rápido, no existe diferencia entre ambos grupos. Sin embargo, entre los días 1 y 7 se aprecia claramente cómo el GCV cierra más rápido la úlcera, alcanzando la curación al séptimo día. En el día 14 ambos grupos tienen el mismo desenlace, es decir el cierre total del defecto epitelial.
En las pruebas de hipótesis se utilizó la prueba no paramétrica de Mann-Whitney para muestras independientes y se obtuvo que la reducción del tamaño de la úlcera al día 1 es la misma en ACV que en GCV (p=0.257), por lo que se acepta la hipótesis nula. Por el contrario, en el día 7 la reducción del tamaño es mejor en GCV que en ACV (p=0.000) y de igual manera en el día 10 (p=0.010), lo cual rechaza la hipótesis nula.
Al finalizar, el día 14, la reducción sigue siendo igual en ambos grupos (p=0.693) lo cual demuestra que ambos medicamentos son igualmente efectivos en la curación de la queratitis epitelial herpética.
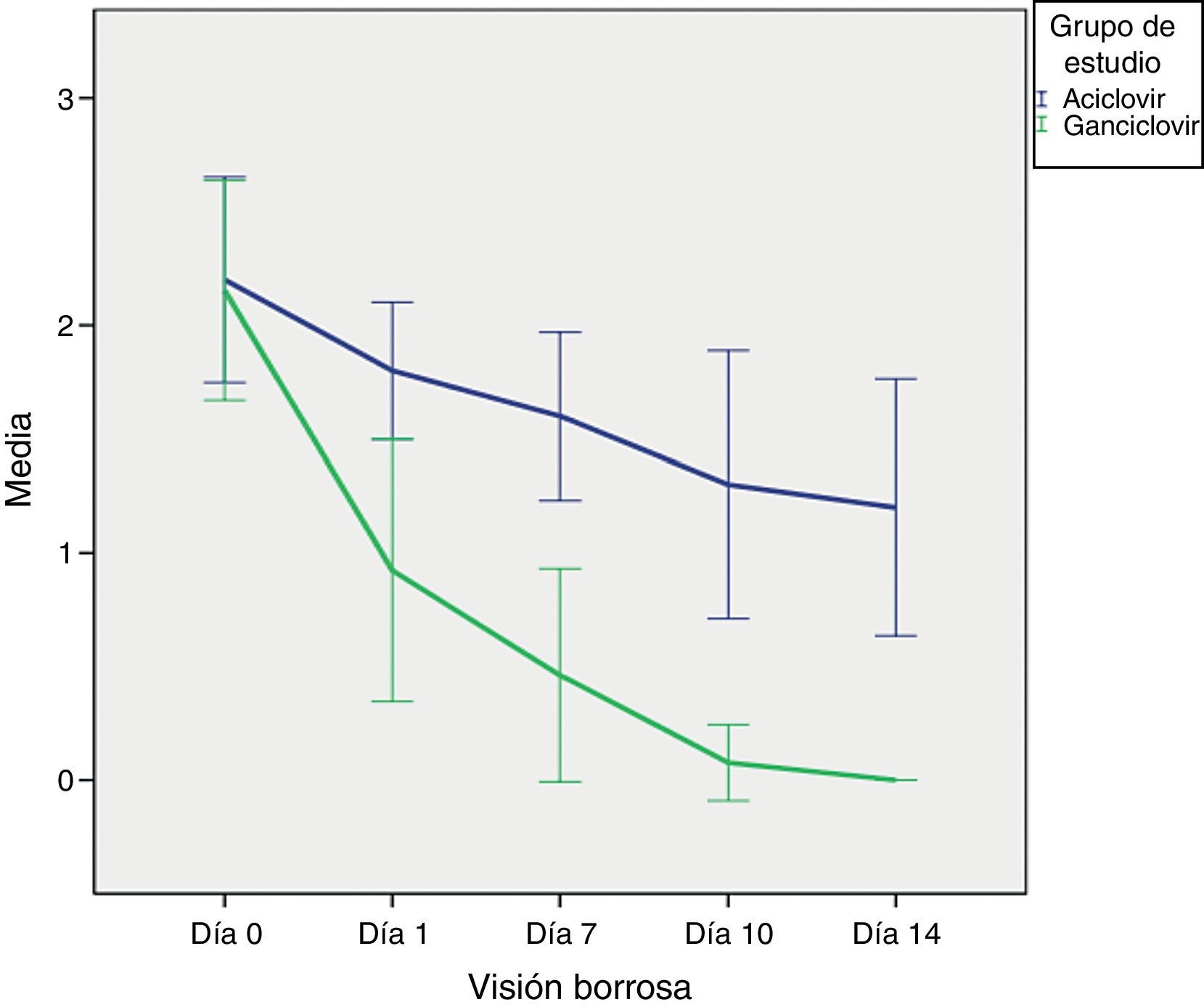
Agudeza visualLa mediana de la agudeza visual en escala logarítmica (log Mar) en el primer día fue en ACV 0.10 (RIC0.18) y en GCV de 0.18 (RIC0.35) (p=0.343). La agudeza visual en equivalente Snellen que corresponde a log Mar es: 20/20 (0.00), 20/25 (0.10), 20/30 (0.18) y 20/40 (0.30). Esto demuestra que hubo una diferencia de una línea de visión entre ambos grupos.
Al día 7 de tratamiento en el grupo de ACV la visión mejoró a 0 (RIC0.10) y se mantuvo hasta el día 14 (p=0.522). Por el contrario, en el grupo de GCV al día 7 la mediana fue de 0.10 (RIC0.20) (p=0.446) y para los días 7 y 14 fue de 0 (RIC0.30) (p=0.522), lo cual no fue estadísticamente significativo (tabla 2).
Las tendencias de agudeza visual se pueden observar en la figura 2, en donde claramente se ve que las agudezas visuales antes de la intervención no fueron similares en los 2 grupos y que la mejoría se observa al día 7 de tratamiento. Sin embargo, desde el día 1 al 14 el grupo de ACV obtuvo una mejor visión.
En las pruebas de hipótesis utilizando la de Mann-Whitney se obtuvo que para todos los días de evaluación el cambio en la agudeza visual no fue estadísticamente significativo, por lo que se retiene la hipótesis nula, la cual señala que no existe diferencia entre ambos grupos.
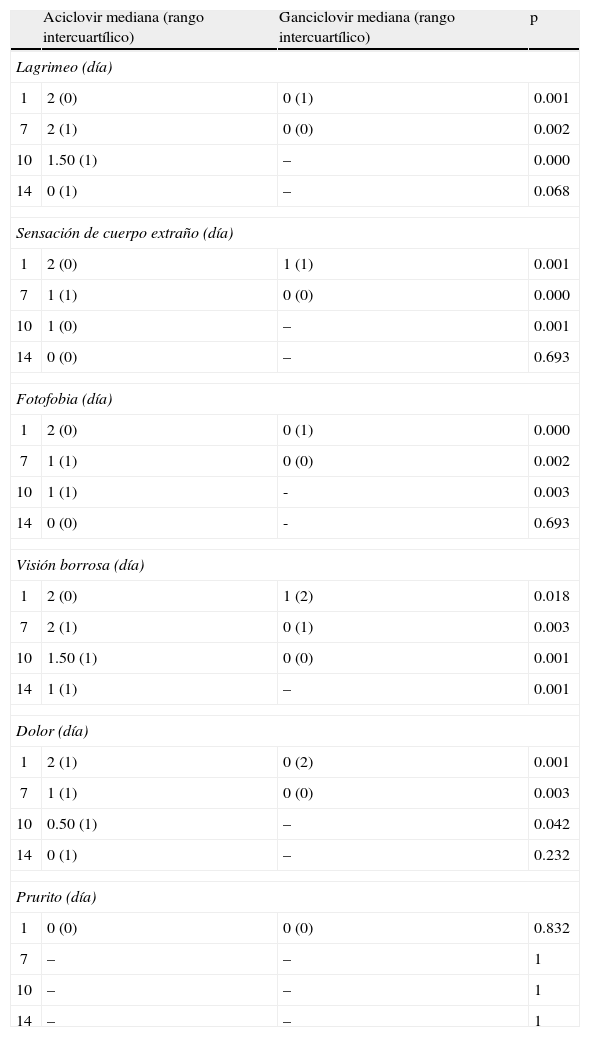
Síntomas durante el tratamientoLos síntomas se evaluaron mediante una escala validada aplicada al paciente en cada evaluación y fueron: lagrimeo, sensación de cuerpo extraño, fotofobia, visión borrosa, dolor y prurito. Se asignó un valor de acuerdo con la severidad de los síntomas (0 ausente, 1 leve, 2 moderado y 3 severo) y se aplicó el cuestionario a los pacientes en cada día de evaluación. En la tabla 3 se muestra cada uno de los síntomas con la mediana y RIC correspondientes de acuerdo con el día de tratamiento, así como el valor de significación estadística.
Síntomas en los grupos de tratamiento
| Aciclovir mediana (rango intercuartílico) | Ganciclovir mediana (rango intercuartílico) | p | |
| Lagrimeo (día) | |||
| 1 | 2 (0) | 0 (1) | 0.001 |
| 7 | 2 (1) | 0 (0) | 0.002 |
| 10 | 1.50 (1) | – | 0.000 |
| 14 | 0 (1) | – | 0.068 |
| Sensación de cuerpo extraño (día) | |||
| 1 | 2 (0) | 1 (1) | 0.001 |
| 7 | 1 (1) | 0 (0) | 0.000 |
| 10 | 1 (0) | – | 0.001 |
| 14 | 0 (0) | – | 0.693 |
| Fotofobia (día) | |||
| 1 | 2 (0) | 0 (1) | 0.000 |
| 7 | 1 (1) | 0 (0) | 0.002 |
| 10 | 1 (1) | - | 0.003 |
| 14 | 0 (0) | - | 0.693 |
| Visión borrosa (día) | |||
| 1 | 2 (0) | 1 (2) | 0.018 |
| 7 | 2 (1) | 0 (1) | 0.003 |
| 10 | 1.50 (1) | 0 (0) | 0.001 |
| 14 | 1 (1) | – | 0.001 |
| Dolor (día) | |||
| 1 | 2 (1) | 0 (2) | 0.001 |
| 7 | 1 (1) | 0 (0) | 0.003 |
| 10 | 0.50 (1) | – | 0.042 |
| 14 | 0 (1) | – | 0.232 |
| Prurito (día) | |||
| 1 | 0 (0) | 0 (0) | 0.832 |
| 7 | – | – | 1 |
| 10 | – | – | 1 |
| 14 | – | – | 1 |
(0=ausente, 1=leve, 2=moderado, 3=severo).
Nota: los datos omitidos en cada grupo de estudio se deben a que no hubo diferencia significativa.
El lagrimeo al inicio fue similar en ambos grupos (fig. 3). Para el primer día de tratamiento se muestra que el lagrimeo había disminuido notablemente en el grupo GCV y esta tendencia se mantuvo en los días 7 y 10 (p=0.002). En el día 14 el lagrimeo fue similar en ambos grupos (p=0.068). Después de aplicar la prueba de la mediana para muestras independientes se observa que el GCV es superior al ACV en los días 1, 7 y 10, e igual en el día 14.
La sensación de cuerpo extraño en el primer, séptimo y décimo día fue menor en el grupo de GCV (p=0.001). Al día 14 ambos grupos fueron similares (p=0.693). Como se observa en la figura 4, inicialmente los pacientes tenían el mismo grado de sensación de cuerpo extraño y esta se redujo sostenidamente con mayor rapidez en el grupo de GCV, para después desaparecer al día 14.
La fotofobia tuvo un comportamiento similar (fig. 5): en los días 1, 7 y 10 se redujo con mayor velocidad en los pacientes tratados con GCV (p=0.002) comparado con los de ACV y nuevamente al día 14 no existió diferencia entre ambos grupos.
Por otra parte, la visión borrosa se redujo de forma más rápida y durante los 14 días de tratamiento en el grupo GCV (p=0.001) (fig. 6). Es destacable que este síntoma en el día 0 presentó exactamente la misma magnitud en ambos grupos. El hecho de que los del grupo de ACV terminaran al día 14 con mayor visión borrosa puede explicarse por la composición del vehículo del medicamento GCV (gel) y ACV (ungüento).
El dolor reportado fue menor en el grupo de GCV en los días 1, 7 y 10 (p=0.002) y al día 14 igual que los de ACV. En la figura 7 se puede apreciar el descenso sostenido de este síntoma hasta el día 7, y para los días 10 y 14 en ambos grupos había desaparecido por completo.
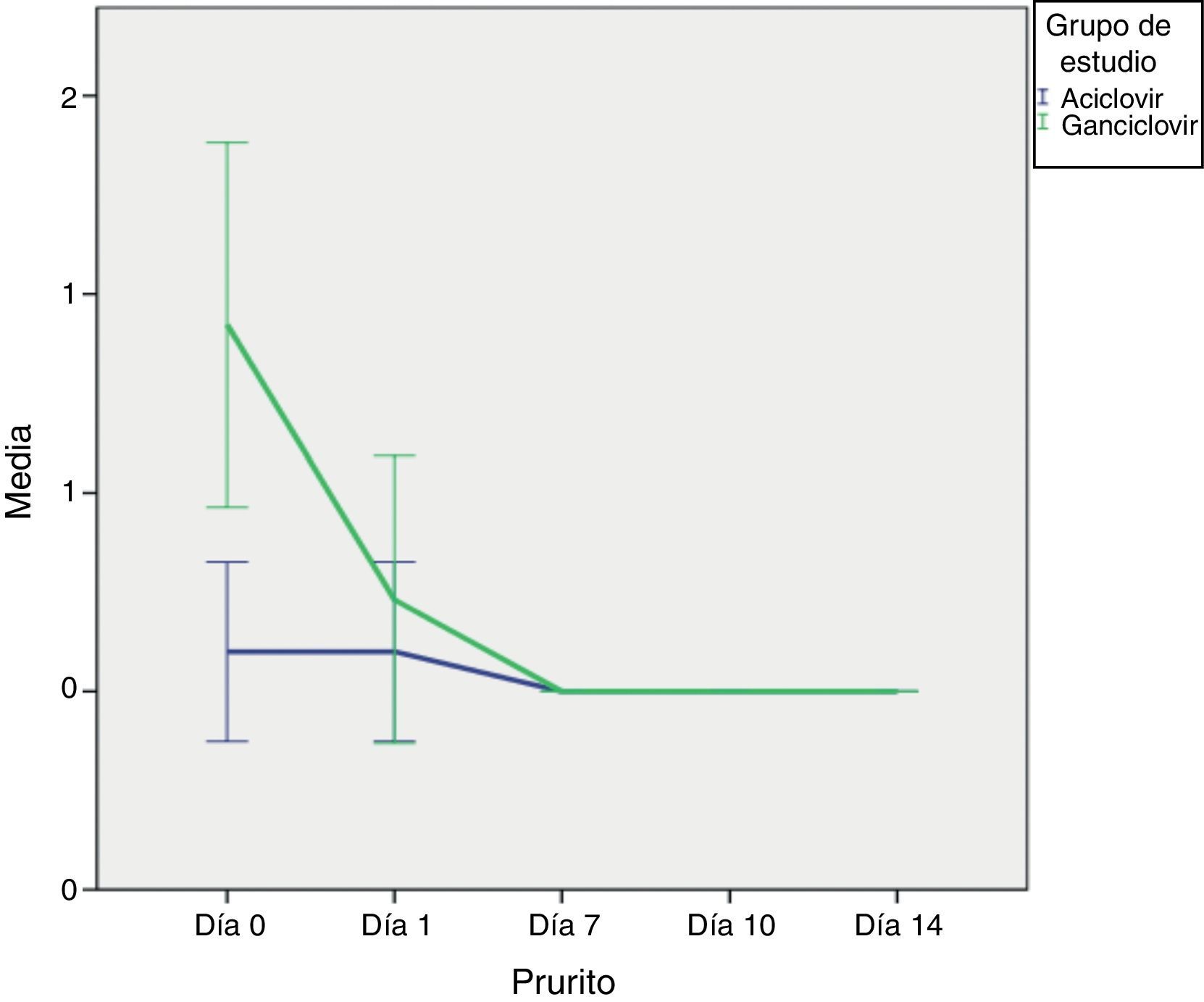
Finalmente, el prurito fue igual en ambos grupos y no fue estadísticamente significativo. En la figura 8 se puede observar la gran variabilidad de los datos y cómo al día 7 ninguno de los 2 brazos de tratamiento reportó este síntoma.
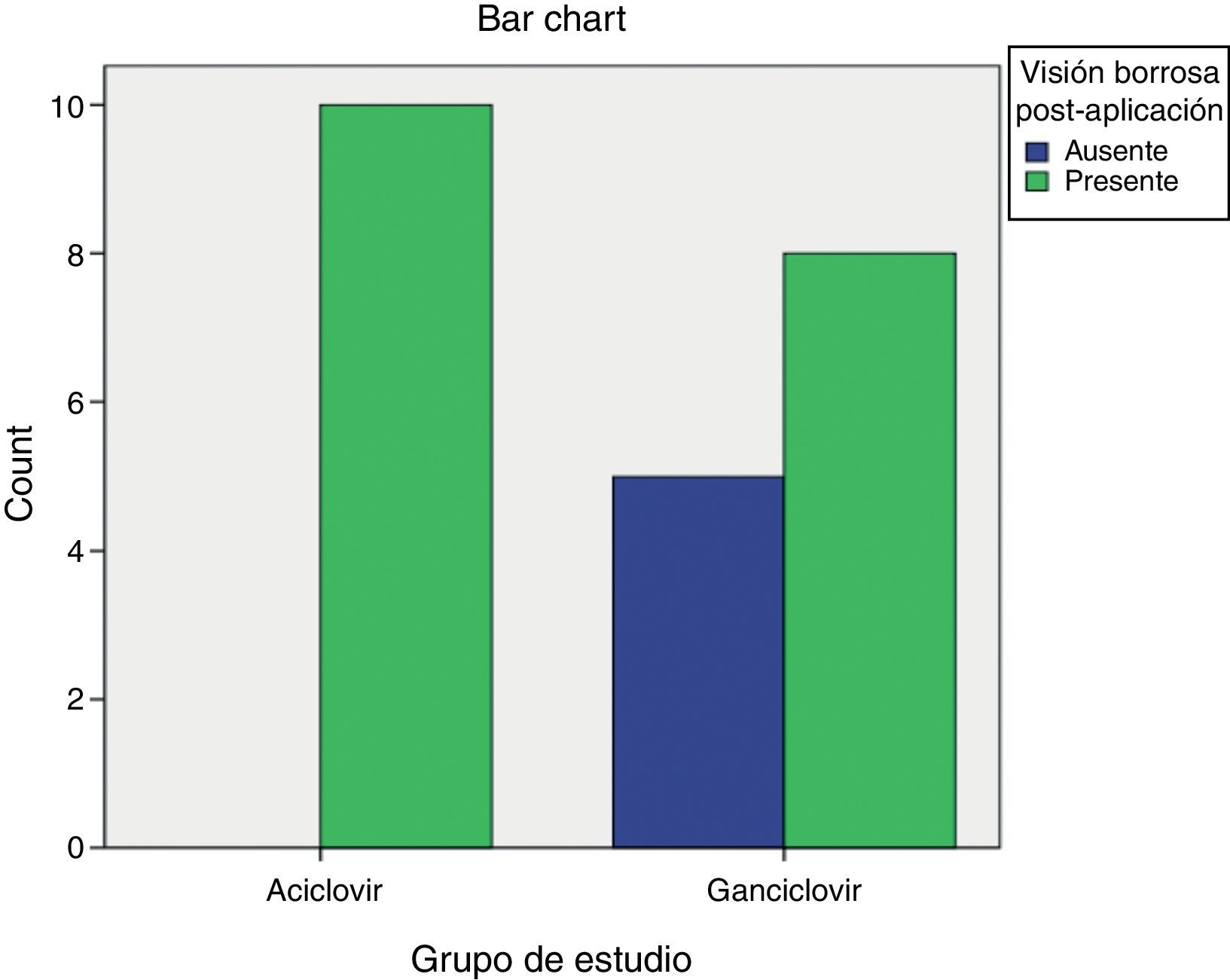
Visión borrosa postaplicaciónLa visión borrosa inmediata (<60min) después de aplicar los antivirales se registró como ausente o presente. En la figura 9 se aprecia cómo en el grupo de ACV la totalidad de los pacientes reportaron este síntoma después de aplicarlo (n=10). Por el contrario, en el grupo de GCV solo 8 pacientes reportaron visión borrosa y 5 no la tuvieron (n=13).
Probabilidad acumulada de curaciónEn el análisis de supervivencia con la curva de Kaplan-Meier (fig. 10) se observa en el eje de las «y» la probabilidad de no curación (1) y de curación (0); y en el eje de las «x», el día de curación. En el grupo de GCV se observa cómo en los primeros días (<7 días) la probabilidad acumulada de curación es mayor en este brazo de tratamiento. En los tratados con ACV la mayor probabilidad de curación no se observa hasta después de los 7 días de tratamiento.
DiscusiónEl HSV afecta a la gran mayoría de las personas durante su vida. La enfermedad herpética ocular puede dañar diversas estructuras, de las cuales la córnea es la más comúnmente afectada. La queratitis herpética forma el 80% de los casos de infección por herpes11,12. La primoinfección la mayoría de las veces resulta asintomática y se manifiesta como una blefaroconjuntivitis asociada a infección de vías respiratorias altas18. Sin embargo, la latencia del virus es una característica particular en las infecciones herpéticas y las reactivaciones constituyen una constante a lo largo de la vida, disparadas por situaciones de estrés, trauma o inmunodeficiencia. La incidencia reportada por Wilhelmus et al., se calcula en 12-22 casos por 100,000 personas/año y se presentan un millón de episodios nuevos anualmente.
La morbilidad ocular causada por la queratitis epitelial la coloca como la causa más común de ceguera por causas corneales13. La disminución en la capacidad visual se explica por la pérdida de la transparencia del tejido corneal, lo que imposibilita o distorsiona la llegada de rayos de luz a la retina. Este fenómeno es resultado de las dendritas fantasma u opacidades subepiteliales que representan estigmas de daño autoinmune por infecciones previas del epitelio corneal11. Debido a que representa un factor de riesgo para la pérdida visual y para la diseminación a otros tejidos oculares, el tratamiento con antivirales ayuda a prevenir estas consecuencias.
La revisión sistemática realizada por la colaboración Cochrane en 2010 evaluó las tasas de restitución del epitelio corneal en 106 ensayos clínicos de tratamiento de la queratitis epitelial, que incluían a 5 872 ojos. Los tratamientos evaluados fueron con antivirales, interferón o desbridamiento del epitelio corneal. Se llegó a la conclusión de que los antivirales (trifluridina, ACV y GCV) son igualmente efectivos y permitieron curar el 90% de los ojos tratados a las 2 semanas. Esto nos lleva a la conclusión de que el ACV y el GCV son igualmente efectivos para el tratamiento de la queratitis epitelial.
En México se encuentran comercialmente disponibles el ACV 3% ungüento (Sophivir, Laboratorios Sophia) y el GCV 0.15% gel (Virgangel, Laboratorios Pisa). En la práctica clínica habitual la mayoría de los oftalmólogos prescriben el ACV ya que el uso de GCV no es muy popular. Sin embargo, al empezar a utilizar el GCV algunos médicos observaron que la curación era superior en los primeros días en comparación con el ACV, razón por la cual nace la idea de este ensayo clínico aleatorizado. Al revisar los tiempos de evaluación en los estudios incluidos en la revisión sistemática se encontró que las evaluaciones se realizaban por convención a los días 7, 10 y 14 de tratamiento; pero no antes del día 7. Esto representó una razón más para desarrollar el protocolo e investigar la efectividad de ambos antivirales en días tempranos.
El objetivo principal del presente ensayo fue evaluar si el GCV era más efectivo en días tempranos (menos de 7 días) para lograr la restitución del epitelio corneal (curación) en la queratitis epitelial. Esto se logró midiendo el tamaño de la úlcera al día 1, 7, 10 y 14 de tratamiento. En la figura 1 se aprecian los resultados de estas observaciones, y a pesar de que el tamaño de la dendrita era mayor en el grupo de GCV antes de iniciar el tratamiento, la restitución del epitelio se llevó a cabo más rápido que en el grupo de ACV.
Las razones por la cuales se cree que sucede esto son 2. La primera es que el vehículo del GCV es carbómero, lo cual le confiere propiedades de gel. Esto en teoría tiene un tiempo de contacto mayor de la sustancia activa con la superficie ocular, por lo que se incrementa la biodisponibilidad del fármaco. La segunda razón es que el carbómero al ser un polímero hidrófilo de elevado peso molecular funciona como lubricante y humectante ocular, lo cual facilita la recuperación del epitelio corneal.
Por otra parte, el ACV tiene una baja solubilidad en soluciones acuosas por lo que las preparaciones oftálmicas necesariamente se fabrican en forma de ungüento utilizando el petrolato como vehículo19. A pesar de que es un antiviral altamente selectivo para ser activado solamente por la timidin-cinasa viral, lo cual le confiere una selectividad alta para las células infectadas, el uso tópico no fue favorecido debido a que el ungüento resultaba en visión borrosa al aplicarlo, además de que los pacientes no cubren adecuadamente la superficie corneal lo que limita su acción farmacológica. Adicionalmente, se conoce el efecto tóxico sobre el epitelio a largo plazo si se aplica de forma continua.
La visión borrosa postaplicación reportada por los pacientes va relacionada de igual manera con la composición del vehículo de ambos fármacos. Resulta evidente que el carbómero al ser más soluble y transparente causa una menor distorsión visual comparado con el ungüento que es opaco y espeso. Este factor puede influir en el cumplimiento del tratamiento, ya que los pacientes podrían no cumplir con la posología del fármaco por evitar estos síntomas.
En cuanto a la escala sintomática, observamos que para el lagrimeo, sensación de cuerpo extraño, fotofobia, visión borrosa y dolor, el GCV fue más efectivo en reducir los síntomas en días tempranos. La razón por la que se justifican estos resultados podría ser la curación más rápida con el GCV, enfocada no solo a la eliminación del virus, sino a la restitución de la superficie corneal con promotores de la epitelización como el carbómero. Por el contrario, para el prurito resultó igual que el ACV. En el desenlace al día 14 ambos grupos resultaron equivalentes en la resolución de los síntomas.
La elección del antiviral ideal depende de su efectividad contra el virus, los efectos tóxicos y la comodidad de uso para el paciente. Con relación a la toxicidad, el ACV, análogo de guanina, es activado solamente por la timidin-cinasa viral para detener la síntesis de ADN, lo cual le confiere una alta afinidad por las células infectadas, lo cual resulta en una menor toxicidad para el epitelio sano. Esta selectividad se logró gracias a la alteración de los grupos de carbono, lo cual hace que la ADN polimerasa de células no infectadas no se vea afectada por el ACV20.
El GCV, análogo nucleósido acíclico relacionado con el ACV, constituye un profármaco inhibidor potente de la replicación del HSV. También se activa por la timidin-cinasa viral para fosforilarse e inhibir la ADN polimerasa viral19. En Europa ha sido utilizado durante más de 15 años en el tratamiento de las formas epiteliales de queratitis, en México recientemente fue aprobado y distribuido para los mismo fines. Las ventajas farmacológicas del GCV es que es una molécula de menor tamaño, altamente lipofílica y con una afinidad celular alta, resultado de la estructura análoga con los nucleósidos endógenos, lo cual explica su alta difusión en el epitelio corneal20.
Respecto a la farmacología del GCV tópico, se desarrolló un estudio en conejos en donde se detectaron concentraciones del GCV en el humor acuoso después de 3h de haberlo aplicado 6 veces en la córnea; el nivel era dependiente de la dosis y frecuencia de aplicación21. Esto nos lleva a pensar en probables aplicaciones del GCV como tratamiento de la queratouveítis herpética o en terapias profilácticas en pacientes con queratoplastia por causas herpéticas, lo cual constituyen nuevos estudios de la presente línea de investigación. Asimismo, la actividad comprobada contra otros virus como los adenovirus20, Epstein-Barr21, y herpes zóster22 amplían el horizonte de aplicaciones clínicas de este fármaco. Deben realizarse ensayos clínicos aleatorizados en humanos para aumentar el nivel de evidencia de estas aplicaciones.
A diferencia del estudio publicado por Hoh et al.22, los pacientes se revisaron en menos de 7 días, se reportó menor visión borrosa postaplicación y no existieron efectos adversos relacionados con la toxicidad del medicamento. La curación en los casos de GCV antes del día 14 fue un resultado común en ambos estudios.
Finalmente, se puede destacar que la comodidad de uso y tolerancia de medicamentos tópicos de uso oftalmológico es un factor crucial para el cumplimiento del tratamiento prescrito. Este estudio demuestra cómo los pacientes toleraron el uso de un gel comparado con un ungüento. Aunque igualmente efectivos, este tipo de características podría favorecer la elección de un antiviral sobre otro.
ConclusionesEl GCV constituye una alternativa terapéutica efectiva para el tratamiento de la queratitis epitelial herpética. La curación en menor tiempo, la mejoría más rápida de los síntomas, la menor visión borrosa postaplicación y la presentación en gel constituyen ventajas frente al ACV. Es aconsejable aumentar el tamaño de la muestra en el presente estudio para que el nivel de evidencia pueda ser mayor.
Finalmente, se proponen nuevas líneas de investigación respecto al uso de este fármaco para evitar los efectos sistémicos de los antivirales orales.
FinanciamientoNo se obtuvo financiamiento por parte de compañías farmacéuticas para la realización del protocolo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.