Objetivo: Comparar los cambios en la morfometría corneal de pacientes operados de LASIK y LASEK, evaluados mediante microscopía confocal in vivo.
Método: Se realizó una investigación observacional, descriptiva, longitudinal y prospectiva. Se evaluaron 146 pacientes intervenidos con láser de excímeros para la corrección de ametropías por el autor, con las técnicas quirúrgicas: LASIK con microquerátomo pendular y LASEK, en el Hospital Abel Santamaría Cuadrado en Pinar del Río, Cuba, desde noviembre del 2010 a junio del 2011. La muestra quedó constituida por 134 pacientes, que cumplieron con los criterios de selección establecidos. Se formaron dos grupos: uno de 78 pacientes (151 ojos) operados con LASIK y otro de 56 pacientes (111 ojos) operados con LASEK. Se utilizaron métodos de estadística descriptiva, prueba T para muestras independientes, comparación de correlaciones y regresión lineal.
Resultados: Se obtuvo en el LASEK más rápida y total recuperación del plexo nervioso sub-basal, mayores valores de paquimetría, lecho corneal residual y densidad de queratocitos en el estroma corneal.
Conclusiones: La selección de la técnica quirúrgica LASEK posibilita una menor repercusión en la homeostasis corneal en cuanto a menor pérdida de queratocitos, mayor preservación del lecho corneal residual y recuperación del plexo nervioso sub-basal al año de la cirugía.
Objective: To compare corneal morphometrical changes observed between LASIK and LASEK surgical techniques, through in vivo confocal microscopy.
Method: An observational, descriptive, longitudinal and prospective investigation was carried out. 146 patients underwent excimer laser for myopia correction using the surgical techniques: LASIK with pendulous microkeratome and LASEK, it took place in Abel Santamaría Hospital in Cuba from November 2010 to June 2011. The sample was constituted by the 134 patients that complete the established selection criteria. They were divided into two groups: a group of 78 patients (151 eyes) operated with LASIK and another group of 56 patients (111 eyes) operated with LASEK. Methods of descriptive statistics were used, T test for independent samples, comparison of correlations and lineal regression.
Results: A quicker and faster total recovery of the sub-basal nerves was obtained with the LASEK surgical technique, as well as thicker paquimetry values, residual corneal bed and higher keratocyte density in the corneal stroma.
Conclusions: The selection of the surgical technique LASEK for the could facilitate a smaller repercussion in the corneal homeostasis and smaller keratocyte loss, bigger preservation of the residual corneal bed and a successful recovery of the sub-basal nerves at the year of the surgery.
• Introducción
Actualmente, se ha demostrado la eficacia y seguridad de varios tipos de cirugías refractivas,1-4 destacándose el uso del láser de excímeros como herramienta de alta precisión y seguridad para dicho esculpido (aplanamiento), desarrollado por Srinivasan y publicado por Stephen Trokel entre otros, del Centro Médico de la Universidad de Columbia (E.E.U.U.) en 1983.5-8
El láser de excímeros utiliza pulsos controlados de energía de luz ultravioleta lejano de 193 nm de longitud de onda, para aplicar ablación sobre tejido estromal, produciendo un patrón de ablación refractiva y generando nuevos radios de curvatura.3,5 El término "excimer" deriva de "dímero excitado", es una forma química diatómica singular que sólo existe en estado excitado y durante un tiempo minúsculo. Los pulsos de emisión láser durante la cirugía, se limitan a decenas de nanosegundos.9-11 Uno de los átomos del excímero corresponde siempre a un gas noble (argón, kriptón o xenón), mientras que el otro debe ser un halógeno (flúor, cloro, bromo o yodo).6,12,13
Ambos elementos están en concentraciones muy pequeñas en una mezcla de helio, y se combinan para formar un compuesto inestable que rápidamente se disocia y libera la energía en forma de luz ultravioleta. La fotoablación se produce debido a que cada fotón de luz ultravioleta de 193 nm posee 6.4 eV (electrón volt), que es suficiente para separar las uniones carbono-carbono de 3.5 eV, es decir, que la fotoablación se basa en la ruptura de uniones moleculares.3,6,7,14 Debido a que la energía de los fotones se concentra en un punto focal de una fina capa de tejido corneal, se produce una intensa liberación de energía y presión que eyecta en forma perpendicular a la superficie, los fragmentos moleculares a una velocidad de aproximadamente 1 500 m/s, generándose al mismo tiempo ondas de choque que se propagan a través del ojo produciendo un sonido característico.3,5,7,15
El pulso del láser dura 15 ns, los tejidos son removidos casi sin dejar residuos, con un mínimo daño térmico (daño colateral del tejido circundante), obteniéndose superficies de ablación muy uniformes. La emisión de pulsos de altísima potencia inferiores al microsegundo, lo convierte en un bisturí perfecto que deja los límites de corte intactos.12 El rayo láser ultravioleta aplicado en el estroma corneal rompe los enlaces covalentes de las proteínas sólo en el tejido atravesado por el rayo, además con ajuste micrométrico de la profundidad deseada.11,16 El corte responde a una fotoablación con eliminación de tejido corneal, penetrando unos 14 μm por cada dioptría que interesa eliminar, provocando cambios anatómicos que modifican las dioptrías necesarias para conseguir la visión emétrope.3,7,15
Independientemente de los altos estándares de visión alcanzados con esta novedosa tecnología, en la última década se han investigado continuamente los cambios morfométricos corneales posteriores a este procedimiento, como una forma de evaluar la seguridad y efectividad de los mismos. Motivados por estos aspectos la actual investigación tiene como objetivo comparar los cambios morfométricos LASIK y LASEK, según las modificaciones obtenidas por estudio in vivo en microscopía confocal de la córnea.
• Método
Se realizó una investigación longitudinal y prospectiva. El universo de estudio estuvo constituido por todos los pacientes (N=146) que fueron intervenidos con láser de excímeros para la corrección de ametropías por el autor, con las técnicas quirúrgicas: LASIK y LASEK, en el Hospital Abel Santamaría Cuadrado en Pinar del Río, Cuba, de noviembre de 2010 a junio de 2011. La muestra quedó constituida por 134 pacientes que cumplieron con los criterios de selección establecidos. Se formaron dos grupos: uno de 78 pacientes (151 ojos) operados con LASIK y otro de 56 pacientes (111 ojos) operados con LASEK.
Criterios de selección
• Criterios de inclusión:
- Edad mayor de 20 años con estabilidad refractiva de dos años.
- Defecto refractivo: miopía hasta 8 dioptrías, astigmatismo hasta 4 dioptrías, astigmatismo miópico compuesto con menos de 8 dioptrías (en suma algebraica de esfera y cilindro).
- Agudeza visual sin corrección de 0.5 o menos.
- Agudeza visual con corrección en el ojo de menor visión superior a 0.3.
- Lecho corneal residual programado mayor de 300 μm en LASIK y mayor de 400 μm en LASEK.
- Queratometría media inicial y programada final entre 36 y 48 dioptrías.
- Paquimetría preoperatoria superior a 500 μm.
• Criterios de exclusión:
Generales:
- Pacientes que no cooperaron en la realización de la microscopía confocal.
- Pacientes que no asistieron a alguna de las consultas programadas en el estudio.
- Pacientes que no otorgaron su consentimiento para participar en el estudio.
- Enfermedades sistémicas como diabetes mellitus, epilepsia, enfermedades del colágeno, inmunodeprimidos, trastornos psiquiátricos, síndrome de Marfán, Ehlers Danlos, psoriasis, alergias.
- Infecciones sistémicas.
- Embarazo.
- Puerperio (hasta seis meses).
Oculares:
- Ojo único.
- Alteración de los anexos oculares y de la lágrima (infección, inflamación, ojo seco).
- Configuraciones orbitarias anormales (órbitas pequeñas o profundas, hendidura palpebral pequeña, enoftalmos, arco superciliar prominente).
- Enfermedad corneal previa (queratitis por herpes simple, zóster, ectasia corneal confirmada o en sospecha, erosiones corneales recidivantes, leucomas, pannus, distrofias, degeneraciones).
- Estrabismo o cirugía previa del mismo.
- Cirugía refractiva corneal anterior.
- Glaucoma o hipertensión ocular.
- Esclerosis del cristalino o catarata.
- Uveítis.
- Enfermedades de la retina (desgarros, historia de desprendimiento de retina, vitrectomía, degeneración macular, retinosis pigmentaria).
Técnica quirúrgica y seguimiento de los pacientes
Todos los casos fueron operados por el autor de la investigación. La planificación de la cirugía se realizó con el programa ORK-CAM para tratamientos asféricos. El LASIK con microquerátomo pendular, programación de grosor del flap de 160 μm y lecho estromal residual mayor de 300 μm. El LASEK con mitomicina C y lecho estromal residual mayor de 400 μm. En ambas técnicas las zonas ópticas de 6.50 mm en todos los casos. El tratamiento se realizó con el ESIRIS (Schwind- Alemania), el cual posee las siguientes características: equipo de excimer láser, diámetro del spot 0.8 mm, perfil de ablación gaussiano, tasa de repetición 200 Hz, eyetracking activo de alta velocidad (328 Hz), distancia de trabajo 29.5 cm, tubo láser cerámico y protección del sistema de transmisión del láser por compresión de aire. Las cirugías se efectuaron con valores de temperatura de 18°C-22°C, humedad relativa de 38%-42% y ablación por capas entre 0.530 y 0.580. Se operaron los dos ojos el mismo día. No hubo complicaciones transoperatorias.
Se siguió el siguiente protocolo quirúrgico:
• Preoperatorio: Medidas de higiene palpebral. Cloranfenicol (colirio oftálmico) una gota cada cuatro horas, desde 24 horas antes de la cirugía.
• Transoperatorio:
LASIK
Instilación de anestésico tópico una gota en el ojo a operar. Aislamiento del área quirúrgica con paño hendido y colocación de blefaróstato, exponiendo el globo ocular. Lavado con solución salina balanceada en fondos de saco conjuntivales. Colocación de anillo de succión 9.0 mm en córneas con curvatura superior o igual a 43.0 dioptrías, y anillo de succión 10.0 mm en córneas inferiores a 43.0 dioptrías de curvatura. Se realizó la succión con valores entre 609 y 612 mmHg. Corte del colgajo con microquerátomo pendular (Carriazo), ubicación de la bisagra nasal. Secado debajo y anterior a la bisagra con microesponja. Enfoque y aplicación del láser con protección de la bisagra. Lavado con solución salina balanceada de la zona tratada y la cara estromal del colgajo. Recolocación del colgajo en su posición original, procediendo a la limpieza de partículas o residuos que puedan permanecer en el lecho. Secado de los márgenes con ayuda de microesponjas y comprobación de la adhesión del flap. Instilación de una gota de cloranfenicol, prednisolona y lubricantes en fondo de saco inferior. Se realizó biomicroscopía anterior en el quirófano con el objetivo de precisar adhesión y regularidad del colgajo, así como la ausencia de cuerpos extraños en la interfase.
LASEK
Instilación de anestésico tópico una gota en el ojo a operar. Aislamiento del área quirúrgica con campo quirúrgico estéril y colocación de blefarostato exponiendo el globo ocular. Lavado con solución salina balanceada en fondos de saco conjuntivales. Aplicación de iodopovidona al 5% en fondos de sacos conjuntivales por tres minutos. Colocación de contenedor de alcohol de 8.5 mm con centro en pupila, previo marcado corneal durante 30 segundos. Lavado profuso con solución salina balanceada. Separación del epitelio corneal desde los bordes de marcado, excepto en córnea superior. Enfoque y aplicación del láser. Colocación de microesponja con mitomicina C durante 20 segundos en lecho estromal. Lavado profuso con solución salina balanceada. Recolocación del epitelio corneal. Colocación de lente de contacto blando. Instilación de una gota de cloranfenicol, prednisolona y lubricantes en fondo de saco inferior.
El tratamiento posoperatorio consistió en: lubricantes una gota cada dos horas, cloranfenicol una gota cada horas horas, prednisolona una gota cada 12 horas. En el LASEK se retiró el lente de contacto terapeútico a los siete días del procedimiento.
Se realizaron consultas a las 24 horas, siete días, al mes, tres meses, seis meses y al año posterior a la cirugía. Se realizaron los exámenes programados por consulta (agudeza visual sin corrección, topografía corneal, refracción dinámica). No existieron complicaciones posoperatorias hasta el año de la cirugía. La agudeza visual sin corrección fue la programada previamente, y permaneció sin variaciones durante todo el año en todos los casos.
Técnica de microscopía confocal de la córnea
Se utilizó el microscopio confocal ConfoScan 4® de NIDEK para la obtención y estudio de las imágenes in vivo del tejido corneal. Se acopló el anillo Z para la fijación del globo ocular con el lente 40x. Se programó en modo escaneo automático, con fijación central, velocidad de adquisición de la imagen a 25 imágenes por segundo, magnificación de 500x, resolución lateral de 0.6 μm/pixel, con 350 imágenes por escaneo, distancia de trabajo de 1.98 mm.
Se instiló lidocaína y posteriormente ácido poliacrílico (gel oftálmico), como medio de acoplamiento entre la córnea y el anillo Z. Se avanzó el lente hasta hacer contactar el anillo con la sustancia de acoplamiento. El lente objetivo fue alineado con el centro de la córnea hasta observar las primeras imágenes de epitelio corneal. Las imágenes digitales obtenidas fueron capturadas en modo automático y grabadas en computadora Pentium 4 con ambiente Windows® 2000, para su posterior análisis. Antes y después de cada examen se realizó la limpieza del lente objetivo con alcohol isopropílico.
Cada imagen obtenida se encuentra separada de la imagen adyacente por 4 μm, una profundidad de campo de 25 μm, nivel de intensidad de 0 a 255, presión del anillo Z de 20%. Todas las tomas pertenecen a los 4 mm centrales de la córnea. Ninguno de los sujetos experimentó síntomas visuales o complicaciones corneales durante o posterior al examen.
Se realizó microscopía confocal de la córnea en el preoperatorio, a los siete días, un mes, tres, seis meses y al año de la cirugía. En los pacientes operados por LASEK no se realizó microscopía a los siete días porque coincidió con la retirada del lente de contacto, aspecto que afecta el resultado del examen. Se realizaron los exámenes necesarios en cada paciente hasta obtener, por microscopía confocal cuantitativa de enfoque completo (curva CMTF), escaneos e imágenes de máxima estabilidad en cuanto a presión aplicada por el anillo Z con variaciones inferiores al 10%, representado por la curva amarilla.
Las imágenes seleccionadas no fueron modificadas en brillo y contraste, fueron codificadas para realizar el análisis sin conocer el momento posoperatorio, la magnitud de la ametropía tratada y la técnica quirúrgica utilizada.
Fueron definidas las siguientes imágenes:
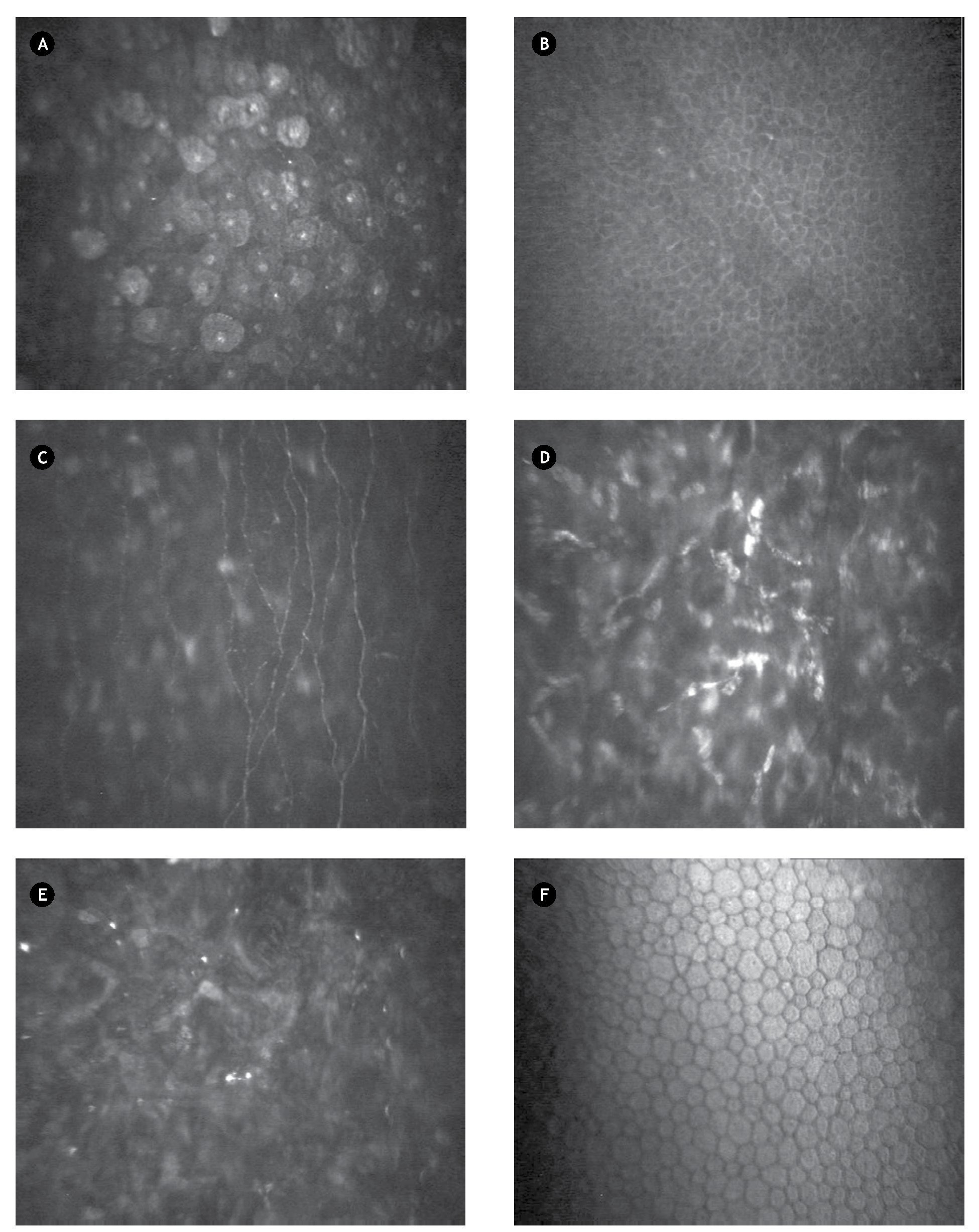
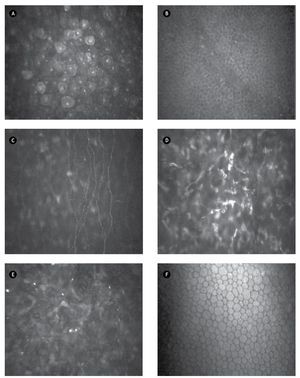
- Imagen de epitelio corneal apical: definida como capa de células poligonales de bordes definidos, con núcleo brillante que resalta sobre el citoplasma homogéneo (Figura 1A).
- Imagen de epitelio corneal basal: definida como capa de células con citoplasma homogéneo más oscuro, que carecen de núcleo y presentan bordes definidos (Figura 1B).
- Imagen de plexo nervioso sub-basal: definida con presencia de fibras nerviosas que contrastan sobre el fondo oscuro, finas, brillantes, distribuidas de forma paralela u oblicua con diversas bifurcaciones que se conectan entre sí, ubicadas entre el epitelio basal y la membrana de Bowman (Figura 1C).
- Imagen de estroma corneal: definida por la presencia de cuerpos ovales, alargados y brillantes (presumiblemente núcleos de queratocitos), que contrastan sobre el fondo oscuro (Figura 1D).
- Imagen de interfase quirúrgica: definida por la presencia de cuerpos brillantes puntiformes que resaltan sobre el fondo oscuro, en pacientes operados por LASIK (Figura 1E).
- Imagen de endotelio corneal: definida por células hexagonales de bordes definidos, anucleadas, con citoplasma homogéneo (Figura 1F).
•Figura 1. Microscopía confocal a los tres meses de LASIK. A) Epitelio corneal apical. B) Epitelio corneal basal. C) Plexo nervioso sub-basal. D) Estroma corneal. E) Interfase quirúrgica. F) Endotelio corneal.
- Imagen de haze corneal: definido por imagen de estroma corneal donde no pueden ser definidos los límites de los queratocitos, con mayor brillo que el resto de las imágenes estromales y que coincide con picos en la curva CMTF.
Métodos de recolección y análisis de la información
Los cálculos obtenidos de las variables fueron incorporados a una tabla de datos en SPSS versión 11.5. Se utilizaron métodos de estadística descriptiva expresados en frecuencias absolutas, frecuencias relativas y medias. Se realizó la comparación de los resultados de ambos grupos de estudio a través de la prueba T para muestras independientes, además se realizó la comparación de los niveles de correlación obtenidos en ambas técnicas quirúrgicas. Los resultados fueron presentados en tablas y gráficos.
• Resultados
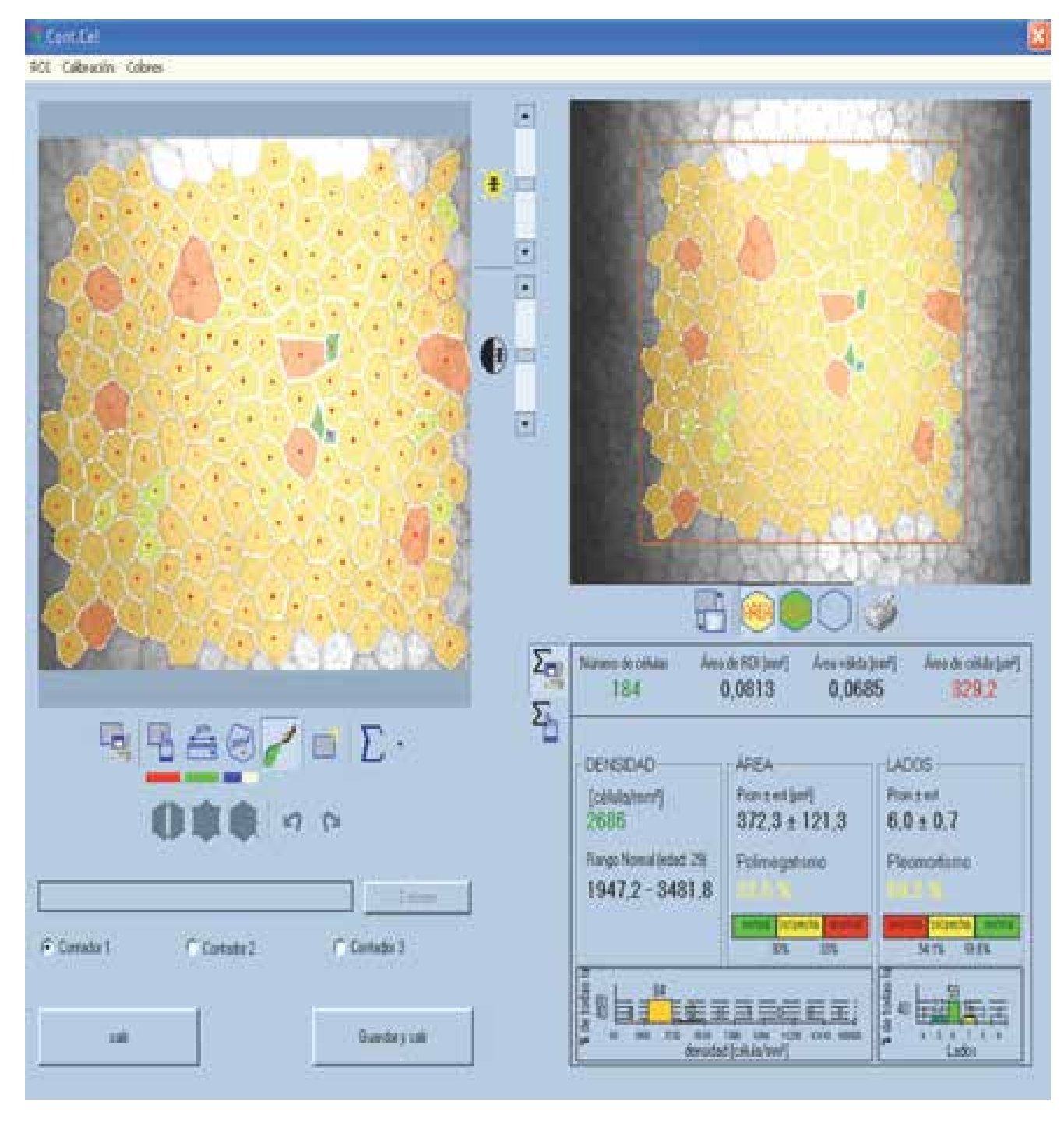
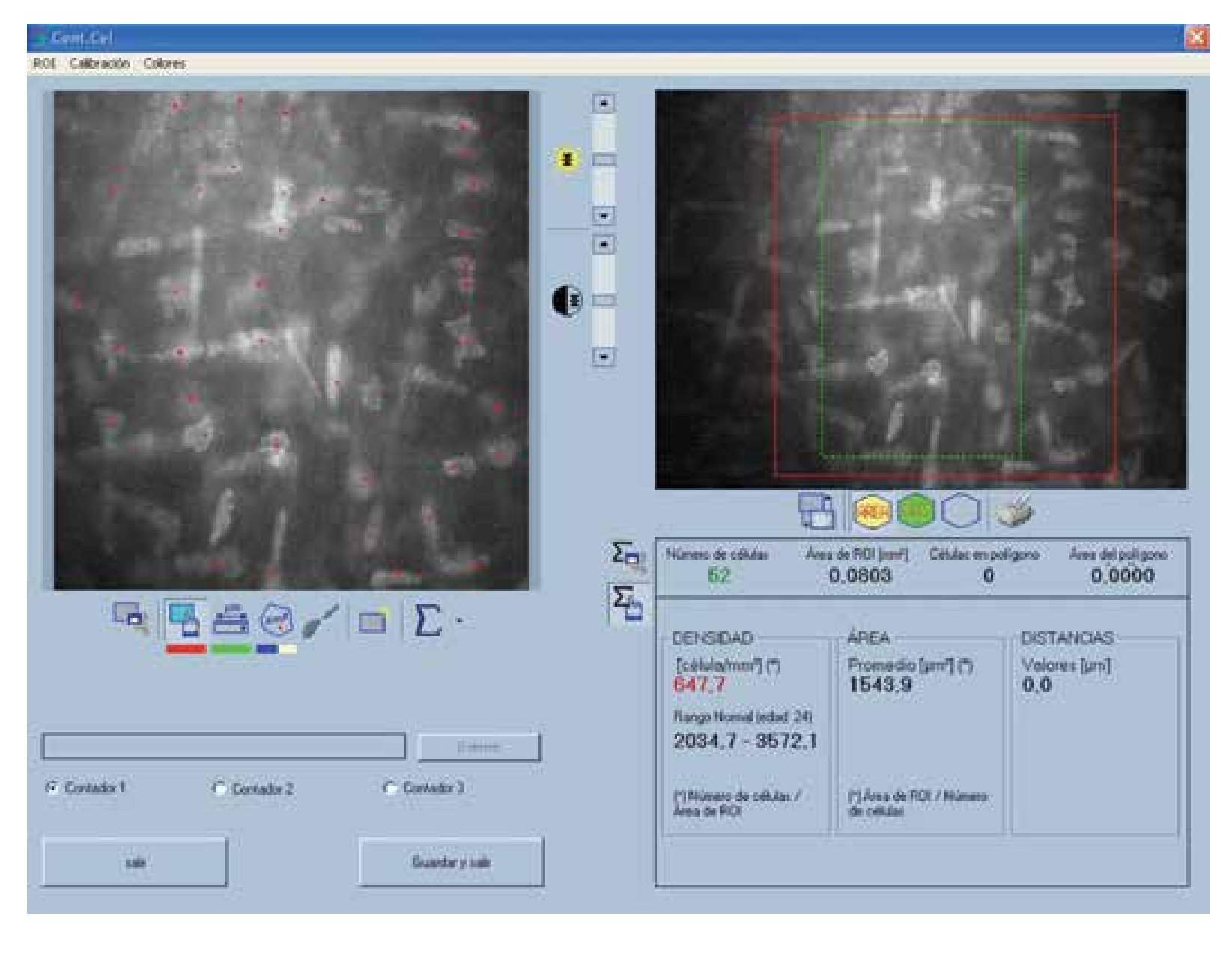
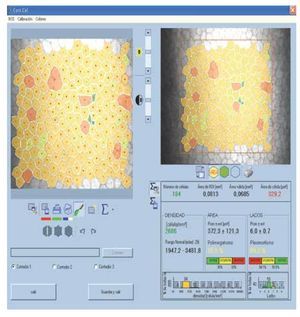
En cuanto a la densidad de células epiteliales, no se obtuvieron diferencias significativas entre ambos grupos de estudio en la densidad celular apical y la basal. Los resultados obtenidos del estudio endotelial por ambas técnicas no mostraron diferencias estadísticamente significativas, en cuanto a densidad celular endotelial, pleomorfismo y polimegatismo (p=0.000; a=0.05) (Figura 2).
•Figura 2. Cálculo de variables endoteliales. En la porción superior derecha se observa la selección del área, en la porción superior izquierda el marcado automático de las células. En la porción inferior se observan los valores obtenidos de densidad celular endotelial, pleomorfismo y polimegatismo.
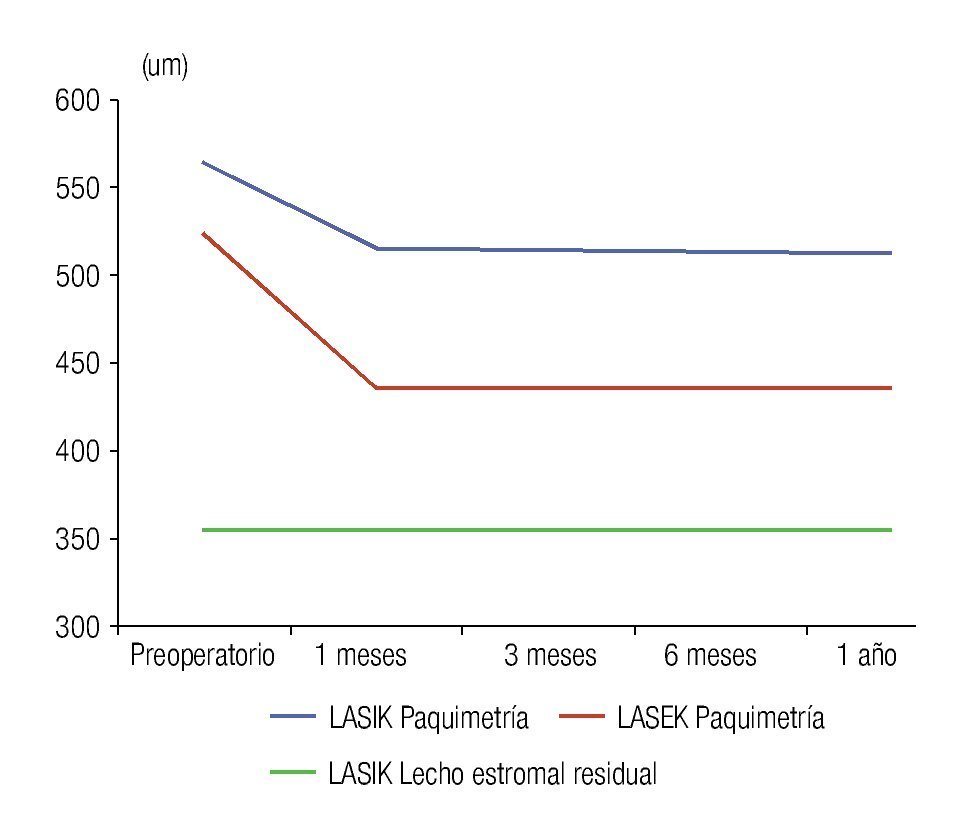
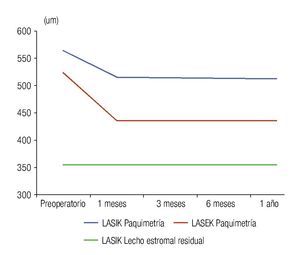
Los valores obtenidos de grosor del epitelio corneal no difieren de forma significativa entre ambas técnicas quirúrgicas, sin embargo, los valores de paquimetría corneal difieren durante todo el posoperatorio hasta el año de la cirugía; los niveles de paquimetría corneal en el LASIK son superiores desde el preoperatorio, debido a que para esta técnica quirúrgica, en su mayoría, fueron seleccionados los pacientes con paquimetrías superiores; los pacientes con paquimetrías cercanas a 500 μm (límite del estudio) formaron el grupo de LASEK. La Figura 3 muestra las curvas de paquimetría de cada técnica quirúrgica, donde existe una disminución significativa de la variable después de la cirugía por la pérdida de estroma corneal ablacionado en ambas técnicas quirúrgicas. Además, se incorpora la curva de lecho estromal residual en el LASIK, el valor de esta variable en el LASEK coincide con la paquimetría, debido a que toda la córnea se comporta como lecho estromal residual porque no existe corte del tejido, por lo que se hace pertinente la comparación entre la paquimetría en el LASEK con el lecho estromal residual en el LASIK, arrojando diferencias estadísticamente significativas en todo momento del posoperatorio. Se obtuvo que los pacientes intervenidos con LASEK poseen mayor lecho estromal residual que los pacientes operados con LASIK, con diferencias estadísticamente significativas.
•Figura 3. Paquimetría corneal y lecho estromal residual en ambos grupos de estudio.
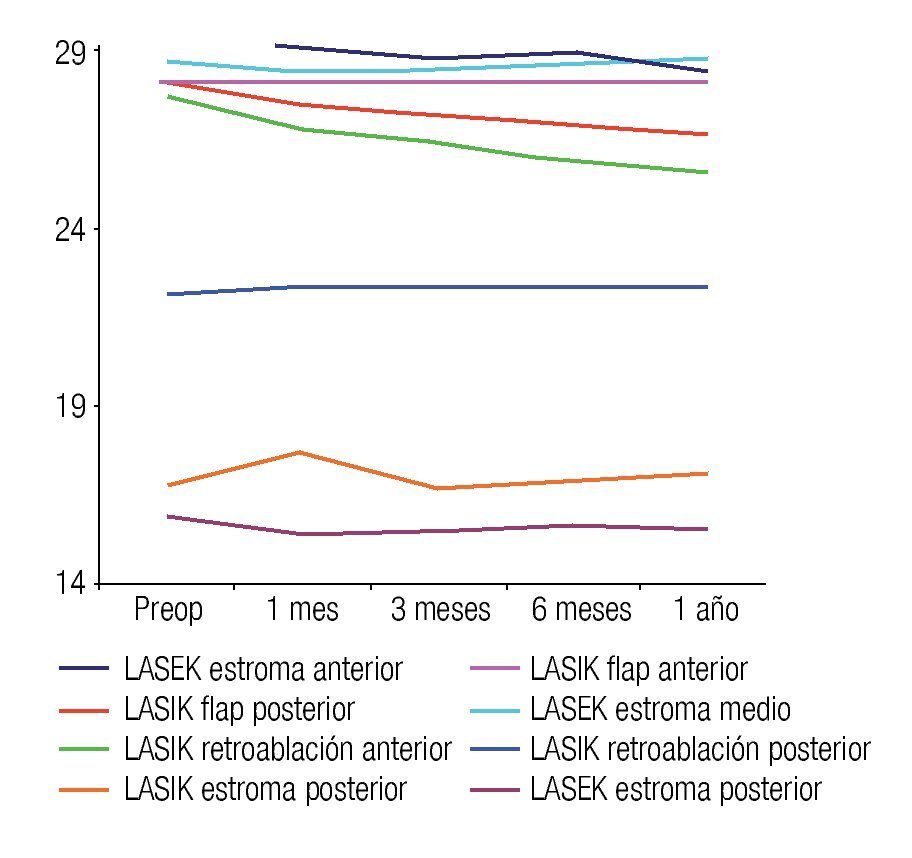
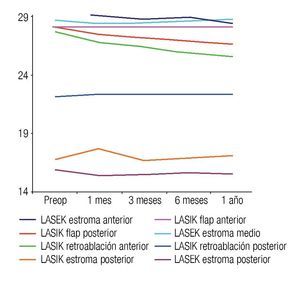
La densidad de queratocitos por subcapas estromales se muestra en la Figura 4, donde se observan ocho curvas, cinco de ellas representan las subcapas estromales analizadas en LASIK y el resto, las subcapas estromales analizadas en pacientes operados con LASEK. La densidad de queratocitos obtenida posterior a LASEK en estroma anterior y medio, es significativamente superior a la densidad de queratocitos en ambas regiones del flap y zonas de retroablación en pacientes operados con LASIK, esta diferencia se mantiene hasta el año de la cirugía (p=0.000; a=0.05). La densidad de queratocitos en estroma posterior no arrojó diferencias significativas entre ambas técnicas quirúrgicas. En pacientes operados de LASEK fue superior esta variable en todo momento del estudio (Figura 5).
•Figura 4. Densidad de queratocitos por subcapas estromales en ambos grupos de estudio.
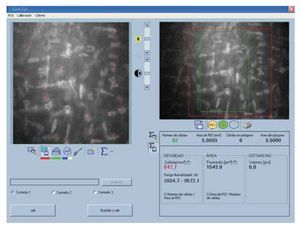
•Figura 5. Cálculo de la densidad de queratocitos. En la porción superior derecha se observa la selección del área, en la porción superior izquierda el marcado de cada queratocito. El primer cociente obtenido de densidad es el que se encuentra con letras rojas. Este valor se divide por la profundidad de campo efectiva del equipo: 25, para obtener la densidad en cél/mm3.
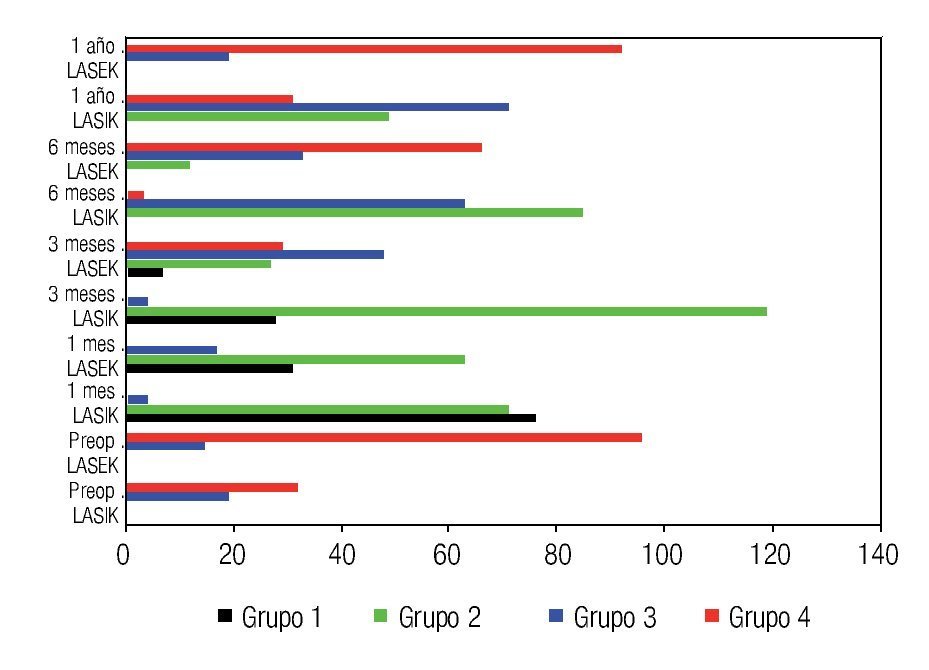
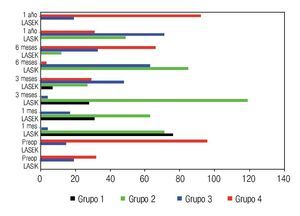
La Figura 6 muestra las características del plexo nervioso sub-basal en ambas técnicas quirúrgicas. En el preoperatorio se obtuvieron en toda la muestra características de los grupos tres y cuatro, sin embargo, al mes del tratamiento existen pacientes con ausencia de plexo nervioso sub-basal con predominio significativo en operados con LASIK (grupo uno), además en esta etapa del posoperatorio no hay pacientes con características del grupo cuatro, es decir, hay una desaparición brusca posterior al tratamiento de las características óptimas del plexo nervioso sub-basal en ambas técnicas quirúrgicas.
•Figura 6. Características del plexo nervioso sub-basal de ambos grupos de estudio.
Sin embargo, a los tres meses de la intervención ya se observa en pacientes operados con LASEK, un inicio de la recuperación del plexo nervioso sub-basal explicado por la presencia en esta etapa de pacientes con características del grupo cuatro del plexo, sin embargo en pacientes operados con LASIK el inicio de la recuperación se retarda a los seis meses del posoperatorio, donde la mayoría de los pacientes se encuentran en los grupos dos y tres de desarrollo del plexo nervioso. Al año de la cirugía, los pacientes operados con LASEK se encuentran en los grupos tres y cuatro de características del plexo, mostrando una rápida y total recuperación con respecto a niveles preoperatorios; sin embargo los pacientes operados con LASIK se encuentran distribuidos en los grupos dos, tres y cuatro, al año posterior a LASIK no existe una recuperación del plexo nervioso sub-basal comparado con niveles preoperatorios. No se obtuvo correlación entre las características del plexo nervioso y la magnitud de la ametropía tratada, en ambas técnicas quirúrgicas.
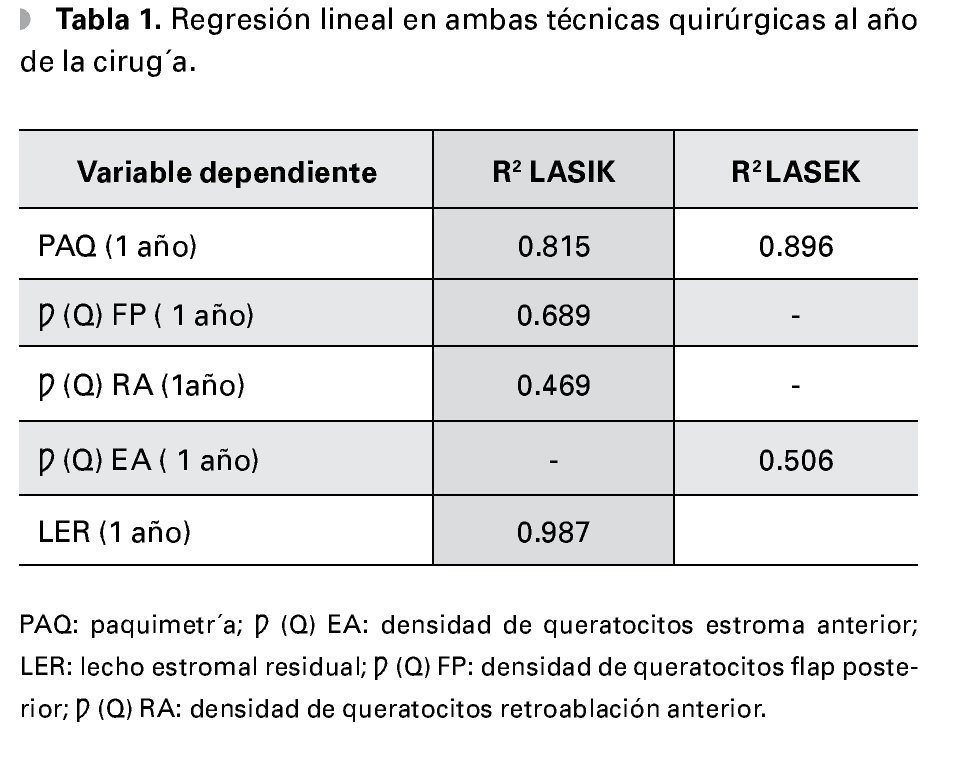
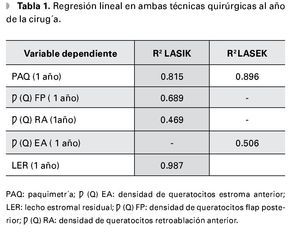
En cuanto al análisis de regresión lineal en ambas técnicas quirúrgicas, se obtienen valores elevados de R2 como muestra la Tabla 1. En pacientes operados por la técnica LASEK, las variaciones de paquimetría corneal al año de la cirugía son más dependientes de la paquimetría preoperatoria y la magnitud de la ametropía tratada que en pacientes operados con LASIK.
La disminución de la densidad de queratocitos al año de la cirugía es más dependiente de su valor preoperatorio y de la ametropía tratada, en pacientes operados con la técnica LASIK en la subcapa flap posterior. Teniendo en cuenta que el valor del lecho estromal residual en el LASEK es igual al valor de paquimetría al año de la cirugía, podemos afirmar comparando valores de R2 que las variaciones del lecho estromal residual al año de LASIK son más dependientes del valor programado en el preoperatorio y de la magnitud de la ametropía tratada, que en pacientes operados con LASEK.
• Discusión
El epitelio corneal constituye una capa continua de membranas plasmáticas debido a la unión de sus células por zónulas occludens. Las drogas lipofílicas traspasan el epitelio con facilidad, ya que sus membranas plasmáticas están compuestas por fosfolípidos.17 Debido a que el epitelio corneal posee más de las dos terceras partes de las membranas plasmáticas de la córnea, este es el lugar de mayor depósito para drogas lipofílicas. Además en el grosor epitelial también influye la frecuencia de aplicación de medicamentos oftalmológicos en el primer mes de posoperatorio que refuerza el factor farmacológico, presente en la técnica LASIK donde el epitelio está íntegro a las 24 horas de procedimiento.
Los mecanismos de regulación corneal permiten la homeostasis corneal y por tanto, la disminución de las consecuencias producidas por los factores mencionados, fenómeno constatado por la disminución paulatina del grosor epitelial hasta el año de la cirugía, con niveles similares a los del preoperatorio en LASIK. Además, los pacientes de este estudio mantuvieron constante la agudeza visual sin corrección, independientemente de los cambios de grosor epitelial durante el posoperatorio, aspecto que evidencia la no influencia de estas modificaciones en el resultado visual.
Posterior a LASEK, el epitelio corneal comienza un proceso de cicatrización durante siete días, momento en el que se realiza el retiro del lente de contacto. En este estudio la primera medición del grosor epitelial se realizó al mes de tratamiento, donde los valores obtenidos son similares a los del preoperatorio, hasta el año de la cirugía el epitelio corneal mantuvo niveles similares de grosor.
La disminución de la paquimetría en el posoperatorio obedece a la pérdida del tejido estromal central, que se produce en vistas a lograr el efecto refractivo deseado.18-21 La correlación directa negativa con la magnitud de la ametropía corresponde con lo expresado por Munnerlyn, en cuanto a profundidad de la ablación y su relación con esta variable.8,16,22
Los valores del lecho corneal residual son superiores a 300 μm en LASIK y 400 μm en LASEK, valor protocolizado en Cuba en vistas a prevenir la seguridad del procedimiento y la ectasia corneal posterior a este tratamiento, una de las complicaciones más temidas de esta cirugía.13,23-25 No existen diferencias significativas entre el grosor del lecho programado y el obtenido al año. Considero que la microscopía confocal de la córnea permite la medición óptima de esta variable, con mayor exactitud que los métodos ultrasónicos, su seguimiento y comprobación de estabilidad en el tiempo.
El análisis de regresión lineal adquiere mayor valor clínico debido a que los valores paquimétricos obtenidos se realizan en el paciente con un mayor valor de exactitud, que las técnicas utilizadas habitualmente de paquimetría ultrasónica, los valores obtenidos in vivo a través de la microscopía posibilitan una exactitud casi perfecta de los valores reales, se analiza a cada paciente de forma más exacta con elevada confiabilidad de predictibilidad de parámetros morfológicos esperados después del año de la cirugía.
Considero que la ausencia de corte lamelar influye en que posterior a LASEK, se recuperen de forma más rápida las características preoperatorias del plexo nervioso sub-basal, esta recuperación es total al año de la cirugía.26-29 La profundidad de la ablación, la cantidad de tejido removido en el estroma y la profundidad de daño a los nervios estromales se encuentran estrechamente relacionados.30,31 La reinervación en córneas indica que, la inervación epitelial es restaurada sólo si existe una mínima regeneración neural en el estroma.30,32-36
Las diferencias de densidad obtenida entre las subcapas estromales están dadas, en primer lugar, por la variabilidad morfológica intrínseca del estroma corneal. Los queratocitos de la región anterior y media del estroma tienen algunas diferencias morfológicas, además producen diferente cantidad de queratán sulfato y dermatán sulfato.37,38 Las primeras 100 μm del estroma corneal posteriores a la membrana de Bowman contienen desde el punto de vista morfológico distintas subpoblaciones de queratocitos,39 con una apariencia granular y procesos de extensión celular citoplasmática.26,40-42
Estudios en humanos y conejos ilustran mayor densidad celular en el estroma anterior comparado con el estroma posterior. En segundo lugar, el efecto fotoablativo en las subcapas flap anterior, retroablación posterior, estroma posterior y predescemético es mínimo o inexistente, por lo que la disminución de queratocitos en estas subcapas es menor.43-45
Las diferencias entre los autores pueden estar relacionadas con varios factores. En la precisión de la medición influyen parámetros ópticos del instrumento para grabar las imágenes del estroma corneal, como los métodos usados para identificar y contar células en estas imágenes. La densidad celular determinada en diferentes estudios con diversos instrumentos puede ser confrontada solamente, si los instrumentos comparados entre sí son calibrados.46 Además, el núcleo del queratocito no puede ser distinguido de otros objetos con brillo y contraste similar.47 El programa identifica objetos brillantes y selecciona los que representen núcleos celulares, los criterios de selección del programa se basan en el estudio de córneas normales.48 Previas evaluaciones estiman en córneas normales una variabilidad aproximada de 7.8% interobservadores.26,35,49
La correlación directa negativa entre la disminución de la densidad de queratocitos y la mayor magnitud de ametropía a tratar, es evidente en ambas técnicas quirúrgicas. Mientras mayor es la profundidad de la ablación, mayor es la cantidad de tejido estromal removido y el factor fotoablativo es superior en tiempo de acción sobre el estroma corneal, con sus consecuencias histológicas.
El factor tiempo de acción fotoablativo se relaciona con la frecuencia de aplicación de los disparos, específicamente con los cambios de hidratación del estroma corneal que ocurren con el tiempo. Los tratamientos más prolongados pueden afectar adversamente la hidratación tisular. El tiempo de acción fotoablativo es inversamente proporcional al nivel de hidratación corneal, la córnea pierde hidratación a medida que avanza el tiempo de aplicación del láser, por lo que más tejido corneal es removido, aspecto que justifica un mayor efecto fotoablativo sobre la población queratocitaria en mayores magnitudes de ametropías tratadas y por tanto, influye la disminución de la densidad de esta línea celular.19,26,50
La significación clínica de esta pérdida gradual de queratocitos es desconocida, como también lo es la densidad necesaria de estas células para mantener la transparencia corneal.49 El número mínimo necesario de queratocitos para mantener la salud corneal es desconocido, particularmente en el estroma anterior donde la densidad es mayor.47 Conocer la densidad de queratocitos es importante para entender cómo es el comportamiento de estas células productoras del colágeno y los proteoglicanos necesarios para mantener el tejido corneal, su deficiencia durante años pudiera afectar la transparencia y curvatura corneal, la importancia de su estudio antes y después de intervenciones quirúrgicas corneales es un elemento que adquiere cada vez mayor importancia.
En pacientes cubanos donde hemos constatado la disminución de la densidad de queratocitos, es un elemento de seguridad de la técnica quirúrgica aplicada, la no modificación de esta variable en subcapas más profundas del estroma que garantizan el mantenimiento de la salud corneal a largo plazo. Considero que la drástica disminución de la población queratocitaria en otros estudios a niveles profundos del estroma, se deben a la mayor magnitud de ametropías tratadas con el consiguiente aumento de la profundidad de la ablación.
Si bien no se han reportado cambios corneales y en la agudeza visual posoperatoria cuando existe disminución de la densidad queratocitaria, la menor afectación posible de la homeostasis estromal debe convertirse en premisa esencial de todo cirujano de defectos refractivos en vistas a propiciar de por vida una óptima agudeza visual y función corneal, que depende entre otros factores, de la integridad estructural y funcional de la célula fundamental del estroma corneal: el queratocito. Por lo que en pacientes con magnitudes de ametropías cercanas a 8 dioptrías, independientemente del valor de paquimetría corneal inicial, es prudente seleccionar un tratamiento de superficie con menor repercusión histológica en subcapas inferiores del estroma corneal y donde hemos constatado que la disminución de queratocitos es menor.
En pacientes cubanos no existieron diferencias significativas en cuanto a variación de densidad celular endotelial, pleomorfismo y polimegatismo. Las variaciones existentes entre diferentes autores respecto al tema se deben al espectro de defectos refractivos tratados, que genera respuestas histológicas variables de acuerdo a la cantidad de micras ablacionadas y por tanto, a la profundidad de la ablación. Igualmente, respetar el lecho corneal residual superior a 300 μm en LASIK y 400 μm en LASEK, atenúa el efecto del láser de excímeros en el endotelio corneal, ya que la ablación se realiza a menor profundidad. Las ecuaciones de regresión lineal que relacionan las variables histológicas con la magnitud de la ametropía tratada, son de vital importancia. La predicción del valor de paquimetría real al año de cirugía refractiva corneal, a partir de la magnitud de la ametropía tratada y de la paquimetría preoperatoria medida por microscopía, posibilitan una selección óptima de los pacientes tributarios a esta cirugía, factor determinante en el éxito quirúrgico de estos procederes y en su seguridad a largo plazo. Además, la obtención de este valor paquimétrico con un año de antelación asegura una paquimetría óptima futura posterior a tratamiento, incluso la posibilidad de un nuevo tratamiento refractivo de ser necesario. Por otra parte, el conocimiento de esta variable a partir de la paquimetría in vivo preoperatoria influye en la selección del tipo de tratamiento a utilizar, donde la elección de tratamiento con láser de superficie pudiera garantizar mayor paquimetría predictiva al año.
• Conclusiones
En conclusión, la técnica quirúrgica LASEK fue superior, en cuanto a mayor rapidez y total recuperación del plexo nervioso sub-basal, mayores valores de paquimetría, lecho corneal residual y densidad de queratocitos en el estroma corneal. La selección de la técnica quirúrgica LASEK para tratamiento de ametropías elevadas, posibilita una menor repercusión en la homeostasis corneal en cuanto a menor pérdida de queratocitos, mayor preservación del lecho corneal residual y recuperación del plexo nervioso sub-basal al año de la cirugía.
• Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
• Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Eduardo Rojas Álvarez.
Polvorín 158 altos, Pinar del Río, Cuba.
Teléfono: 727 076.
Correo electrónico: dr_erojas@princesa.pri.sld.cu