Presentamos 4 casos de enfermedad de Stargardt/fundus flavimaculatus y exponemos algunas consideraciones acerca del diagnóstico y evolución de esta distrofia retiniana. La angiografía fluoresceínica ha servido tradicionalmente para diagnosticar y clasificar la enfermedad de Stargardt. La tomografía óptica de coherencia nos proporciona nueva información acerca de la localización de los flecos retinianos, así como del estado del epitelio pigmentario retiniano y de la capa de fotorreceptores, lo cual puede ser útil para determinar el pronóstico visual de estos pacientes. Alteraciones en la línea elipsoide, en el grosor foveal o en la localización de los flecos pueden ayudarnos a realizar un pronóstico visual para el paciente.
We report 4 cases of Stargardt disease/fundus flavimaculatus and we expose some considerations about the diagnosis and evolution of this retinal dystrophy. Fluorescein angiography has traditionally served to diagnose and classify Stargardt disease. Optical coherence tomography provides new information on the location of retinal flecks as well as on the status of the retinal pigment epithelium and photoreceptor layer, which may be useful to determine visual prognosis. Alterations in the ellipsoid line, foveal thickness or the localization of the flecks can support us to perform an accurate visual prognosis for the patient.
La enfermedad de Stargardt/fundus flavimaculatus (FF) es la distrofia macular más común1. Se caracteriza por una pérdida progresiva de agudeza visual (AV) en las primeras décadas de la vida. La AV suele bajar hasta 20/200, aunque la cantidad de pérdida visual depende de la edad de presentación2.
Presentamos 4 casos de la enfermedad de Stargardt como representación de los distintos fenotipos que puede adquirir y exponemos los resultados de las distintas pruebas complementarias realizadas a los pacientes.
Presentación de los casosCaso 1Paciente de 26 años remitido por déficit progresivo de AV. La mejor AV corregida era de 0.4 en ambos ojos (AO) medida en escala decimal.
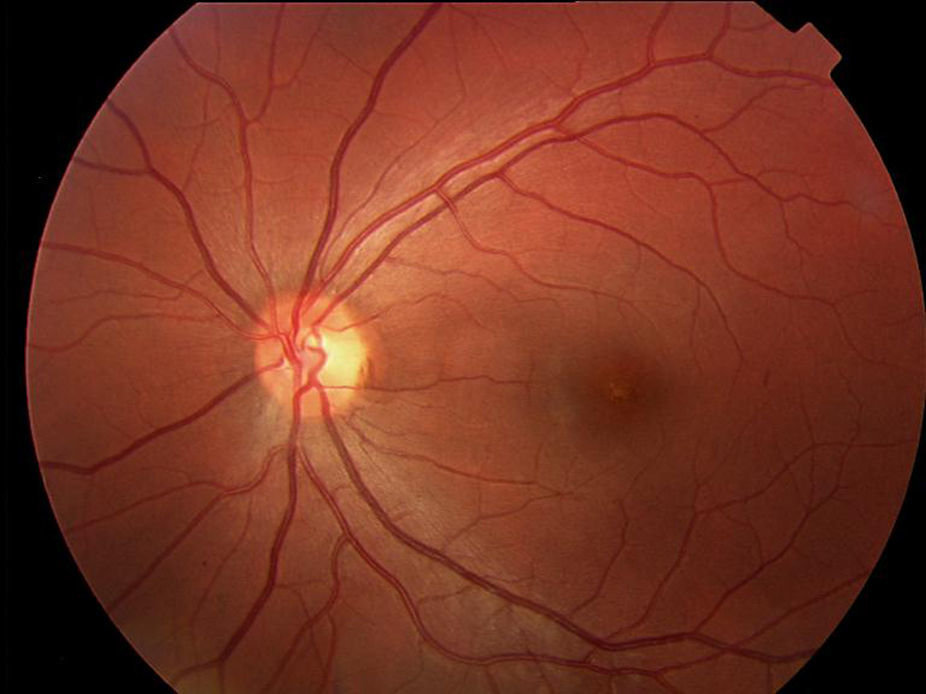
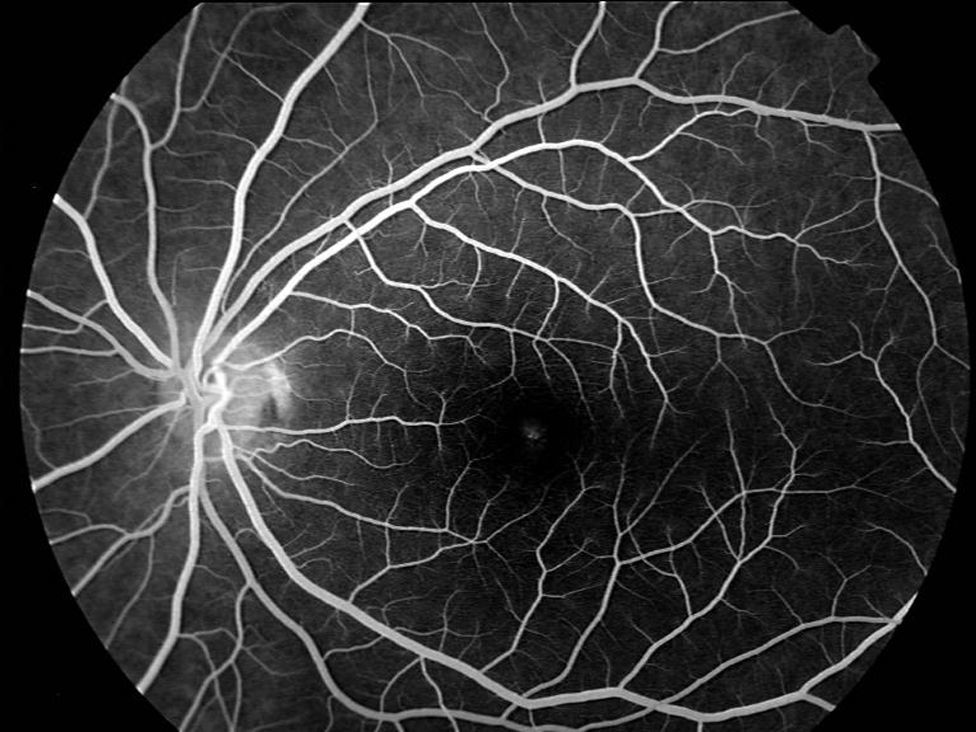
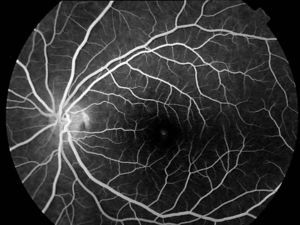
En la oftalmoscopia presentaba un color retiniano anaranjado que se tradujo en la angiografía fluoresceínica en un bloqueo de la fluorescencia coroidea y una ligera hiperfluorescencia puntiforme foveal en AO (figs. 1 y 2).
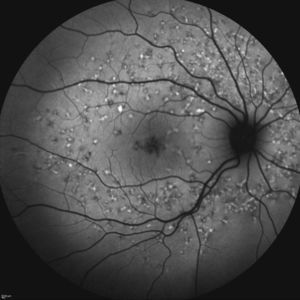
Caso 2Paciente de 50 años remitido hace 13 por déficit bilateral de AV desde los 20 años de edad. Presentaba una AV de 0.4 en OD y 0.1 en OI medida en escala decimal con corrección, siendo inferior a 0.05 en AO en la actualidad. Presentaba un FF con flecos en la región extramacular que confluyeron y se degradaron dando lugar a una atrofia geográfica macular (fig. 3).
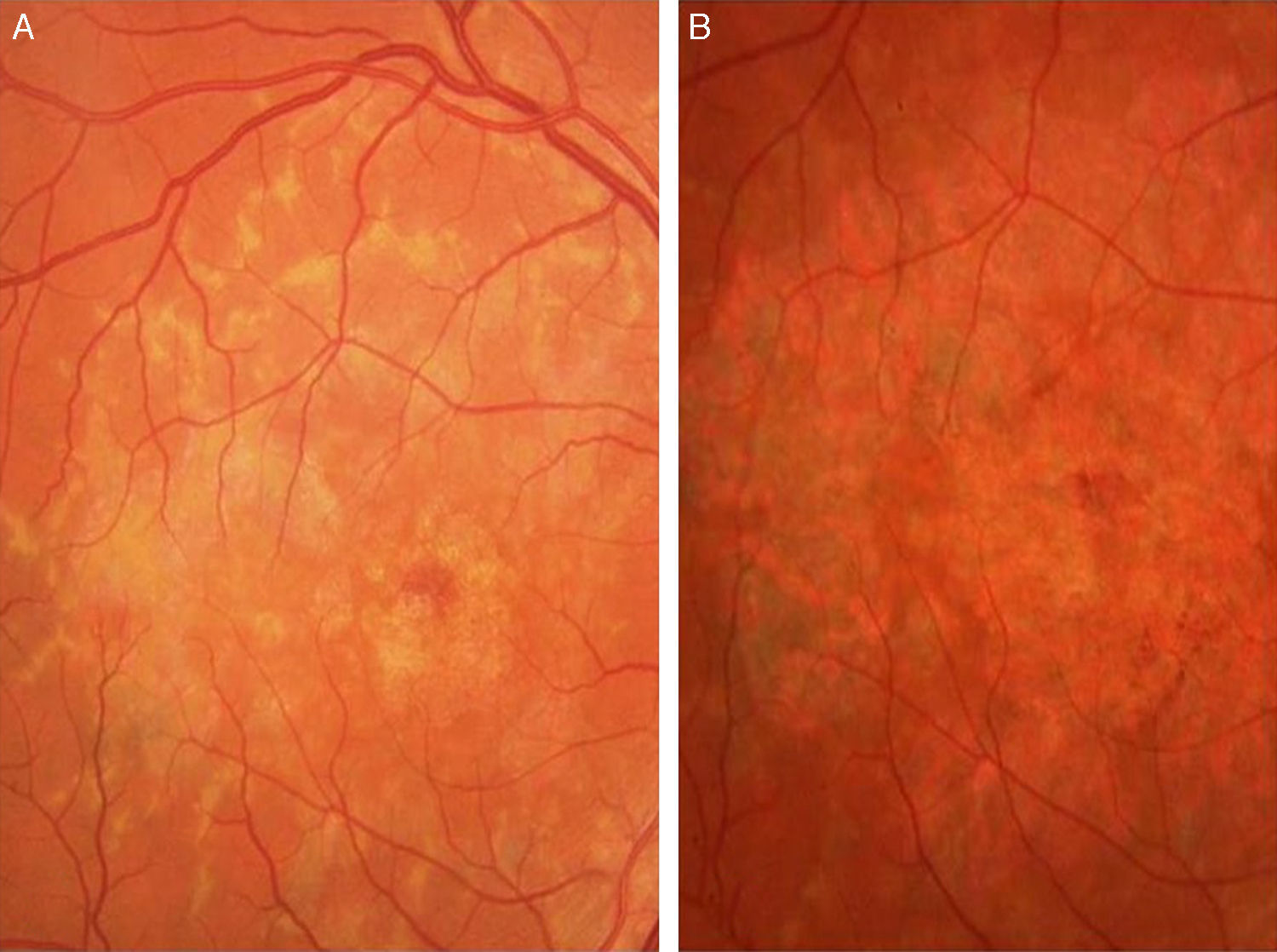
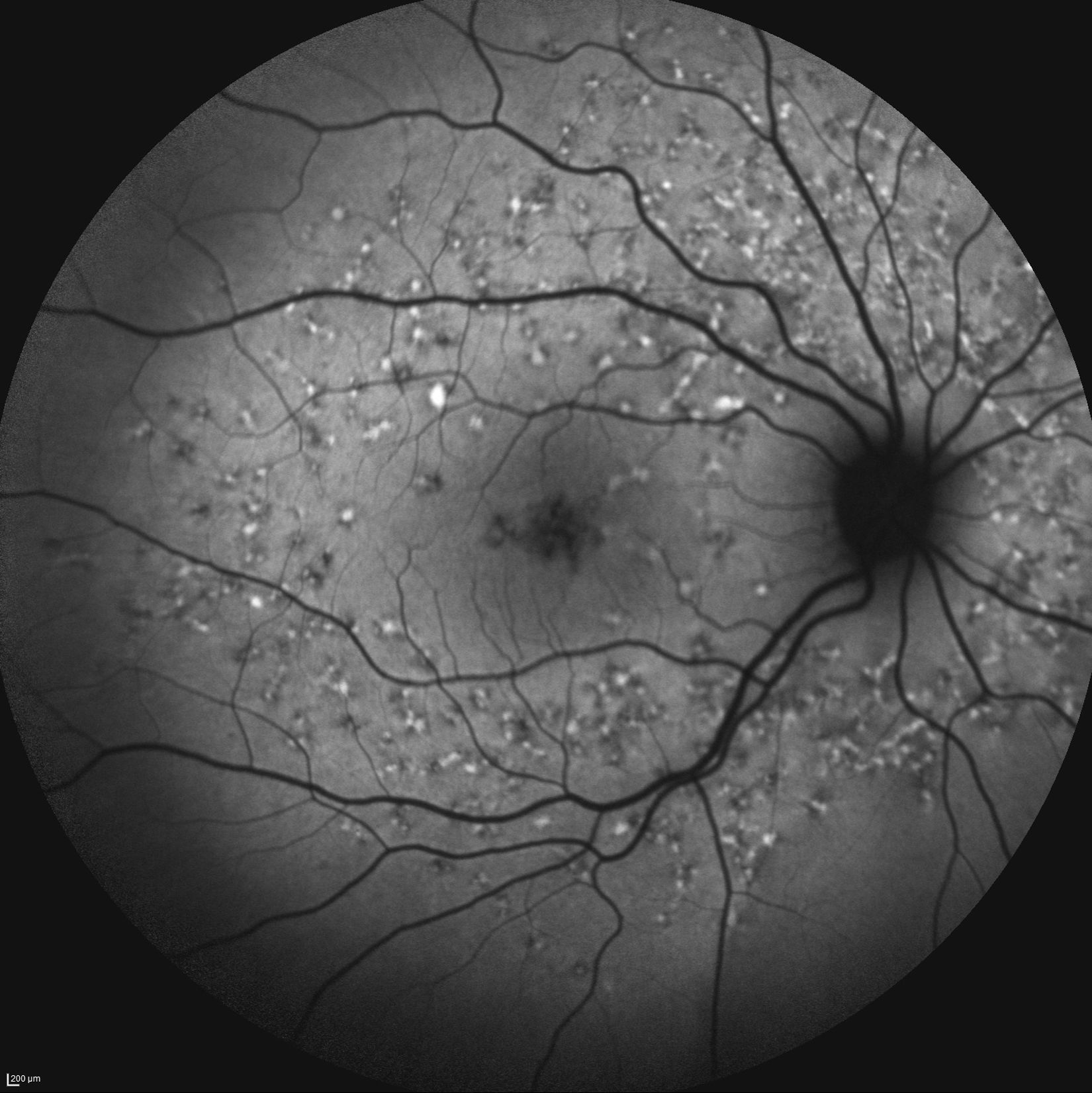
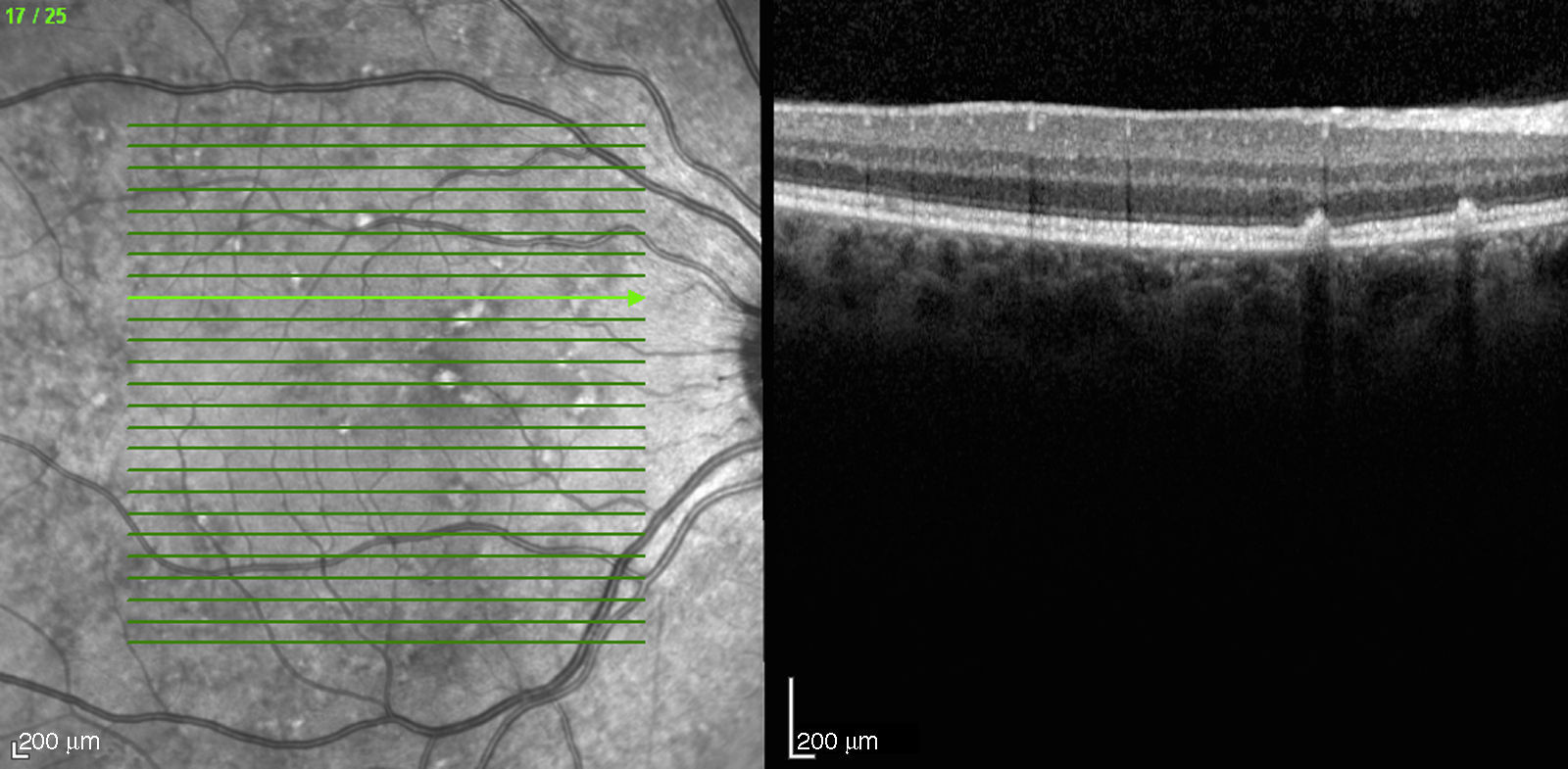
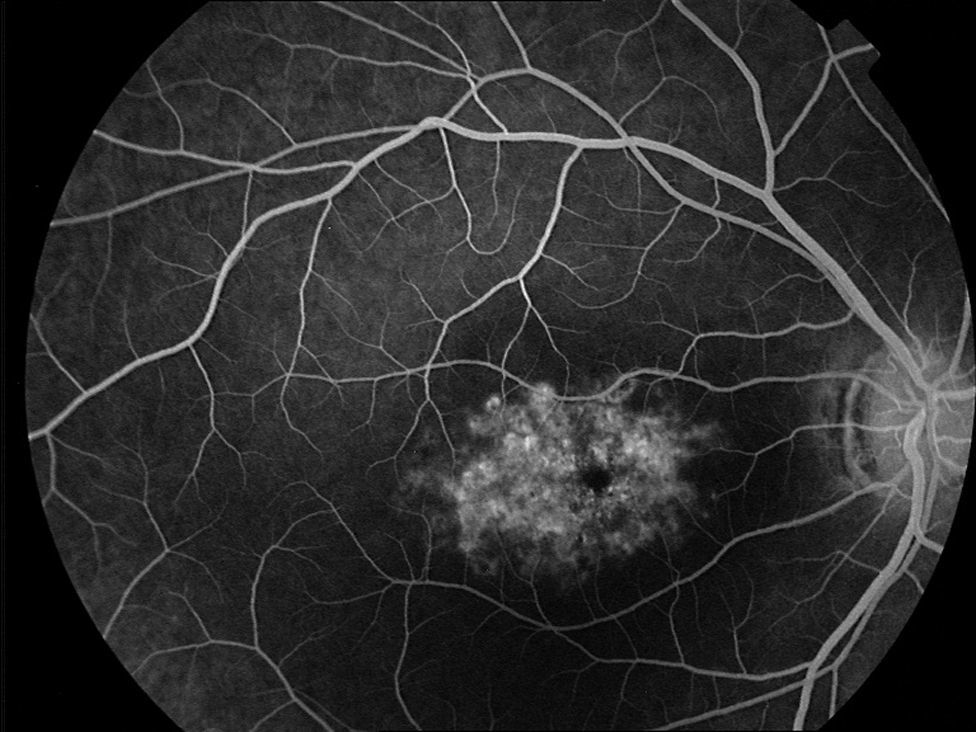
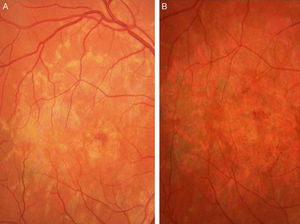
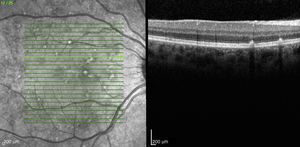
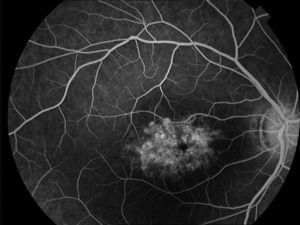
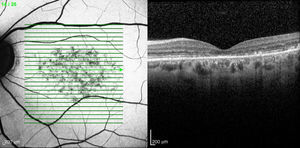
Caso 3Paciente de 42 años remitida por déficit bilateral de AV hace 6 años. Presentaba una AV de 0.6 AO (escala decimal) y un FF con flecos perimaculares y en media periferia. En la actualidad presenta una AV de 0.3 AO y ha comenzado a desarrollar una zona de atrofia focal macular en OD. En la autofluorescencia se puede observar la hiperreflectividad de los flecos junto con la zona hiporreflectiva macular que se corresponde con la zona de atrofia (fig. 4). Se puede objetivar la correspondencia entre la imagen de los flecos en la autofluorescencia y la tomografía óptica de coherencia (OCT), apareciendo en esta última como acúmulos de material hiperreflectivo a nivel del EPR y los fotorreceptores, protruyendo hacia la capa nuclear externa, produciendo a ese nivel una disrupción de la capa elipsoide, sin existir un claro adelgazamiento en el grosor retiniano (fig. 5).
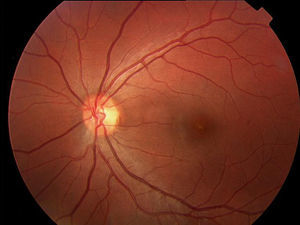
Caso 4Paciente de 35 años con déficit de AV bilateral de 2 años de evolución. Presentaba una AV de 0.5 en AO (escala decimal). En la oftalmoscopia presentaba una atrofia anular del epitelio pigmentario retiniano macular que en la angiografía fluoresceínica se traducía en una hiperfluorescencia con patrón en «ojo de buey» asociada al signo del silencio coroideo (fig. 6).
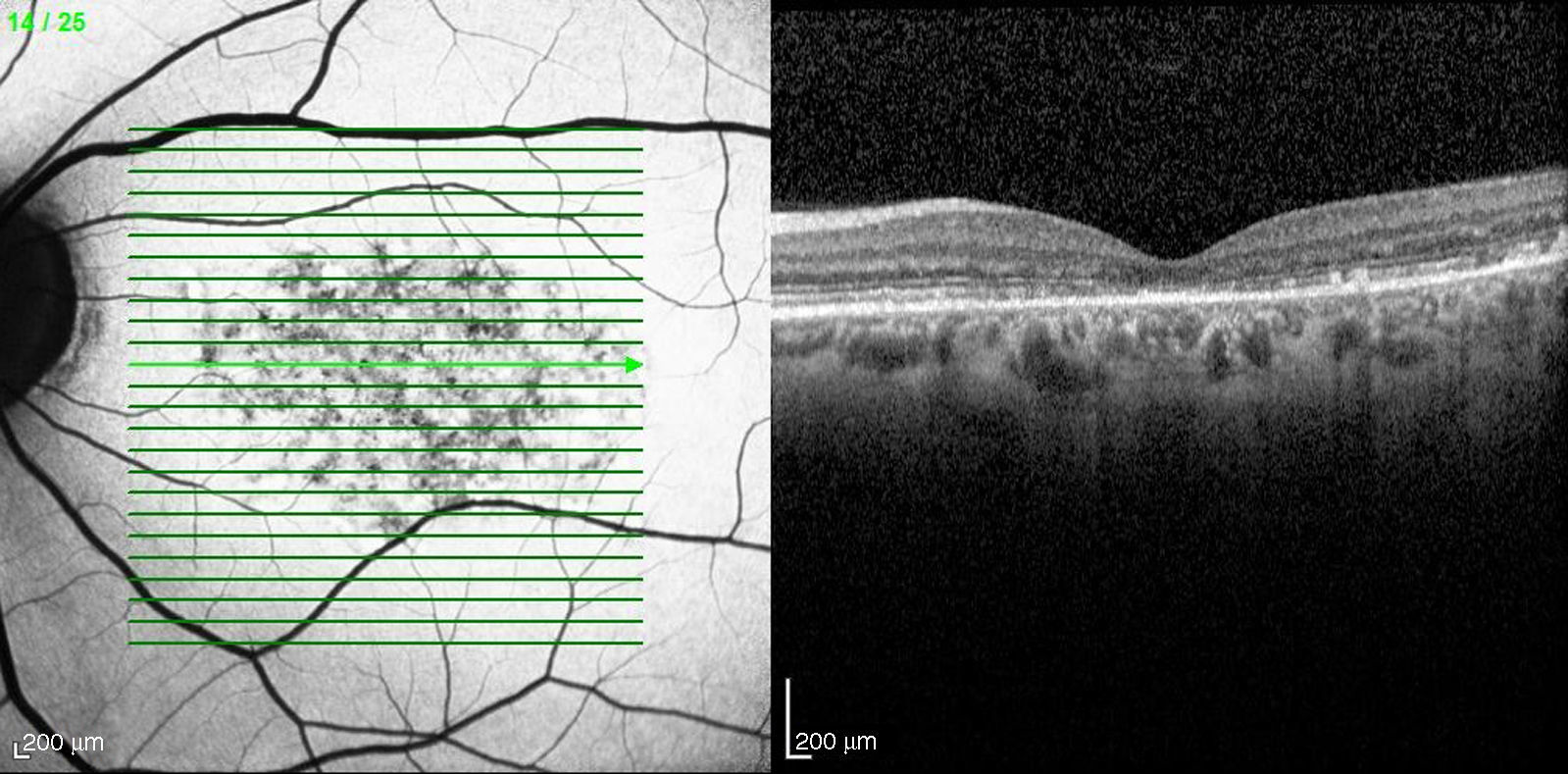
En la OCT (Heidelberg) se aprecia una coroides adelgazada, con una capa de Sattler casi inexistente y un grosor macular disminuido (184μm). Existen además zonas hiperreflectivas a nivel de la zona de interdigitación de los fotorreceptores junto con zonas de disrupción de esta misma zona, en cuanto a la línea elipsoide hay una pérdida de esta línea a nivel macular (fig. 7).
La AV ha permanecido estable hasta la fecha.
El resto de la exploración oftalmológica de los 4 pacientes era normal y solo el primer caso tenía antecedentes familiares de la enfermedad (un hermano).
DiscusiónLa enfermedad de Stargardt y el FF son variantes de la misma enfermedad. Distintas mutaciones del gen ABCR (cromosoma 1) causan los distintos fenotipos clínicos. La severidad del fenotipo dependerá de la actividad residual de la proteína que codifica el gen ABCR3–5.
Atendiendo a estos fenotipos y a la angiografía fluoresceínica en el momento de presentación J.D.M. Gass estableció 4 grupos6.
El primer caso representa al primer grupo (fondo bermellón y fluorescencia coroidea oculta). Ante un déficit visual y funduscopia aparentemente normal solo el bloqueo de la fluorescencia coroidea por la lipofucsina nos hace plantear el diagnóstico. El clásico signo angiográfico del silencio coroideo es patognomónico de la enfermedad.
El segundo grupo encuadra pacientes con maculopatía atrófica con o sin flecos, variando desde un aspecto de «metal batido» a la atrofia geográfica del segundo paciente, pasando por la típica imagen en «ojo de buey» del tercer caso.
Al tercer grupo pertenecen los pacientes con maculopatía atrófica pero con los síntomas y signos tardíos de la retinitis pigmentosa.
En el cuarto grupo están los pacientes con flecos retinianos no asociados a atrofia macular y que suelen cursar con buena AV si la fóvea no está afectada. Aquí encuadraríamos el cuarto caso.
Los flecos son máculas blanco-amarillentas heterogéneas en forma y distribución. La localización intrarretiniana de los flecos es incierta, aunque la acumulación de los mismos sigue un patrón de expansión centrífugo7. En el caso que presentamos los flecos retinianos están situados en la zona perimacular y media periferia.
La OCT puede ser útil además para evidenciar alteraciones en la morfología de la línea elipsoide, que se relaciona directamente con la disminución de la AV8,9; existen también alteraciones en el grosor foveal y los flecos son visibles como depósitos a nivel del epitelio pigmentario de la retina altamente hiperreflectivos9–11. En los casos que presentamos existen también pérdida de la integridad de la línea elipsoide así como disminución de los grosores foveales, lo que nos hace pensar que es el motivo de la disminución de AV que presentan estos pacientes.
Otra prueba diagnóstica de interés en esta enfermedad, no invasiva, es la autofluorescencia retiniana, que nos ayuda a evaluar a los pacientes y monitorizar el seguimiento de la enfermedad. Pueden existir en las fases iniciales spots de incremento o descenso de la autofluorescencia así como zonas de gran hiporreflectividad que conrresponderían a zonas de atrofia avanzada 13. En la autofluorescencia que presentamos (caso 3) se puede observar la hiperautofluorescencia de los flecos junto a la zona hipoautofluorescente correspondiente a la zona de atrofia; esta zona hipoautofluorescente puede ser medida y monitorizada para realizar un seguimiento de la enfermedad12. En el caso 4, sin embargo, existe una zona hipoautofluorescente a nivel macular parcheada que se corresponde a las zonas de atrofia que se pueden observar en la OCT.
En cuanto al tratamiento, actualmente no existe ninguna alternativa terapéutica en estos pacientes. Se han ensayado en ratones tratamientos genéticos para tratar de reducir la síntesis de A2E con resultados prometedores14, lo que lleva a pensar que la terapia génica será el tratamiento disponible en el futuro para estos pacientes.
Otro tratamiento que se ha ensayado ha sido el uso de isotretinoína, con muy buenos resultados pero una gran toxicidad debido al uso crónico15.
ConclusionesLas nuevas técnicas de imagen como la OCT o la autofluorescencia nos permiten conocer mejor la fisiopatología de la dolencia y no solo la anatomía y estructura de las lesiones producidas por la enfermedad de Stargardt, y así poder realizar un correcto pronóstico visual para el paciente.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.