Objetivos: Reportar la frecuencia y características microbiológicas de los patógenos corneales más comúnmente aislados en queratitis infecciosas, en un centro de referencia oftalmológica en México, así como reportar los patrones de resistencia y sensibilidad in vitro a los antibióticos comúnmente usados en la comunidad.
Material y métodos: Estudio retrospectivo, muestras obtenidas de córneas con diagnóstico de queratitis infecciosa en el periodo enero a diciembre de 2012. Se analizaron resultados de cultivos, tinciones y antibiogramas.
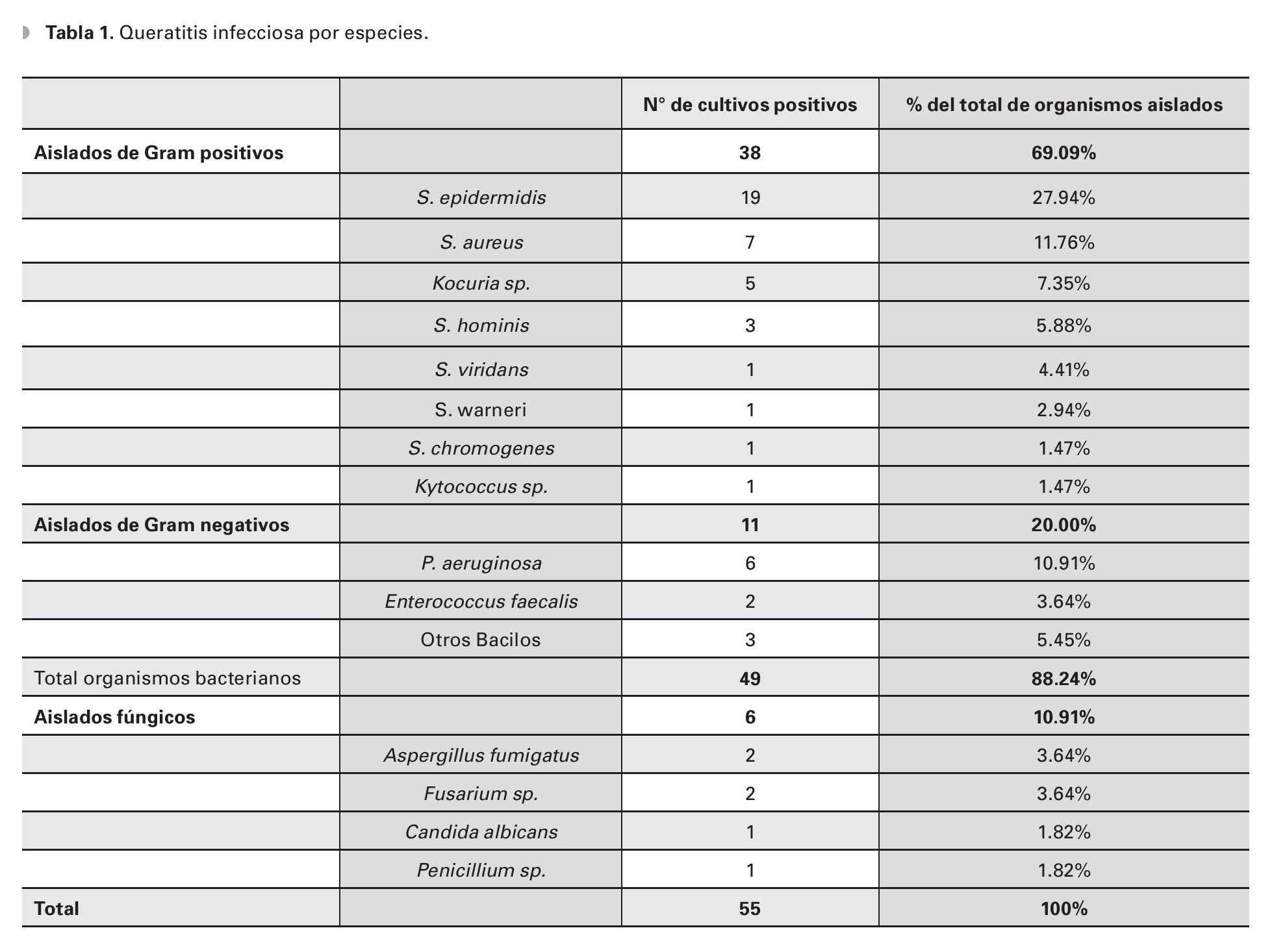
Resultados: Total de 120 raspados corneales tomados durante el estudio. Se obtuvieron patógenos en 55 muestras (45.83%), 49 (88.4%) atribuidas a organismos bacterianos. El Staphylococcus epidermidis (S. epidermidis) fue el organismo más comúnmente aislado y la Pseudomonas aeruginosa el Gram negativo más común. Se registraron cinco casos (7.35%) de queratitis asociada a Kocuria sp, que mostraron sensibilidad del 100% a moxifloxacino, ciprofloxacino, gentamicina y oxacilina, El 89.58% de los cultivos fueron sensibles a moxifloxacino y vancomicina, observándose sensibilidad del 85.71% a gentamicina. Se mostró resistencia a ciprofloxacino en 24.48% de total de los cultivos y en 36.84% de los aislados de S. epidermidis. El 100% de los cultivos de Enterococcus faecalis (E. faecalis) fueron resistentes a moxifloxacino y ciprofloxacino.
Conclusiones: Dada la alta sensibilidad de los principales microorganismos a quinolonas, se recomiendan como tratamiento empírico inicial en queratitis infecciosas. Se observó una resistencia de 39.35% de los Gram positivos a oxacilina, una multirresistencia del E. faecalis a los antibióticos probados y cinco casos de queratitis por Kocuria sp., organismo oportunista no comúnmente asociado a queratitis.
Objectives: To report the frequency and microbiological characteristics of the most commonly isolated corneal pathogens from infectious keratitis in a reference center in Mexico City. To describe the in vitro resistance and sensitivity patterns to the common use antibiotics in the community.
Material and methods: Retrospective study, samples were obtained from corneas with diagnosis of infectious keratitis in the period January-December 2012. Results of cultures, stains and antibiograms were analyzed.
Results: A total of 120 corneal scrapes were taken during the study period. Pathogens were obtained in 55 samples (45.83%), 49 (88.4%) of them attributed to bacterial organisms. Staphylococcus epidermidis was the most common isolated organism and Pseudomonas aeruginosa the most common Gram negative. We registered 5 cases of keratitis associated to Kocuria sp., all of them were 100% sensitive to moxifloxacin, ciprofloxacin, gentamicin and oxacillin. 89.58% of the isolates were sensitive to moxifloxacin and vancomycin, observing a general sensitivity of 85.71% to gentamicin. Resistance to ciprofloxacin was observed in 24.48% of the isolates and in 36.84% of the Pseudomonas isolates. All the Enterococcus faecalis isolates were moxifloxacin and ciprofloxacin resistant.
Conclusions: The most common causative microorganisms were sensitive to quinolones; hence we recommend its use as empiric treatment in infectious keratitis. Resistance to oxacillin was observed in 39.35% of Gram positives, antibiotic multiresistance of the analyzed Enterococcus isolates was remarkable and five cases of Kocuria sp. keratitis, an opportunistic organism not usually associated to keratitis, were observed.
Introducción
La queratitis infecciosa es una causa importante de morbilidad ocular que puede resultar en pérdida visual severa, es una de las causas más comunes de ceguera corneal.1 La determinación temprana del agente infeccioso causal y de su sensibilidad a los antibióticos, es esencial para lograr resultados terapéuticos favorables, mejorar el pronóstico visual y preservar la integridad del globo ocular.2 Sin la instauración de la antibioticoterapia adecuada, sólo el 50% de los ojos con queratitis microbiana tendrán buenos resultados visuales.3
Las recomendaciones iniciales en el manejo de la queratitis infecciosa incluyen el uso empírico de un antibiótico de amplio espectro (quinolona de cuarta generación) o el uso concomitante más de un antibiótico reforzado, mientras el organismo causal es identificado.4 El uso generalizado de antibióticos de amplio espectro, pueden relacionarse con un cambio en el espectro de microorganismos y en su sensibilidad a antibióticos.5 Se han observado cambios regionales en las tendencias microbiológicas en las queratitis infecciosas y evidencia de cambios en los patrones de sensibilidad a antibióticos, así como emergencia de cepas resistentes a los antimicrobianos disponibles.5,6
Los estudios epidemiológicos locales permiten determinar la frecuencia de los organismos causales y de su patrón de sensibilidad a los antibióticos de uso común en la comunidad, proveyendo una guía basada en evidencia que permita lograr un manejo exitoso de las queratitis microbianas.7-9
El presente estudio tiene como objetivo reportar la frecuencia y características microbiológicas de los patógenos corneales más comúnmente aislados en queratitis infecciosas, en un centro de referencia oftalmológica en México, reportar los patrones de resistencia y sensibilidad in vitro a los antibióticos comúnmente usados en la comunidad; así como comparar estos resultado con los obtenidos en nuestro Instituto para el ciclo 2011.8 Finalmente, se proveen recomendaciones sobre nuevas tendencias en investigación microbiológica y uso de antibióticos en la terapia de las queratitis infecciosas.
Material y métodos
Estudio retrospectivo realizado en el Instituto de Oftalmología Fundación “Conde de Valenciana” entre 1º de enero al 31 de diciembre de 2012. Se analizó la base de datos del Departamento de Microbiología y Proteómica Ocular de la misma Institución, para identificar las muestras obtenidas de raspados corneales de córneas con diagnóstico de queratitis infecciosa en el periodo mencionado. La base de datos posteriormente fue utilizada para obtener información demográfica básica, resultados de las tinciones y cultivos, así como la sensibilidad y resistencia a antibióticos.
Los cultivos corneales se tomaron de manera rutinaria utilizando un hisopo de alginato de calcio, previa instilación de anestésico tópico (Tetracaína, Ponti Ofteno, Laboratorio Sophia, Zapopan, Jal., México). Posteriormente, se inocularon cuatro medios sólidos (agar sangre, agar chocolate, sal manitol y Sabouraud) y uno líquido (caldo de infusión cerebro-corazón). Los medios fueron cultivados bajos las condiciones atmosféricas apropiadas (37ºC/5% CO2). Los cultivos fueron determinados como positivos cuando hubo crecimiento en la línea de inoculación, en al menos un medio sólido. Se realizaron tinciones de Gram y Giemsa para todas las muestras; sin embargo, una microscopía positiva para tinción en ausencia de crecimiento bacteriano en el cultivo, fue considerada como evidencia insuficiente para crecimiento de microorganismos.
Se utilizó el sistema automatizado VITEK 2C® (Laboratorio bioMérieux, Francia), para identificación bacteriana y determinación de la sensibilidad antimicrobiana a antibióticos. Se analizaron 10 antibióticos utilizados rutinariamente en patologías infecciosas oculares: oxacilina (1 µg), sulfas (300 µg), vancomicina (30 µg), gentamicina (30 µg), ciprofloxacino (5 µg), ceftriaxona (30 µg), cefazolina (30 µg), tobramicina (10 µg), tetraciclina (30 µg) y moxifloxacino (5 µg).
Resultados
Demografía
Durante el periodo entre enero a diciembre de 2012, 120 muestras de raspados corneales fueron recolectadas de 120 pacientes. Sesenta y cinco pacientes fueron mujeres (54.2%) y 55 (45.8%) fueron hombres. La edad promedio de los pacientes fue de 45.40 ± 21.56 años, con un rango de 2-84 años. El 35.83% de las muestras analizadas (43/120 muestras), tenían tratamiento con algún tipo de antibiótico tópico, previo a la realización de cultivo y tinciones.
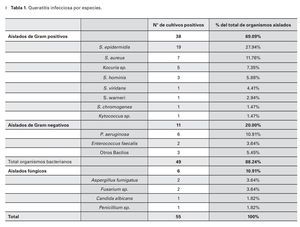
El cultivo fue positivo en 45.83% (55 aislados) de las muestras, identificándose 16 diferentes microorganismos (Tabla 1), sin reportarse infecciones polimicrobianas.
Características clínicas
Se registraron los hallazgos relevantes (factores de riesgo y hallazgos clínicos) para los cinco microorganismos más comúnmente aislados en el estudio (Tabla 2). El 78.9% (15/19) de las queratitis por Staphylococcus epidermidis (S. epidermidis) se caracterizaron por tener infiltrados inflamatorios densos y bien delimitados. Se describió un infiltrado inflamatorio denso y secreción abundante en el 71.4% (5/7) y 85.7% (6/7), respectivamente, de los casos por Staphylococcus aureus (S. aureus). El 100% de los casos (5/5) de queratitis por Kocuria sp., se caracterizó por presentar abundante secreción mucoide. El uso de lente de contacto blando se observó como factor de riesgo asociado en el 50% (3/6) de los casos, por queratitis por Pseudomonas. Todos los casos de queratitis fúngicas tuvieron como antecedente, el uso de antibiótico tópico por más de una semana.
Cultivos y tinciones
Las bacterias constituyeron el 89.09% (49 aislados) de los cultivos positivos, 10.91% (seis aislados) de cultivos fueron positivos para infecciones fúngicas y no hubo reportes de queratitis por parásitos.
El 69% (38) del total de los aislados fueron bacterias Gram positivos. El S. epidermidis fue el organismo más comúnmente cultivado (19 aislados, 34.55%), seguido de S. aureus (siete aislados, 12.73%) y Pseudomonas aeruginosa (P. aeruginosa) (seis aislados, 10.91%) (Tabla 1). El 69% (38) del total de los aislados fueron bacterias Gram positivas en orden de frecuencias, después del S.epidermidis y S. aureus fueron el Kocuria sp. (cinco aislados, 9.09%) y el Staphylococcus hominis (S. hominis) (tres aislados, 5.45%). Después de la P. aeruginosa, el Enterococcus faecalis (E. faecalis) fue el organismo más representativo en los aislados bacterianos Gram negativos (dos aislados, 3.64%).
En todos los casos donde los cultivos fueron positivos, la tinción se correlacionó con el tipo de microorganismo aislado. En 13.84% (9/65) de los cultivos donde no se obtuvo desarrollo bacteriano, se reportó tinción para Gram positivo (cinco cocos Gram positivos, 7.69%) o identificación de estructuras fúngicas (cinco casos con identificación de hifas, 6.15%).
Sensibilidad a antibióticos de uso común en oftalmología
General
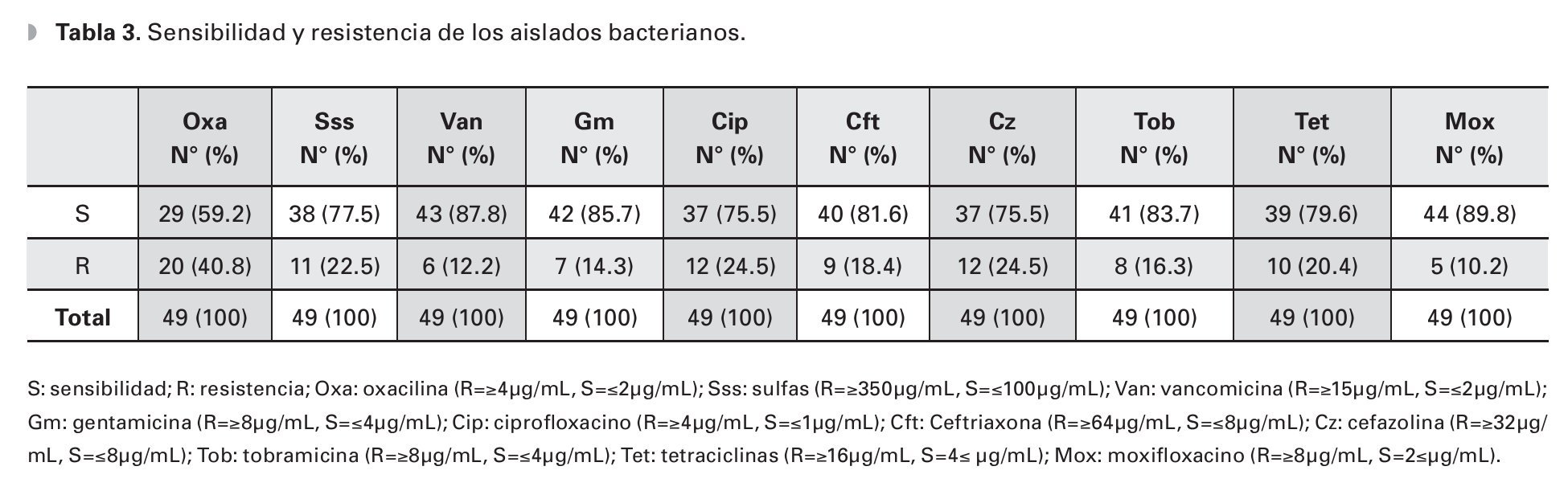
Un total de 49 cultivos fueron probados para su sensibilidad ante moxifloxacino, de los cuales 44 (89.79%) fueron sensibles al mismo. Un comportamiento muy similar se observó en los cultivos probados ante vancomicina, gentamicina y ciprofloxacino con una sensibilidad de 89.58%, 85.71% y 75.51%, respectivamente. Se observó una resistencia moderada a baja de los cultivos probados ante la cefalosporinas de uso oftalmológico probadas en el antibiograma, siendo resistentes a cefazolina el 24.48% de los aislados bacterianos (Tabla 3).
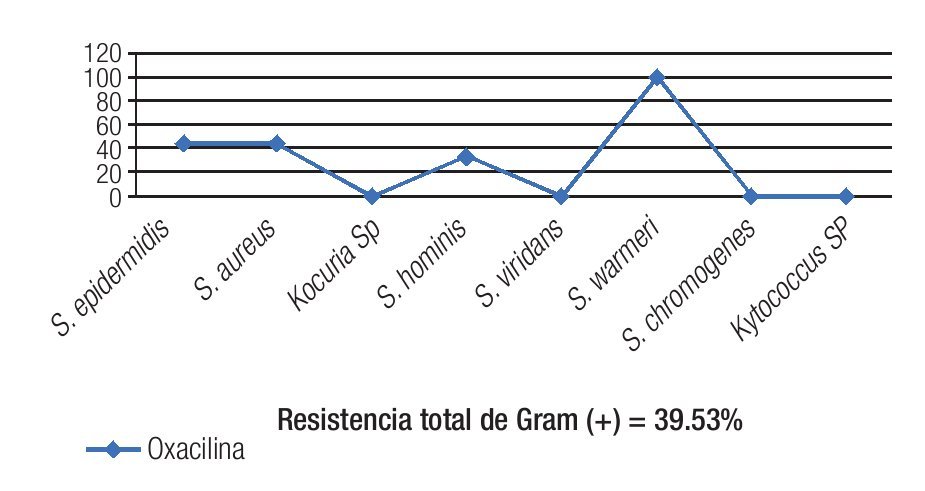
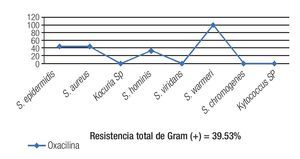
El 40.81% de los cultivos analizados fueron resistentes a oxacilina (Tabla 3). La resistencia a oxacilina se observó para Gram positivos en 39.53% de los aislados y en 50% de los aislados para Gram negativos (Figura 1).
Figura 1. La resistencia total de Gram positivos a meticilina fue de 39.53%. Los dos principales patógenos Gram positivos (S. epidermidis y S. aureus) tuvieron una resistencia de 40%.
Resistencia por organismos
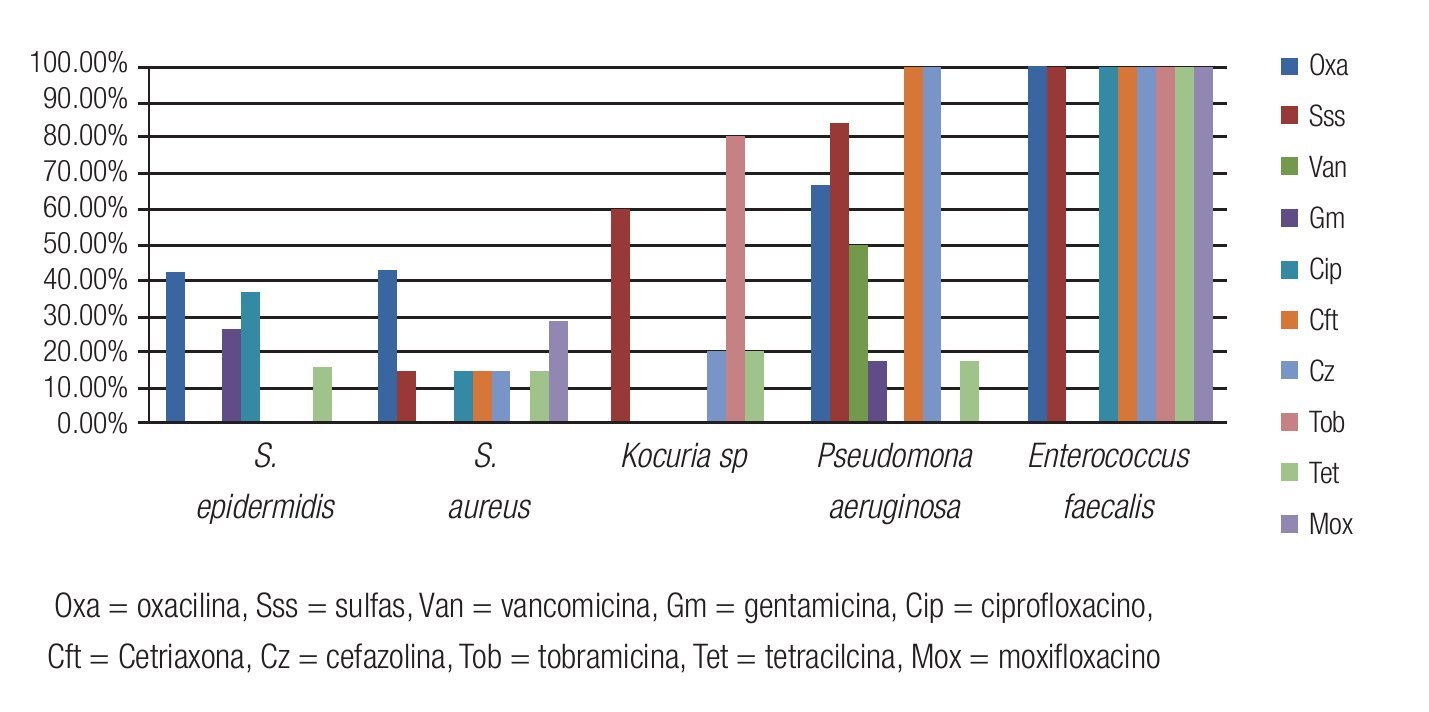
El 100% de los aislados de S. epidermidis fueron sensibles a vancomicina, cefazolina, tobramicina y moxifloxacino. Este microorganismo mostró una sensibilidad a gentamicina y ciprofloxacino (73.68% y 63.15%, respectivamente). El 42.10% de los cultivos de S. epidermidis fueron resistentes a oxacilina/meticilina.
El S. aureus mostró una sensibilidad de 100% para vancomicina, gentamicina y tobramicina, la sensibilidad a moxifloxacino fue de 71.42%; con resistencias de 14.28% a cefazolina y ciprofloxacino y 42.85% a meticilina.
Los cultivos de P. aeruginosa fueron 100% sensibles para ciprofloxacino, tobramicina y moxifloxacino, teniendo ésta una resistencia del 100% a cefazolina y ceftriaxona.
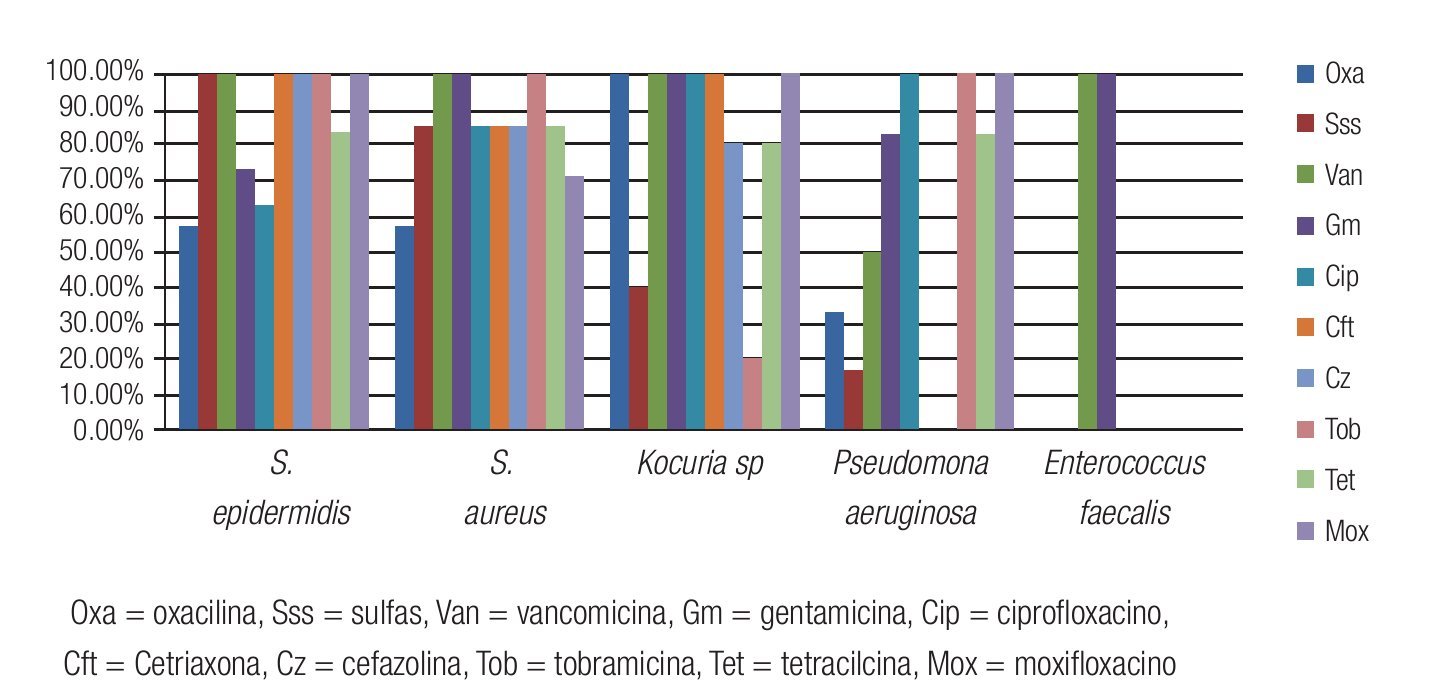
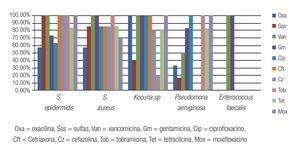
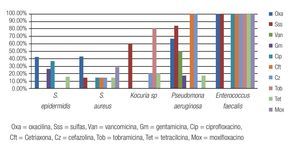
Las Figuras 2 y 3 resumen la sensibilidad y resistencia de los cinco principales microorganismos bacterianos aislados, para los antibióticos probados en el antibiograma.
Figura 2. Porcentaje de aislados de microorganismos que mostraron sensibilidad a los diferentes antibióticos probados en el estudio. Se observó una buena sensibilidad a la vancomicina, gentamicina y moxifloxacino de la mayoría de los aislados de Gram positivos. El 100% de los aislados fueron sensibles a tobramicina y moxifloxacino.
Figura 3. Porcentaje de aislados de microorganismos que mostraron resistencia a los diferentes antibióticos probados en el estudio. Se observó resistencia del 100% de los aislados de E. faecalis a todos los antibióticos probados, excepto vancomicina y gentamicina.
Tendencias estacionales
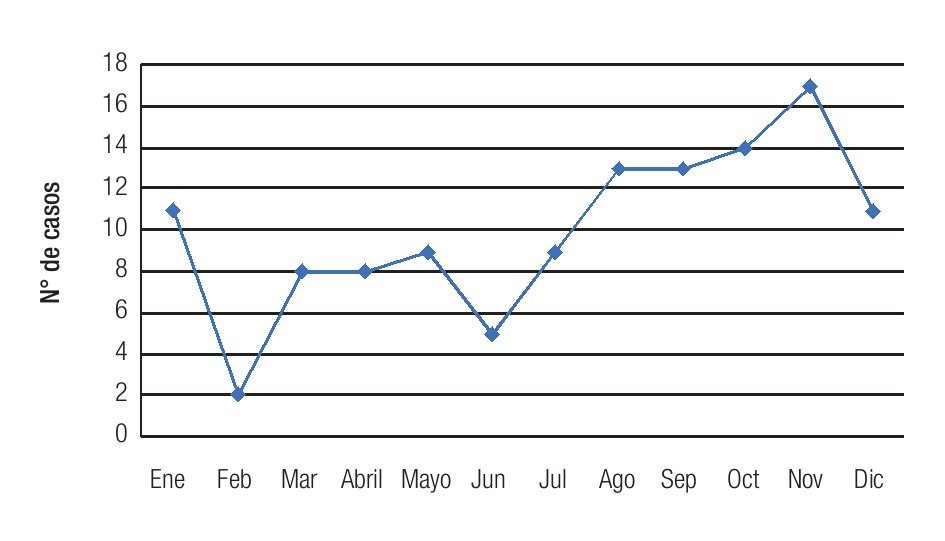
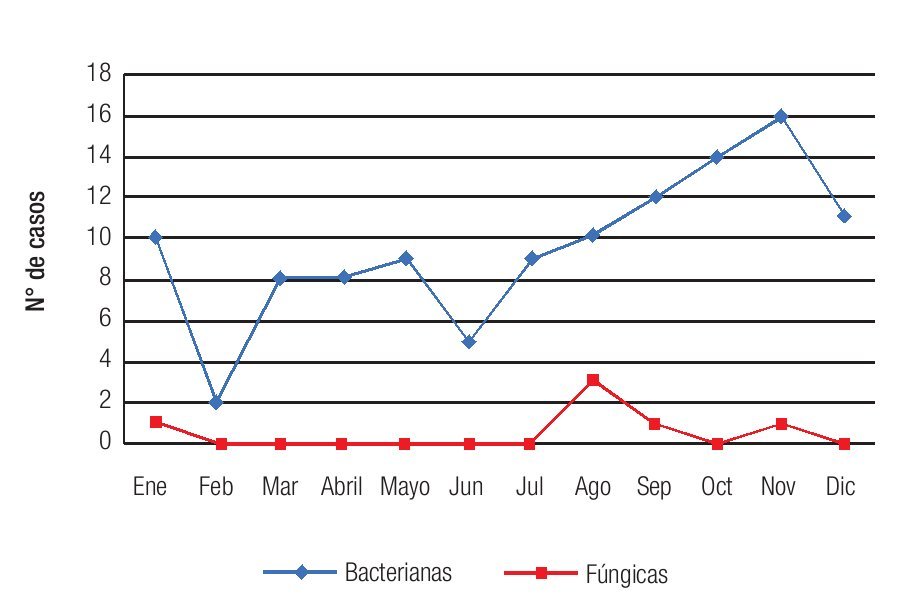
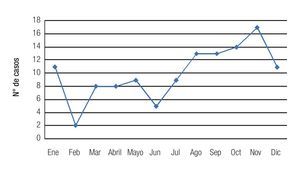
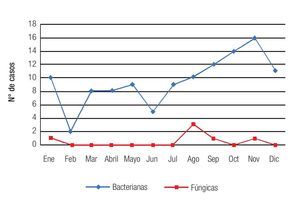
Se observó una tendencia a un aumento en la incidencia mensual de queratitis hacia los meses de finales de verano y otoño, con un pico de incidencia en noviembre, registrándose 17 casos (Figura 4). La distribución mensual de las queratitis según la etiología (bacteriana o fúngica) siguió un patrón similar, observándose una distribución no equitativa en el año con una tendencia al aumento en incidencia en los meses de finales de verano (agosto) y otoño (septiembre, octubre y noviembre) (Figura 5). No se observó una tendencia significativa en el patrón estacional o en la incidencia mensual para los grupos específicos de microorganismos bacterianos o fúngicos.
Figura 4. Se observa un aumento en la incidencia de los casos de queratitis, hacia los meses de finales de verano y otoño.
Figura 5. Se observa una tendencia hacia un aumento en la incidencia de las queratitis en los meses de finales de verano y otoño, independientemente de la etiología.
Discusión
El análisis de las muestras corneales derivadas de queratitis infecciosas en este estudio fue positivo para el cultivo de microorganismos en el 44.83% de los casos, por debajo de lo reportado por algunas otras series (51.8% - 71.9%).10-12 El uso de antibiótico tópico previo a la toma y realización del cultivo de la úlcera corneal infecciosa puede disminuir la tasa de recuperación de microorganismos, disminuyendo la posibilidad de obtener un cultivo positivo.13 En el presente estudio, 35.83% de los pacientes tenían antecedentes de uso previo de antibiótico tópico, lo que pudiera justificar la baja tasa de positividad de cultivo en nuestra serie; otra posible explicación de esta baja tasa es el uso de anestésico con conservadores (tetracaína), ya que según lo reportado por Labetoulle y colaboradores, el uso de anestésico con conservadores (tetracaína) conlleva a un mayor número de resultados falsos negativos comparados con el uso de anestésicos sin conservadores.14
Coincidente con lo reportado en la literatura médica,15,16 los microorganismos más comúnmente aislados (69.09% de los patógenos cultivados en el presente estudio) fueron los Gram positivos. La especie Staphylococcus predominó en los aislados y el organismo Gram negativo más frecuente fue P. aeruginosa.
El 10.91% de los cultivos resultaron positivos para hongos, congruente con la baja incidencia (5%-20%) de las queratitis fúngicas reportada en grandes series de queratitis microbianas.17,18
Los organismos fúngicos más comunes fueron Aspergillus fumigatus y Fusarium sp., acorde a lo previamente reportado por series en EU17,19 (en orden de frecuencia: Aspergillus sp.,Fusarium sp., Candida sp. y Curvularia sp.) y en México20 (en orden de frecuencia: Fusarium sp., Aspergillus flavus y Curvularia sp.). Aunque Aspergillus sp. es considerado mundialmente como el organismo causal de la mayoría de las úlceras corneales fúngicas, Fusarium sp. es el microorganismo más comúnmente aislado en reportes provenientes del sur de Estados Unidos, Europa, China y África.21,22
Es importante mencionar la incidencia de cinco casos de queratitis asociada a infección por Kocuria sp. (dos casos de Kocuria kristinae, dos casos de Kocuria rosea y un caso de Kocuria varians). El género Kocuria es un coco Gram positivo, coagulasa negativo, de la familia Micrococcaceae; es una bacteria comensal de la orofaringe y de la piel en el humano y es considerada oportunista, dado que es responsable de procesos infecciosos que generalmente complican enfermedades graves subyacentes.23,24 Debido a la dificultad para la identificación del organismo por ensayos fenotípicos, síndromes clínicos asociados a este agente se creían raros; sin embargo, se prevé que la prevalencia de las infecciones por estas bacterias aumente con la implementación de equipos de identificación microbiana más sensibles (ejemplo, identificación basada en genoma).24,25
En nuestro caso hubo un cambio en el sistema de identificación microbiológica, del sistema VITEK 2® (Laboratorio bioMérieux, Francia) al sistema VITEK 2C®; que ofrece una base de datos para la identificación de microorganismos más extensa, una plataforma con mejoras en la automatización, resultados más rápidos y mayor confiabilidad, dado que elimina las operaciones manuales repetitivas.
Casi el 90% de los microorganismos aislados en el presente estudio fueron sensibles a moxifloxacino, 85% y 83% sensibles a gentamicina y tobramicina respectivamente, lo cual propone a los antibióticos previamente mencionados (principalmente a la fluoroquinolona, antibiótico de amplio espectro); éstas son quinolonas de cuarta generación, sólo existen dos en el mercado mexicano y sólo se estudia como una excelente opción para tratamiento empírico con monoterapia, mientras se esperan los resultados de la investigación microbiológica o cuando no se cuenta con los medios para realizar la misma.
Existen reportes sobre el incremento en la resistencia a fluoroquinolonas en aislados de S. aureus y Pseudomonassp.9,26 En el presente estudio los dos principales microorganismos Gram positivos (S. epidermidis y S. aureus) mostraron una sensibilidad moderada a ciprofloxacino (63.1% y 85.7%, respectivamente), mientras que se reportó una sensibilidad del 100% de los aislados de P. aeruginosa. Así, el ciprofloxacino representa una opción de monoterapia empírica viable para las úlceras corneales microbianas en la muestra analizada, siendo que tres cuartas partes del total de los microorganismos aislados son sensibles a la misma y es específicamente útil en casos de sospecha de infección por Pseudomonas; planteando la ventaja de tener un menor costo que el moxifloxacino.
De igual manera, se observó una sensibilidad del 95% de los microorganismos Gram positivos a vancomicina y del 83.3% de los Gram negativos a gentamicina y tobramicina, sugiriendo la eficacia de su uso combinado como antibióticos fortificados en el tratamiento empírico de las queratitis infecciosas.
Los aislados de P. aeruginosa, además de mostrar una excelente sensibilidad al ciprofloxacino, presentaron una notable sensibilidad a los aminoglucósidos (gentamicina y tobramicina) y moxifloxacino. Nuevamente, este hallazgo permite reafirmar a los aminoglucósidos como una buena terapia empírica inicial, en casos de sospecha de queratitis por P. aeruginosa, y a las quinolonas como monoterapia inicial.
Se observó una notable tendencia a la resistencia del 100% a la mayoría de los antibióticos probados de los aislados de E. faecalis, observándose sensibilidad del 100% a vancomicina y gentamicina. Existen pocos reportes sobre queratitis infecciosa causada por cepas multirresistentes de E. faecalis, poca experiencia sobre su evolución clínica y su respuesta al tratamiento con antibiótico;27 sin embargo, a pesar de que los reportes en general muestran úlceras complicadas, la mayoría de los casos reportados mostraron sensibilidad a vancomicina y una buena respuesta al tratamiento.28
La oxacilina comparte los mismos mecanismos de resistencia bacteriana que la meticilina,29 y desde 1990 es el antibiótico utilizado para probar resistencia a meticilina en cepas de estafilococos.30 En la serie actual, 39.53% de los organismos Gram positivos mostraron una resistencia del 100% a oxacilina/meticilina; mostrando una disminución con el observado en el reporte previo de nuestro grupo de estudio8 (72.72% en el 2011); pudiendo este fenómeno estar relacionado al menor número de úlceras tratadas previamente con antibiótico, comparando 2012 con el año previo (55.8% en 2011 vs. 35.83% en 2012) y al surgimiento de aislados de Kocuria sp. (100% sensibles a oxacilina), lo que modificó la tendencia de sensibilidad a meticilina de los Gram positivos. El S. aureus y el S. epidermidis (organismos Gram positivos más comunes en este reporte), mostraron resistencia a oxacilina en 42% de los aislados, mientras que en el reporte previo se mostró un resistencia del 75% y 100%, respectivamente.8
Algunos hallazgos clínicos relevantes encontrados en nuestro estudio al analizar los cuatro microorganismos aislados más comunes, fueron: infiltrado inflamatorio denso y bien delimitado en el 78.9% de las queratitis por S. epidermidis; y secreción abundante e infiltrado inflamatorio denso (en 71.4% y 85.7%, respectivamente) en las queratitis por S. aureus. El 50% de los pacientes con queratitis cuyo raspado corneal fue positivo para Pseudomonas, tenía como antecedente el uso de lente de contacto, coincidiendo con lo reportado por la literatura médica como factor de riesgo predisponente para el desarrollo de úlcera corneal por este microorganismo.31 La Tabla 2, resume los hallazgos relevantes encontrados para los principales patógenos aislados y el antibiótico recomendado como tratamiento, según los resultados de nuestro análisis.
El análisis de tendencias estacionales, mostró una mayor incidencia de las queratitis infecciosas en los meses de finales de verano y otoño. Esto es congruente con lo reportado en la literatura médica, donde la mayor incidencia de queratitis infecciosas se presenta en los meses con climas cálidos (comúnmente época de cosecha) y ventosos (Figura 4).32,33 El patrón estacional de las queratitis infecciosas es útil para guiar el tratamiento empírico de las mismas en áreas con acceso limitado de cuidado oftalmológico; asimismo, es esencial para orientar el tamizaje de las queratitis en áreas donde el entrenamiento oftalmológico es mínimo.33
Una limitación de nuestro estudio es que a pesar de reportar tendencias microbiológicas y perfil de antibiograma en queratitis infecciosas en una población específica (Ciudad de México), es difícil aseverar que los datos reportados sean propios de esta región geográfica, dado que en nuestro centro oftalmológico son atendidos pacientes que vienen también de otras localidades (interior del país).
En general, la recomendación es que el manejo de las queratitis infecciosas severas (involucrando el eje pupilar, infiltrado mayor de 2 mm, lisis severa, reacción importante en cámara anterior), debe ser guiado por cultivo. En queratitis con tratamiento empírico previo y sin respuesta al mismo, suspender el tratamiento por 24-48 horas ayudará a aumentar la tasa de recuperación de microorganismos y mejorará la probabilidad de obtener un cultivo positivo.34
Tras realizar el cultivo corneal, se debe de iniciar la terapia antimicrobiana empírica con un antibiótico de amplio espectro (monoterapia con fluoroquinolonas de cuarta generación o combinación de fortificados), impregnando cada minuto por los primeros cinco minutos, cada cinco minutos por los siguientes 15 minutos y cada 15 minutos por una hora.35 Se deberá continuar con la antibioticoterapia cada hora durante las primeras 24-48 horas, realizando evaluación clínica en casos severos (involucro estromal profundo o úlceras mayores a 2 mm con supuración y lisis extensa), diariamente hasta evidenciar mejoría (reducción en el dolor, disminución de la secreción, disminución del edema palpebral e inyección ciliar, consolidación y mejor definición del perímetro del infiltrado, reducción del edema corneal y de la reacción en cámara anterior y reepitelización).7,35 Idealmente, no se deberá modificar la terapia antes de las 48 horas de iniciado el tratamiento antimicrobiano.5 En caso de evidenciar signos de progresión después de 48 horas de iniciado el tratamiento, se debe sospechar de organismos resistentes o pobre apego al mismo; se podrá suspender el tratamiento 24 horas para cultivar de nuevo.
Conclusión
En conclusión, en el presente reporte se proveen guías sobre las tendencias microbiológicas y sensibilidad a antibióticos en las queratitis infecciosas, en un centro oftalmológico de referencia. Estas tendencias podrían ayudar a guiar conductas de tratamiento empíricas, sin embargo cada región debe considerar sus propias condiciones geográficas, climatológicas, de urbanización y socioeconómicas para establecer las mejores pautas terapeúticas.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Enrique O. Graue Hernández.
Jefe del Departamento de Córnea y Cirugía Refractiva, Instituto de Oftalmología “Conde de Valenciana”, IAP.
Chimalpopoca N° 14, Colonia Obrera,
C.P. 06800, México D.F., México.
Teléfono: (+52) 555442 1700, ext. 3710 (oficina). Fax: (+52) 55544 21700, ext. 3701.
Correo electrónico: egraueh@gmail.com