Mycobacterium chelonae (M. chelonae) es una micobacteria atípica no pigmentada de crecimiento rápido. Existe una gran variedad de patologías atribuibles a las micobacterias atípicas, presentándose el primer reporte en oftalmología en 1965. Los casos con involucro corneal tienen en común el antecedente de úlceras crónicas con mala respuesta al tratamiento médico, infección previa, cirugía, uso de lente de contacto o tratamiento con esteroides tópicos de larga evolución. El siguiente artículo trata las generalidades de queratitis infecciosa secundaria a M. chelonae, incluyendo epidemiología, clasificación, manifestaciones clínicas, diagnóstico diferencial, tratamiento y presentación de un caso clínico, posterior a queratoplastía penetrante.
Mycobacterium chelonae (M. chelonae) is a non-pigmented fast-growing atypical Mycobacterium. There is a great variety of attributable pathologies due to atypical Mycobacteria, being the first report in ophthalmology in 1965. The cases with corneal involvement have in common the presence of chronic ulcers poor response to treatment, previous infection, surgery, use of contact lens or prolonged treatment with topical steroids. The following revision article is about the generalities of infectious keratitis secondary to M. chelonae, including epidemiology, classification, clinical manifestations, differential diagnosis, treatment and a case report after penetrating keratoplasty.
• Introducción
Las queratitis infecciosas son una causa importante de morbilidad ocular en todo el mundo, con potencial riesgo de pérdida de la visión e incluso de la integridad ocular. La severidad de la afección corneal depende tanto de las condiciones subyacentes del paciente, como de la patogenicidad del agente infeccioso.
En la mayoría de los casos de queratitis infecciosa, existe al menos un factor predisponente que altera el epitelio corneal, permitiendo que un microorganismo pueda iniciar un proceso infeccioso. Conocer cuál es ese factor predisponente puede orientar hacia la etiología.
Existe un amplio espectro de microorganismos implicados como agentes causales de queratitis infecciosa, siendo en la mayoría de origen bacteriano (70%-90%).
Mycobacterium chelonae (M. chelonae) es una micobacteria atípica de rápido crecimiento, fue reconocida por primera vez como patógeno en los humanos en 1953 por Moore y Frerichs, quienes la aislaron de una articulación de rodilla infectada.1
Reciben este nombre debido a algunas características que los diferencian del tipo "clásico" o Mycobacterium tuberculosis.
Existe una gran variedad de patologías atribuibles a micobacterias atípicas, siendo el primer reporte en oftalmología en 1965 por Turner y Stinson. El primer caso de úlcera corneal crónica causada por M. chelonaee, fue reportado en 1978.2 Aylward, reporta en 1987 el primer caso de infección por esta bacteria en un botón corneal.3 En la mayoría de los casos es confundida con hongos, parásitos o virus.
• Presentación del caso
M. chelonae posqueratoplastía penetrante
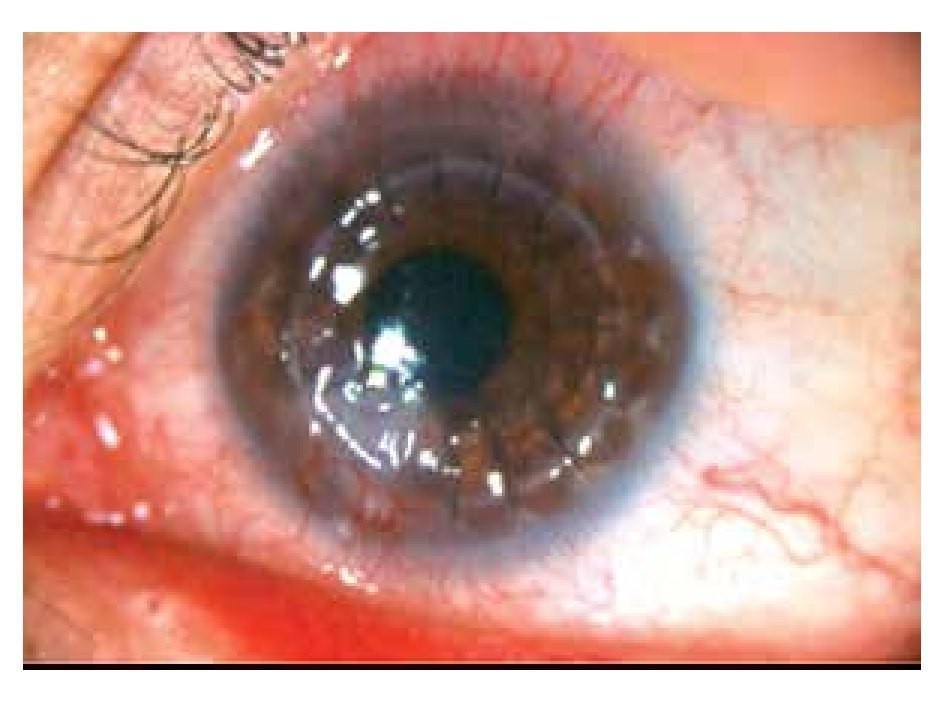
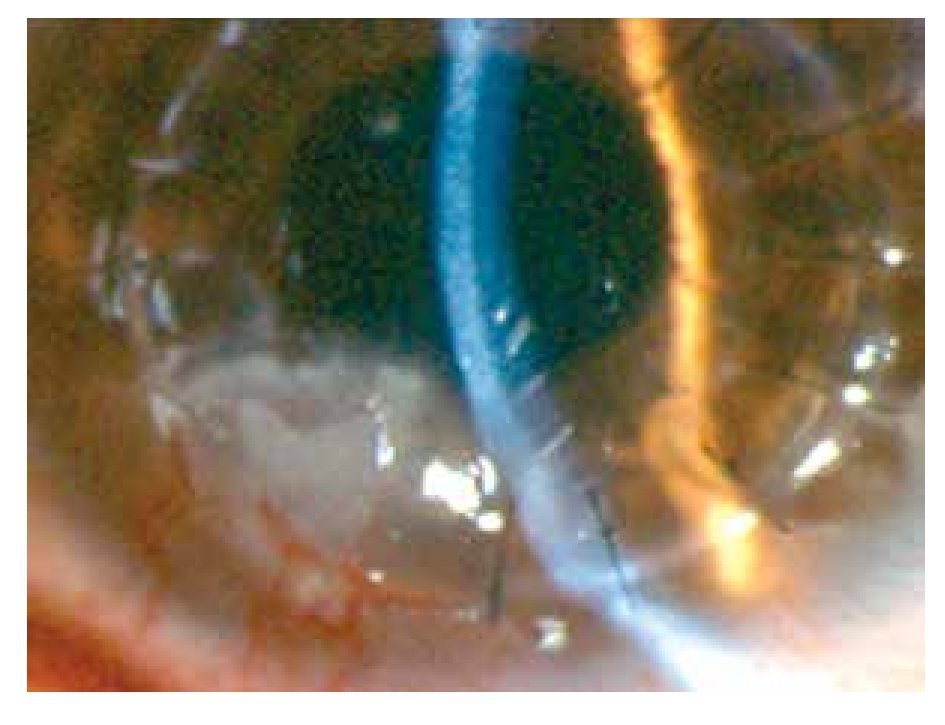
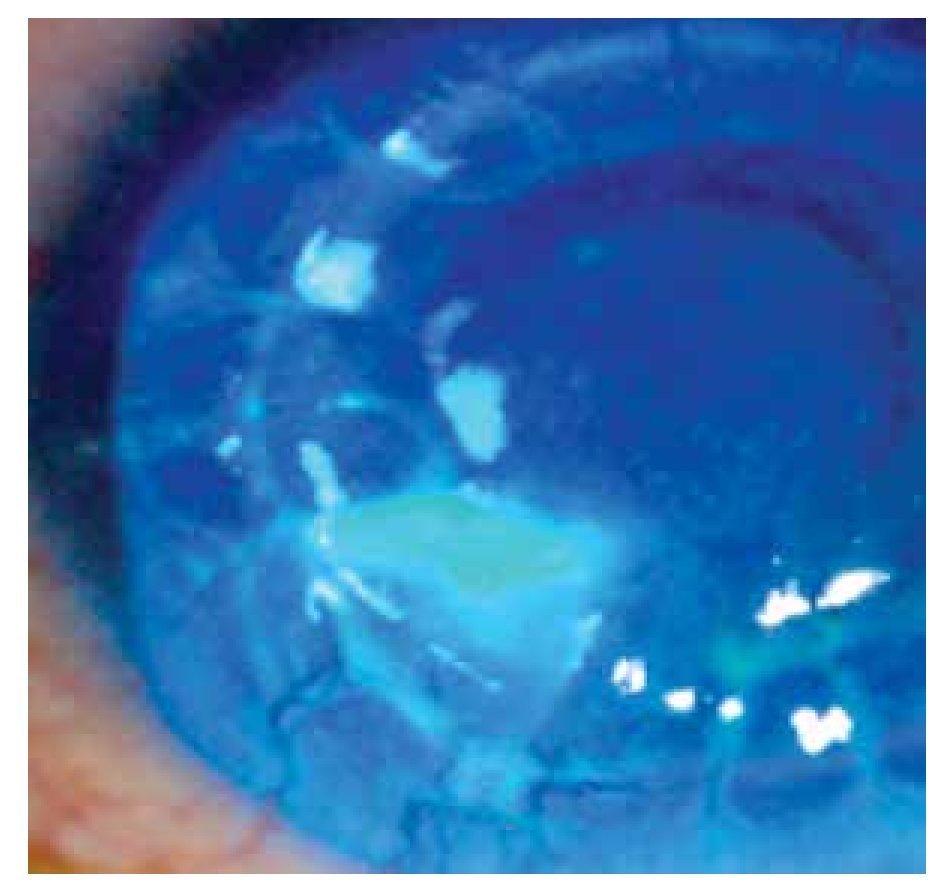
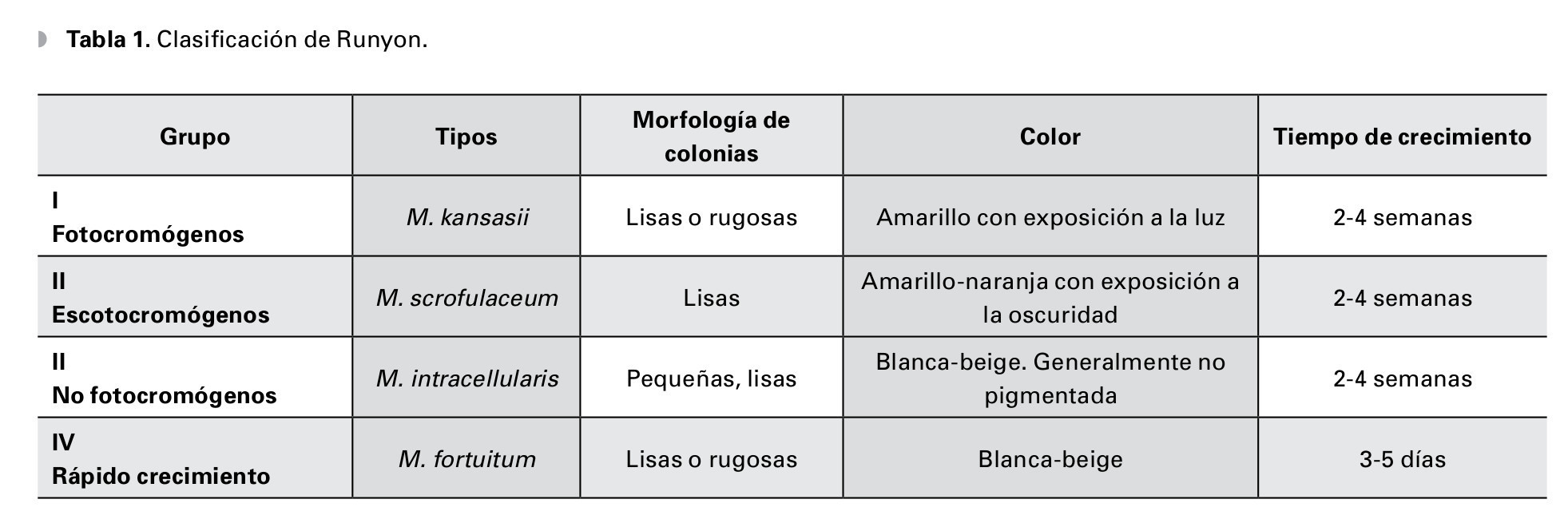
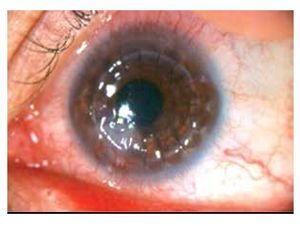
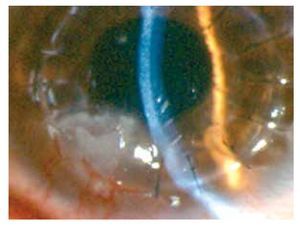
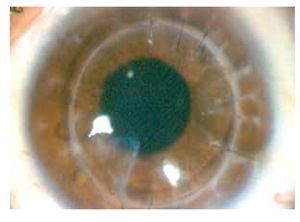
Masculino de 27 años de edad, con antecedente de queratoplastía penetrante de ojo izquierdo por leucoma corneal secundario a virus herpes simple. Acude cuatro meses después con dolor leve, disminución de agudeza visual, sensación de cuerpo extraño, opacidad e hiperemia de ojo izquierdo. En ese momento, se encontró en tratamiento con acetato de fluorometolona (1 mg/1 mL) cada 12 horas e hialuronato de sodio (4 mg/1 mL) cada tres horas. A la exploración física, se encuentra una capacidad visual de 1/10, conjuntiva hiperémica, úlcera en interfase botón huésped inferonasal, de 5 x 4 mm con adelgazamiento central del 50%, vasos que llegan hasta la misma, lisis estromal perilesional y pliegues en Descemet (Figuras 1 y 2), la tinción con fluoresceína delimita la lesión encontrándose además desepitelización difusa (Figura 3), cámara anterior sin células, polo posterior sin alteraciones. Se toma muestra de la lesión, para tinción Gram, cultivo y antibiograma. Se inicia tratamiento empírico con gatifloxacina 0.3% cada hora y se continúa con acetato de fluorometolona (1 mg/1 mL) cada 12 horas e hialuronato de sodio (4 mg/1 mL) cada hora. La tinción de Gram es negativa a bacterias, giemsa con abundantes leucocitos polimorfonucleares y tejido necrótico, PAS negativo a hongos. El cultivo es negativo a bacterias aerobias a las 48 horas de incubación, y negativo a Cándida. A los siete días, se realiza tinción de Ziehl-Neelsen sobre la laminilla de tinción de PAS, encontrándose bacilos ácido alcohol resistentes intracelulares en polimorfonucleares. El antibiograma muestra sensibilidad a fluoroquinolonas, macrólidos, aminoglucósidos y cefalosporinas. Se llega al diagnóstico de úlcera corneal en interfase botón huésped secundaria a micobacteria atípica, tipo M. chelonae.
•Figura 1. Hiperemia conjuntival, úlcera en interfase, botón huésped inferonasal de 5 x 4 mm.
•Figura 2. Adelgazamiento central del 50%, neovascularización superficial, lisis estromal y pliegues en Descemet.
•Figura 3. Tinción con fluoresceína que delimita la lesión, queratitis punteada difusa.
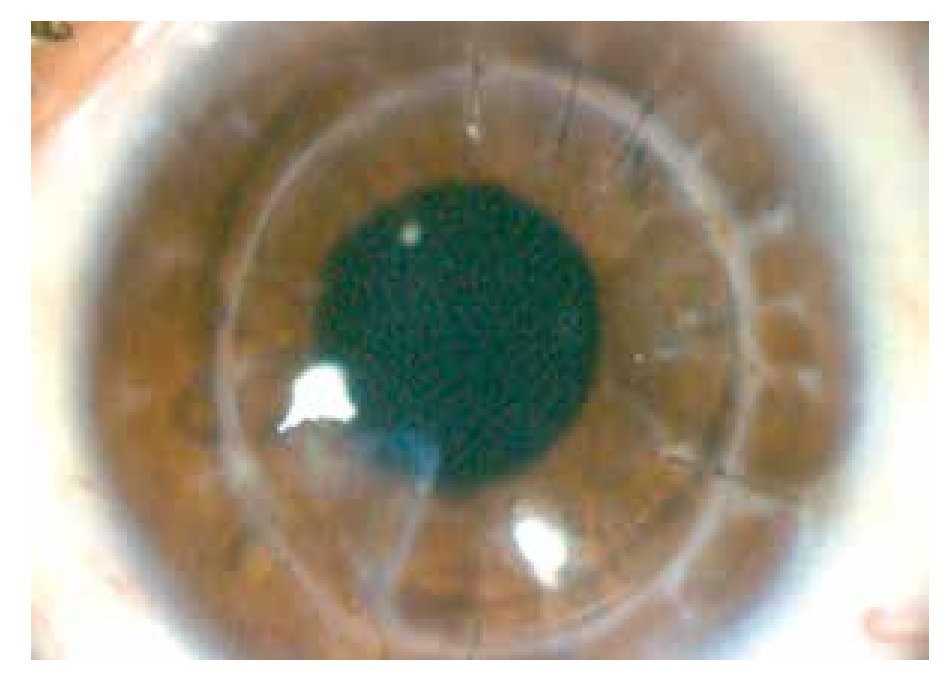
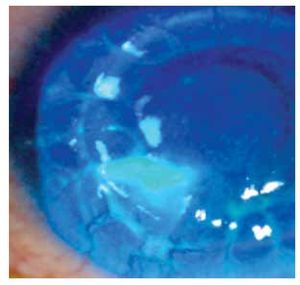
Por mejoría clínica se decide continuar con el mismo tratamiento hasta resolución del cuadro infeccioso. Seis meses después, se encuentra con capacidad visual de 7/10, el botón corneal se encontró con leucoma en cuadrante inferonasal de 2 x 2 mm y vascularización superficial (Figura 4).
• Figura 4. Resolución del cuadro clínico.
• Discusión
Historia de las micobacterias
El primer miembro del género Mycobacterium, el bacilo de lepra (Mycobacterium leprae) fue descubierto por Hansen en 1868. En 1882, Robert Koch descubrió al bacilo de tuberculina. De 1898 a 1910, Theobald Smith demostró que el bacilo ácido-rápido consistía de dos grupos, el humano, M. tuberculosis y el bovino, Mycobacterium bovis.
En el siglo XIX y XX, los investigadores se percataron de la existencia de bacilos ácido-rápidos saprofíticos incapaces de producir enfermedades. Por muchos años microorganismos parecidos a M. tuberculosis, fueron aislados de abscesos y lesiones pulmonares durante autopsias en humanos. Al inocular a estos microorganismos en animales de laboratorio, no se produjo ninguna enfermedad, por lo que no fueron reconocidos como causantes de enfermedad en humanos.
Los reportes de Pinner en 1935, Handuroy en 1946 y Pollak y Buhler en 1953, sirvieron para demostrar la importancia de estos inusuales organismos saprofíticos o "micobacterias atípicas". Pollak y Buhler aislaron a la micobacteria atípica de dos pacientes con enfermedad pulmonar. Este organismo fue llamado "bacilo amarillo" por el color de sus colonias. Runyon demostró que el color amarillo se presentaba después de la exposición al sol y reincubación, dándole entonces el nombre de "fotocromógeno". En 1955, Handuroy nombró a este microorganismo Mycobacterium kansasii.
Pollak y Buhler cultivaron a un microorganismo distinto en pacientes con enfermedad parecida a tuberculosis, llamándolo "bacilo naranja" para distinguirlo del "bacilo amarillo". Este microorganismo pertenecía al grupo de micobacteria atípica, la cual producía colonias amarillas o naranjas en oscuridad, por lo que se les dio el nombre de escotocromógenos.
En 1949, Cuttino y Mc Cabe describieron un organismo ácido-rápido al cual llamaron Nocardia intracellularis. En 1957, se encontró a otra micobacteria atípica causante de enfermedad pulmonar en un humano en Battey, Georgia, dándosele el nombre de "Bacilo Battey". Se reconoce ahora que Nocardia intracellularis y el "Bacilo Battey" son el mismo microorganismo. Runyon les dio el nombre de no fotocromógenos, por la incapacidad de sus colonias para desarrollar pigmento con la exposición a la luz.
En 1938 Costa Cruz, aisló un organismo de un absceso pulmonar en una mujer en Brasil, dándole el nombre de Mycobacterium fortuitum. Este organismo ácido-rápido, es de rápido crecimiento y pertenece al grupo de especies saprófitas, Mycobacterium phlei y Mycobacterium smegmatis.
En 1948, Mc Callum aisló a Mycobacterium ulcerans de úlceras en humanos. En 1954, Linell y Norden encontraron otro organismo responsable de úlceras en la piel, llamándolo Mycobacterium balnei. Se prefiere el nombre de Mycobacterium marinum, éste es fotocromógeno y de rápido crecimiento. Tanto M. ulcerans y M. marinum crecen a temperatura bajas.
Existen varios factores responsables del reconocimiento de micobacteria atípica, como es el que M. tuberculosis haya desarrollado resistencia a diversos agentes terapéuticos, por lo que hubo un aumento en las pruebas utilizadas para su aislamiento, caracterización y cultivo, sirviendo entonces para revelar la presencia de las micobacterias atípicas.
Clasificación de micobacterias atípicas
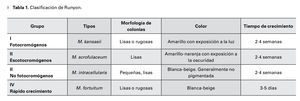
En 1954, Runyon describió la micobacteria atípica a partir de 120 pacientes, dividiéndola en cuatro grandes grupos, de acuerdo a las características de sus colonias y al desarrollo de pigmentación al ser expuestas con la luz.
Clasificación de Runyon
La Tabla 1 muestra la clasificación de acuerdo a la morfología de las colonias observadas en cultivo, color y tiempo de crecimiento.
Hace una década se incluyó a Mycobacterium abscessus como una subespecie de M. chelonae. Se ha descrito una nueva especie, Mycobacterium mucogenicum, también conocida como "M. chelonae-like", estableciéndose una nueva reclasificación de las micobacterias del complejo M. fortuitum (o complejo M. fortuitum-chelonae) en seis especies: M. fortuitum, M. peregrinum, M. fortuitum tercera biovariedad, M. chelonae, M. abscessus y M. mucogenicum.
Epidemiología de las micobacterias atípicas
M. chelonae es una micobacteria ubicua y de distribución universal. Se ha descrito en humanos, animales y medio ambiente, en todos los continentes. Se ha recuperado del suelo y, fundamentalmente, del agua. Es resistente a la cloración. Se ha podido aislar en el agua de redes hospitalarias y en algunos desinfectantes como el violeta de genciana. Puede hallarse en el esputo de individuos sanos.
En el laboratorio la identificación del grupo al que pertenecen es importante, ya que la mayoría de estos microorganismos son de escasa patogenicidad. Por el contrario, las especies englobadas en el grupo M. fortuitum, grupo IV de Runyon, están consideradas como patógenos humanos oportunistas. Es importante identificar correctamente estos microorganismos, ya que pueden requerir regímenes terapéuticos distintos.
Patología de las micobacterias atípicas
M. atípico es un organismo oportunista. Es necesario que existan factores predisponentes para que se produzca enfermedad. En particular los niños y adultos con enfermedades crónicas debilitantes, son los más susceptibles a infecciones por micobacterias. Algunos de los casos reportados, tienen el antecedente de haber sido tratados por un largo periodo con esteroides.4 Existe una relación directa entre la infección pulmonar secundaria a micobacteria atípica y el daño preexistente al pulmón, como en pacientes con silicosis o enfisema. En la mayoría de los casos, no se puede encontrar ningún factor predisponerte.
El portal de entrada de micobacteria atípica no es del todo conocido. El hecho de que algunos organismos se encuentren en lavados gástricos, sugiere la posibilidad de que pudiera ser ingerido. Estos organismos se depositan en los nódulos cervicales, ya sea vía hematógena o linfática. La inoculación de la piel, es bien conocida.4 También es posible que éste se adquiera al ser inhalado, sin embargo hasta el momento no existe evidencia de esta vía. Es muy probable que las lesiones pulmonares tengan una vía de diseminación hematógena similar a M. tuberculosis.
La enfermedad pulmonar es la manifestación más frecuente de la infección por micobacterias atípicas, siendo el grupo I y II de Runyon los más involucrados.
Las infecciones corneales secundarias a micobacterias atípicas del grupo IV de Runyon, han sido reportadas en varias ocasiones en pacientes sin evidencia de otra enfermedad.4 Es posible que estas infecciones sean secundarias a inhalación o al contacto directo con polvo o cuerpos extraños infectados por esta micobacteria. Cuando existe infección por microorganismos del grupo III de Runyon, se han observado lesiones en coroides, atrofia óptica, hemorragias retinianas e infección orbitaria bilateral.
Manifestaciones oftalmológicas de las micobacterias atípicas
Todos los pacientes con involucro corneal, tienen en común el antecedente de infección previa, cirugía, uso de lente de contacto o tratamiento con esteroides de larga evolución. En la mayoría de los casos, los pacientes han presentado úlceras de larga evolución con mala respuesta al tratamiento médico, siendo tratadas con diversos antibióticos ya sea tópicos y/o sistémicos, esteroides o combinación de antibióticos y esteroides.
Las micobacterias pueden afectar la córnea (generalmente por M. chelonae, grupo IV de Runyon) u ocasionar lesiones coroideas, palidez del nervio óptico, hemorragias retinianas o involucro orbitario (generalmente por el "Bacilo Battey", grupo III de Runyon).
Las úlceras corneales son de color blancogrisáceo, extendiéndose hasta estroma profundo.
Generalmente afectan la porción central de la córnea, variando en tamaño de 1.5 mm hasta todo el diámetro corneal. La forma puede variar desde úlceras grandes con bordes irregulares, hasta pequeñas con bordes bien definidos. Pueden tener un aspecto exudativo, lo que hace que en la mayoría de los casos sean confundidas con úlceras de origen bacteriano, hasta "secas". Son indoloras, de crecimiento lento y caracterizadas por periodos de remisión-recurrencia. Es muy raro que ocurra perforación asociado a hipopión y endoftalmitis. Las reacciones en cámara anterior van desde inflamación leve a moderada. En ocasiones pueden observarse infiltrados corneales o lesiones satélites adyacentes a la úlcera, lo que dificulta el diagnóstico, pudiendo simular una queratitis micótica.
La vascularización corneal no es una característica común, pudiendo encontrase en ciertos casos. La inyección conjuntival y reacción ciliar varían desde moderada a severa.
Diagnóstico diferencial
No es fácil distinguir cuando se trata de una úlcera ocasionada por bacterias, hongos o micobacterias. Las lesiones satélites, que son características de úlceras corneales micóticas, también se pueden encontrar en infecciones por M. fortuitum. El hipopión es una característica común en infección micótica. Este hallazgo se presenta en varios casos de M. fortuitum, con reacción en cámara anterior leve a moderada. Es difícil distinguir entre las lesiones ocasionadas por micobacteria y aquellas por hongos, por lo que deben hacerse tinciones especiales para bacilos ácido-rápidos, así como preparaciones en hidróxido de potasio y cultivos especiales para hongos. Independientemente del caso, la terapia con esteroides está contraindicada tanto para los hongos como para las micobacterias.
Las úlceras corneales por Nocardia asteroides son raras, con un curso indolente y debe distinguirse de aquella ocasionada por micobacteria. Los dos organismos son Gram positivos. Las formas ácido-rápidas de Nocardia, pueden confundirse con micobacterias en la tinción de Ziehl- Neelsen.
La invasión corneal por el bacilo de tuberculosis (M. tuberculosis) es extremadamente rara, debe diferenciarse de la infección por micobacteria atípica. La afección corneal por M. tuberculosis es secundaria a infección de conjuntiva, esclera o úvea.
Aspectos microbiológicos
En el examen microscópico, estas bacterias aparecen como bacilos ácido alcohol resistentes directamente en la muestra. Algunas cepas presentan poca afinidad por los fluorocromos, por lo que pueden no teñirse adecuadamente con Auramina. Se debe realizar siempre una tinción de Ziehl-Neelsen ante la sospecha de M. chelonae u otros miembros de este grupo.
M. chelonae crece en los medios habituales de micobacterias
Löwenstein-Jensen o agar Middlebrook, en tres a siete días como una colonia no pigmentada. Se detecta a las 24-48 horas de la siembra en los medios de cultivo líquidos que actualmente se recomiendan para el cultivo primario de micobacterias, como son el Bactec 460 TB, Bactec MGIT 960, MB/ BacT o ESP II.
Crece también en medios habituales, como el agar sangre. Su temperatura de crecimiento idónea es a 28°C-30ºC.
Se han descrito numerosas pruebas bioquímicas para la identificación de estos organismos. Como se mencionó antes, la velocidad de crecimiento y la ausencia de pigmento, selecciona el grupo de las micobacterias de rápido crecimiento no pigmentadas. De entre todas ellas, interesa discriminar el complejo patógeno M. fortuitum, que puede realizarse mediante las pruebas de crecimiento en agar McConkey sin cristal violeta y la prueba aril-sulfatasa, que es positiva a los tres días.
M. chelonae, M. abscessus y M. mucogenicum se diferencian de M. fortuitum por la ausencia de la enzima nitratorreductasa, y por su incapacidad de asimilar hierro a partir de un medio con citrato férrico amoniacal. Algunas cepas de M. mucogenicum pueden dar positivas alguna de las dos pruebas anteriores, reflejando cierta heterogeneidad en esta nueva especie.
M. chelonae puede diferenciarse de M. abscessus mediante dos pruebas: la ausencia de crecimiento en medio con NaCl al 5% y la utilización de citrato sódico.
Existen ahora varias técnicas moleculares para la identificación de micobacterias como el método PRA (PCR-RFLP Analysis), que analiza el gen hsp65, mediante el cual se obtiene distintos patrones de bandas, cuyo tamaño y composición pueden integrarse en una base de datos. Esta técnica permite identificar y separar correctamente especies de M. chelonae y M. abscessus en cuatro a cinco horas, a partir de pocas colonias crecidas en medios sólidos o de cultivos líquidos.
Sensibilidad antibiótica de micobacterias
Se recomienda preparar una suspensión de la micobacteria a una concentración equivalente al patrón 0.5 de McFarland, alcanzando un inóculo final del antibiótico de 5x105 ufc/ml. Se incuba el panel a 30ºC y se realiza la lectura a las 72 horas. Si no hay suficiente crecimiento, se realizará la lectura diariamente hasta los cinco días.
Se han desarrollado diferentes técnicas para el antibiograma de estas micobacterias, como son el método de difusión en agar con discos, la técnica de elución de discos en agar, o la determinación de la concentración mínima inhibitoria (CMI) por dilución en agar.
Se recomienda de forma estricta, realizar la lectura a los tres días de incubación. M. fortuitum, pero la velocidad de crecimiento de M. chelonae o M. abscessus es más inconstante, de forma que no es posible realizar la lectura antes de los cuatro a cinco días.
La CMI al sulfametoxazol es difícil de establecer, ya que se propone considerar sólo el 80% de inhibición de crecimiento. No obstante, se ha observado que, prácticamente todas las cepas de M. chelonae y M. abscessus son virtualmente resistentes.
La claritromicina y el ciprofloxacino presentan dificultad para establecer el punto final de la CMI. Más del 95% de las cepas de M. chelonae son sensibles a la claritromicina.
Con el imipenem se ha comprobado que existe poca reproducibilidad interlaboratorio. Algunos autores lo atribuyen a la inestabilidad del fármaco. La sensibilidad al imipenem varía del 40%-60% entre las cepas de M. chelonae.
En estudios de sensibilidad realizados por la técnica de microdilución se ha observado que las cepas de M. chelonae son sensibles a la tobramicina, mientras que M. abscessus se muestra más sensible.
Por lo que se refiere al tratamiento, M. chelonae y M. abscessus son resistentes a los fármacos antituberculosos. En las infecciones localizadas suele asociarse al tratamiento quirúrgico, si es posible un antimicrobiano eficaz (claritromicina). En las infecciones diseminadas se recomiendan las asociaciones de claritromicina y amikacina, claritromicina y tobramicina, o amikacina e imipenem.
Tratamiento de las micobacterias
El grupo IV de Runyon, incluyendo a M. fortuitum y M. chelonae, es resistente a todos los medicamentos conocidos para el tratamiento de tuberculosis.
La combinación de amikacina tópica y ciprofloxacino o amikacina con claritromicina, ha sido la piedra angular del tratamiento de las queratitis secundarias a M. chelonae.5 A pesar del tratamiento agresivo, en la mayoría de los casos no se obtiene un buen resultado clínico.
La claritromicina es un antibiótico macrólido, con excelente actividad in vitro contra M. chelonae,6 de manera tópica ha demostrado penetrar el epitelio intacto corneal.
Ford reportó que hasta un 55% de los casos de queratitis secundaria a micobacterias no tuberculosas, no respondían bien al tratamiento médico, siendo necesario una intervención quirúrgica para la erradicación del mismo. En aquellos pacientes posoperados de LASIK con queratitis secundaria a micobacteria atípica, a veces es necesario retirar el flap o incluso realizarse queratoplastía penetrante acompañado de tratamiento médico, para poder erradicar la infección.
La gatifloxacina, una fluoroquinolona de última generación con amplio espectro antimicrobiano, ha demostrado ser más activa en comparación con el ciprofloxacino contra micobacterias de rápido crecimiento, por lo que actualmente se considera como una buena alternativa para el tratamiento de estas infecciones.
El tratamiento con ciprofloxacino ha demostrado ser eficaz en estudios in vitro contra M. chelonae,7 pero menos efectivo en casos de queratitis por M. chelonae in vivo, en comparación con M. fortuitum.
M. chelonae generalmente es sensible a amikacina y claritromicina, pero resistente a ciprofloxacino. Las fluoroquinolonas actúan en dos sitios a nivel cromosomal, DNA girasa (topoisomerasa II) y topoisomerasa IV. La resistencia microbiana se desarrolla cuando existen mutaciones en la enzima topoisomerasa. La cadena C-8 metoxi de la gatifloxacina, evita que las bacterias desarrollen resistencia, al ser necesario la mutación de las dos topoisomerasas para que se desarrolle resistencia.
La gatifloxacina 0.3% incrementa la eficacia de la amikacina fortificada (50 mg/mL) y claritromicina (10 mg/mL), cuando se administran en terapia combinada. La eficacia de la triple combinación con gatifloxacina, amikacina y claritromicina, es superior que la monoterapia con gatifloxacina en cuanto al número de unidades formadoras de colonias.8
Se ha observado que parte de la mala respuesta al tratamiento del ciprofloxacino, ya sea solo o en combinación con amikacina fortificada, ha sido debido al uso concomitante de esteroides. En un modelo animal de queratitis por micobacterias hecho por Joon y colaboradores, el 80% de los ojos con estos organismos que eran sensibles al tratamiento antibiótico, no respondieron adecuadamente debido al uso simultáneo de esteroides.
La actividad antimicrobiana de los medicamentos depende de su penetración a través del epitelio corneal. Se sabe que la claritromicina alcanza adecuados niveles terapéuticos en el tejido corneal en comparación con la azitromicina, la cual tiene muy poca penetración a nivel tisular.9
La gatifloxacina y la triple combinación de gatifloxacina, amikacina fortificada y claritromicina, son consideradas como una buena opción terapéutica, a pesar de que en la mayoría no se logra una total erradicación del microorganismo y por ende de la infección, siendo necesario como se mencionó antes una intervención quirúrgica.10
Diversos estudios han demostrado que la terapia local con esteroides, está contraindicada en infecciones corneales por micobacterias. La mayoría de los casos de queratitis secundaria a M. fortuitum o al grupo IV de Runyon, son tratados al menos en una ocasión con esteroides durante el curso de la infección,4 debido a que en muchos casos son confundidos con queratitis de origen bacteriano, más que por micobacterias.
• Conclusiones
Existen diversos factores predisponente para las queratitis infecciosas como es el uso de lentes de contacto, traumatismos, cirugías oculares y diversas afecciones locales y/o generales. Los agentes etiológicos abarcan una enorme diversidad de microorganismos, incluyendo bacterias, micobacterias, virus, hongos y parásitos.
M. chelonae es una especie perteneciente al grupo de micobacterias no pigmentadas de crecimiento rápido, incluidas en el grupo IV de Runyon.
Las queratitis secundarias a M. chelonae se caracterizan por tener un curso tórpido, subagudo, de difícil diagnóstico si no se tiene una alta sospecha, y que a pesar de tratamiento antimicrobiano y quirúrgico, tiene un pronóstico reservado.
La combinación de amikacina y gatifloxacina tópica junto con claritromicina vía oral, han sido la piedra angular del tratamiento de las queratitis secundarias a M. chelonae.
• Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
• Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Correspondencia:
Dra. Jessica Ariadna Carmona Hernández.
Circuito Científicos N° 17, Ciudad Satélite,
C.P. 53100, Naucalpan, Méx., México.
Teléfono: 5562 3003. Celular: (044 55) 1822 6941.
Correo electrónico: jessica1812@hotmail.com