Objetivo: Evaluar la eficacia del uso de bevacizumab intralesional, para reducir la recidiva de pterigión posterior al tratamiento quirúrgico.
Métodos: Fueron incluidos 76 pacientes con diagnóstico de pterigión (primario o recidivante), los cuales recibieron algún tipo de cirugía ya fuera cierre simple o injerto conjuntival (31 y 45, respectivamente). Fueron divididos en dos grupos de manera aleatoria para recibir bevacizumab por inyección intralesional, posterior al procedimiento quirúrgico. El seguimiento se evaluó a los cuatro meses posteriores al procedimiento.
Resultados: La mediana de edad de los pacientes fue de 39.5 años (17-69 años); 24 (31.6%) mujeres y 52 (68.4%) hombres. Del total, 56 pacientes presentaban pterigión primario y 20 recidivante. En 56 pacientes se utilizó bevacizumab intralesional adyuvante a la terapia quirúrgica. En los pacientes con pterigión primario en quienes se utilizó bevacizumab como terapia coadyuvante, solamente dos (4.7%) presentaron recurrencia de la enfermedad a los cuatro meses posteriores del evento quirúrgico. En contraste, de los pacientes en quienes no se administró bevacizumab, 10 (76.9%) presentaron recidiva al cuarto mes (p≤0.001). Del grupo de pacientes con pterigión recidivante y que recibieron terapia adyuvante con bevacizumab posterior al tratamiento quirúrgico, solamente uno (7.7%) presentó recidiva de la enfermedad a los cuatro meses contra cinco (71.4%) pacientes del grupo con las mismas características, en los cuales no se utilizó bevacizumab (p=0.007).
Conclusión: El uso de bevacizumab intralesional posterior a la terapia quirúrgica, es efectivo para reducir la recidiva de la enfermedad a mediano plazo.
Objective: To evaluate the efficacy of intralesional bevacizumab in reducing pterygium recurrence after surgical treatment.
Methods: We included 76 patients diagnosed with pterygium (primary or relapsed), which received some form of surgery either simple closure or conjunctival graft (31 and 45 respectively). They were separated in two groups at random to receive intralesional injection of bevacizumab after surgery. The follow up was assessed at four months after the procedure.
Results: The median age of patients was 39.5 years (17-69 years), 24 (31.6%) female and 52 (68.4%) male. Of these, 56 patients had primary pterygium and 20 recurrent. In 56 patients was used intralesional bevacizumab adjunct to surgical therapy. In patients with primary pterygium in which bevacizumab was used as adjuvant therapy, only two (4.7%) had recurrent disease at four months after the surgical event; in contrast, patients in whom wasn´t used bevacizumab, in 10 of them (76.9%) was founded recurrence at four months (p≤0.001). Group of patients with recurrent pterygium who received adjuvant therapy with bevacizumab after surgery, only one (7.7%) had disease recurrence at four months versus five (71.4%) patients with the same characteristics in the bevacizumab which was not used (p=0.007).
Conclusion: The use of bevacizumab after intralesional surgical therapy is effective in reducing disease recurrence in the medium term.
Introducción
La palabra pterigión tiene su raíz del griego “ptery” que significa “ala”.1 Se trata de una lesión conjuntival, en la cual el tejido conectivo se extiende sobre la córnea. Se ha comprobado que factores como la inflamación y la proliferación fibrovascular2 forman un papel importante en su desarrollo, requiriéndose neovascularización y angiogénesis para su progresión.3 La lesión tiene forma triangular, con base en la periferia, usualmente en la conjuntiva nasal y se extiende hacia la córnea donde tiene su vértice,4 allí puede afectar la visión y causar sensación de cuerpo extraño. Se presenta con una prevalencia que varía del 1.2% hasta alcanzar un 23.4%, dependiendo la población estudiada.5
Algunos factores de riesgo para desarrollar pterigión, incluyen la córnea expuesta a la radiación ultravioleta de la luz solar y otras fuentes. Ésta provoca estrés oxidativo y mutaciones genéticas que estimulan procesos inflamatorios hiperproliferativos.6,7 El viento y el polvo son factores que producen irritación ambiental, por lo cual es más común observar esta anomalía en hombres que en mujeres y más en aquellos que realizan sus actividades al aire libre.8 Entre otros posibles factores causales están diferentes mecanismos anti-apoptóticos, inmunológicos, citocinas, moduladores de matriz extracelular, factores genéticos e infecciones virales.9
Los primeros reportes de su tratamiento se remontan al año 1000 a.C., cuando el médico hindú Susruta Samhita resecó un pterigión.10 Desde entonces, la escisión quirúrgica continúa siendo el tratamiento base para esta patología.11 A través del tiempo han sido probadas diferentes terapias conservadoras para minimizar los síntomas clínicos o retrasar su progresión, si se encuentra en etapas tempranas. Hoy, existen abordajes para prevenir la recurrencia posquirúrgica como la radioterapia, algunas técnicas quirúrgicas como queratoplastía lamelar o autoinjerto y fármacos quimioterapéuticos como el bevacizumab, un anticuerpo monoclonal humanizado, que actúa de forma selectiva contra el factor de crecimiento del endotelio vascular (VEGF).12,13
Métodos
Se trata de un estudio prospectivo y longitudinal, en el cual fueron incluidos 76 pacientes con diagnóstico de pterigión, que recibieron su atención en el Hospital General de Zona N° 67 “Bicentenario de la Independencia” del Instituto Mexicano del Seguro Social, con sede en Apodaca, México, por parte del Servicio de Oftalmología, desde diciembre de 2010 hasta febrero de 2012. Todos los pacientes incluidos en el estudio aceptaron la firma del consentimiento informado, el protocolo fue aprobado por el Comité de Ética de la Institución.
Las características demográficas de los pacientes fueron analizadas y se les dividió en dos grupos según la etapa de la enfermedad, ya sea primaria o recidivante; a su vez, se subdividieron aleatoriamente mediante unas tarjetas, según el uso o no de bevacizumab para su tratamiento. Otra variable considerada fue el tipo de pterigión estacionario o progresivo.
Una vez clasificadas, las lesiones se trataron por uno de dos abordajes quirúrgicos: cierre simple o injerto conjuntival. Posterior al proceso quirúrgico, el grupo de pacientes asignado al uso de bevacizumab recibió una inyección intracorpórea de dicho fármaco, a dosis de 2.5 mg/0.1 mL utilizando aguja calibre 25, con microscopio dentro del quirófano. El seguimiento de los pacientes fue de cuatro meses.
Análisis estadístico
Para realizar el análisis estadístico se utilizó el software SPSS v. 15 (Chicago, IL, USA), con el cual se realizó un análisis descriptivo para obtener la mediana de las variables discretas, media para variables continuas y frecuencias para variables nominales. En el análisis comparativo de las variables cualitativas, se utilizaron tablas de contingencia con el valor de ji cuadrada para valorar su significancia estadística. En cuanto a las variables cuantitativas se utilizó la prueba de Kolmogorov-Smirnoff, en base a la cual para las variables paramétricas se utilizó la prueba t de Student y en las no paramétricas la U de Mann-Whitney.
Resultados
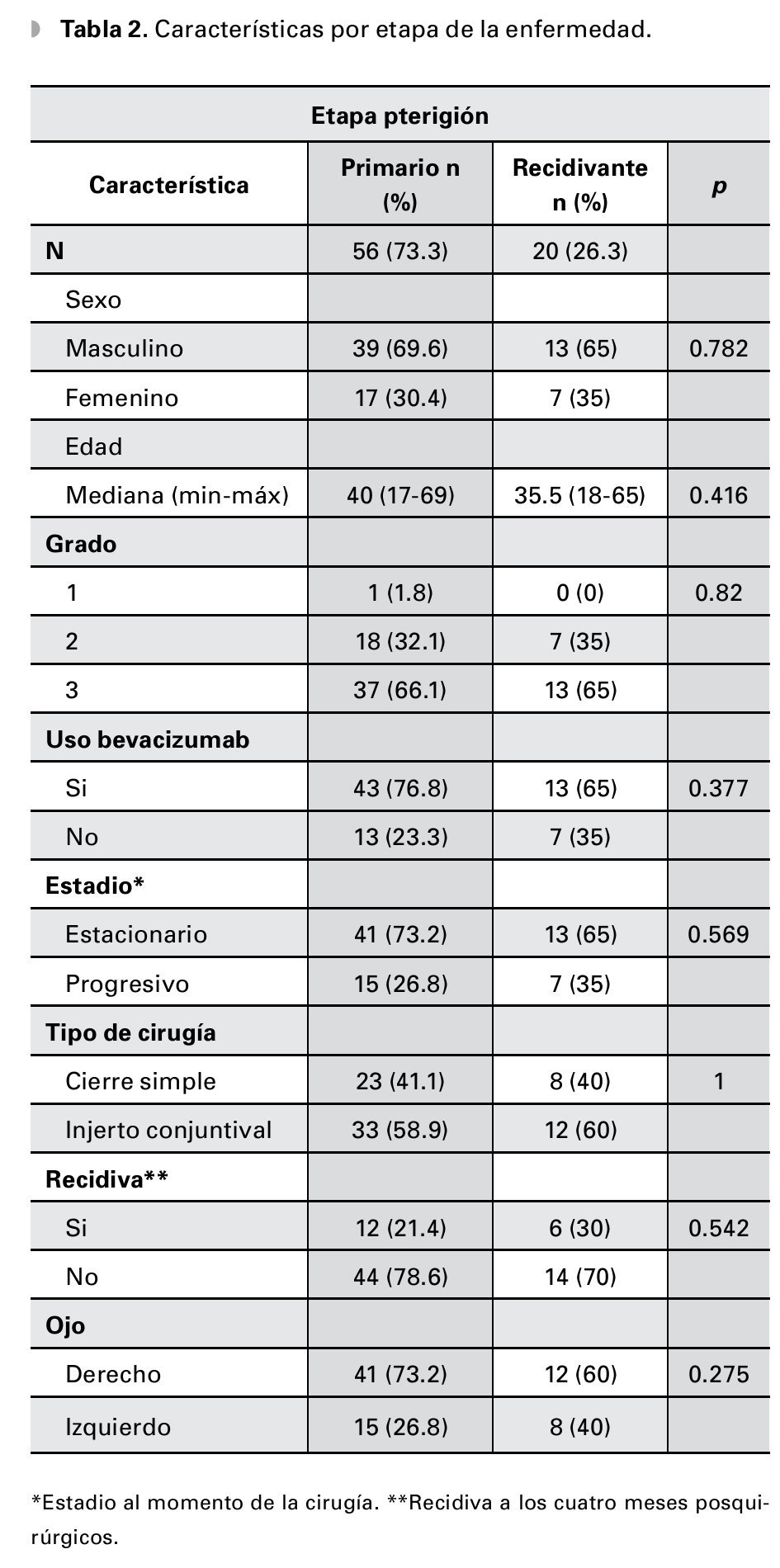
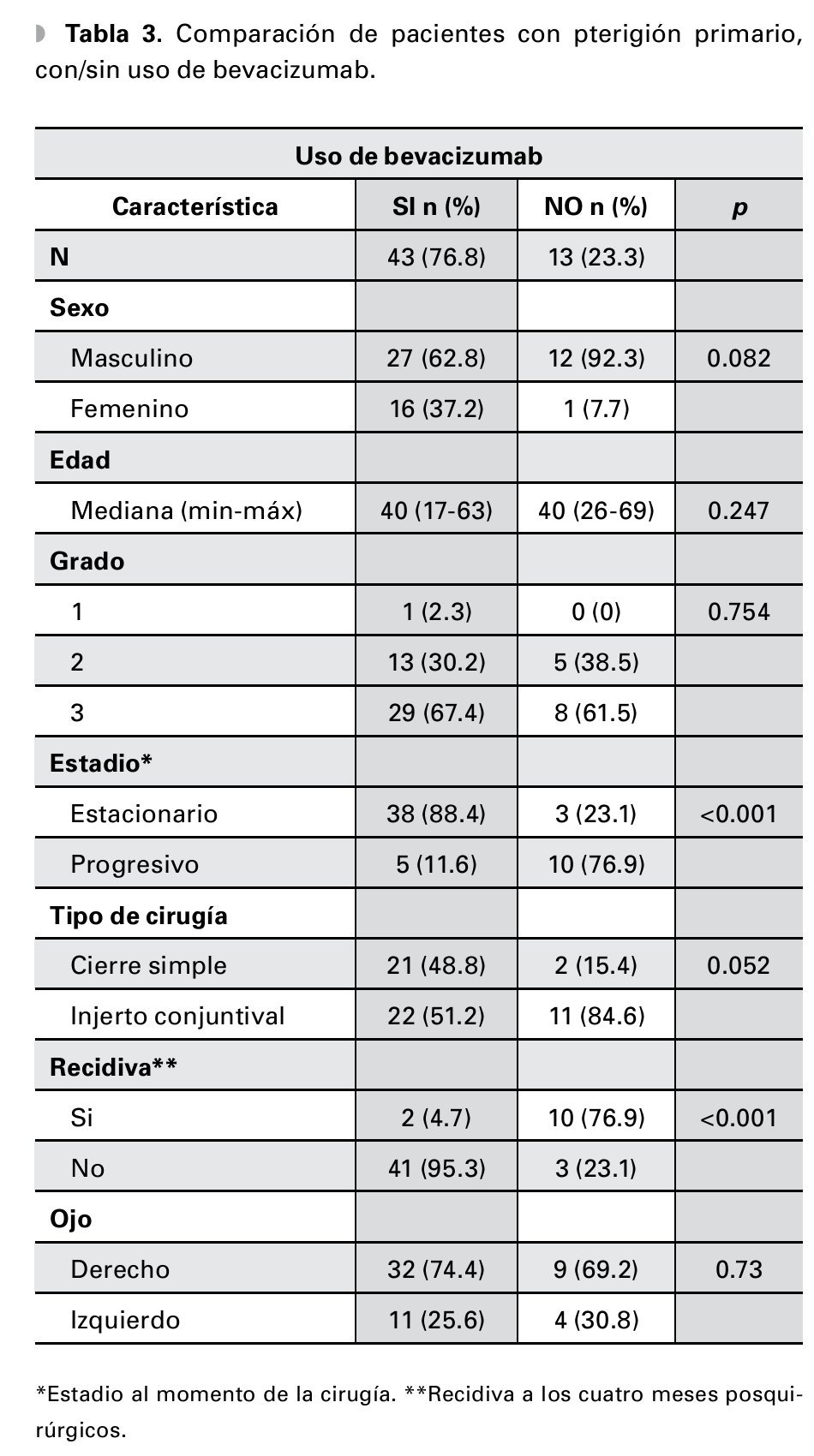
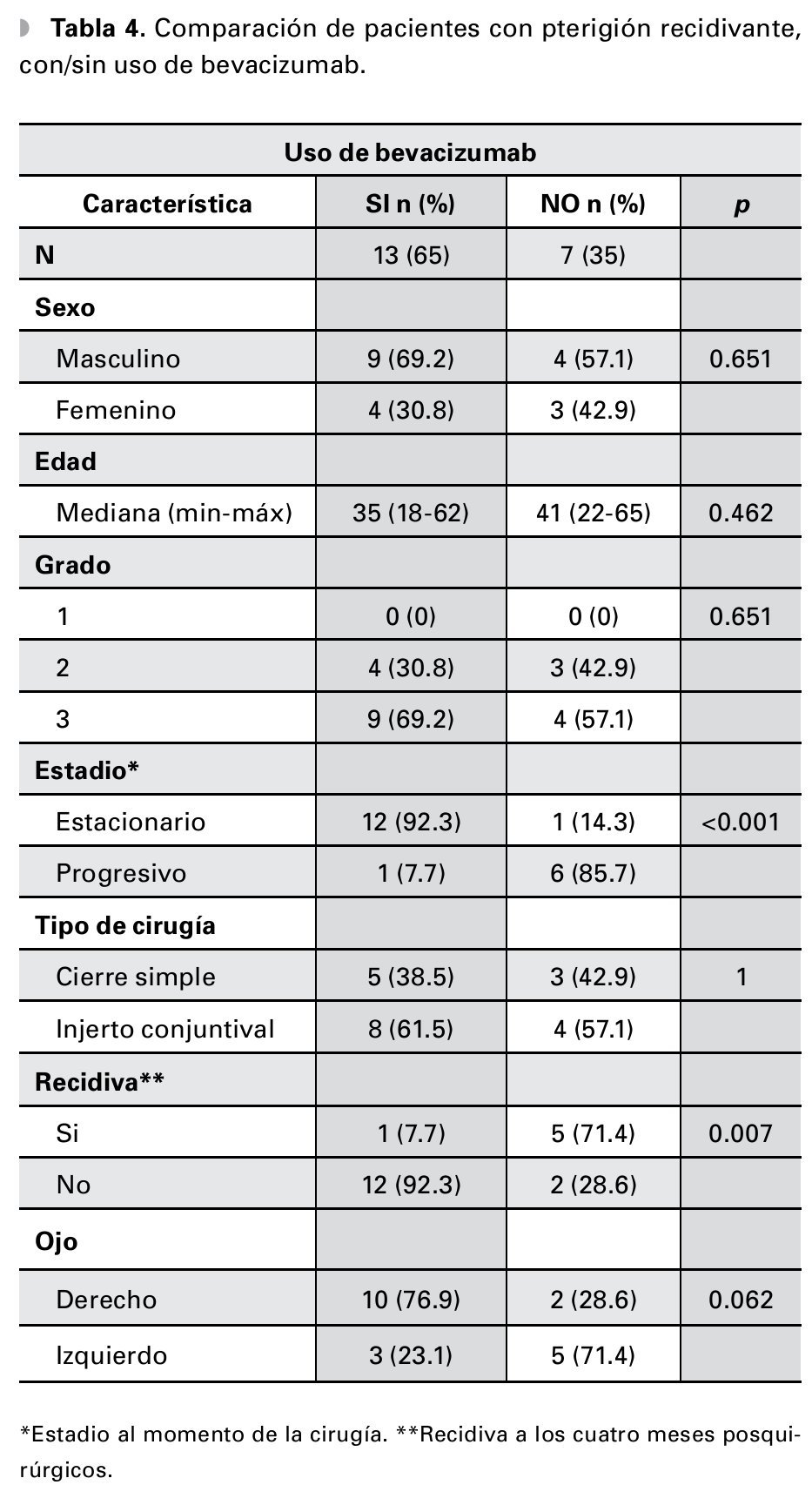
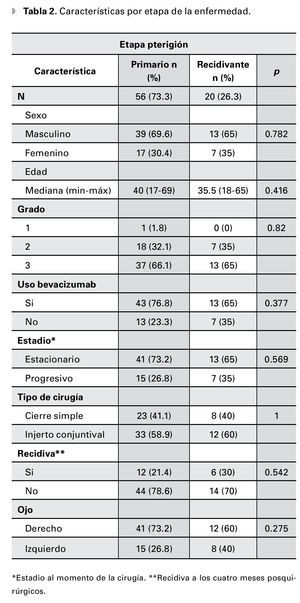
Se analizó un total de 76 pacientes, con una mediana de edad de 39.5 años (rango: 17-69). Del total de pacientes, 24 (31.6%) son mujeres y 52 (68.4%) hombres (Tabla 1). Para su análisis, se dividió a los pacientes según la etapa del pterigión en: pterigión primario (n=56, 73.7%, con una mediana de edad de 40 años) o recidivante (n=20, 26.3%, con una mediana de edad de 35.5 años) (Tabla 2). A su vez, se subdividió en cada uno de los grupos dependiendo el uso o no de bevacizumab para el tratamiento (Tablas 3 y 4).
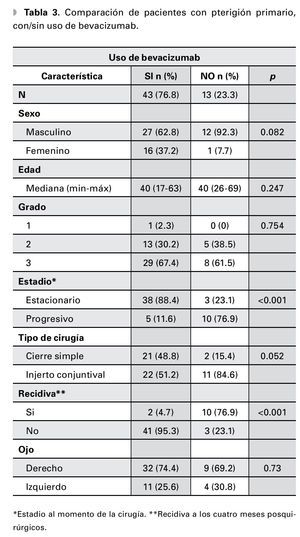
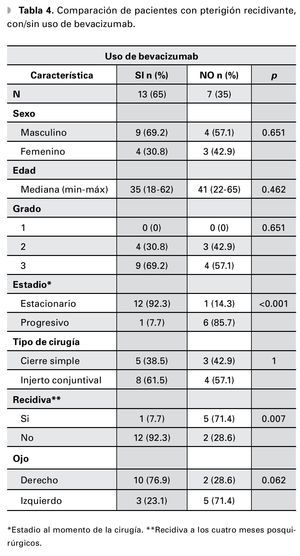
De los pacientes con pterigión primario en quienes se inyectó bevacizumab como terapia coadyuvante, solamente dos (4.7%) presentaron recurrencia a los cuatro meses posteriores del evento quirúrgico contra 41 (95.3%) que no presentaron evidencia de recidiva. En contraste, el grupo de pacientes con las mismas características sin uso de bevacizumab tuvo 10 (76.9%) recidivas al cuarto mes (p≤0.001) (Tabla 3). En tanto, del grupo de pacientes con pterigión recidivante y que recibieron terapia adyuvante con bevacizumab posterior al tratamiento quirúrgico, solamente uno (7.7%) presentó recidiva de la enfermedad a los cuatro meses contra cinco (71.4%) del grupo con las mismas características, en los cuales no se utilizó bevacizumab (p=0.007) (Tabla 4).
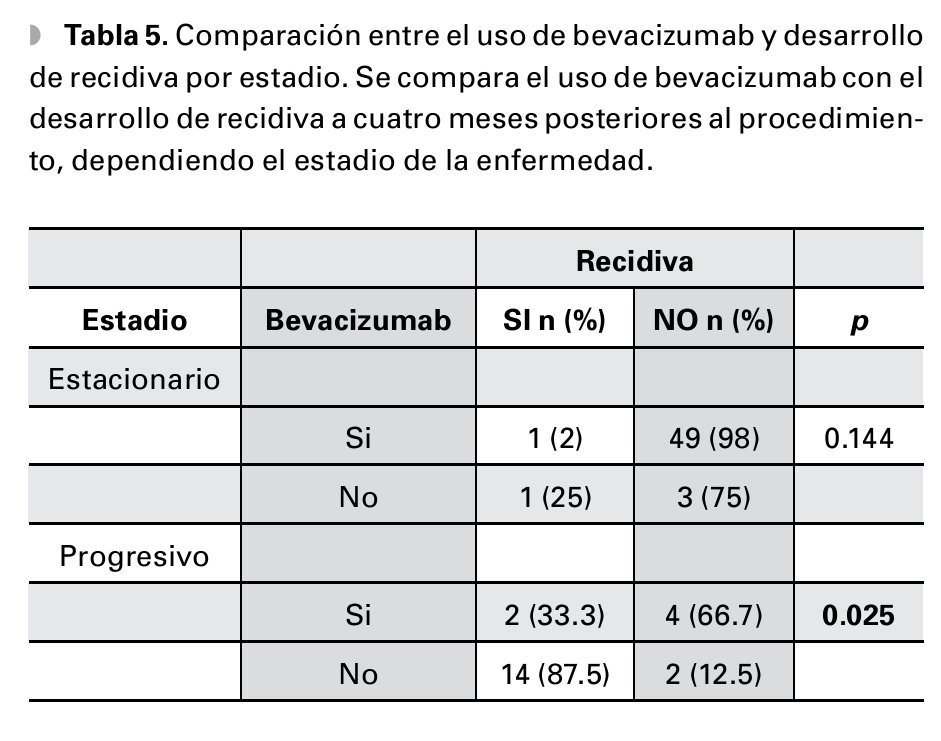
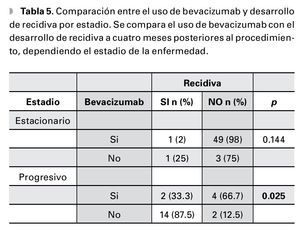
En los pacientes que presentaron pterigión estacionario, no se encontró una diferencia significativa entre el uso de bevacizumab y la aparición de recidiva a los cuatro meses (p=0.144), en contraste, con el grupo de pacientes con enfermedad progresiva en el cual el uso de bevacizumab disminuye el desarrollo de recidiva a los cuatro meses, posteriores al procedimiento (p=0.025) (Tabla 5).
Discusión
Para su estudio, el pterigión ha sido clasificado como un desorden degenerativo, vinculándose a su aparición diferentes factores como clima seco, ambientes con alto contenido de polvo, microtraumatismos y más frecuentemente a la exposición a radiación UVB solar, pero su formación es dependiente de la aparición de neovascularización.14
La angiogénesis es necesaria para la nutrición de la mayor parte de tumores sólidos, se requiere un correcto balance entre los estimuladores e inhibidores para mantener un funcionamiento adecuado de este proceso.15 En años recientes ha sido demostrado un aumento en la expresión del VEGF, en tejido obtenido de pacientes con pterigión.16 Por lo tanto, se ha establecido que el uso de fármacos activos contra el VEGF puede ser útil para la regresión de la vasculatura intralesional, o prevenir la recurrencia de esta patología posterior a la escisión quirúrgica.16
El bevacizumab es un anticuerpo monoclonal humanizado anti-VEGF, que ha sido probado para su uso en diferentes tipos de tumores como el cáncer de colon y recto,17 pero en la literatura médica aún existen pocos reportes de su uso para el tratamiento del pterigión. Estos reportes presentan diversas variaciones, desde la ruta de administración (inyección intralesional o uso tópico), hasta su modo de empleo (monoterapia o terapia adyuvante postescisión quirúrgica).18
En nuestro estudio, del grupo de pacientes que presentaban pterigión primario y que recibieron bevacizumab como coadyuvante, solamente dos (4.7%) presentaron recurrencia de la enfermedad a los cuatro meses posteriores del evento quirúrgico. En contraste, 10 pacientes (76.9%) del grupo de las mismas características sin uso de bevacizumab recurrieron al cuarto mes (p≤0.001). Nuestros resultados contrastan con los obtenidos por Razeghinejad y colaboradores, quienes no encontraron diferencia significativa en la recurrencia de la enfermedad posterior al uso de bevacizumab.19
En el estudio de Fallah Tafti y colaboradores,18 se reportó progresión del pterigión a pesar del bevacizumab inyectado para el tratamiento en aquellos pacientes con casos recidivantes la enfermedad. En nuestro estudio, del grupo de pacientes con pterigión recidivante y que recibieron bevacizumab posterior al tratamiento quirúrgico, solamente se presentó recidiva en uno (7.7%) contra cinco (71.4%) pacientes del grupo con las mismas características, sin uso de bevacizumab (p=0.007).
El equipo de Leippi y colaboradores evaluaron el uso de bevacizumab tópico como terapia adyuvante, posterior a la escisión del tejido en pacientes con pterigión recidivante. De los ojos evaluados, el 40% presentó hiperemia conjuntival clasificado como recurrencia en etapa 1, 20% presentó fibrosis del limbo (etapa 2), 20% recurrencia en etapa 3, mientras que un 20% de los casos, ya no presentó datos de recurrencia de la enfermedad. Este equipo concluye, apoyando el uso tópico de inhibidores del VEGF.20
Conclusión
Tomando en consideración los pocos reportes en la literatura médica que existen sobre el uso del bevacizumab en el tratamiento del pterigión recurrente, las diferencias en su administración y empleo, así como la escasa información sobre posibles eventos adversos en pacientes quirúrgicos, los autores concluyen que es de suma importancia la realización de estudios clínicos controlados sobre el uso de este tratamiento.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.
Correspondencia:
Dr. Juan Luis González Treviño.
Doctor´s Hospital, Despacho N° 919.
Ecuador N° 2331, Colonia Balcones de Galerías,
C.P. 64629, Monterrey, N. L., México.
Teléfonos: 1366 3852/53.
Correo electrónico: drjuanluisgonzalez@prodigy.net.mx