The objective of this research was to evaluate the effect of stimulation of receptors CRH2 in the paraventricular nucleus of the hypothalamus on food intake and expression of behavioral satiety sequence (BSS) in adrenalectomized rats. Eight independent groups of Wistar rats were utilized; four adrenalectomized groups (ADX) and four were false surgery. All subjects were implanted with a cannula in the paraventricular nucleus of the hypothalamus and were administered with one of the four treatments: vehicle, urocortin-2 (UCN2, CRH2 agonist), antisauvagine-30 (CRH2 antagonist) or antisauvagine-30+UCN2 (pretreatment). UCN2 administration reduced intake of carbohydrates and fats in ADX rats due to the interruption of the BSS. In rats with false surgery it decreased fat intake due to the advancement of the BSS. Pretreatment prevented the effects induced by UCN2 in ADX rats but not in rats with false surgery. These results suggest that receptors CRH2 modulated intake and BSS in ADX rats, contributing with relevant information for the understanding of the anorexic ethiology and the behavioral pattern associated to it.
El objetivo de la presente investigación fue evaluar el efecto de la estimulación de los receptores CRH2 del núcleo paraventricular hipotalámico sobre la ingesta de alimento y la expresión de la secuencia de saciedad conductual (SSC) en ratas adrenalectomizadas. Se trabajó con ocho grupos independientes de ratas Wistar, cuatro grupos adrenalectomizados (ADX) y cuatro con falsa cirugía. A todos los sujetos se les implantó una cánula en el núcleo paraventricular hipotalámico, y se les administró uno de cuatro tratamientos: vehículo, urocortina 2 (UCN2, agonista de CRH2), antisauvagina 30 (antagonista de CRH2), y antisauvagina-30+UCN2 (pretratamiento). La administración de UCN2 redujo la ingesta de hidratos de carbono y de grasas en las ratas ADX, debido a la interrupción de la SSC; mientras que en las ratas con falsa cirugía, la UCN2 solo disminuyó la ingesta de grasas, debido al adelanto de la SSC. El pretratamiento previno los efectos inducidos en las ratas ADX, pero no en las ratas con falsa cirugía. Estos resultados indican que los receptores CRH2 modularon la ingesta y la SSC en las ratas ADX, lo que constituye un aporte importante en la comprensión de la etiología de la anorexia y del patrón conductual asociado a esta.
La hormona liberadora de corticotropina (CRH, por sus siglas en inglés) es un neuropéptido implicado en la regulación de la conducta alimentaria y en la homeostasis energética. Se han descrito dos receptores CRH, el CRH1 y el CRH2, ambos acoplados a proteínas Gs y a la adenilatociclasa para el incremento de la producción del adenosín monofosfato cíclico. A los receptores CRH1 se les relaciona con la modulación de algunas conductas cognitivas, en tanto que a los CRH2 se les asocia con el control de las conductas motivacionales y las de supervivencia, como son: la alimentación, la reproducción y la defensa. La familia de neuropéptidos de la CRH está conformada por la CRH y las urocortinas (UCN1, UCN2 y UCN3). La UCN1 se une con alta afinidad a los receptores CRH1, en tanto que la UCN2 y la UCN3 se unen con mayor afinidad a los receptores CRH2 (Fox y Lowry, 2013). Se ha demostrado que la administración central y periférica de la CRH, o alguno de los péptidos miembros de la familia UCN, disminuyen la ingesta de alimento (Currie et al., 2001; Krahn, Gosnell, Levine y Morley, 1988). Sin embargo, el efecto hipofágico puede presentar algunas variaciones; por ejemplo, se ha reportado que la administración periférica de UCN1 indujo un efecto inhibitorio más potente sobre la ingesta de alimento que la de CRH, UCN2 o UCN3 (Tanaka et al., 2009). En cambio, Wang et al. (2011) señalan que la administración intraperitoneal de UCN1 o UCN2 produjo una hipofagia más potente que la UCN3. Estos hallazgos consolidan los resultados de investigaciones previas, en las que ya se había reportado que la administración intracerebroventricular de UCN2 producía un efecto anorexigénico 10 veces más potente que la UCN3, el cual además fue prevenido con el antagonista selectivo CRH2 antisauvagina 30 (ASV30) (Pelleymounter, Joppa, Ling y Foster, 2004).
Investigaciones en las que se utilizó el análisis microestructural de la conducta alimentaria demostraron que la administración intraperitoneal de UCN2 redujo la frecuencia de los episodios alimentarios, y no se observaron efectos colaterales adversos (Fekete et al., 2011); en tanto que la administración de UCN1 en el núcleo supraóptico de ratas con alimentación libre demoró el inicio de la ingesta de alimento, en comparación con animales privados (Fatima, Andrabi, Wolf, Engelmann y Spina, 2013). No obstante, ya previamente, Ohata y Shibasaki (2004) habían reportado que si bien una hora después de administrar UCN2 o UCN3 (intracerebroventricular) se reducía la ingesta de alimento, la UCN3 también suprimía la actividad motora. Las controversias en los resultados de estas investigaciones evidencian la necesidad de continuar el estudio de la relación entre los receptores CRH2 y la conducta alimentaria a través de otros modelos experimentales y otras herramientas de análisis conductual, como son la adrenalectomía (ADX) y la secuencia de saciedad conductual (SSC), respectivamente.
Se sabe que la fuente principal de CRH se localiza en el núcleo paraventricular hipotalámico (NPV), y que regula la actividad del eje hipotálamo-pituitaria-adrenales (Bazhan y Zelena, 2013; Sawchenko, 1987), cuyo funcionamiento anómalo se ha vinculado con la patogénesis de la anorexia (Lawson et al., 2013; Monteleone et al., 2016). La interrupción de esta vía, por medio de ADX, constituye un modelo experimental animal útil para la investigación de la conducta alimentaria, ya que la remoción de las glándulas adrenales induce alteración en la ingesta de alimento y en el peso corporal. La ingesta de alimento se reduce en respuesta al aumento de la expresión del ácido ribonucleico mensajero de la CRH en el NPV, y se sabe que dicho efecto se debe a la ausencia del feedback negativo de los glucocorticoides en este núcleo; en tanto que el reemplazo con corticosterona restablece la ingesta (Freedman, Castonguay y Stern, 1985; Torres, Costa, Castro, Antunes-Rodrigues y Elias, 2010). Respecto al peso corporal, se ha reportado que la ADX lo reduce, aun en ratas obesas (Freedman et al., 1985), posiblemente en respuesta a la deficiencia de glucocorticoides (Torres, Sabino, Ruginsk, Antunes-Rodrigues y Elias, 2009).
Además del análisis microestructural, otra herramienta que ha permitido realizar un análisis detallado de la conducta alimentaria es la SSC. Halford, Wanninayake y Blundell (1998) la definen como la transición ordenada de comer, actividad, acicalamiento y descanso postingesta de alimento. La SSC puede ser utilizada para identificar si la hipofagia producida por un fármaco se debe a mecanismos «naturales», ligados a la satisfacción (terminación del intervalo de alimentación), o a mecanismos colaterales adversos que alteran el patrón de la SSC (e.g., náuseas, dolor, sedación, hiperactividad). La SSC está relacionada con el proceso de satisfacción y el desarrollo de la saciedad (inhibición de una próxima alimentación). En este contexto, la transición gráfica entre la conducta de comer y la conducta de descanso se considera un índice conductual de satisfacción; de modo que el desplazamiento de este punto a la izquierda indica el adelanto del proceso de satisfacción, y el desplazamiento a la derecha señala la demora o el retardo del proceso (Rodgers, Holch y Tallet, 2010).
Las evidencias muestran la importante participación de los receptores CRH2 sobre el consumo de alimento, de modo que el desbalance en este sistema de neurotransmisores puede llevar a la obesidad o a la anorexia. No obstante, no está totalmente establecido el papel funcional de cada una de las variantes de estos receptores, ni los patrones conductuales que caracterizan la conducta alimentaria modulada por estos. Por lo tanto, el objetivo de la presente investigación fue evaluar el efecto de la estimulación de los receptores CRH2 del NPV sobre la ingesta del alimento y la expresión de la SSC en ratas ADX.
MétodoSujetosSe utilizaron 51 ratas macho de la cepa Wistar de 300g de peso. Los animales fueron provistos por el bioterio de la FES Iztacala-UNAM; además, los procedimientos utilizados en este estudio se llevaron a cabo bajo los lineamientos de la Norma Oficial Mexicana (NOM-O62-ZOO-1999) de especificaciones técnicas para la producción, cuidado y uso de los animales de laboratorio.
DietaLos sujetos experimentales estuvieron bajo un paradigma de autoselección dietaria con comederos separados, para: hidratos de carbono (harina de maíz [maíz nixtamalizado], marca Maseca, elaborada por Molinos Azteca de Chalco S.A. de C.V., planta Teotihuacán, Estado de México, México), proteínas (proteína aislada de soya al 90%, marca Soya Profam 646, elaborada por AMD Protein Specialities Division, Decatur, IL, EUA) y grasa (manteca vegetal, marca Inca, elaborada por Anderson Clayton & Co. S.A. de C.V., planta Tultitlán, Estado de México, México). El orden de presentación de los comederos se cambió diariamente para evitar el desarrollo de «preferencia de lugar».
FármacosLos fármacos que se utilizaron fueron: Antisauvagina 30 trifluoracetato (2¿g/0.5¿l, antagonista CRH2), adquirido con Sigma Chemical Co. (St. Louis, MO, EUA), y Urocortina 2 (1¿g/0.5¿l, agonista CRH2), adquirido con Phoenix Pharmaceuticals Inc. (CA, EUA). La administración de los fármacos se realizó con una jeringa digital para fluidos de alta precisión, adquirido con Hamilton Co. (Reno, NV, EUA). Ambos fármacos fueron infundidos a una velocidad de 0.25¿l/min en el NPV y, para asegurar una difusión completa de las sustancias, el microinyector permaneció un minuto adicional dentro de la cánula guía.
CirugíasEstereotáxica. Los animales fueron anestesiados con pentobarbital sódico (35mg/kg, intraperitoneal) para realizar la implantación de una cánula guía en el NPV. Las coordenadas estereotáxicas (posterior a bregma -1.4mm, lateral -0.4mm y ventral -6.4mm) se establecieron tomando como referencia el atlas estereotáxico de Paxinos y Watson (1988).
ADX bilateral. Bajo la misma dosis de anestesia antes señalada, se realizó una segunda cirugía para extraer las glándulas adrenales (ratas ADX), o para realizar una «falsa cirugía», en la que solo se visualizaron las glándulas (ratas FC). Las ratas ADX tuvieron disponible solución salina al 0.9% para beber. Al término de las cirugías, a todos los sujetos se les aplicó penicilina benzatínica (50,000U/kg) para prevenir factibles infecciones, y posteriormente se les permitió un periodo de recuperación de siete días.
ProcedimientoAl llegar al laboratorio, los sujetos experimentales fueron asignados a uno de ocho grupos independientes y habituados a las condiciones experimentales (e.g., ciclo de luz, dieta) por una semana. Se colocaron aleatoriamente en cajas habitación-individuales con acceso ad libitum al agua y al alimento (hidratos de carbono, proteínas y grasa), bajo un ciclo invertido de luz/oscuridad de 12×12h (12:00 p.m. inicio de oscuridad); condiciones que permanecieron durante toda la investigación. Posterior al periodo de habituación se realizó la cirugía estereotáxica y la ADX, o la FC. Luego del periodo de recuperación, un grupo de ratas con FC y un grupo de ratas ADX fueron asignados a uno de cuatro tratamientos farmacológicos. Los fármacos y/o el vehículo fueron administrados en el NPV. Todos los grupos recibieron dos inyecciones, con un lapso intermedio de 10min. Los tratamientos y el nombre con el que fueron identificados los grupos (entre paréntesis) se presentan a continuación:
- 1.
Vehículo+vehículo (grupo control o grupo ADX, según la condición de FC o de ADX, respectivamente);
- 2.
Vehículo+Urocortina 2 (dos grupos, uno por cada condición de cirugía);
- 3.
Antisauvagina 30+vehículo (dos grupos, uno por cada condición de cirugía); y
- 4.
Antisauvagina 30+Urocortina 2 (dos grupos pretratados, uno por cada condición de cirugía).
Una vez iniciado el periodo de oscuridad se realizó un registro de duración continua de 60min y, al finalizar el registro, se pesaron los comederos (cuidando de recolectar el alimento derramado) para determinar el consumo de alimento. Todas las sesiones fueron grabadas con una cámara de circuito cerrado para baja intensidad de luz.
Análisis conductualPara realizar el análisis de la SSC, los 60min de registro continuo fueron divididos en 12 segmentos de cincomin cada uno, y se examinaron las categorías conductuales siguientes: alimentación (consumo de cualquier alimento), descanso (las ratas permanecen inactivas con la cabeza en el piso), actividad (desplazarse, husmear o levantarse sobre las patas traseras dentro de la caja-habitación) y acicalarse (rascar, lamer o morder cualquier parte del cuerpo).
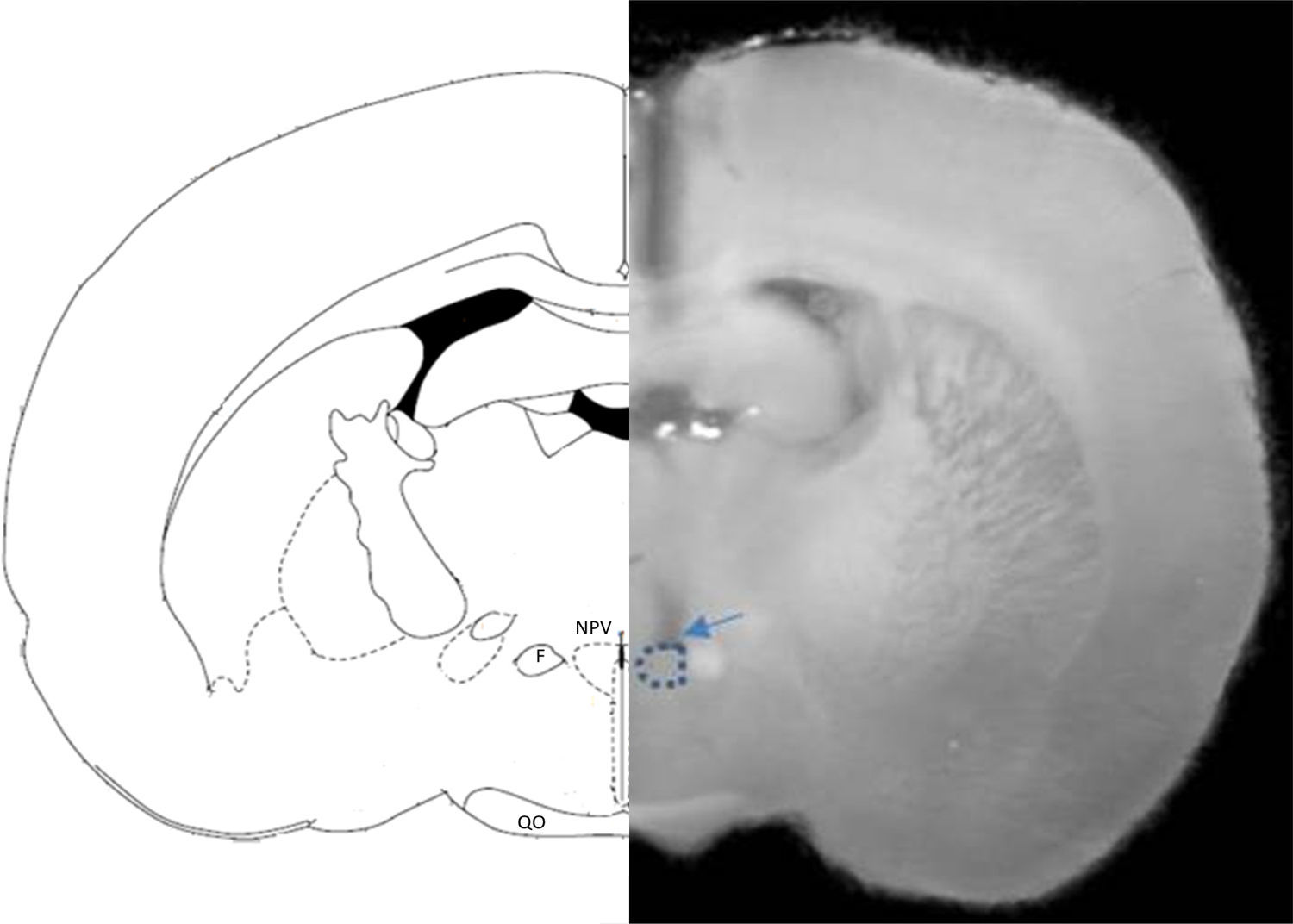
HistologíaAl finalizar las sesiones, los animales fueron sacrificados con pentobarbital sódico y perfundidos intracardialmente, primero con solución salina y luego con formalina al 10%. El cerebro se removió y se mantuvo siete días en formol al 10%. Posteriormente, para verificar el sitio de implantación de la cánula guía, se realizaron cortes histológicos coronales de 70¿m de espesor.
Análisis estadísticosPara analizar los datos relativos a la ingesta de alimento (hidratos de carbono, proteínas y grasa) se utilizó un ANOVA de dos vías (tratamiento×dieta). Con los datos de los parámetros de la SSC se obtuvo el área bajo la curva (ABC), y posteriormente se realizó un ANOVA de una vía. En ambos casos, la obtención de un ANOVA significativo fue seguido de la prueba post hoc de Bonferroni. Los análisis estadísticos y el ABC se realizaron con el programa GraphPad Prism 5.01. Estos análisis se hicieron primero con los grupos correspondientes a las ratas FC, y después con los grupos de las ratas ADX. En ambos casos, solo fueron considerados los datos de los animales cuya cánula se localizó en el área suprayacente del NPV.
ResultadosHistologíaDespués de verificar la localización de la cánula (fig. 1), los grupos quedaron constituidos por el número de sujetos siguiente: grupo control (n=6), grupo UCN2 (n=6), grupo ASV30 (n=6), grupo pretratado (n=6), grupo ADX (n=9), grupo ADX-UCN2 (n=6), grupo ADX-ASV30 (n=6), y grupo ADX-pretratado (n=6).
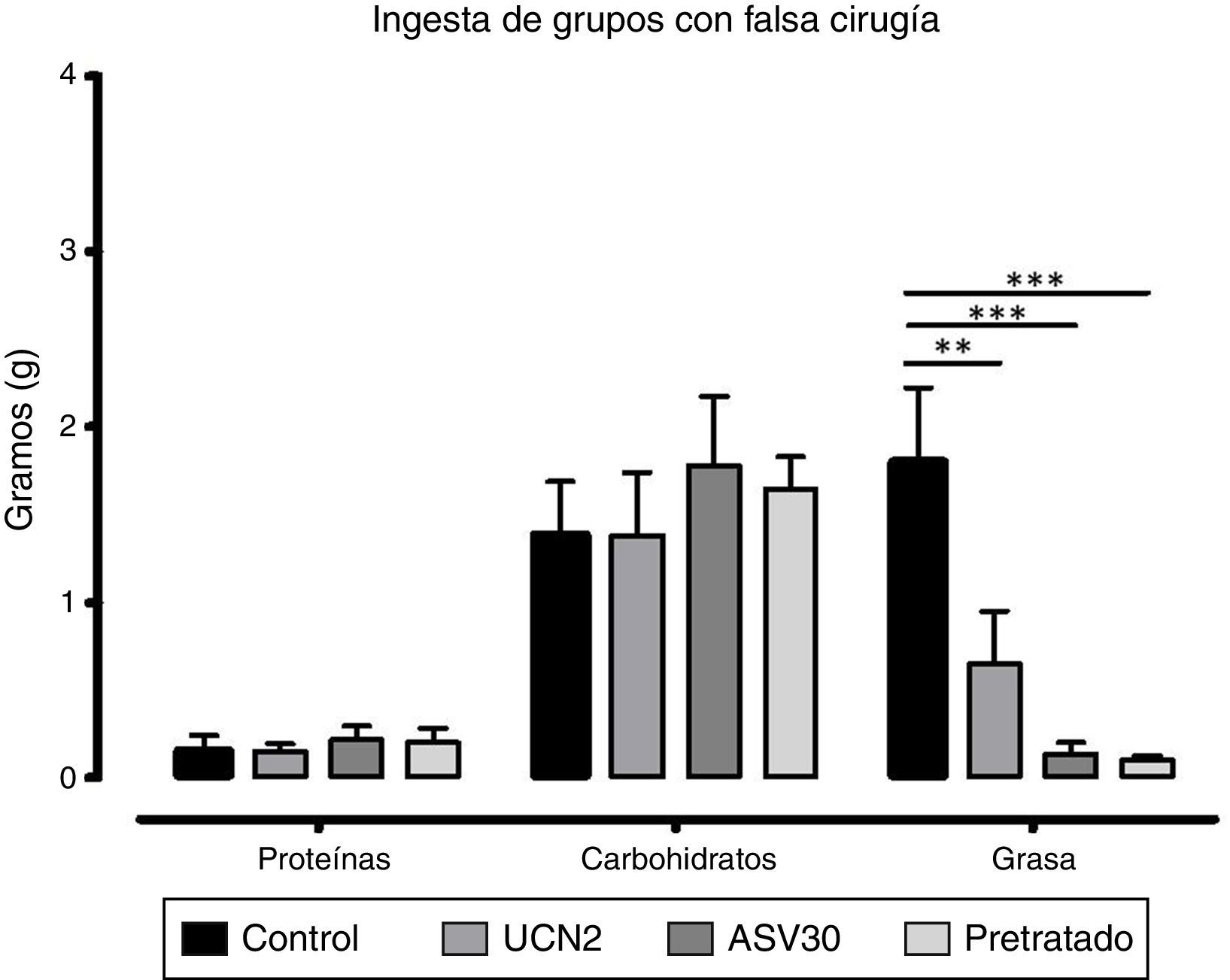
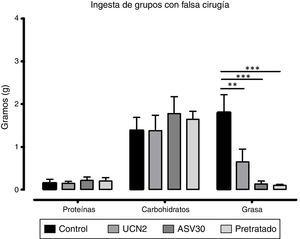
Grupos con falsa cirugíaEl ANOVA de dos vías reveló diferencias significativas en la interacción dieta×tratamiento [F (6, 60)=4.57, p=0.0007]. También se encontraron diferencias significativas en el factor dieta [F (2, 60)=32.72; p=0.0001] y, de acuerdo a la prueba post hoc, se identificó una reducción de la ingesta de grasa en los grupos UCN2, ASV30 vs. grupo control (fig. 2). Esto indica que los tratamientos afectaron diferencialmente la ingestión de los macronutrientes, y particularmente la de grasa, en tanto que el pretratamiento con el antagonista fue incapaz de revertir este efecto.
Media±error estándar de la media del consumo de proteínas, hidratos de carbono y grasa en los grupos con falsa cirugía. ASV30: antisauvagina 30; Control: tratamiento de solución salina; Pretratado: UCN2+ ASV30; UCN2: urocortina 2. Las líneas horizontales indican la diferencia entre grupos. **p<0.01; ***p<0.001.
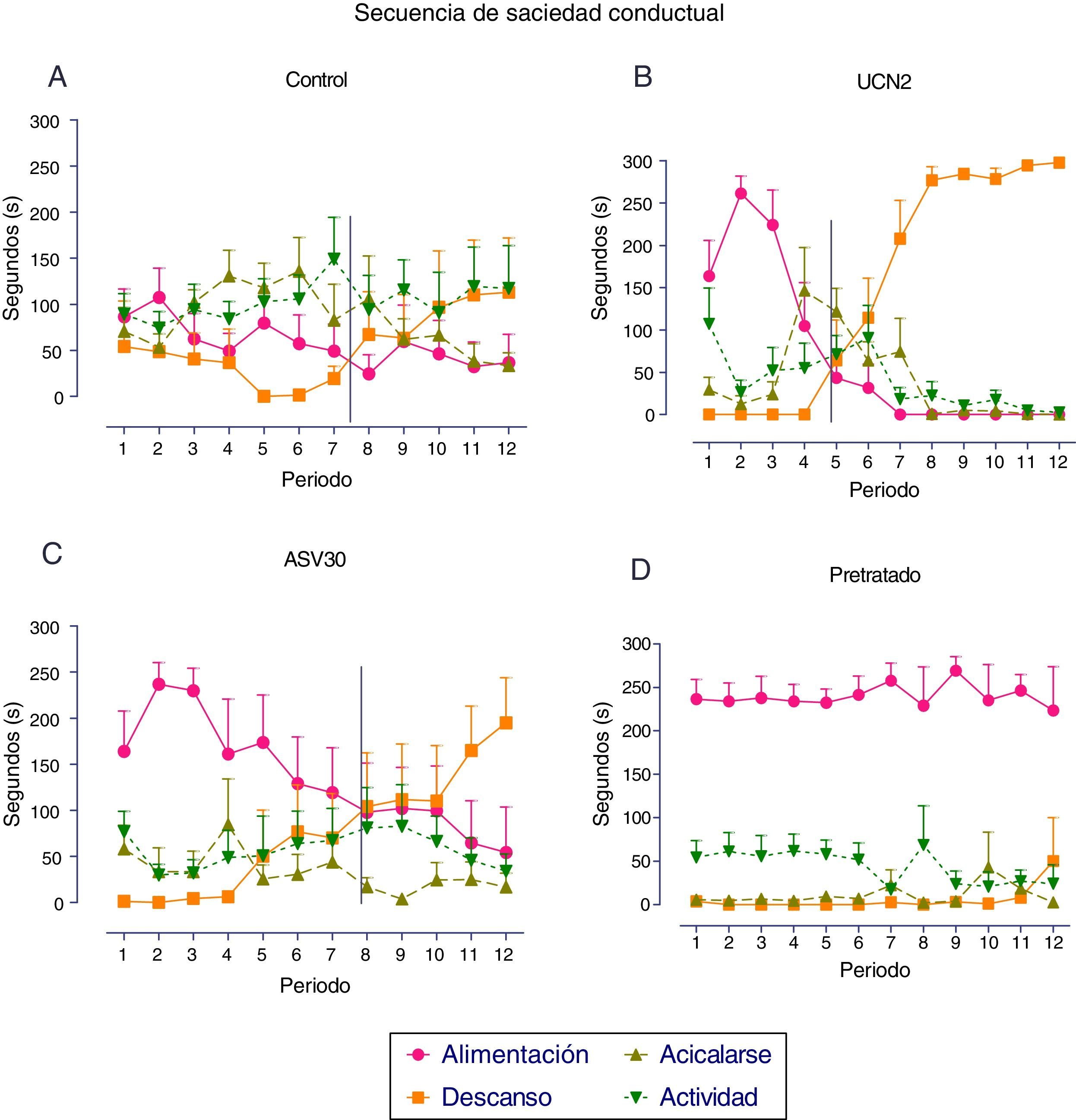
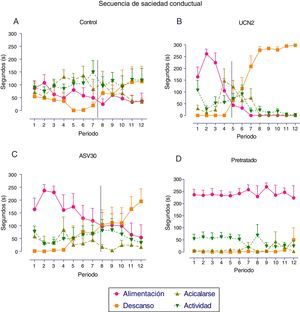
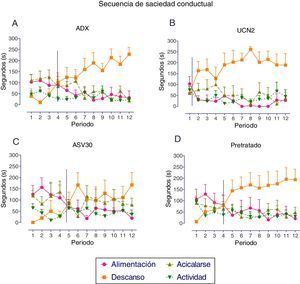
En la figura 3 se expresa el análisis de la SSC registrado para cada grupo con FC. El grupo control expresó el patrón típico, de modo que inicialmente se observó la conducta de alimentación, seguida de las conductas de actividad y de acicalarse, y finalmente la conducta de descanso; en tanto que la transición entre la conducta de alimentación y la de descanso se presentó entre los periodos siete y ocho. De igual forma, el grupo UCN2 desarrolló una SSC típica, sin embargo el punto de transición se desplazó a la izquierda con relación al grupo control (adelanto de la secuencia), lo cual indica un desarrollo temprano del proceso de satisfacción. Si bien el grupo ASV30 también desarrolló la SSC típica, la transición entre la conducta de alimentación y la de descanso se estableció en el periodo ocho, lo que indica que no hubo afectación del proceso de satisfacción. En el grupo pretratado no se localizó la transición entre esas conductas.
Media±error estándar de la media de los parámetros de la secuencia de saciedad conductual en los grupos con falsa cirugía. A: tratamiento de solución salina (control); B: urocortina 2 (UCN2); C: antisauvagina 30 (ASV30); D: UCN2+ASV30 (pretratado). La línea vertical indica el momento de la transición entre las conductas de alimentación y de descanso.
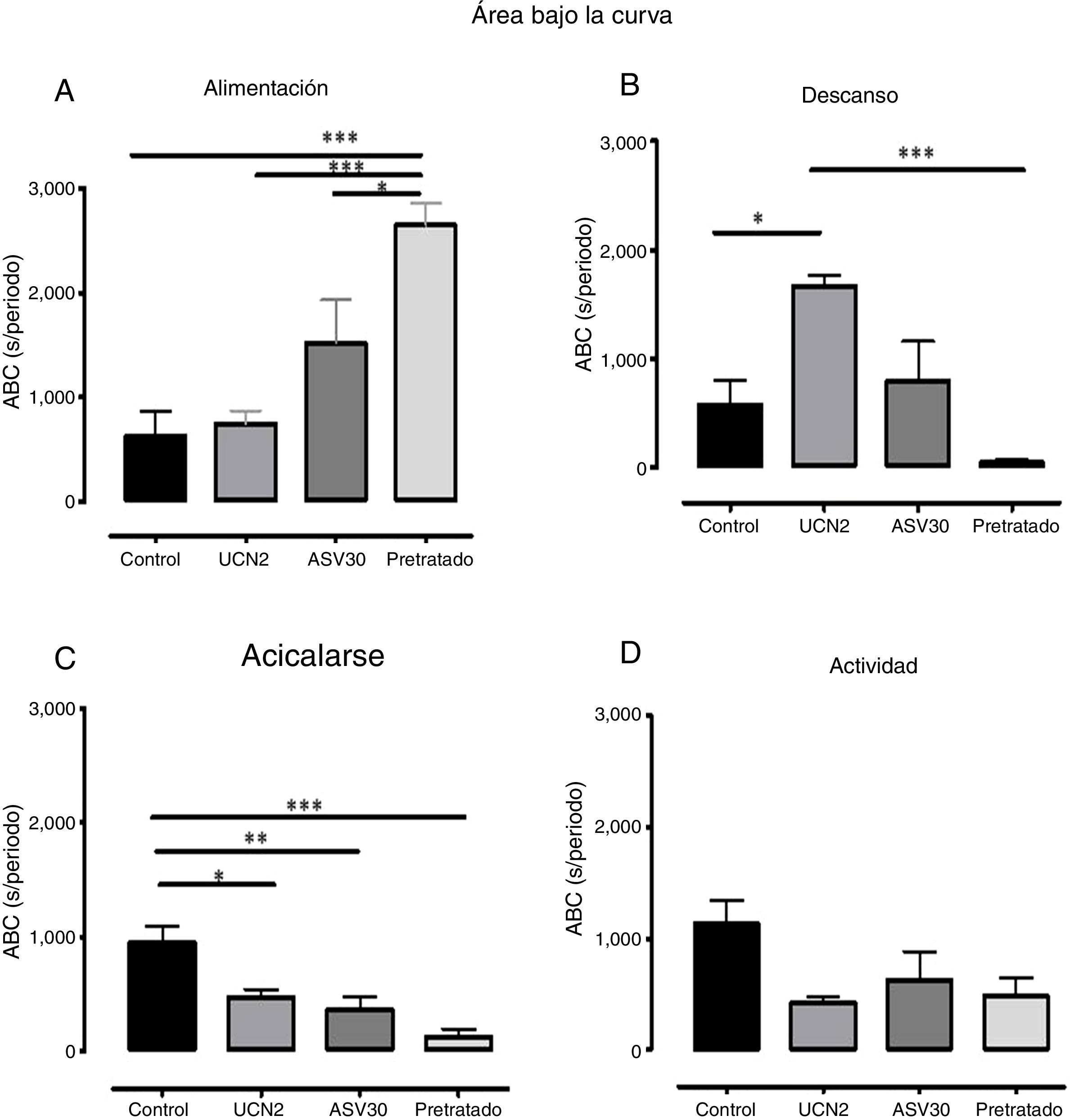
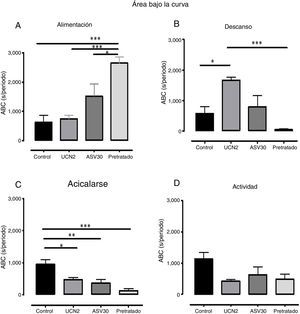
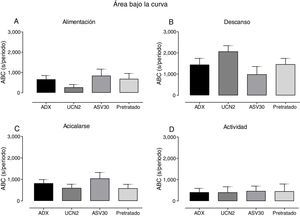
En la figura 4 se expone el análisis del ABC en cuanto a los parámetros: alimentación, actividad, acicalarse y descanso. El análisis ANOVA de una vía determinó diferencias significativas en alimentación [F (3, 23)=12.49, p=0.0001], mientras que la prueba post hoc señaló un incremento en el tiempo destinado a la alimentación en el grupo pretratado vs. grupo control, UCN2 y ASV30. El descanso también registró diferencias significativas [F (3, 23)=9.66, p=0.0004], con aumento de la conducta en el grupo UCN2 vs. grupo control y grupo pretratado. Asimismo, la conducta de acicalarse también arrojó diferencias significativas [F (3, 23)=10.49, p=0.0002], con reducción en los grupos UCN, ASV30 y pretratado vs. grupo control. Finalmente, cabe destacar el hecho de que el parámetro de actividad no registró diferencias estadísticas significativas.
Media±error estándar de la media del área bajo la curva (ABC) de los parámetros de la secuencia de saciedad conductual (alimentación, descanso, acicalarse y actividad) en los grupos con falsa cirugía. ASV30: antisauvagina 30; Control: tratamiento de solución salina; Pretratado: UCN2+ ASV30; UCN2: urocortina 2. *p<0.05; **p<0.01; ***p<0.001.
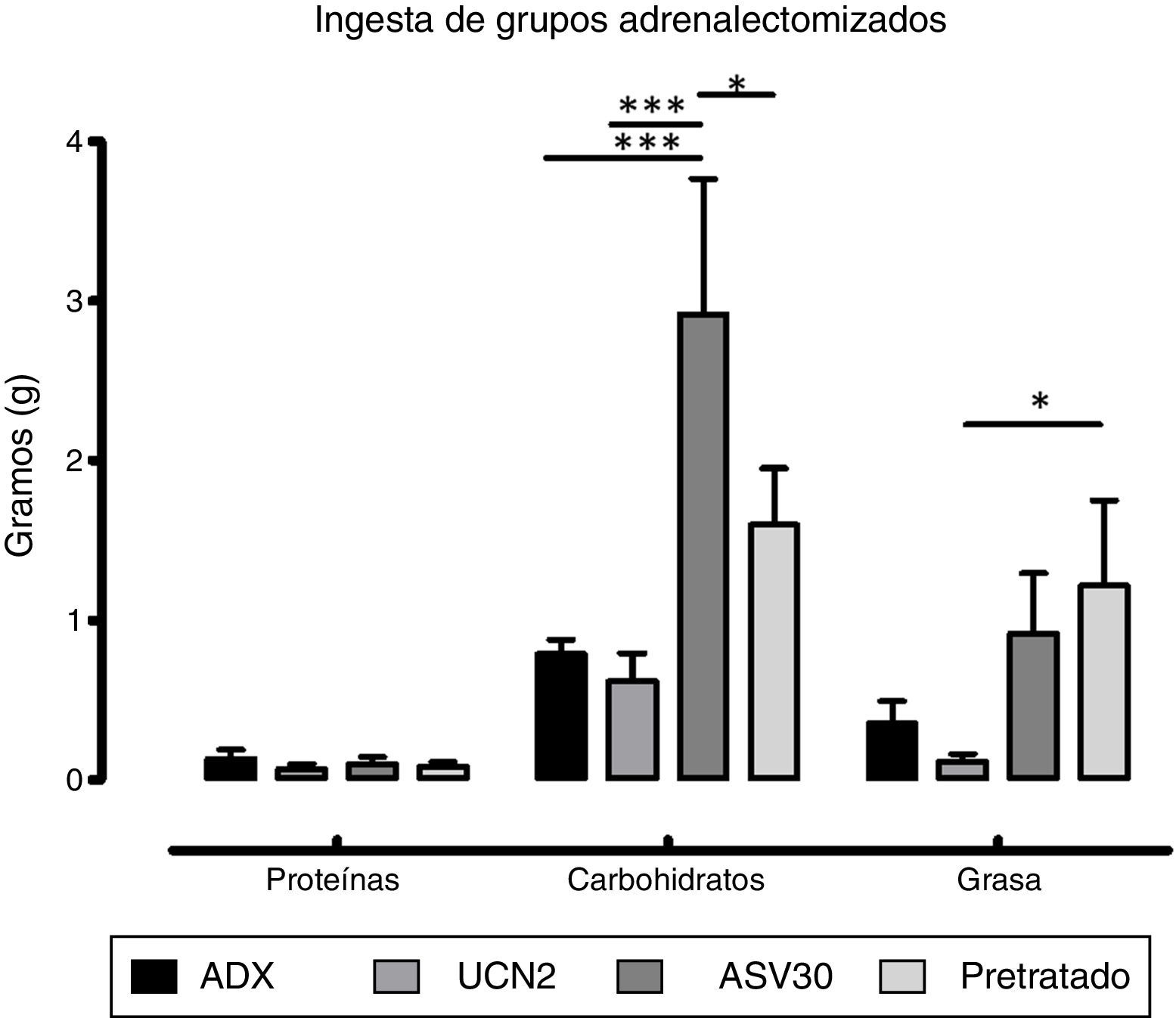
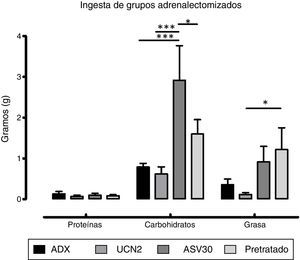
El ANOVA de dos vías reportó diferencias significativas en la interacción dieta×tratamiento [F (6, 69)=3.46, p=0.0047]. Con respecto a los efectos principales, el factor dieta mostró diferencias significativas [F (2, 69)=21.12, p=0.0001]. La prueba post hoc de Bonferroni indicó un aumento del consumo de hidratos de carbono en el grupo ASV30 vs. grupo control ADX, y una disminución en los grupos UCN2 y pretratado vs. grupo ASV30. También se encontró un aumento de la ingesta de grasa en el grupo pretratado vs. grupo UCN2 (fig. 5). Asimismo, el análisis del factor tratamiento indicó diferencias significativas [F (3, 69)=7.42; p=0.0002]. Esto indica que los tratamientos en las ratas ADX afectaron diferencialmente la ingestión de los hidratos de carbono y de la grasa. El pretratamiento con el antagonista bloqueó el efecto anorexigénico inducido por la UCN2 sobre la ingestión de los hidratos de carbono y de la grasa.
Media±error estándar de la media del consumo de proteínas, hidratos de carbono y grasa en los grupos adrenalectomizados. ASV30: antisauvagina 30; ADX/control: tratamiento de solución salina; Pretratado: UCN2+ASV30; UCN2: urocortina 2. Las líneas horizontales indican la diferencia entre grupos. *p<0.05; ***p<0.001.
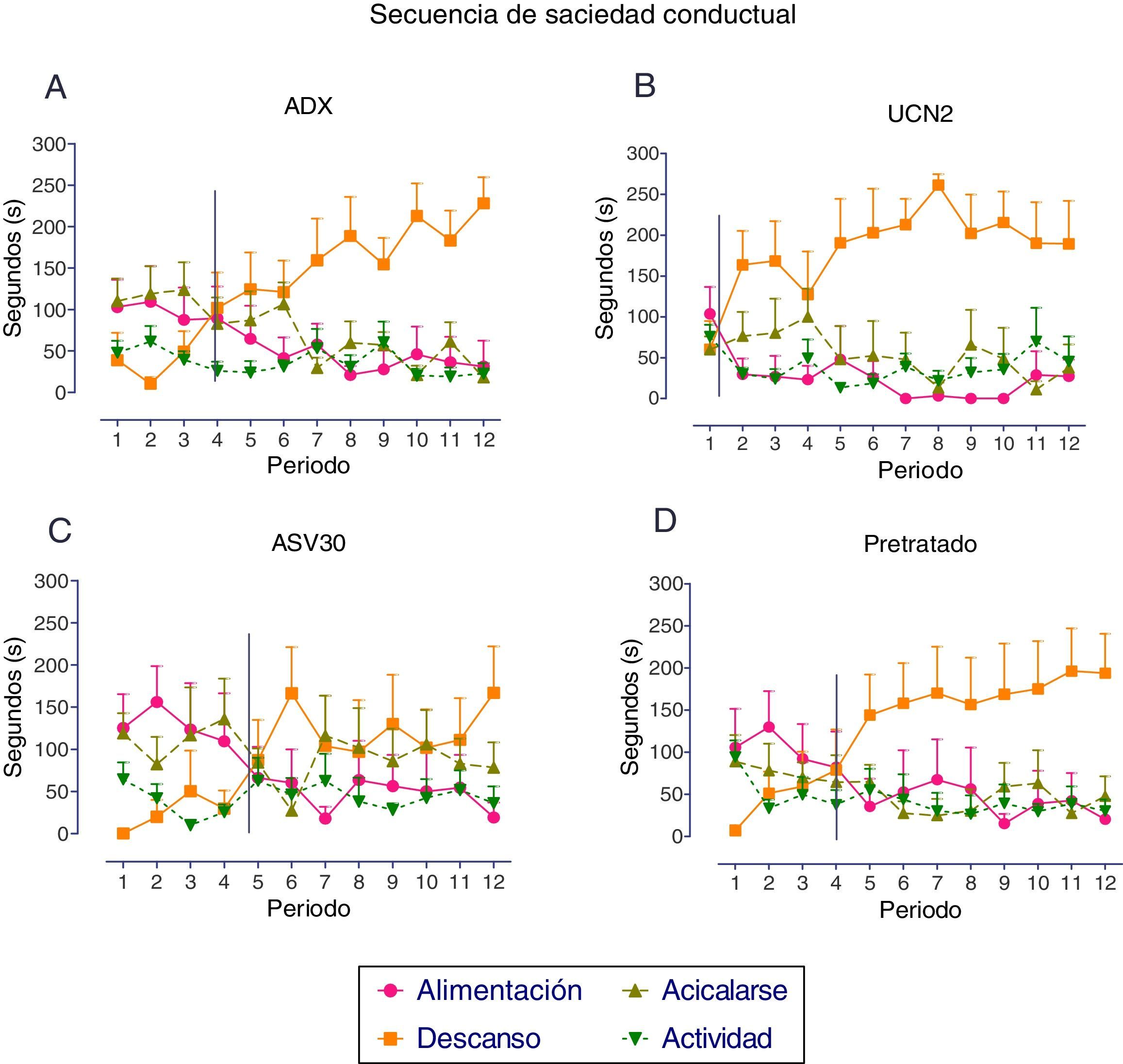
En la figura 6 se expresa el análisis de la SSC registrado para cada grupo. En el grupo control ADX se observó el patrón típico de la secuencia, ya que en los primeros periodos se presentó la conducta de alimentación, seguida de actividad y de descanso; y aunque la duración de la conducta de acicalarse fue relativamente alta, no afectó la presencia de la alimentación, en tanto que la transición entre la alimentación y el descanso se observó en el periodo cuatro. Por el contrario, la administración de la UCN2 interrumpió el desarrollo natural de la SSC, ya que la transición entre la conducta de descanso y la de alimentación se presentó entre los periodos uno y dos; conductualmente, este efecto hipofágico de la UCN2 se expresa a partir del desarrollo temprano de la conducta de descanso. En tanto que la administración del antagonista ASV30 permitió el desarrollo del patrón típico de la SSC, considerando que en los primeros periodos estos sujetos experimentales presentaron, en el orden esperado las conductas: alimentación, acicalamiento, actividad y descanso; mientras que la transición entre la alimentación y el descanso se presentó en el periodo cinco. Por último, el grupo con pretratamiento desarrolló el patrón típico de la SSC, con la transición entre la conducta de alimentación y la de descanso en el periodo cuatro; por tanto, el pretratamiento previno la interrupción de la SSC inducida por la UCN2.
Media±error estándar de la media de los parámetros de la secuencia de saciedad conductual en los grupos adrenalectomizados. A: tratamiento de solución salina (adrenalectomizados, control); B: urocortina 2 (UCN2); C: antisauvagina 30 (ASV30); D: UCN2+ASV30 (pretratado). La línea vertical indica el momento de la transición entre las conductas de alimentación y la de descanso.
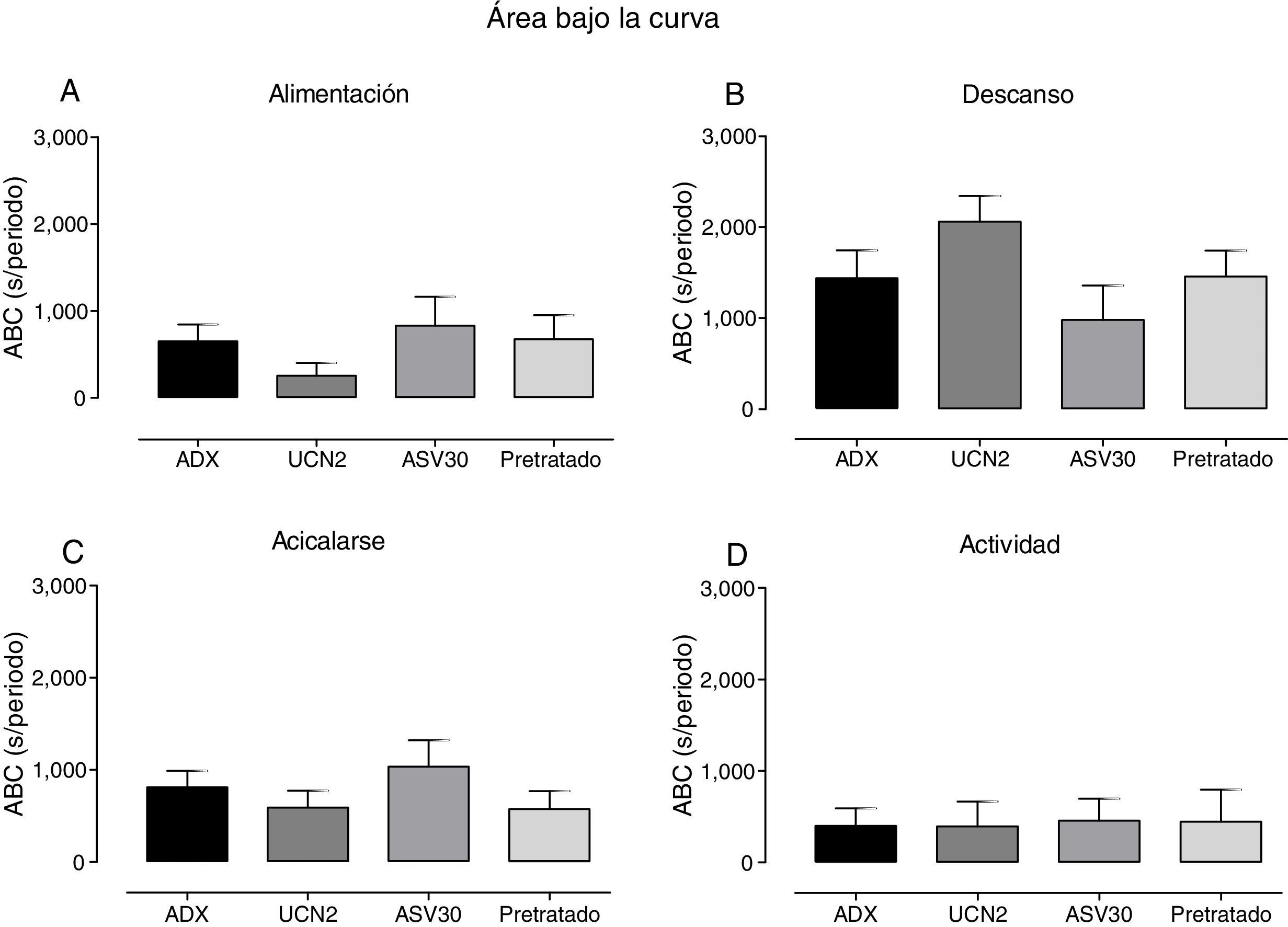
Si bien el análisis del ABC de los parámetros de la SSC en las ratas ADX no mostró diferencias estadísticas significativas (fig. 7), la administración de la UCN2 tendió a disminuir el tiempo de ingesta e incrementar el de descanso y, por el contrario, el pretratamiento tendió a revertir estos efectos.
Media±error estándar de la media del área bajo la curva (ABC) de los parámetros de la secuencia de saciedad conductual (alimentación, descanso, acicalarse y actividad) en los grupos adrenalectomizados. ASV30: antisauvagina 30; Control: tratamiento de solución salina; Pretratado: UCN2+ASV30; UCN2: urocortina 2. No se registraron diferencias estadísticas significativas.
En las ratas con FC se encontró la reducción selectiva de la ingesta de grasa al administrar UCN2 (agonista CRH2) en el NPV, efecto que el pretratamiento con ASV30 (antagonista CRH2) fue incapaz de bloquear. Este resultado muestra que la ingestión de grasa al inicio del ciclo de oscuridad no se debió a la participación de los receptores CRH2, y posiblemente sean los receptores CRH1 los responsables de modular la ingesta de la grasa. En contraste, en las ratas ADX, con la administración de UCN2 se observó la reducción de la ingesta de hidratos de carbono y de grasa, efecto que fue bloqueado con la administración del antagonista ASV30. Estos resultados aluden a que la ingestión de hidratos de carbono y de grasa fue modulada por los receptores CRH2 en las ratas ADX. Al respecto, investigaciones previas señalan que estos receptores particularmente modulan la ingestión de hidratos de carbono al inicio del ciclo natural de oscuridad; mientras que los CRH1 predominantemente controlan la ingesta de grasa en el ciclo diurno, y al final del periodo de alimentación en el ciclo oscuro (Tempel y Leibowitz, 1994). También se ha observado que el tiempo de acción de la UCN2 sobre la ingesta de alimento varía dependiendo de la dosis y de las condiciones experimentales, como son el acceso libre al alimento vs. la privación (Ohata y Shibasaki, 2004). En la presente investigación, con acceso libre al alimento, las ratas ADX fueron más sensibles al efecto anorexigénico inducido por la UCN2. Probablemente este efecto se debe a que, en las ratas con FC, la expresión del ácido ribonucleico mensajero del receptor CRH2 aumenta hasta la tercera hora del ciclo de oscuridad (Ohata y Shibasaki, 2004), motivo por el cual los receptores no se encuentran activos y disponibles a la unión del ligando en las primeras horas del ciclo de oscuridad, retardando así el efecto anorexigénico. En contraste, en las ratas ADX, la sobreexpresión de la CRH estimula la presencia y la disponibilidad de los receptores CRH, facilitando la unión del ligando a los receptores (Herman y Morrison, 1996).
El análisis conductual mostró algunas diferencias en el desarrollo de la SSC entre las ratas con FC vs. las ratas ADX. Aunque ambos grupos control (FC y ADX) presentaron el patrón típico de la SSC, el grupo ADX concluyó más tempranamente la ingesta de alimento que el grupo con FC. Investigaciones previas reportan que la ADX disminuye un 46% la ingesta de alimento en el periodo de oscuridad (Kumar, Papamichael y Leibowitz, 1988); mientras que los resultados de la presente investigación indican que el efecto hipofágico inducido por la ADX se debió al adelanto del proceso de satisfacción, entendida esta como el proceso que permite dar por terminada la ingesta de alimento, y que se deriva de condiciones fisiológicas, metabólicas y sensoriales naturales (Blundell et al., 2010).
La administración de UCN2 en el NPV de las ratas con FC produjo una SSC típica, pero el punto de transición entre la conducta de alimentación y la conducta de descanso se desplazó a la izquierda con relación al grupo control, lo que indica que el proceso de satisfacción se adelantó (Rodgers et al., 2010). Conductualmente, el efecto anorexigénico inducido por la UCN2 en las ratas con FC se explica por la terminación temprana del proceso de satisfacción y, consistentemente con este resultado, el análisis del ABC también señaló un aumento significativo de la conducta de descanso. El pretratamiento con el antagonista CRH2 bloqueó el aumento de la conducta de descanso, evidenciando que la modulación de esta conducta fue por los receptores CRH2. Al respecto, investigaciones previas señalan que la CRH regula y/o modula el sueño y la vigilia (Opp, 1998). Pero, en contraste, la administración de UCN2 en las ratas ADX interrumpió el patrón típico de la SSC, el análisis cualitativo mostró que la conducta de descanso predominó en los primeros minutos del registro, desplazando la presencia de la conducta de alimentación, la cual finalizó tempranamente (primer periodo de observación). Esto sugiere que el efecto hipofágico inducido por la UCN2 en las ratas ADX se debió al desarrollo prematuro de la conducta de descansar, y no al proceso de satisfacción. Halford et al. (1998) interpretan este patrón como interrupción de la SSC por sedación (periodo inicial dominado por conductas de descanso que desplazan a la conducta de alimentación).
En el grupo ADX pretratado se preservó el patrón natural de la SSC, revirtiendo la interrupción inducida por la UCN2, una vez que la transición entre la conducta de alimentación y la de descansó retornó al periodo establecido en el grupo control ADX; esto sugiere que el desarrollo de la SSC fue modulado selectivamente por receptores CRH2. Contrariamente, en el grupo pretratado con FC no se encontró el patrón típico de la SSC, lo que confirma que la ingesta de alimento no fue modulada por mecanismos selectivos, lo que impidió el bloqueo de los efectos inducidos por la UCN2 sobre la ingesta de alimento. En esta condición los sujetos estuvieron más tiempo en contacto con el alimento, pero no lo consumieron, y la transición entre la conducta de alimentación y el descanso no se estableció en una hora de registro. Patrones semejantes se han observado en paradigmas de aversión al sabor o ante alimento no palatable, en donde el animal está motivado para comer, pero no consume lo suficiente para desarrollar el patrón clásico de la SSC, de modo que la transición entre la conducta de alimentación y la de descanso no se identifica (Ishii, Blundell, Halford y Rodgers, 2003). Esto confirma que el control de la conducta alimentaria en las ratas con FC no fue modulada solo por los receptores CRH2, sino que probablemente también estén participando receptores CRH1, o algún otro sistema de neurotransmisores que aumente su actividad al inicio del ciclo de oscuridad.
Así, los resultados de este trabajo indican que los receptores CRH2 del NPV no solo controlan el consumo de alimento, sino que también modulan el término de la conducta alimentaria. En condiciones fisiológicas «normales», la estimulación de los receptores CRH2 al inicio del periodo de oscuridad produjo la secuencia de saciedad típica, sin embargo no es posible descartar la participación de los receptores CRH1 y de otros sistemas de neurotransmisores. Si bien condiciones de sobreexpresión del receptor CRH2 (inducido por la ADX) producen el patrón típico de la SSC, es con terminación prematura de la ingesta de alimento.
Por tanto, se concluye que la estimulación de los receptores CRH2 del NPV al inicio del ciclo de oscuridad redujo la ingesta de hidratos de carbono y de grasas en las ratas ADX. No obstante, en las ratas con FC solo disminuyó la de grasas, posiblemente debido a la activación de receptores CRH1. El análisis de la SSC reveló que el efecto anorexigénico inducido por la UCN2 en las ratas ADX se debió a la interrupción del proceso de satisfacción por sedación, el pretratamiento con el antagonista ASV30 previno la interrupción inducida por la UCN2, lo cual indica que la SSC fue modulada por receptores CRH2. En el caso de las ratas con FC, la UCN2 produjo una SSC típica, adelantando el proceso de satisfacción. El pretratamiento con el antagonista fue incapaz de revertir este efecto, lo cual alude a que la SSC fue modulada solo en parte por receptores CRH2 al inicio del ciclo de oscuridad, y posiblemente en este momento también estén participando los receptores CRH1, u otro sistema de neurotransmisores. Estos resultados constituyen un aporte importante para un mejor entendimiento de la etiología neurobiológica de la anorexia y del patrón conductual asociado a esta.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo es producto de los fondos otorgados por UNAM-DGAPA-PAPIIT a los proyectos IN306711 e IN224214.
Conflicto de interesesLos autores manifiestan no tener conflicto de intereses.
Esta investigación forma parte de la tesis doctoral de la primera autora, quien agradece al Posgrado en Ciencias Biológicas de la UNAM la formación académica recibida a través de su Programa de Doctorado, así como al Consejo Nacional de Ciencia y Tecnología por la concesión de la beca otorgada para la realización de sus estudios.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.