El cáncer de próstata (CaP) es una de las principales causas de muerte por cáncer en el hombre a nivel mundial. Desde su aparición, ha habido un intenso debate sobre la eficacia del antígeno prostático específico (APE) como herramienta de tamizaje en el CaP. En este artículo, revisamos el estado actual de los biomarcadores moleculares, su importancia pronóstica y su papel en la toma de decisiones terapéuticas.
El objetivo de esta revisión es definir el uso potencial de estos biomarcadores con la intención de definir mejor los grupos de hombres con alto riesgo de desarrollar CaP, discriminar entre cáncer indolente y agresivo, así como mejorar las técnicas de tamizaje y las estrategias terapéuticas en pacientes con enfermedad avanzada.
La mayoría de estos biomarcadores no han sido validados pues no proporcionan información útil de pronóstico, ni ofrecen mejores resultados que los parámetros clínico-patológicos ya establecidos. Sin embargo, con el fin de mejorar la toma de decisiones clínicas, numerosos grupos se han centrado en desarrollar estos resultados. Lo idóneo sería un panel de múltiples biomarcadores diagnósticos y pronósticos junto con el APE.
Prostate cancer (CaP) is one of the main causes of death by cancer in men worldwide. Since the introduction of prostate-specific antigen (PSA), there has been an intense debate on its efficacy as a screening tool for prostate cancer. In the present article, we review the current status of molecular biomarkers, their prognostic importance, and their role in the making of therapeutic decisions.
The aim of this review was to define the potential use of these biomarkers in better defining the groups of men at high risk for developing CaP, in distinguishing between indolent and aggressive cancer, improving screening techniques, and improving therapeutic strategies in patients with advanced disease.
The majority of these biomarkers have not been validated because they do not provide useful outcome information nor offer better results than the already established clinicopathologic parameters. Nevertheless, in an effort to improve clinical decision-making, numerous groups are focusing on developing these results. A panel of multiple diagnostic and prognostic biomarkers in conjunction with PSA would be ideal.
Hoy en día, el cáncer de próstata (CaP) se considera uno de los problemas médicos más importantes a los que se enfrenta la población masculina. De hecho, en los países occidentales es la neoplasia sólida más frecuente, que supera en número al cáncer de pulmón y colorrectal. Además, constituye actualmente la segunda causa de mortalidad por cáncer en los hombres1.
El único marcador usado actualmente en el diagnóstico del CaP y en la monitorización del tratamiento es el antígeno prostático específico (APE), pero tiene sus limitaciones. En términos de marcador diagnóstico, el APE presenta una especificidad baja (33%)2. Una mejora en el diagnóstico con marcadores de tamizaje más específicos, evitaría un gran número de biopsias de próstata innecesarias y constituiría, a su vez, una prueba diagnóstica menos invasiva. El APE tiene, además, poco valor como biomarcador de pronóstico. Uno de los mayores problemas clínicos del CaP es decidir qué opción de tratamiento se adapta mejor a cada paciente en el momento del diagnóstico. El CaP es extremadamente heterogéneo y puede presentarse como una enfermedad indolente o agresiva. Desafortunadamente, no disponemos de biomarcadores que predigan la progresión de la enfermedad en el momento del diagnóstico. El uso del APE ha liderado el diagnóstico de muchos cánceres potencialmente indolentes, y los tratamientos agresivos de estos han causado una significativa morbilidad sin beneficio clínico en muchos casos. Por el contrario, es de sobra conocido que aproximadamente un 30% de los pacientes tratados con intención curativa van a experimentar recaída a los 5 años de iniciado el tratamiento, de ahí la importancia de definir mejor los grupos de riesgo3.
La toma de decisiones terapéuticas en pacientes con CaP resistente a la castración es un desafío debido a los cambios frecuentes e inconsistentes en el suero del APE, a los síntomas del paciente y los hallazgos radiográficos. Actualmente, las células tumorales circulantes (CTC) han demostrado ser el factor predictor independiente de supervivencia global más importante4. Teniendo en cuenta los recientes hallazgos, los micro ARN (miARNs) podrían tener un papel importante junto a las CTC y al APE en la predicción de la respuesta al tratamiento.
Con el presente trabajo, pretendemos discutir el uso potencial de nuevos biomarcadores en el CaP.
Biomarcadores en el CaPEl Instituto Nacional del Cáncer define biomarcador como “una molécula biológica que se encuentra en la sangre, fluidos corporales o tejidos, siendo un signo de un proceso normal o anormal o de una condición o enfermedad”5. El biomarcador ideal debe informar sobre la enfermedad y su progresión, identificar a los individuos de alto riesgo, predecir la recurrencia y monitorizar la respuesta al tratamiento. Debe ser económico, no invasivo, de fácil acceso y rápidamente cuantificable. Como hemos comentado, con esta revisión pretendemos analizar las deficiencias de la prueba del APE con respecto a estos ideales, resumir los biomarcadores emergentes más prometedores para el CaP y la necesidad de desarrollar una prueba que distinga entre pacientes sanos, pacientes con hiperplasia benigna de próstata, un cáncer clínicamente insignificante y un cáncer clínicamente significativo (cáncer de próstata resistente a la castración [CPRC] metastásico).
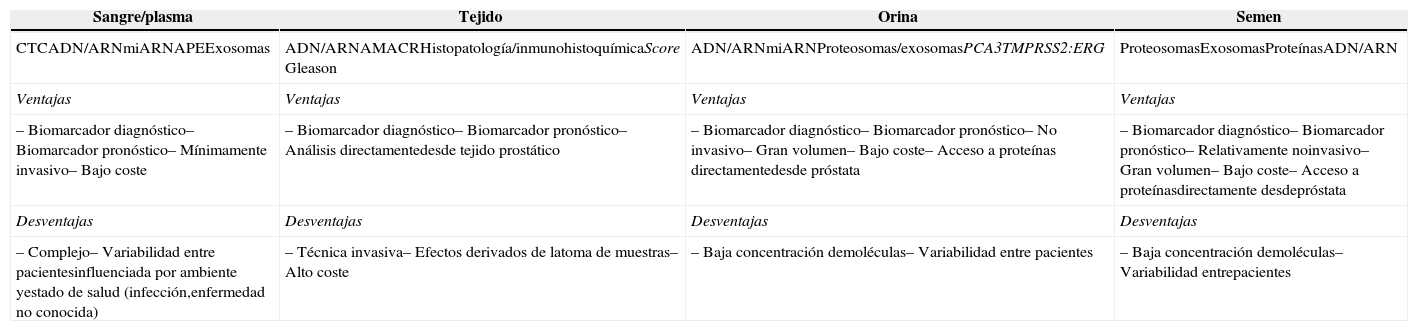
La revolución en la genómica del cáncer está cambiando el campo del diagnóstico y la terapéutica de éste, lo que nos lleva a la era de la medicina personalizada, en la que la selección del tratamiento se basa en las características moleculares del tumor de cada paciente. Para el logro y la implantación de este objetivo en la práctica clínica, se requiere de la identificación de biomarcadores predictivos, de la validación de las pruebas para la medición de estos biomarcadores y, por último, de ensayos clínicos prospectivos diseñados para calificar el biomarcador en un contexto específico de uso. A pesar de los extensos esfuerzos de la investigación, hasta la fecha en la práctica clínica se han introducido pocos biomarcadores para este cáncer. Prestaremos especial atención a los biomarcadores descritos recientemente, aquellos de aplicación en la práctica clínica urológica actual o cuyo uso se espera próximamente. En la tabla 1 resumimos los diferentes biomateriales disponibles actualmente para la identificación de biomarcadores de CaP, así como sus ventajas e inconvenientes.
Biomateriales disponibles para la identificación de biomarcadores de cáncer de próstata.
| Sangre/plasma | Tejido | Orina | Semen |
|---|---|---|---|
| CTCADN/ARNmiARNAPEExosomas | ADN/ARNAMACRHistopatología/inmunohistoquímicaScore Gleason | ADN/ARNmiARNProteosomas/exosomasPCA3TMPRSS2:ERG | ProteosomasExosomasProteínasADN/ARN |
| Ventajas | Ventajas | Ventajas | Ventajas |
| – Biomarcador diagnóstico– Biomarcador pronóstico– Mínimamente invasivo– Bajo coste | – Biomarcador diagnóstico– Biomarcador pronóstico– Análisis directamentedesde tejido prostático | – Biomarcador diagnóstico– Biomarcador pronóstico– No invasivo– Gran volumen– Bajo coste– Acceso a proteínas directamentedesde próstata | – Biomarcador diagnóstico– Biomarcador pronóstico– Relativamente noinvasivo– Gran volumen– Bajo coste– Acceso a proteínasdirectamente desdepróstata |
| Desventajas | Desventajas | Desventajas | Desventajas |
| – Complejo– Variabilidad entre pacientesinfluenciada por ambiente yestado de salud (infección,enfermedad no conocida) | – Técnica invasiva– Efectos derivados de latoma de muestras– Alto coste | – Baja concentración demoléculas– Variabilidad entre pacientes | – Baja concentración demoléculas– Variabilidad entrepacientes |
CTC: células tumorales circulantes; miRNA: micro ARN; AMACR: alfa-metilacil-CoA racemasa; APE: antígeno prostático específico. Las muestras biológicas para la investigación del CaP incluyen sangre, orina, semen y tejido de la próstata. Cada una de ellas presenta ventajas y desventajas que pueden afectar a la validación clínica de los biomarcadores y a la adopción de éstas, como pruebas de rutina. El plasma humano contiene la mayor cantidad de proteínas humanas que podrían servir como posibles marcadores para el diagnóstico y pronóstico del CaP. La orina se ha convertido en una popular fuente para el descubrimiento de biomarcadores debido a su naturaleza no invasiva. El semen es un material relativamente no invasivo para el análisis de biomarcadores de próstata. Las proteínas extraídas directamente de la próstata son de fácil acceso, sin embargo, existe una gran variabilidad de composición entre los pacientes. Por último, el tejido prostático a pesar de una rica fuente de posibles marcadores biológicos de cáncer de próstata, es el más invasivo de todos. Tomado de Choudhurya AD, Eelesc R, Freedland SJ, et al. The Role of Genetic Markers in the Management of Prostate Cancer. European Urology 2012;62:577–587.
La determinación de APE en suero continúa siendo el test de tamizaje más utilizado en el diagnóstico del CaP. Sin embargo, no hay un único valor de APE fiable que nos permita distinguir a pacientes con CaP de aquellos que no lo padecen y, así, una de las consecuencias del uso del APE como tamizaje en la población es el coste y la morbilidad que la biopsia de próstata conlleva en pacientes sin cáncer. En un intento de mejorar el funcionamiento del APE en sí mismo, ha habido numerosas investigaciones, incluyendo las mediciones del APE libre (APEI) e isoformas de APE.
• Antígeno prostático gen 3 (PCA3)El hallazgo de nuevos marcadores con una alta especificidad en el diagnóstico del CaP centra gran parte de las investigaciones actuales. Cabe destacar el PCA3, un marcador de ARNm no codificador específico de la próstata que se sobreexpresa en el 95% de los CaP cuando se comparan con tejido prostático normal o con hiperplasia benigna de próstata6. Tras numerosos estudios, que confirmaban estos hallazgos, se comercializa Progensa® PCA3 (Gen-Probe Inc., San Diego, CA, EUA), prueba diagnóstica que detecta cuantitativamente los niveles de PCA3 en orina y líquido prostático.
Recientes trabajos se centran en el valor de este marcador como test de primera línea de tamizaje. Con la intención de compararlo con el APE, un reciente estudio se centra en la utilidad del PCA3 como test inicial de diagnóstico. Este estudio revela que una puntuación de PCA3 > 35 en orina tiene sensibilidad del 68% y especificidad del 55.7% en la detección del CaP, comparada con el 57.4% y el 53.8% que ofrece el APE por encima de 2ng/mL7.
Donde sí ha sido estudiado extensamente el PCA3, es en aquellos pacientes con niveles de APE entre 2.5-10ng/mL y en aquellos otros con biopsias previas negativas y cifras de APE persistentemente elevadas. La Food and Drug Administration (FDA) ha aprobado el uso del PCA3 score con un punto de corte de 25, como indicador de necesidad de biopsia en estos pacientes, remarcando su alto valor predictivo negativo de 90%, sensibilidad de 77.5%, especificidad de 57.1% y valor predictivo positivo de 33.6%8,9. Sin embargo, numerosos estudios muestran mayor rentabilidad diagnóstica con un valor de 35. Debido a esto, el valor de corte continúa siendo motivo de discusión en la actualidad.
El PCA3 ofrece mejores resultados estadísticos en biopsia inicial o en la primera de repetición, y es superado por otros marcadores como el porcentaje de APEl/total (APEt), a partir de la segunda biopsia de repetición. Sin embargo, algunos autores han obtenido resultados estadísticos similares para el PCA3, independientemente de si la biopsia de repetición era la primera o la segunda10.
El desarrollo clínico de este marcador ha hecho que llegue a incorporarse como factor pronóstico independiente en varios nomogramas con la intención de cuantificar la posibilidad de una primera biopsia positiva, mejorando de esta manera la capacidad predictiva de los modelos previos. Según la literatura, el uso del PCA3 score proporciona una tasa de ahorro de primera biopsia de próstata de entre el 40% al 67%, cuando se combina con el APE y el tacto rectal. No obstante, genera más dudas como marcador único, dado que se detecta en neoplasia prostática intraepitelial (PIN, por sus siglas en inglés, prostatic intraepithelial neoplasia) de alto grado y en algún CaP por debajo de un valor de 35, mientras que en ocasiones no se ha revelado en algún caso con niveles por encima de 100. Por lo tanto, la capacidad predictiva del PCA3 se ve incrementada cuando se añaden otras variables como el APE y el tacto rectal, o cuando se agregan nuevos biomarcadores, como veremos más adelante.
• Isoforma del APE 2 ProPSA (p2PSA) e índice Beckman Coulter Prostate Health Index (PHI)Se han descrito varias modificaciones del valor de APE en suero, lo que podría mejorar la especificidad de este en la detección precoz del CaP. Entre ellas, figuran formas moleculares de APE, precursores inactivos que se expresan, como es el caso del proPSA en CaP. Una de las isoformas del proPSA, la 2 proPSA, se ha erigido como un potencial biomarcador al comprobar su mayor concentración en tejido canceroso11. El desarrollo de este nuevo biomarcador ha permitido integrarlo en un modelo matemático junto con el APEt y el APEl para generar el índice PHI, variable que se incluye en estudios actuales con la intención de valorar el potencial de este biomarcador. La hormonoterapia (HT), la hemofilia, las politransfusiones y las alteraciones en el proteinograma son algunos de los factores que pueden afectar a su determinación, estos deben ser tenidos en cuenta en su manejo clínico. Por el contrario, la edad o la raza no parecen influir en sus valores12. En la actualidad, ya se dispon e de un kit para la detección del p2PSA en suero.
El p2PSA demostró una mejor precisión que el APEt y el cociente APEl/APEt en la detección de CaP en la primera biopsia13. Se ha valorado su utilidad como marcador en varios rangos de APE, observando que, con valores entre 2-10ng/mL ofrece mejores resultados estadísticos en la detección del CaP que con el APEt y el cociente APEl/ APEt14,15.
• Gen de fusión TMPRSS2-ERGLa incorporación del score combinado de TMPRSS2-ERG produjo un beneficio claro al aumentar del 15% al 90% la probabilidad de encontrar CaP en la biopsia de próstata. La presencia del gen de fusión en orina y la no detección de CaP en la biopsia empieza a plantearse como una indicación clara de rebiopsia temprana, debido a la alta especificidad que ofrece este biomarcador, el “cáncer está pero no se ha detectado”, lo que sabemos, ocurre en más del 40% de las biopsias que llevamos a cabo según el esquema de 10-12 cilindros estándar.
• Hipermetilación del tejido de la primera biopsiaEn aquellos de nuestros pacientes con una primera biopsia negativa, pero con alta sospecha de CaP por parámetros clínicos o antecedentes de proliferación acinar atípica pequeña (ASAP, por sus siglas en inglés, atypical small acinar proliferation) o PIN en la primera; la hipermetilación del gen adenomatous polyposis coli (APC) en el tejido de la primera biopsia negativa podría ahorrar hasta un 30% de biopsias por el alto valor predictivo negativo (96%) que presenta16. No se trata de un bio marcador sérico, y faltan estudios que reproduzcan y corroboren estos resultados.
Biomarcadores con valor pronóstico y de respuesta al tratamiento en CaPUna vez confirmado el diagnóstico, es muy difícil estratificar el tumor, debido a la naturaleza multifocal de la enfermedad. Una estratificación inadecuada del tumor puede llevar a procedimientos radicales como la escisión prostática. Además, aproximadamente el 30% de los pacientes que se someten a una prostatectomía radical (PR) recurrirán; un indicador de que hubiera sido mejor optar por un tratamiento conservador. Asimismo, el CaP metastásico tiene un pronóstico variable que puede implicar una forma muy indolente de la enfermedad que hace que ésta no tenga impacto en la calidad de vida de los pacientes y que estos vivan hasta 15 años tras el diagnóstico. Por esta razón, se utilizan estrategias de vigilancia activa que consisten en supervisar los niveles de APE y llevar a cabo una biopsia si se considera necesario. Si se demuestra que el cáncer progresa, se optaría por tratamientos que habría que adecuar a la edad y situación clínica del paciente. En otros casos, el CaP tiene un curso mucho más agresivo y sólo transcurren 2 años de media hasta que hay signos clínicos de metástasis. Estos pacientes desarrollan rápidamente efectos locales, como la incontinencia urinaria y el dolor pélvico y, a menudo se presentan con la enfermedad en sus últimas etapas, cuando ya no existen opciones terapéuticas curativas.
Sin duda, es en este campo donde se necesita de manera más urgente desarrollar biomarcadores que se incorporen a los distintos nomogramas de variables clínico-patológicas que manejamos en nuestra práctica clínica.
• Antígeno prostático gen 3 (PCA3)Existen controversias entre los autores que han validado este marcador con fines pronósticos. Con la idea de conocer el papel que este marcador pudiera jugar en la vigilancia activa, Ploussard et al. estudia la relación entre los niveles de PCA3 y el volumen tumoral, en 106 pacientes con CaP de bajo riesgo y sometidos a cirugía radical. Concluyen que existe una correlación lineal significativa entre los niveles de este marcador y el volumen tumoral. Por tanto, la adición del PCA3 score puede mejorar los modelos predictivos de bajo riesgo tumoral y de CaP insignificante, mientras que por el contrario, no mejora la capacidad predictiva de afectación extraprostática e invasión de las vesículas seminales17,18. La tendencia más consistente en la literatura médica, es que el valor de PCA3, incluso con valores de score entre 20 y 35, se relaciona con tumores de bajo volumen y CaP insignificante, por lo que su papel en el futuro podría ser caracterizar a aquellos pacientes con CaP candidatos a protocolos de vigilancia activa; si bien, su valor en el seguimiento es más controvertido.
El bajo número de pacientes analizados puede estar detrás de las controversias en el valor pronóstico del PCA3. Nosotros concluimos que, hasta el momento y de acuerdo con los estudios analizados, no hay ninguna evidencia para la utilidad de PCA3 en los protocolos de vigilancia activa. Asimismo, creemos que este test no es capaz de predecir la agresividad del CaP. El valor pronóstico de este marcador merece un análisis con un mayor número de pacientes y un examen como variable pronóstica independiente en estudios multivariados frente a las variables ya conocidas.
• Isoforma del APE y sus derivados como el porcentaje de p2PSA/APEl y el índice PHILa relación entre el p2PSA con el Gleason de la biopsia de próstata ofrece resultados controvertidos. Un análisis de 350 muestras de PR demuestra que en el multivariante, la determinación del porcentaje p2PSA mejoraba la predicción de factores patológicos de mal pronóstico en la pieza quirúrgica19.
• Gen de fusión TMPRSS2-ERGLas implicaciones pronósticas de la proteasa transmembrana (TMPRSS2:ERG) generaron controversias en un principio, debido a la heterogeneidad de las series estudiadas y a las diferentes técnicas que se emplearon en su determinación. La TMPRSS2-ERG está presente en muchos CaP. La validación del score del gen de fusión en orina después de un masaje prostático tiene una alto valor pronóstico, ya que está relacionado estadísticamente con el Gleason tanto de la biopsia como de la pieza de PR, así como con la presencia en la pieza de CaP significativo (especificidad superior al 90% y valor predictivo positivo del 94%). Actualmente, está en fase de investigación y no está disponible ningún test diagnóstico.
La combinación en orina de PCA3 y TMPRSS2-ERG junto con los niveles de APE en suero, han sido postulados para mejorar el rendimiento en la detección del CaP, ofreciendo claramente información pronóstica. Asimismo, el score del gen de fusión se mostró relacionado con el Gleason de la biopsia de próstata y el estadio patológico20.
En un estudio de 521 pacientes sometidos a PR21, se relacionó la presencia del gen de fusión con un Gleason < 7, pero por el contrario, no ocurría lo mismo con el estadio patológico ni con el pronóstico de esos pacientes22. En aquellos intervenidos sin HT, el gen de fusión en sí no marca diferencias en cuanto a la supervivencia libre de progresión bioquímica o libre de progresión, pero cuando se divide a los pacientes en función de su presencia o ausencia de la fusión, se obtienen paneles clínico-patológicos diferentes23. Por el contrario, sí que se objetivan diferencias en expresión génica en función de la presencia o ausencia de la fusión, y ésta diferente expresión de copias de gen de fusión sí que podría marcar diferencias pronósticas24,25.
Otro estudio reciente en pacientes con CaP sometidos a observación, revela que la presencia de la fusión se asociaba a una mayor mortalidad por CaP26. A su vez, se ha apuntado que una variante genética de la fusión, denominada 2+Edel y caracterizada por la duplicidad de la fusión TMPRSS- ERG junto a la deleción intersticial de las secuencias 5´ de ERG, se relaciona de manera independiente con una peor supervivencia.
Un serie de pacientes con CPRC metastásico demostró que todas las metástasis portadoras de la fusión se asociaban a la variable 2+Edel27.
• Panel de genesUn reciente estudio28 identifica una serie de genes que indican la progresión del CaP, genes que a su vez pueden usarse como biomarcadores con la intención de definir grupos de pacientes con alto riesgo de desarrollar CaP. En la actualidad, no hay un método definitivo para diferenciar el cáncer indolente del agresivo y las estrategias de vigilancia no convencen a los especialistas. Por esta razón, en el estudio se pretenden identificar marcadores de progresión del CaP usando un panel de 91 genes y evaluando sus niveles de expresión de tejido tumoral.
Se estudió la expresión genética en una serie piloto de muestras en PR de 29 pacientes, en la que se identificaron 10 genes, de los que 6 podrían ser utilizados para predecir la progresión del CaP, demostrada por el grado Gleason y por la recurrencia, hasta en un 89.7% de los casos.
Los 6 genes definidos fueron: ANPEP, EFNA1, ABLI1, INMT, HSPB1 y PSCA. Usado conjuntamente con la determinación del Gleason y el nivel de APE antes de la cirugía, el gen TRIP resultó capaz de predecir la recurrencia en el 86% de los casos.
Una de las conclusiones del trabajo, más allá de la identificación de los genes, es que el uso de biomarcadores múltiples demuestra una mayor habilidad para identificar correctamente la enfermedad agresiva que un único biomarcador, por lo que pueden ser preferibles los análisis multivariables a los univariables. Esto no es del todo sorprendente, ya que el cáncer es una enfermedad compleja que se produce como resultado de distintas mutaciones de genes involucrados en una variedad de vías bioquímicas. Es más, las mutaciones carcinogénicas pueden no ser idénticas para todos los individuos, por lo que podría ser inapropiado esperar que un único biomarcador sea capaz de identificar la progresión de la enfermedad, como sugiere este estudio y otros similares.
Los autores también apuntan a que las muestras usadas en el trabajo pueden estar sesgadas, al haberse utilizado sólo tejidos de tumores extraídos de PR, un procedimiento recomendado generalmente para los tipos con cáncer menos agresivos. Así, sugieren que en otros estudios, tengan en cuentan tejidos provenientes de biopsias y no de extirpaciones quirúrgicas.
En conclusión, este estudio presenta un panel de genes potencialmente indicadores de progresión del CaP. Para verificar el valor de cualquiera de las firmas genéticas, se requiere de un estudio con más muestras. Pero este trabajo, en conjunción con otros similares, ayudará a encontrar los biomarcadores que se deben buscar en la estratificación del CaP.
• CTCLa detección de CTC puede ofrecer información pronóstica así como servir de monitorización de las terapias aplicadas. Se han utilizado varias técnicas para su determinación: RTPCR, por actividad telomerasas, purificación de anticuerpos que detectan antígenos de superficies de las CTC o técnicas de flujo celular con métodos de caracterización inmunofluorescentes o inmunomagnéticos. Actualmente, sólo el sistema CellSearch® (Veridex, Warren, NJ, EUA está aceptado para estudiar el CaP.
Su desarrollo ha sido mayoritario en el seguimiento, caracterización y medición de respuesta en el CaP metastásico y en el CaP resistente a la castración, dado que su detección en CaP órgano-confinado es baja (11%) y su papel pronóstico en este grupo ha sido menos estudiado. Las CTC en pacientes con CaP resistente a la castración pueden exhibir ciertas características diferenciadoras como la expresión de APE, amplificación de receptor androgénico, gen de fusión TMPRSS2- ERG, etc., que a su vez podrían ser detalladas como elementos pronósticos o de monitorización de respuesta.
La incidencia de un tumor metastásico resistente a la castración representa una importante causa de mortalidad relacionada con el CaP. La invasión metastásica se ha considerado, en general, un proceso tardío de la progresión maligna; pero en diversos estudios, se ha sugerido que la diseminación de las células cancerígenas primarias a distancia podría ser un acontecimiento precoz de la tumorigénesis. Además, las CTC pueden evitar el filtro de los ganglios linfáticos y propagarse directamente a través del torrente circulatorio hasta órganos a distancia. Estos hallazgos han propiciado el desarrollo de diferentes análisis para la detección de células tumorales diseminadas en médula ósea y de las CTC en sangre periférica. La mayoría de los estudios clínicos sobre células tumorales diseminadas prestaron atención a la médula ósea, el lugar más frecuente de las metástasis del CaP. Algunos investigadores hallaron correlaciones significativas entre la presencia de células tumorales diseminadas y los parámetros clínico-patológicos, como un grado elevado de Gleason o enfermedad metastásica29. Además, la presencia de células tumorales diseminadas en la médula ósea en el momento del diagnóstico representa un parámetro pronóstico negativo, independiente en pacientes con CaP localizado30. Puesto que la aspiración de la médula ósea es un proceso cruento, los esfuerzos recientes se centran en la detección de CTC en sangre periférica. Hoy día, dichas CTC se pueden detectar fácilmente por PCR en el momento del diagnóstico, antes, durante y después del tratamiento, y un aumento de su número se ha asociado con un Gleason y estadio elevados. Por otro lado, el estudio de la dinámica de la CTC después del tratamiento, demostró que su recuento predice mejor el desenlace clínico que los algoritmos basados en el APE. Los pacientes cuyos recuentos de CTC disminuyeron desde > 5 células en el periodo basal hasta < 5 células después del tratamiento, se caracterizaban por una mayor supervivencia global en comparación con aquellos que mostraron un aumento durante el tratamiento31.
En pacientes con CaP órgano-confinado, el número de CTC detectables parece ser reducido. La caracterización de la CTC y de las células tumorales diseminadas en pacientes con CaP, podría proporcionar información más detallada sobre la biología del cáncer y mejorar el control de la enfermedad mediante la selección de un tratamiento efectivo dirigido en un contexto individual.
• Marcadores de línea germinalExiste evidencia de que la agresividad del CaP tiene un componente hereditario32, y varios grupos han analizado marcadores de riesgo de la línea germinal asociados con la agresividad de la enfermedad. Un alelo asociado con el riesgo de desarrollar CaP y que también se ha asociado con agresividad y con mortalidad específica por CaP en más de un estudio es el rs2735839 (KLK2-KLK3)33,34.
KLK3 codifica APE y el alelo de riesgo SNP (polimorfismo de un solo nucleótido) rs2735839 (G) fue uno de los 6 loci identificados que se asociaban con mayores niveles de APE en pacientes sin CaP. Curiosamente, es el alelo de no riesgo rs2735839 (A), el que se ha correlacionado con una peor supervivencia específica por CaP. Una de las hipótesis que explica estos resultados es que los niveles elevados de APE se asocian con un mayor riesgo, pero con enfermedad más indolente, pudiendo permitir que el cáncer en estos pacientes sea detectado en una etapa temprana y así protegerse de la eventual mortalidad asociada con CaP35. Es necesario seguir trabajando para determinar cómo la variación en este locus influye en el resultado. No importa cuál sea el mecanismo, un potencial uso clínico para este SNP podría ayudarnos a determinar un APE de corte para la biopsia. Aquellos pacientes con el alelo A pueden beneficiarse de un punto de corte más bajo.
La mayoría de los estudios llevados a cabo sobre las variantes genéticas que afectan a la agresividad y al pronóstico del CaP, se han centrado en los alelos asociados con el riesgo de desarrollar cáncer. Sin embargo, es posible que diferentes variantes influyan en el pronóstico de cáncer después de que éste se desarrolle, tales como los genes implicados en el metabolismo de esteroides, la progresión del cáncer, la vigilancia inmune o el metabolismo de fármacos. Si bien los enfoques de genes candidatos han dado resultados que merecen mayor seguimiento36, es importante llevar a cabo verdaderos GWAS (estudio genoma completo) en lugar de estudiar los conjuntos seleccionados de SNPs. Una dificultad en estos análisis ha sido la heterogeneidad en la definición de agresividad de la enfermedad, incluso dentro del mismo estudio37. Por lo tanto, los estudios futuros deben incluir un gran número de pacientes de diversos orígenes étnicos y con definiciones estandarizadas de agresividad.
Paneles de múltiples biomarcadoresLa renacida necesidad de mejorar la capacidad pronóstica y predictiva del APE conlleva a la irrupción de nuevos biomarcadores como arma diagnóstica en el quehacer diario del urólogo. Sin embargo, la alta prevalencia del CaP, su heterogeneidad y las distintas vías moleculares potencialmente implicadas en su patogénesis hacen que sea improbable que un único marcador molecular tenga sensibilidad y especificidad suficientemente altas para considerarlo idóneo. Ello ha dado pie a que en los últimos años hayan empezado a publicarse combinaciones de múltiples marcadores séricos y/o en orina que sumados, aumenten la proporción sensibilidad/ especificidad para el diagnóstico del CaP.
Se han descrito modelos predictivos para indicar la biopsia de próstata basados en paneles de biomarcadores múltiples, por ejemplo, Cao en un estudio piloto, propone dividir a los pacientes candidatos a biopsia según un APE mayor o menor de 10ng/mL y, en cada grupo indicar o no la necesidad de ésta en función de la presencia de PCA3 +/- genes de fusión detectados en orina. Concluye que se pueden ahorrar hasta un 67% de las biopsias innecesarias con sólo un 15% de falsos negativos38.
También se han desarrollado paneles de múltiples biomarcadores en orina que no incluyen el PCA3, como el descrito por Nguyen et al. para 4 variedades de fusión de los genes TMPRSS2-ERG, y que dada la alta especificidad del gen de fusión, podría ser útil para la indicación de biopsia de próstata de repetición39.
DiscusiónEl desarrollo del PCA3 supuso un renacer en el interés de la comunidad científica urológica por el refinamiento y la caracterización pronóstica del CaP. Los progresos biotecnológicos obtenidos en las últimas fechas, representan una fuente notable de biomarcadores tisulares y séricos, exigiéndonos un rigor en su desarrollo clínico y molecular para la selección de aquellos que puedan aportar información pronóstica o diagnóstica a los nomogramas ya establecidos. Estos nomogramas clínicos, basados en la puntuación del grado de Gleason, el estadio tumoral y los valores séricos de APE, continúan siendo en la actualidad, las mejores variables pronósticas en nuestros pacientes con CaP.
Con los inconvenientes bien conocidos del APE, hay un esfuerzo centrado en el desarrollo de herramientas de reemplazo en la detección de CaP. La prueba de APE es actualmente el mejor biomarcador para la recurrencia del CaP y sin duda ha sido, en parte, el responsable del aumento de la conciencia actual sobre el CaP. Sin embargo, ningún estudio hasta la fecha ha demostrado que el cribado con APE reduzca la mortalidad por CaP. Supone un desafío reemplazar el uso del APE, debido fundamentalmente a su naturaleza mínimamente invasiva y a su bajo coste; pero hay, sin embargo, una necesidad urgente de complementar su uso con biomarcadores de mayor especificidad y sensibilidad. Lo idóneo sería un panel de múltiples biomarcadores diagnósticos y pronósticos junto con el APE, constituyendo hoy en día, el centro de las investigaciones de numerosos grupos40,41.
Las características que debe cumplir el biomarcador que “reemplace” al APE incluiría, por un lado, una alta sensibilidad y especificidad, y por otro, sería cuantificable y proporcionaría resultados rápidos a bajo coste, utilizando una metodología de muestreo que sea bien tolerada por los pacientes. Cualquier prueba de sustitución debe ser capaz de monitorizar la progresión de la enfermedad y a su vez, distinguir entre pacientes con CaP clínicamente significativo y CaP clínicamente insignificante. Además, en estadios iniciales de la enfermedad debe ofrecer información individualizada acerca de la mejor estrategia terapéutica a tomar en nuestro paciente, ya sea vigilancia activa o un enfoque agresivo (cirugía, radioterapia, quimioterapia).
El acceso a una determinación asequible y reproducible de nuevos biomarcadores como los genes de fusión y las isoformas del APEI, hará que debamos comparar bioestadísticamente unos biomarcadores con otros en distintos escenarios. En el CPRC será necesario desarrollar biomarcadores que permitan caracterizar qué tratamiento aplicar en cada caso, dado el gran número de alternativas que se nos abren en la actualidad y el alto coste que éstas conllevan. Es posible que las CTC encuentren aquí su sitio.
ConclusionesLa determinación de APE en suero continúa siendo el test de tamizaje más utilizado en el diagnóstico del CaP. A su vez, continúa siendo el mejor biomarcador para la recurrencia del CaP.
El PCA3 es útil en la selección de pacientes candidatos a rebiopsia después de un resultado inicialmente negativo, pero su costo-efectividad queda por demostrar. Su papel en la vigilancia activa del CaP ya diagnosticado, no ha sido confirmado.
El uso conjunto de biomarcadores en orina y suero en paneles de biomarcadores múltiples, junto con la caracterización radiológica del CaP, será el escenario que marque el diagnóstico y el perfil pronóstico del CaP en un futuro próximo, obviando biopsias innecesarias, disminuyendo la tasa de sobrediagnóstico y tratamiento, perfilando los distintos protocolos de vigilancia activa y seleccionando los distintos tratamientos en el CPRC.
Será básica la aportación de múltiples instituciones con ensayos clínicos, para de esta manera, validar prospectivamente la utilidad de estos biomarcadores en la toma de nuestras decisiones clínicas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciamientoNo se recibió patrocinio para llevar a cabo este artículo.
AgradecimientosA los investigadores que entregan parte de su vida al progreso de la ciencia.