¿ INTRODUCCIÓN
El CaP es la segunda causa de muerte en hombres por cáncer después del de pulmón. Después de los 50 años de edad, la incidencia de cáncer de próstata aumenta tres o cuatro veces cada 10 años. En México, el cáncer de próstata (CaP) es el segundo lugar respecto a la incidencia de cáncer después del cáncer de piel y segundo lugar en mortalidad por cáncer después del cáncer cervicouterino.
Aunque el antígeno prostático específico (APE), es el mejor indicador sérico para el diagnóstico del CaP actualmente disponible, tiene grandes limitaciones a pesar de su gran sensibilidad, el uso del APE se ve limitado por su pobre especificidad, por consiguiente, la valoración clínica de pacientes con un valor de APE elevado resultará en el rendimiento de las biopsias prostáticas superfluas en un número concreto de hombres.
Se ha relacionado a la ciclooxigenasa-2 (COX-2) en la carcinogénesis por la estimulación de la angiogénesis y esto es un proceso crucial para el crecimiento y expansión tumoral, existe una sobreexpresión de COX-2 en la mayoría de los carcinomas primarios en humanos independientemente del tipo histológico o el grado,1 en contraste con los tumores pancreáticos benignos no expresan COX-2 y estos resultados sugieren que la COX-2 representa un marcador del potencial maligno en el cáncer pancreático.2
En una investigación que se realizó en tumores intestinales, la expresión de los niveles de COX-1 eran normales en intestino, en cambio, los niveles de la COX-2 son indetectables en intestino normal y sus niveles fueron elevados hasta en 85% en adenocarcinoma colorrectal.3
Existen estudios que apoyan que hay un incremento en la expresión de la COX-2 en especímenes con cáncer de próstata con una puntuación elevada en la escala de Gleason, mientras que otros muestran que la expresión de la COX-2 no es congruentemente elevado en cáncer de próstata y que no se relaciona con el establecimiento con factores de riesgo clínico-patológico semejantes a la escala de Gleason y estadio patológico.4
Mediante la inmunohistoquímica y la RT-PCR se han podido realizar estas investigaciones, y se ha demostrado que la COX-2 juega un papel importante en la proliferación de células cancerosas en la próstata; la inhibición de la expresión de ésta inhibe la carcinogénesis;5 en otra investigación se relacionó la terapia con glucocorticoides a la reducción de la transcripción de la COX-2.6
La endotelina 1 también incrementa significativamente la expresión de la COX-1 y 2, y esta última promueve la actividad y producción de prostaglandina E2 (PGE2); estos efectos dependen de la activación del receptor de la endotelina A (ETaE) y de proteína quinasa (MAPK) en el estudio realizado con células de carcinoma de ovario humano.7
El cáncer de próstata es la segunda causa de muerte en hombres, y en algunos estudios, se han realizado la dieta rica en grasa animal como factor desencadenante para la aparición de cáncer; la expresión de la COX 2 esta asociado al grado del tumor.8
¿ MÉTODOS
Sujetos de estudio: La recolección de las muestras se llevó hacia el final del mes de septiembre de 2008 y hasta abril de 2009, provenientes de pacientes atendidos en el Hospital Central Militar que cumplieron con los siguientes criterios; de inclusión: (a) pacientes con diagnóstico de CaP, candidatos a cirugía radical de próstata, (b) pacientes con diagnóstico de CaP con indicación de tunelización prostática, (c) pacientes con diagnóstico de HPB e indicación de resección transuretral prostática (RTUP). Los criterios de exclusión fueron: (a) pacientes que no autorizan participar en el procedimiento, (b) pacientes que no sean candidatos a RTUP. Criterios de eliminación: (a) pacientes cuyo RNA extraído y purificado presentaba una concentración y pureza inadecuada para el estudio. (b) tejido que en el traslado sufriera desnaturalización de material nucleico. La cantidad de tejido necesaria para la investigación fue de 200 mg como mínimo.
Criterios de eliminación: (a) Cantidad de tejido insuficiente. (b) Tejido que en el traslado sufrió desnaturalización del material genético. La cantidad de tejido necesaria para la investigación, fue de uno hasta cinco gramos; la obtención de las muestras se hizo inmediatamente después de la realización de la intervención quirúrgica; el tiempo máximo de traslado tomó aproximadamente de una hora; desde la obtención de la muestra hasta su traslado al laboratorio de Biología Molecular de la Escuela Médico Militar, donde se mantuvieron a una temperatura de -70°C en el ultracongelador Revco® (Legaci ULT2186 3-35 Dupont SVVA Refrigerants).
Inmunohistoquímica: Por microscopía de luz, las muestras de tejidos de CaP y HPB fueron fijadas por inmersión en formalina (pH=7.4) y se embebieron en parafina. Para el análisis histológico, secciones de tejido (3 mm) fueron teñidas con hematoxilina y eosina (H&E). Las secciones de tejido fueron teñidas con ácido periódico de Shiff`s (PAS) para mostrar los polisacáridos, mucopolisacáridos y glicoproteínas de la membrana celular.
Los cortes fueron incubados con ácido peryódico durante cinco minutos y lavados con agua destilada. Los cortes fueron incubados con el reactivo de Schiff`s durante cinco minutos y contrateñidos con hematoxilina por 30 segundos. El perfil histológico de cinco campos seleccionados aleatoriamente, fueron registrados utilizando el software KS-300 (Carl Zeiss, Jena, Germany). El porcentaje de área dañada con alteraciones histopatológicas fue obtenido (magnificación 400x). Para la inmunohistoquímica las secciones de tejido (3 mm) se desparafinaron y se calentaron para desenmascarar los sitios antigénicos; la actividad endógena de la peroxidasa fue bloqueada con 0.03% de H2O2 en metanol absoluto. Las secciones de tejido fueron incubadas toda la noche a 4ºC a una dilución 1:200 de anticuerpo monoclonal contra COX-2 en solución TRIS Se removió el anticuerpo primario y se realizaron dos lavados repetitivos con TRIS, los cortes fueron incubados con una dilución 1:500 de anticuerpo policlonal de conejo como anticuerpo secundario y se realizaron dos lavados repetitivos con TRIS. Los anticuerpos unidos se detectaron con el complejo avidina-biotina (ABC-kit Vectatastain) y la diaminobenzidina como sustrato. Después de lavar repetidamente con TRIS los cortes fueron contrateñidos con hematoxilina. Todos los cortes fueron incubados bajo las mismas condiciones con la misma concentración de anticuerpo y en la misma corrida, por lo tanto, la inmunotinción fue comparable. Todos los especímenes fueron examinados por el microscopio de luz Axiovert 200M (Carl Zeiss, Jena, Germany). Para el análisis morfométrico automatizado, el porcentaje de células positivas (color marrón) se determinaron con un analizador de imágenes computarizado KS-300 3.0 (Carl Zeiss, Jena, Germany). Este equipo detecta automáticamente las células positivas determinando su porcentaje por campo. Cinco campos aleatorios fueron estudiados a una magnificación de 100 (área total 1584 000 m2). Los resultados fueron expresados como porcentaje.
Análisis de datos: Sobre los correspondientes a la inmunorreactividad de la COX-2, se analizaron con la prueba t de Student, tomando la media de la desviación estándar; se compararon ambos grupos (CaP y HPB) y se consideró una p < 0.05, como diferencia estadísticamente significativa.
¿ RESULTADOS
Del total de 81 pacientes se obtuvieron las muestras biológicas: 42 (51.85%) con diagnóstico establecido de CaP, mientras que 39 (48.14%), con el de HPB.
La edad de los pacientes con cáncer de próstata fue de 67.77 ± 8.65. La edad de los pacientes con HPB fue de 64.37 ± 11.07. La comparación de ambos grupos mediante prueba t para muestras independientes no fue significativa, por lo que se acepta que la edad de ambos grupos es equivalente t = 1.326, gl 54.814, p = 0.190 para dos colas. El valor de Gleason en el grupo de cáncer de próstata fue de 4.47 ± 3.1; mediana cinco y valor máximo nueve.
El valor del antígeno prostático del grupo con cáncer de próstata fue de 35.29. El valor del antígeno prostático del grupo con hiperplasia prostática benigna fue de 26.32.
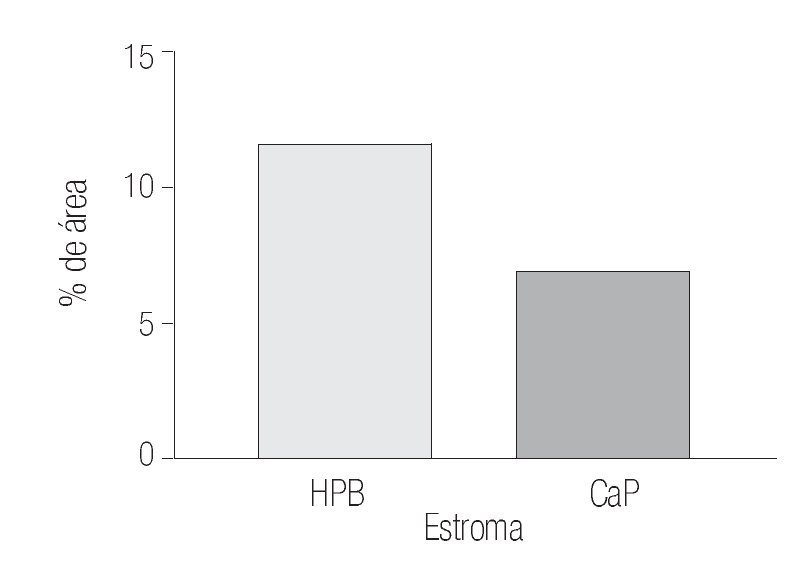
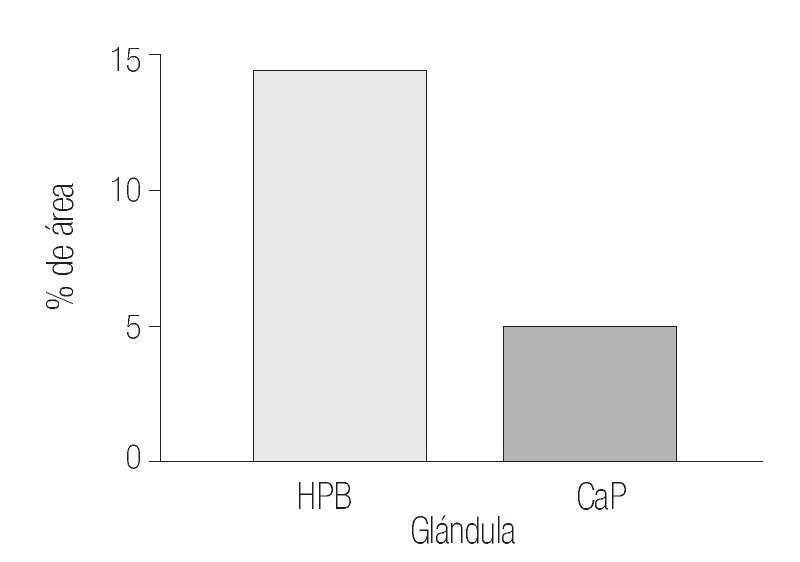
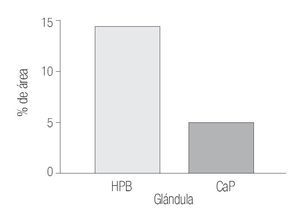
Los datos cuantitativos de la expresión de COX-2 fueron de 12.11% y de 14.76% en estroma y glándula de HPB y de 7.41 y 5.12% en estroma y glándula de CaP.
Mediante prueba de t para variables independientes, se evidenciaron diferencias estadísticamente significativas: p = 0.0314 para porcentaje de inmunorreactividad de las áreas por campo (400x) del estroma; p = 0.0001 para porcentaje de inmunorreactividad de las áreas por campo (400x) de la glándula, donde es evidente que la inmunorreactividad esta mucho más aumentada en tejidos con HPB por lo que se acepta nuestra hipótesis de investigación, asumiendo que existe diferencia estadísticamente significativa entre ambos grupos con respecto al porcentaje de la inmunorreactividad de las áreas por campo (400x) del estroma y el porcentaje de la inmunorreactividad de las áreas por campo (400x) de la glándula (Imágenes 1, 2 y 3)
Imagen 1. Determinación por inmunhistoquímica de la expresión de COX-2 en estroma de CaP (7.41%) de área marcada por campo y HPB (12.11%). En ambos grupos se determinó el porcentaje del área marcada por campo (400x) y se analizaron los valores (p = 0.0314) con un aumento significativo en HPB.
Imagen 2. Determinación por inmunhistoquímica de la expresión de COX-2 en glándula de CaP (5.12 %) de área marcada por campo y HPB (14.76%). En ambos grupos se determinó el porcentaje del área marcada por campo (400x) y se analizaron los valores (p = 0.0001) con un aumento significativo en HPB
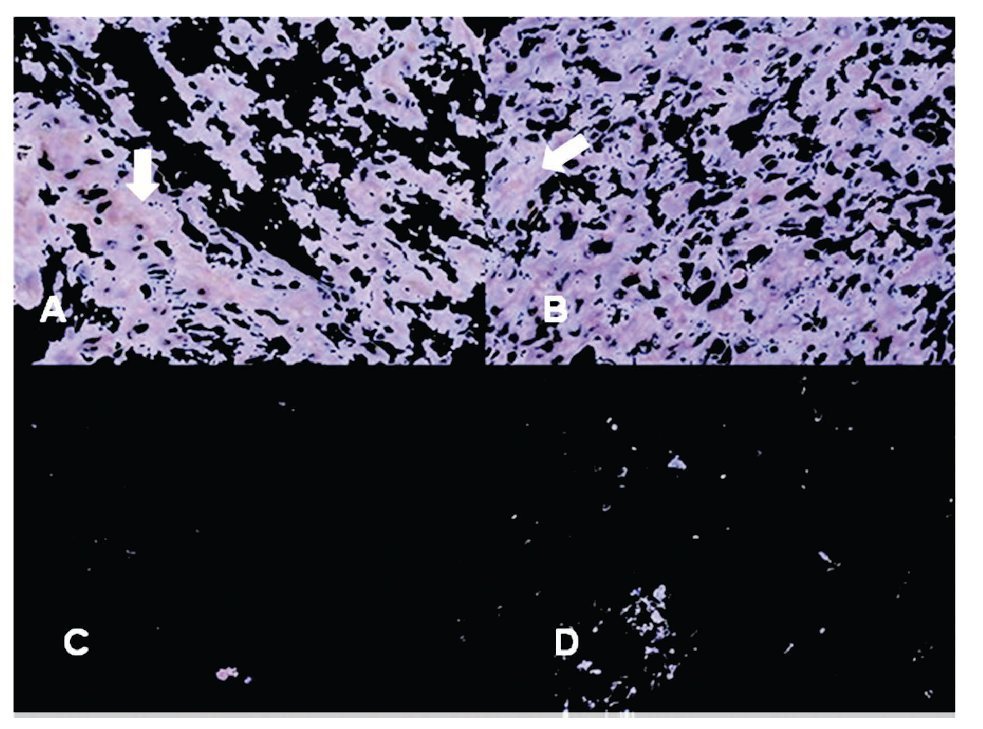
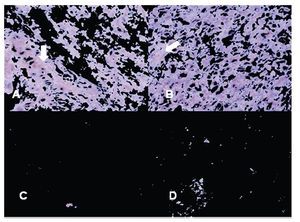
Imagen 3. Localización inmunohistoquímica de COX2 en glándula de Hiperplasia Prostática Benigna y Cáncer de Próstata. Las imágenes son cortes histológicos donde se observa la marca de COX2, en (A) y (B) glándula de Hiperplasia Prostática Benigna, en (C) y (D) glándula de Cáncer de Próstata. Las flechas indican la inmunorreactividad positiva (color café marrón). Se observa disminución evidente de la intensidad de la marca en "C" y "D", en porcentaje de área marcado por campo (A), (B) vs (C), (D); p = 0.0001. Las figuras son representativas (n =), (400x).
¿ DISCUSIÓN
La COX-2 es una enzima inducible que se observa en sitios donde existe inflamación y dolor. En estudios recientes, ya se ha evaluado la expresión de COX-2 en CaP; en ellos, se ha observado una sobrerregulación de COX-2 en CaP que se ha relacionado con la inhibición de la actividad de esta enzima en las células cancerosas.6 Se ha evidenciado una elevación de esta enzima tanto en CaP como en HPB, sin embargo existen discrepancias en los informes publicados en cuanto a los niveles de expresión de la COX-2 en ambos grupos y que tipo de células la expresen. Con respecto a esto, se ha observado que la localización intracelular de COX-2 en las células epiteliales de HPB y cáncer de próstata son diferentes entre sí. Mientras que en la HPB se encuentra significativamente localizada en la membrana celular basal y basolateral, en CaP predomina en el citoplasma.8
La evidencia de la bibliografía señala que la proteína COX-2 se expresa a niveles muy bajos o no detectables en los tejidos normales de la próstata. Además, cuando la tinción de la COX-2 se observó en el cáncer de próstata, el grado de tinción positiva no se correlacionó con los factores de riesgo clínico-patológicos establecidos.6
Sin embargo, otros estudios muestran una relación entre la expresión de COX-2 y el grado de diferenciación del tumor.8
La expresión de la COX-2 en nuestro estudio demostró que esta enzima se expresa significativamente en HPB en comparación con CaP.
¿ CONCLUSIONES
Los resultados anteriores parecen sugerir que la COX-2 tiene un papel importante en el grado de diferenciación tumoral.
Correspondencia: Dr. Esaú Floriano Sánchez.
Escuela Médico Militar. Cerrada de palomas S/N. Col. Lomas de San Isidro. México, D.F.
Teléfono: 5540 7728. Extensión 175. Fax: (52) 5520 2121.
Correo electrónico:floriano_esa@yahoo.com