¿ INTRODUCCIÓN
Entre 230 000 y 240 000 hombres son diagnosticados con cáncer de próstata anualmente en Europa y EUA.1,2 Aproximadamente 40% elige tratamiento definitivo con prostatectomía radical (PR), siendo ésta el estándar de oro en pacientes con una expectativa de vida mayor a 10 años. En 2003, en México se obtuvieron 6536 registros histológicos de cáncer de próstata lo que lo ubica como uno de los tumores más frecuentes en la población masculina; ocupa el segundo lugar de muertes en varones, sólo detrás del cáncer de pulmón, con 3766 defunciones por año, con una tasa de 11.9 por 100 000 habitantes. Se presenta con mayor frecuencia en sujetos mayores de 60 años resaltando el grupo de 75 años y más quienes ocupan casi la mitad de los casos con 47%. Para este mismo año, según el Reporte Histopatológico de Neoplasia Malignas, se presentaron 4602 muertes por cáncer de próstata. El tratamiento puede variar desde prostatectomía radical, radioterapia o bloqueo hormonal, el seguimiento para cualquiera de estas modalidades es la medición en sangre del antígeno prostático específico.
Diversas publicaciones han demostrado que el beneficio curativo de este procedimiento está ligado con la adecuada selección de los casos, evidenciando un beneficio mayor en paciente con tumores de bien diferenciados, con APE ≤20 ng/mL y con enfermedad localizada, teniendo resultados no satisfactorios en enfermedad localmente avanzada o con factores de riesgo (APE ≥20 ng/mL, estadio clínico T3, permeación perineural, Gleason ≥7). D´Amico propuso agrupar los casos de acuerdo al APE, estadio clínico y Gleason de la biopsia, lo que nos permite predecir el riesgo de presentar recurrencia bioquímica (RB). Los índices de control para enfermedad localizada son altos, 20% a 30% de los pacientes experimentaran recurrencia la cual se manifiesta inicialmente con un incremento en el antígeno prostático específico (APE) sin evidencia clínica o radiológica de metástasis.3
Esta recurrencia bioquímica es indicativa de la presencia de tejido prostático epitelial y se asume que representa cáncer. El curso de la recurrencia bioquímica es variable. Algunos experimentan una progresión clínica (PC) para metástasis, mientras para otros no representa mayor problema.
La recurrencia bioquímica no reemplaza a la progresión clínica o la mortalidad específica de cáncer de próstata y está pobremente asociada. Un punto importante en los pacientes con riesgo de progresión clínica es la determinación de un incremento en el APE que representa enfermedad local o sistémica. El manejo de los pacientes con elevaciones del APE se basa en el riesgo de progresión clínica, la esperanza de vida y el determinar si este incremento es por enfermedad local o sistémica.
La recurrencia bioquímica se define como cualquier nivel detectable de APE posterior a la prostatectomía radical o un incremento en el APE después de un periodo de no haber sido detectable. La vida media del APE es de 3.1 días, y después de la prostatectomía radical debe disminuir a niveles indetectables después de cuatro semanas.4 Realizar una prueba periódica de APE posterior a la prostatectomía radical es la piedra angular de la vigilancia posoperatoria para enfermedad recurrente. Las definiciones de la bibliografía incluyen valores únicos o múltiples de APE entre 0.2 a 0.6 ng/ mL. El límite mayormente utilizado es APE ≥0.2 ng/mL después de prostatectomía radical y dos valores consecutivos ≥0.2 ng/mL son aceptados por la Asociación Europea de Urología (EAU) como la base para el inicio de tratamiento.5
De los hombres con APE ≥0.4 ng/mL, 79% demuestra evidencia de progresión clínica. La recomendación para recurrencia bioquímica es APE ≥0.4 ng/mL, por lo que se aceptó como definición de recurrencia bioquímica un APE ≥0.4 ng/mL como mínimo un mes después de la cirugía, seguido de un nivel subsecuente de APE igual o mayor que la primera medición.6 Dos elevaciones sucesivas de APE ≥0.4 es la definición óptima de recurrencia bioquímica que predice eventos clínicamente significativos; sin embargo, no se ha estudiado específicamente la primera determinación de APE y su asociación con la recurrencia bioquímica, incluso en pacientes con niveles por debajo de 0.40 ng/mL que se pueden considerar libres de enfermedad, el cual es el objetivo del siguiente trabajo.
¿ OBJETIVO
Identificar si existe asociación entre la primera determinación del APE posterior a la prostatectomía radical y su recurrencia bioquímica.
Comparar la frecuencia de recurrencia bioquímica de acuerdo a diferentes puntos de corte del APE en la primera determinación después de la prostatectomía radical.
¿ MÉTODOS
Estudio transversal comparativo, descriptivo, abierto, retrospectivo. Se revisaron los expedientes de pacientes con cáncer de próstata tratados con prostatectomía radical en nuestra institución entre enero de 1991 y mayo de 2010 (n = 180 expedientes).
Se estadificaron los pacientes de acuerdo a los niveles de APE. Posteriormente se registró si presentaron recurrencia bioquímica (APE >0.40 ng/mL) y se consignó el tiempo en que se presentó dicha recurrencia. Se compararon los grupos para identificar si existe asociación entre la primera determinación de APE post cirugía y la frecuencia de recurrencia bioquímica.
Los datos se recabaron en la hoja de captura y se elaboró una base de datos en Excel y se realizó estadística descriptiva. Se utilizó prueba de Ji cuadrada. Se consideró como estadísticamente significativo p ≤0.05. Se utilizó el paquete estadístico STATA.
Criterios de Inclusión. Expedientes de pacientes con cáncer de próstata que su tratamiento fue prostatectomía radical que cuenten con determinación de APE dentro de los tres primeros meses posterior a la cirugía.
Criterios de exclusión. Pacientes tratados con radioterapia u hormonoterapia.
¿ RESULTADOS
Se revisaron los expedientes de 180 pacientes los cuales se agruparon de la siguiente forma: de acuerdo a la edad se encontraron dos pacientes menores de 50 años, 50 pacientes entre 51 a 60 años de edad, 104 pacientes entre 61 a 70 años y 24 pacientes por arriba de los 71 años de edad, con un promedio de edad para este estudio de 64 años al momento de la prostatectomía radical.
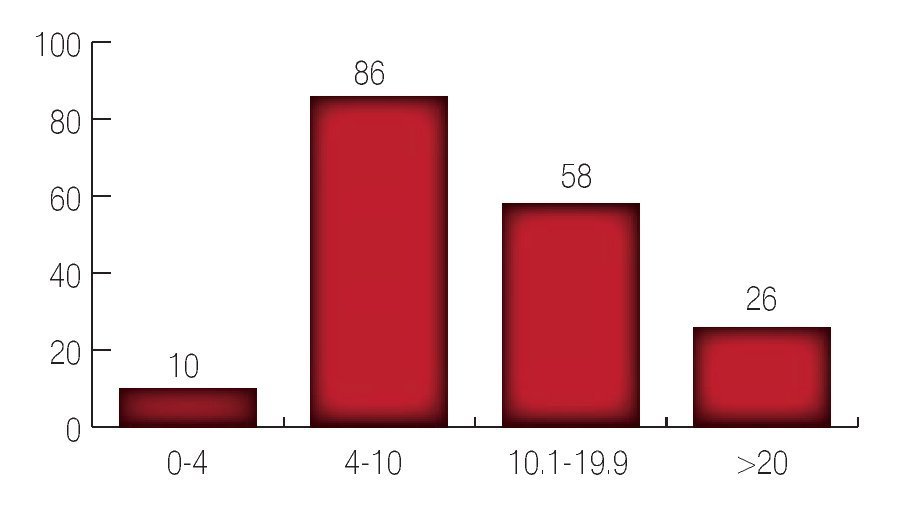
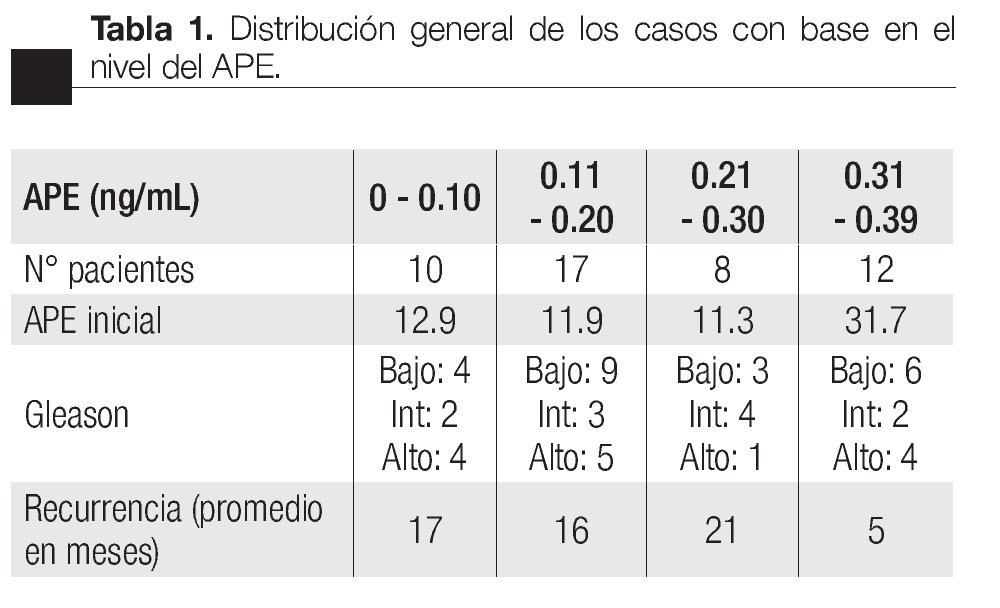
El APE inicial promedio preoperatorio se dividió en niveles de 0 a 4 ng/mL, de 4 a 10 ng/mL, de 10.1 a 19.9 ng/mL y ≥ 20 ng/mL, encontrando 10 pacientes en el grupo de APE de 0 a 4 ng/mL; 86 pacientes con APE entre 4 a 10 ng/mL; 58 pacientes para el grupo entre 10.1 a 19.9 ng/mL y 26 pacientes con APE 320 ng/mL. Con un APE promedio pre-operatorio de 13 ng/mL (Imagen 1).
Imagen 1.Antígeno prostático específico inicial.
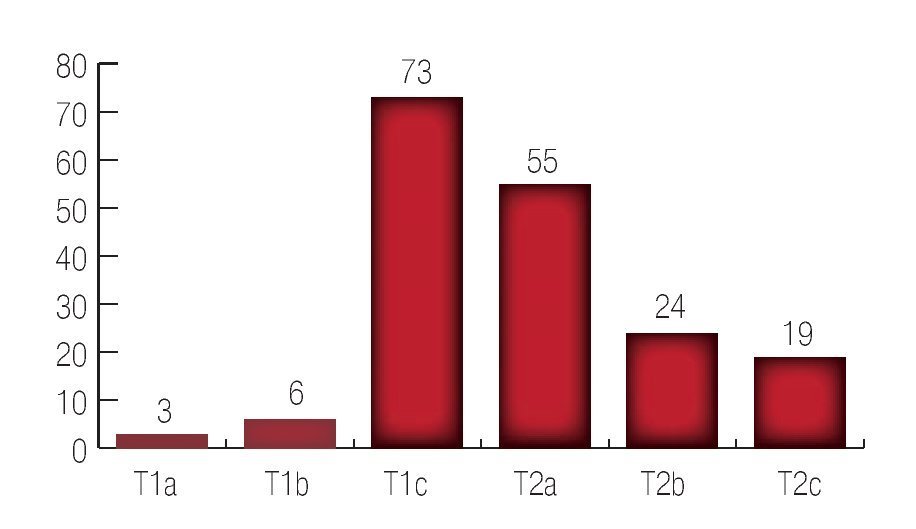
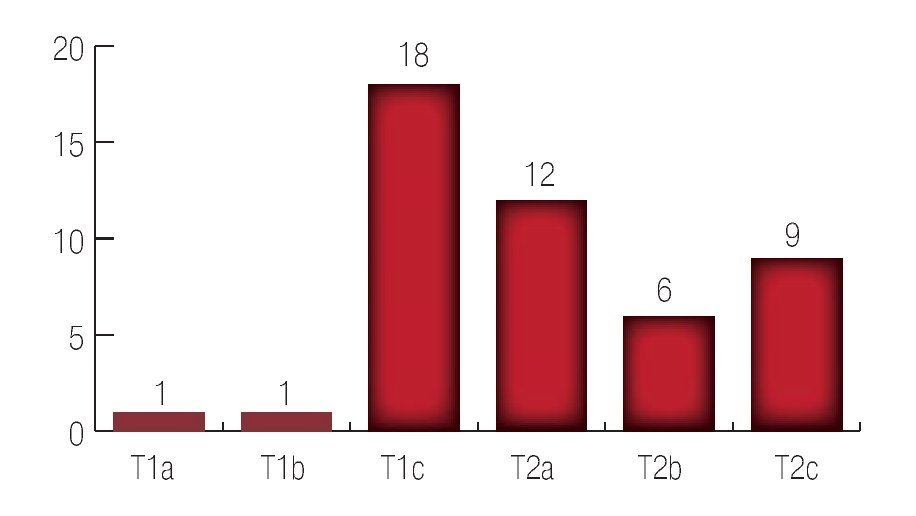
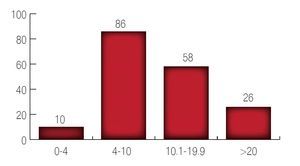
El tacto rectal inicial fue T1a en tres pacientes; T1b en seis pacientes; T1c en 73 pacientes; T2a en 55 pacientes; T2b en 24 pacientes y T2c en 19 pacientes. (Imagen 2).
Imagen 2. Resultado del tacto rectal inicial.
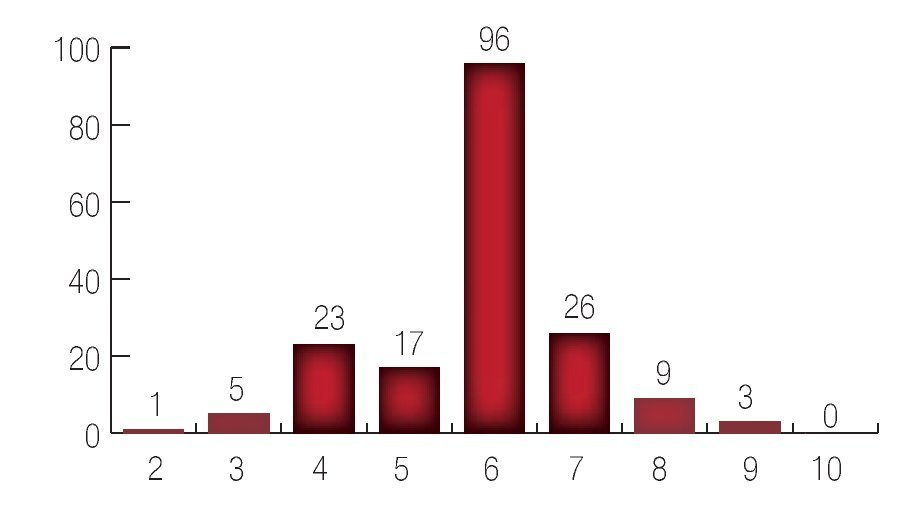
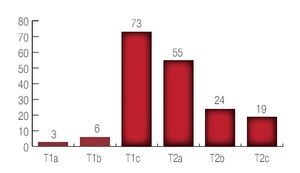
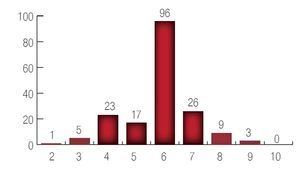
Con respecto al patrón del Gleason pre-operatorio se encontró un paciente con suma de Gleason de 2; cinco pacientes con suma de Gleason 3; 23 pacientes con suma de Gleason 4; 17 pacientes con suma de Gleason 5; 96 pacientes con suma de Gleason de 6; 26 pacientes con suma de Gleason 7; nueve pacientes con suma de Gleason 8 y tres pacientes con suma de Gleason 9. El promedio de la suma de Gleason preoperatorio fue de 6 (Imagen 3).
Imagen 3. Resultado del Gleason inicial.
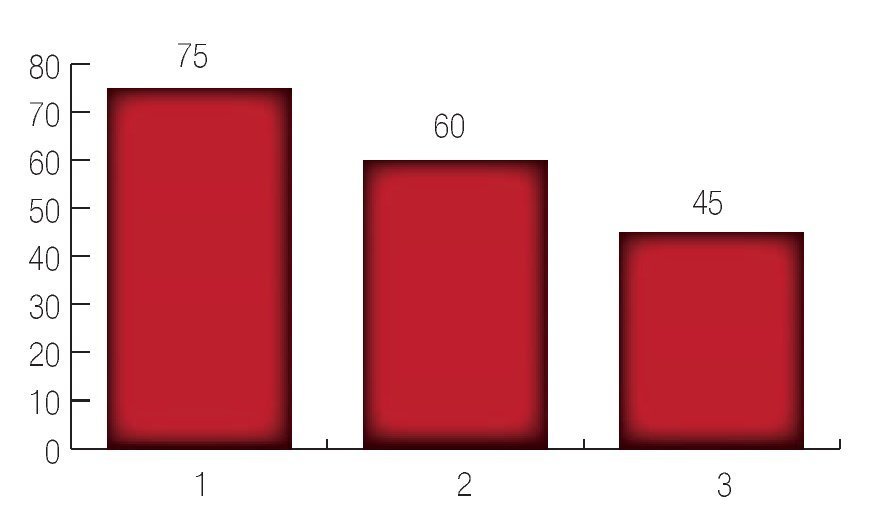
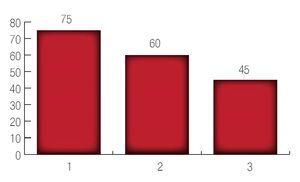
De acuerdo a la clasificación de riesgo de acuerdo a los grupos de D´Amico fue la siguiente: se encontraron 75 pacientes en grupo de riesgo bajo; 60 pacientes en grupo de riesgo intermedio y 45 pacientes en grupo de riesgo alto (Imagen 4).
Imagen 4. Resultado del D'Amico inicial.
Con respecto a la suma de Gleason posoperatoria se encontraron dos pacientes con suma de Gleason 2; dos pacientes con suma de Gleason 3; 10 pacientes con suma de Gleason 4; 14 pacientes con suma de Gleason 5; 86 pacientes con suma de Gleason 6; 40 pacientes con suma de Gleason 7; 17 pacientes con suma de Gleason 8; ocho pacientes con suma de Gleason 9 y un paciente con suma de Gleason 10. Siendo el promedio de la suma de Gleason posterior a la prostatectomía radical de seis.
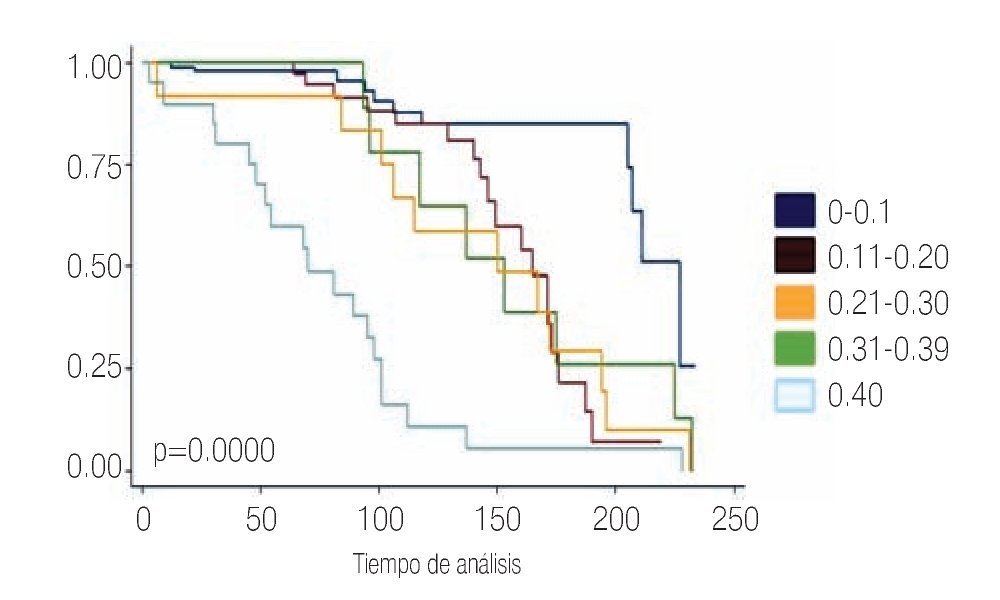
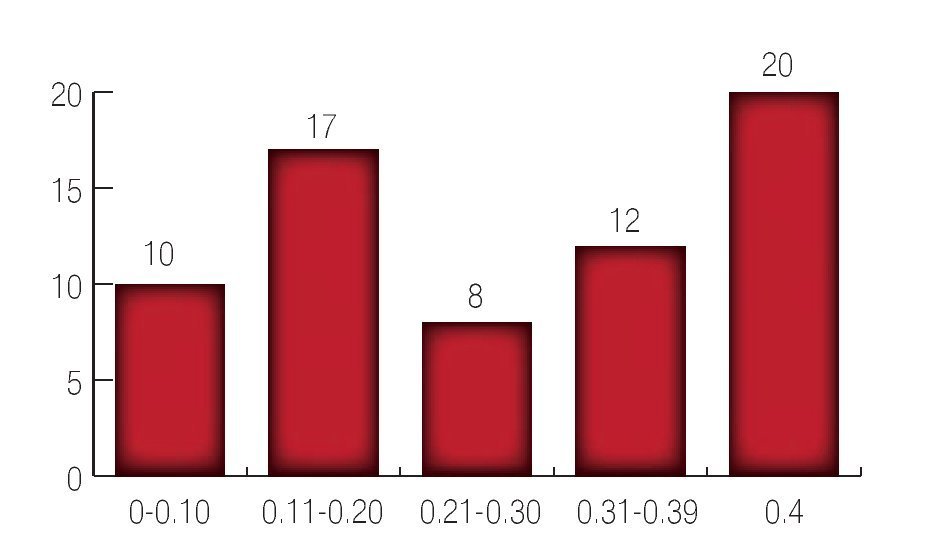
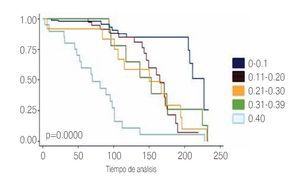
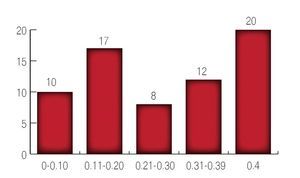
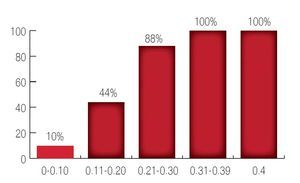
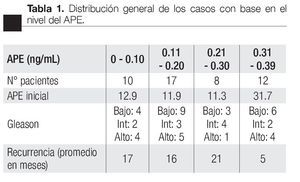
Con respecto al primer APE posoperatorio el cual se tomó dentro de los tres primeros meses posoperatorios se encontró que 101 pacientes tuvieron APE entre 0 a 0.1 ng/mL; 38 pacientes con APE 0.11 a 0.20 ng/mL; nueve pacientes con un APE entre 0.21 a 0.30 ng/mL; 12 pacientes con un APE entre 0.31 a 0.39 ng/mL y 20 pacientes con un APE ≥0.4 ng/mL. Para lo cual se utilizó curvas de Kaplan Meier (Imagen 5).
Imagen 5.Niveles de antígeno prostático a los tres meses del posoperatorio.
En cuanto a la recurrencia, ésta se presentó en 47 de 180 pacientes lo que corresponde a 26%; con un promedio de 12 meses entre la cirugía y la recurrencia; con un periodo libre de recurrencia de 74% a 19 años.
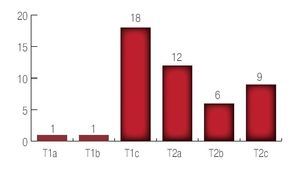
De acuerdo al estadio pre-operatorio la recurrencia se presentó de la siguiente manera: siendo un pacientes para el estadio T1a (1.49%); de un paciente para los T1b (1.49%); 18 pacientes para los T1c (35.8%); 12 pacientes para los T2a (31.3%); seis pacientes para los T2b (14.9%) y nueve pacientes para los T2c (14.9%) (Imagen 6).
Imagen 6. Nivel de recurrencia preoperatoria.
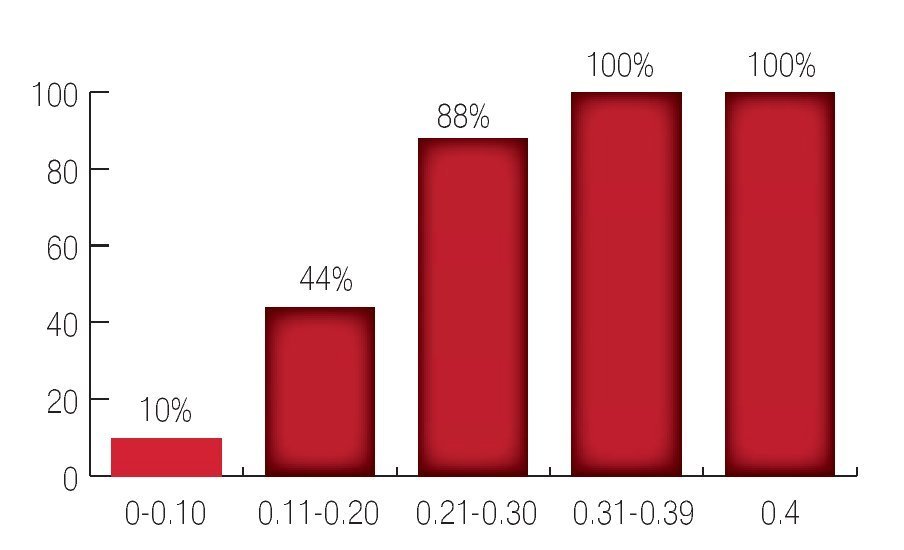
Con respecto al valor del primer APE posoperatorio como mencionamos, de los 101 pacientes con niveles de APE entre 0 a 0.10 ng/mL recurrieron sólo 10 casos, lo que corresponde a 10%; de los 38 pacientes con APE entre 0.11 a 0.20 ng/mL presentaron recurrencia bioquímica 17 pacientes lo que corresponde a 44%; de los nueve pacientes con APE entre 0.21 a 0.30 ng/mL recurrieron ocho pacientes lo que corresponde a 88.8%: de los 12 pacientes con APE entre 0.31 a 0.39 ng/mL se encontró que los 12 pacientes presentaron recurrencia bioquímica lo que equivale a 100%; de los 20 pacientes con niveles de APE de 0.40 ng/mL; se consideraron como recurrencia inmediata o falla al tratamiento. Se utilizaron curvas de Kaplan Meier (Imágenes 7 y 8).
Imagen 7.Recurrencia con base en el primer APE posoperatorio.
Imagen 8. Recurrencia global.
Respecto a los pacientes con APE entre 0 a 0.10 ng/ mL que presentaron recurrencia; un paciente fue T1a; cinco pacientes T1c, dos pacientes T2a; un paciente T2b, un paciente T2c; dos pacientes con Gleason 5; dos pacientes con Gleason 6; dos pacientes con Gleason 7; tres pacientes con Gleason 8; un paciente con Gleason 9. Con un promedio de recurrencia de 17 meses.
Los pacientes con APE entre 0.11 a 0.20 ng/mL se encontraron un paciente con T1b; seis pacientes con T1c; cinco pacientes con T2a, un paciente con T2b, cuatro pacientes con T2c. Respecto al Gleason un paciente con Gleason 4; tres pacientes con Gleason 5; cinco pacientes con Gleason 6; tres pacientes con Gleason 7; cuatro pacientes con Gleason 8 y un paciente con Gleason 9 con una recurrencia promedio de 16 meses.
En los pacientes con Gleason PSA entre 0.21 a 0.30 ng/mL se encontró: cuatro pacientes con T1c; dos pacientes con T2a y dos pacientes con T2c; respecto al Gleason: tres pacientes con Gleason 6; cuatro pacientes con Gleason 7 y un paciente con Gleason 10.
Por último en el grupo de pacientes con APE entre 0.31 a 0.39 ng/mL se encontró: tres pacientes T1c; tres pacientes T2a, cuatro pacientes T2b y dos pacientes T2c; respecto a la suma de Gleason: dos pacientes con Gleason 5; cuatro pacientes con Gleason 6, dos pacientes con Gleason 7; dos pacientes con Gleason 8 y dos pacientes con Gleason 9 (Tabla 1).
¿ DISCUSIÓN
La mayoría de los artículos basan su seguimiento en el APE y es aceptado como punto de corte para recurrencia bioquímica un nivel de 0.40 ng/mL7 y es discutible un APE de 0.2 ng/mL para decir que exista recurrencia bioquímica.7,8 Definiendo recurrencia bioquímica como cualquier nivel de APE detectable después de la pros-tatectomía radical o un aumento del APE posterior a un periodo que estaba indetectable. La vida media del APE es de 3.1 días, y debe disminuir a niveles indetectables después de cuatro semanas. En nuestro estudio encontramos que 26% de los pacientes a pesar de tener un nivel de APE por debajo de 0.40 ng/mL presentaron recurrencia bioquímica durante su seguimiento; analizando los grupos que estudiamos, los que tienen un nivel de APE entre 0 a 0.10 ng/mL, encontramos que 10% de estos pacientes que pueden considerarse curados tienen recurrencia bioquímica dentro de los primeros 17 meses. En el grupo de pacientes que tiene nivel de APE entre 0.31 a 0.39 ng/mL todos presentaron recurrencia bioquímica independientemente del estadio patológico y el grupo de riesgo, por lo que nos surge la siguiente pregunta ¿debemos considerar un nivel de APE posoperatorio de 0.40ng/mL para definir recurrencia bioquímica? ¿O habrá que apoyar a aquellos que toman como punto de corte un nivel de APE de 0.2 ng/mL, para definir recurrencia bioquímica? Asimismo ¿Qué conducta debemos tomar entonces cuando la primera determinación del APE no caiga a los niveles óptimos (0.0 ng/mL)?; ya que el tiempo de recurrencia bioquímica que nosotros encontramos en promedio fue de 12 meses tomando en cuenta todos los puntos de corte del APE que utilizamos en este estudio. Se puede realizar una segunda determinación del APE o iniciar tratamiento adyuvante.
Eisenberg en una serie de 525 pacientes a quienes se le tomaron niveles de APE posoperatorios entre uno y tres meses encontraron un índice libre de de recurrencia bioquímica de 86% en aquellos pacientes que tuvieron nivel de APE indetectable (≤ 0.05 ng/mL) contra 67% entre aquellos pacientes con APE detectable.9-14
Nosotros encontramos que más de 50% de los pacientes recurre cuando el APE no cae por debajo de niveles de 0.2 ng/mL. Lo que más nos llamó la atención fue que en el grupo de pacientes con APE de 0.31 a 0.39 ng/mL; el APE inicial promedio fue de 31 ng/mL por lo que podemos tomar en cuenta al APE como un factor predictivo muy importante de recurrencia bioquímica.
¿ CONCLUSIONES
Las cifras de la primera determinación del APE posterior a la cirugía radical es útil para determinar el riesgo que tienen los pacientes de presentar recurrencia bioquímica de acuerdo al nivel posoperatorio encontrado. Los pacientes que tienen su primera determinación posquirúrgica del APE por arriba de 0.2 ng/mL tienen recurrencia bioquímica temprana. El APE sigue siendo el factor predictivo más importante de falla al tratamiento y se debe considerar como falla bioquímica a aquellos pacientes que tengan un nivel de APE por arriba de 0.2 ng/ mL o sus valores no desciendan por debajo de esta cifra; es importante la primera determinación como pudimos observar en un intento por predecir o identificar a los pacientes en riesgo de presentar recurrencia bioquímica y tal vez valorar el inicio de tratamiento adyuvante temprano. Se requiere ampliar la muestra para corroborar estos hallazgos.
Correspondencia: Dr. Rodrigo Pérez Becerra.
Av. Calzada Tlalpan 4800. Col. Sector XVI CP 14800. Tlalpan. México, D. F.
Teléfono: 40003000, ext: 3044.
Correo electrónico:becerra15@yahoo.com