¿ INTRODUCCIÓN
El carcinoma de células renales (CCR) es la más letal de las neoplasias urológicas. Se presenta como enfermedad metastásica en aproximadamente 20% a 30% de los pacientes, y más de 40% de los casos eventualmente mueren de la enfermedad.1,2
La resección quirúrgica de la enfermedad clínicamente localizada continúa siendo el tratamiento de elección; sin embargo, 20% a 40% recurrirán después de la nefrectomía.2 Esta alta tasa de recurrencia justifica la importancia del seguimiento a largo plazo. Definir las guías de seguimiento para éstos pacientes es importante tanto desde la perspectiva médica como económica, de manera que puedan detectarse tempranamente a los pacientes con enfermedad recurrente tratable, minimizando la utilización de estudios innecesarios sin sacrificar la sobrevida del paciente.
Existen múltiples factores pronósticos estudiados que ayudan a predecir la recurrencia del CCR, e incluyen el estadio tumoral, el grado histológico nuclear (Fuhrman), el estado de actividad del paciente (ECOG PS = Eastern Cooperative Oncology Group performance status) y los marcadores moleculares.3 Sin embargo, el sistema Tumor, Nodes, Metastasis (TNM) ha sido el factor principal pronóstico que se ha utilizado. Utilizando la clasificación TNM de 1997 y la estadificación de la American Joint Comittee on Cancer (AJCC), la sobrevida específica de la enfermedad a cinco años es de 91%, 74%, 67% y 32%, respectivamente para los estadios I al IV.4
El grado tumoral es un factor pronóstico independiente para el CCR; según la clasificación de Fuhrman la tasa de sobrevida a cinco años es de 89%, 65% y 46% para los grados 1, 2 y 3 a 4 respectivamente, independientemente del estadio T.4
En pacientes con enfermedad estadio T1, la sobrevida específica de enfermedad a cinco años se ha reportado en 91%, 83%, 60% y 0% para los grados 1, 2, 3 y 4 respectivamente.4 El mayor riesgo de recurrencia de CCR ocurre dentro de los primeros cinco años de la nefrectomía, siendo la mayoría dentro de los primeros tres años. A pesar de que se han señalado recurrencias hasta 30 años después de la nefrectomía, 43% ocurre durante el primer año.5,6
Los tumores T1 generalmente recurren entre 38 y 45 meses, mientras que los T3 lo hacen entre 17 y 28 meses después de la nefrectomía.7,8 Las medias de recurrencia reportadas son de 7% con un tiempo promedio de 38 meses para los T1, 26% con tiempo promedio de 32 meses para el T2 y 39% con tiempo medio de 17 meses para los T3.7
Las metástasis del CCR se presentan más frecuentemente en los pulmones, y afectan de 3% a 16% de los pacientes después de la nefrectomía.6,7,9-11 Las metástasis óseas ocurren en 2% a 8% de los pacientes después de la nefrectomía.6,7,10,11 La incidencia de metástasis hepáticas va de 1% a 7%, y las cerebrales ocurren en 2% a 4% de los pacientes después de la nefrectomía.6,7,10,11
La mayoría de la enfermedad recurrente se detecta por estudios de laboratorio o imagen en pacientes asintomáticos en 50% a 80% de los casos, el resto se detecta en estudios de extensión en pacientes con síntomas como anorexia, pérdida de peso, fiebre, sudoración nocturna y signos como caquexia, masa abdominal, adenopatías.2
Las herramientas de seguimiento incluyen la historia, el examen físico, laboratorios, pruebas de función hepática (PFH´s), Rx de tórax y tomografía computarizada (TC).
Montie12 propuso uno de los primeros protocolos de seguimiento para el CCR, que incluye historia, examen físico y laboratorios cada seis meses por cinco años iniciando un mes después de la nefrectomía. Una radiografía de tórax cada seis meses iniciando a los seis meses y una TC abdominal a los 12, 24 y 48 meses después de la nefrectomía. Sin embargo, con el advenimiento de la cirugía conservadora de nefronas se ha llevado un seguimiento con TC abdominal más frecuente, a cada seis meses por cinco años.13
Se han realizado protocolos de seguimiento basados en el estadio TNM, y si bien no hay un consenso, las recomendaciones son: para el T1 historia clínica, examen físico anual durante cinco años, Rx de tórax cada seis meses por tres años y luego anual hasta los cinco años; la mayoría acuerdan en no hacer TC abdominal.6,7,10,14
Las recomendaciones para T2 incluye historia, examen físico, laboratorios y Rx de tórax cada seis meses por tres años y luego anual hasta los cinco años y TC abdominal a los dos y cuatro años.14
Las recomendaciones para T3 y T4 incrementan la frecuencia de la TC abdominal a uno, tres y cinco años.14 Luego de la nefrectomía parcial se recomienda TC abdominal cada seis meses por tres años y luego anual hasta el quinto año.14
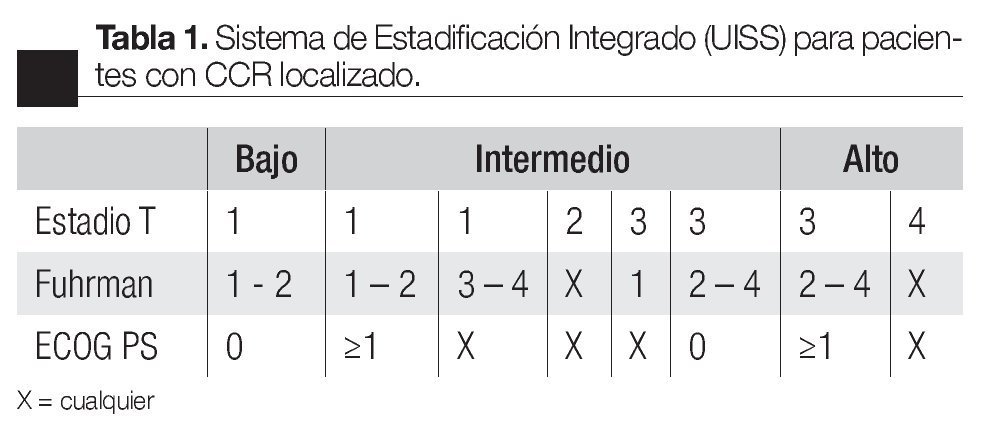
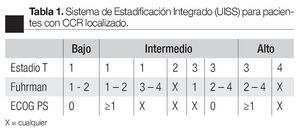
La Universidad de California desarrolló el Sistema Universitario de Estadificación Integrado (por sus siglas en inglés UISS = University Integrated Staging System) basado en una estratificación de grupos de riesgo que combina el TNM, el ECOG PS y el grado nuclear (Fuhrman), validándolo con 4202 pacientes de ocho instituciones.15,16 Categoriza a los pacientes en tres grupos de riesgo bajo, intermedio y alto (Tabla 1).
Para el CCR localizado la sobrevida a cinco años estimada en este estudio fue de 92%, 67% y 44% para el grupo de bajo, intermedio y alto riesgo, respectivamente. Para el CCR metastásico, la sobrevida proyectada a tres años en este estudio fue de 37%, 23% y 12% para el grupo de bajo, intermedio y alto riesgo, respectivamente.13
Basado en la estratificación del UISS, la historia natural del CCR y los tratamientos actuales, se realizaron las siguientes recomendaciones de seguimiento: para los pacientes de bajo riesgo: historia, examen físico, laboratorios y Rx de tórax anual por cinco años y TC abdominal al segundo y cuarto año sin necesidad de seguimiento adicional después del quinto año. Para los pacientes de riesgo intermedio: historia, examen físico, laboratorios y Rx de tórax cada seis meses los primeros tres años, luego anual hasta los 10 años y TC abdominal al año y luego cada dos años hasta los 10 años de seguimiento. Para los pacientes de alto riesgo las recomendaciones son iguales que para el intermedio excepto la TC abdominal que se recomienda realizar cada seis meses los primeros dos años, luego anual hasta el quinto año y posteriormente cada dos años hasta el décimo año de seguimiento.8,17
No se recomienda seguimiento adicional a los pacientes con nefrectomía parcial excepto en los pacientes con CCR familiar como los portadores del síndrome von Hippel-Lindau que tienen una recurrencia ipsilateral de 80% en los primeros 10 años.18
¿ MÉTODOS
Se realizó un estudio de una cohorte histórica descriptiva. Se incluyó a los casos con expediente completo, operados de adenocarcinoma renal en el Hospital General Dr. Manuel Gea González de enero de 1998 a diciembre de 2009. Se excluyó a los pacientes con metástasis en su presentación.
Se consideraron las siguientes variables: sexo, edad, T (tumor), N (ganglios), M (metástasis), informe histopatológico con Fuhrman, ECOG PS, seguimiento en meses a la fecha, fecha de recurrencia y/o muerte, sitio de recurrencia y método de diagnóstico utilizado para la misma.
Se llevó a cabo análisis con estadística descriptiva, medidas de tendencia central y dispersión. Para el análisis estadístico de tiempo libre de recurrencia se utilizaron curvas de Kaplan-Meier, considerando significativo p <0 05 p
Los cálculos estadísticos se realizaron utilizando el paquete de software para Windows Stata/SE Ver 9.1, StataCorp LP. El comité de investigación y ética de nuestra institución aprobó la realización de este estudio.
¿ RESULTADOS
Se revisaron los expedientes de 99 pacientes operados de adenocarcinoma renal en las fechas señaladas, de los que se excluyó a 10 pacientes con metástasis en su presentación, éstos últimos en estadio IV y grupo de riesgo alto.
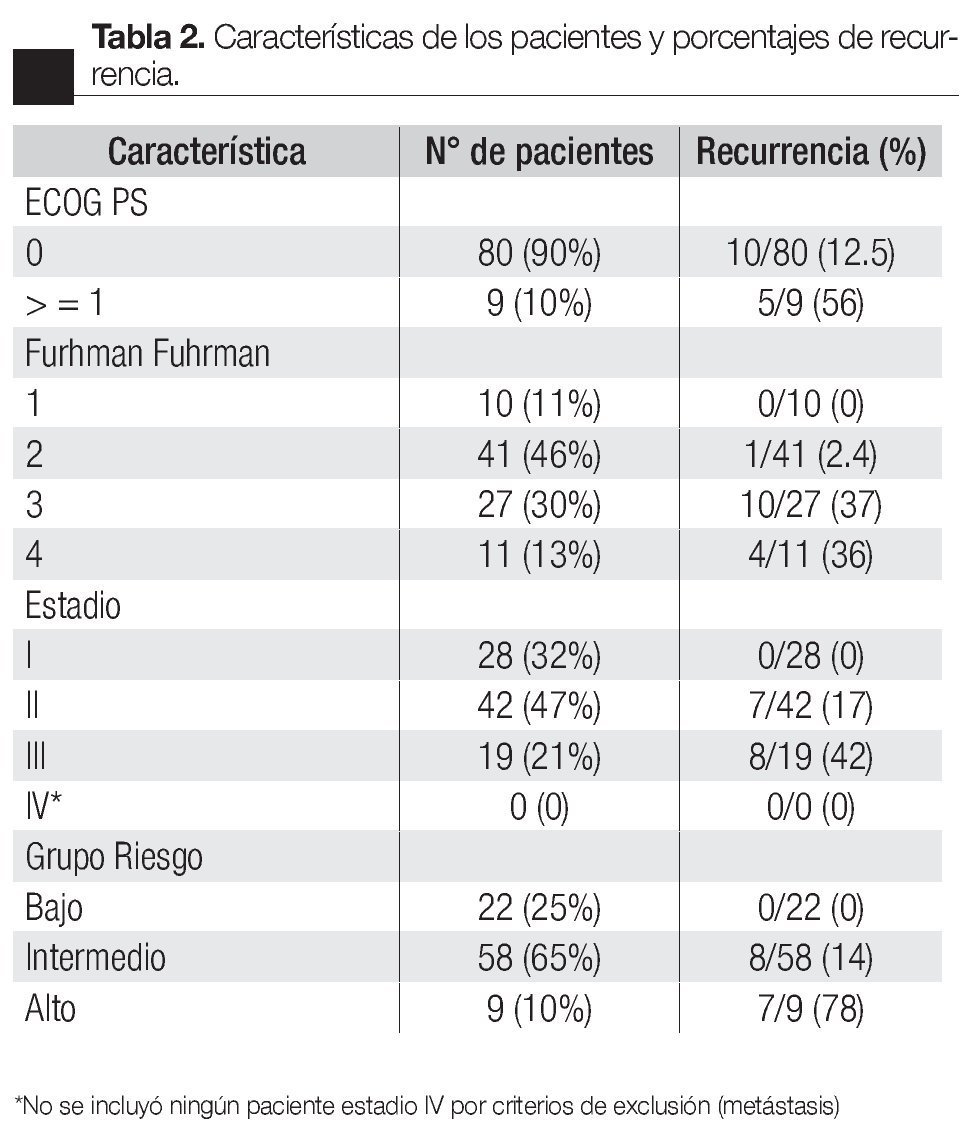
De los 89 casos incluidos en el estudio, hubo 58 hombres (64%) y 32 mujeres (36%); el tiempo de seguimiento promedio fue de 51 meses (seis a 156), período durante el cual recurrieron 15 pacientes, con un porcentaje de 16.8%.
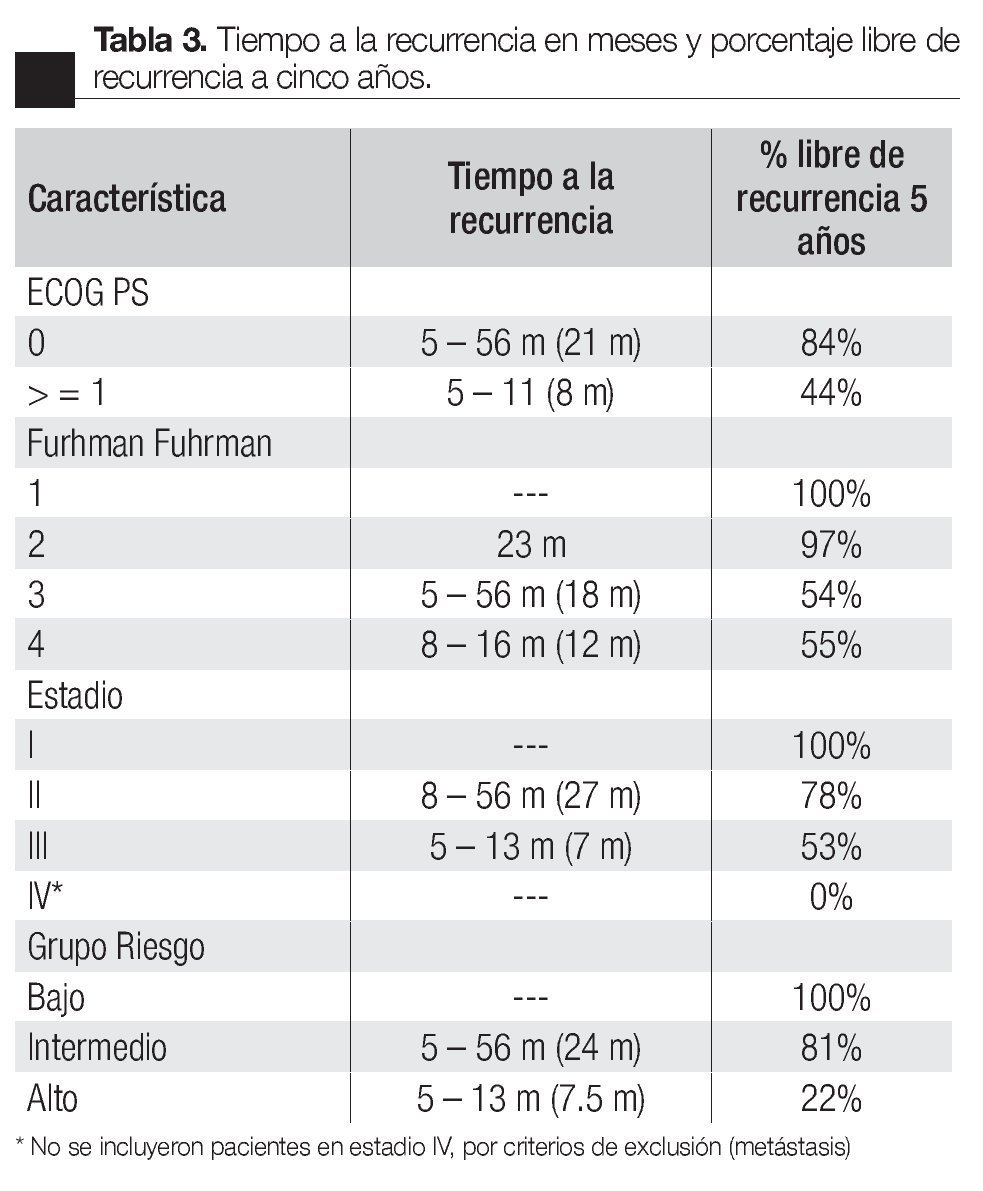
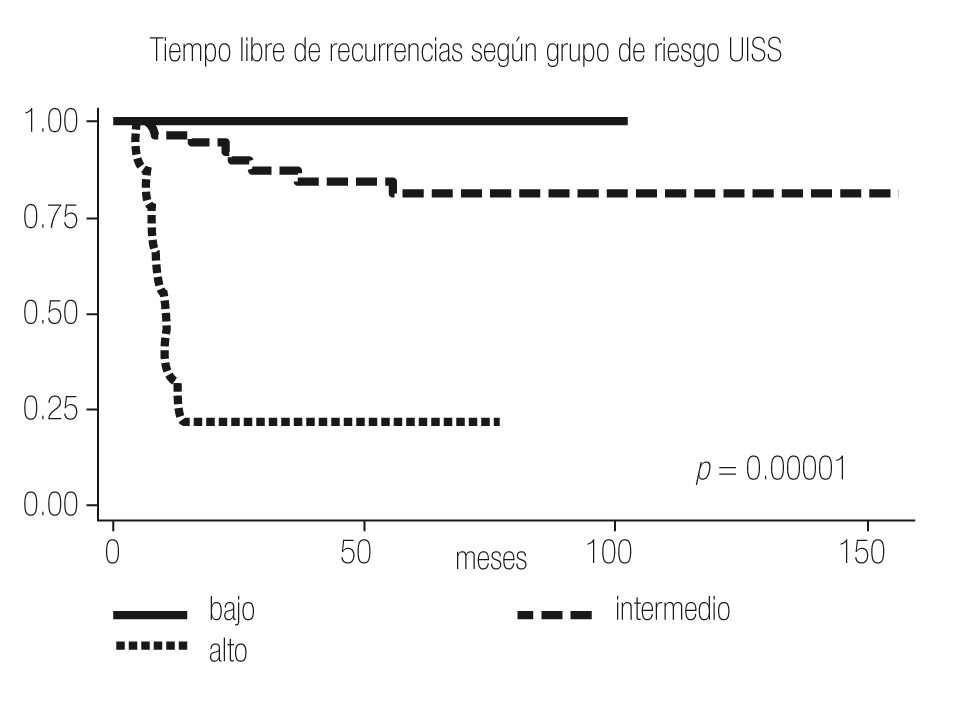
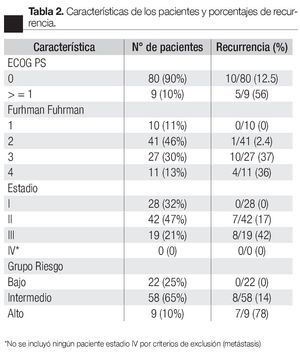
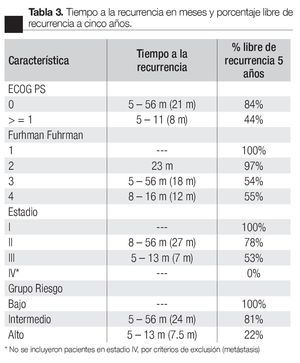
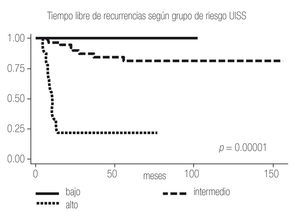
Se estratificaron a todos los pacientes según ECOG PS, Fuhrman, Estadio y Grupo de riesgo (Tabla 2); clasificando de bajo riesgo a 22 pacientes (25%), intermedio a 58 (65%) y alto a nueve (10%), con porcentajes de recurrencia de 0%, 14% y 78% respectivamente. Se calculó también el tiempo a la recurrencia según ECOG PS, Fuhrman, Estadio y Grupo de riesgo (Tabla 3), obteniendo un promedio de tiempo de recurrencia de 24 meses para el grupo de riesgo intermedio y de 7.5 meses para el alto; los porcentajes libres de recurrencia a cinco años fueron de 100%, 81% y 22% para los grupos bajo, intermedio y alto respectivamente (Imagen 1).
Imagen 1.Análisis de Kaplan-Meier sobre el tiempo libre de recurrencia en meses según los grupos de riesgo UISS.
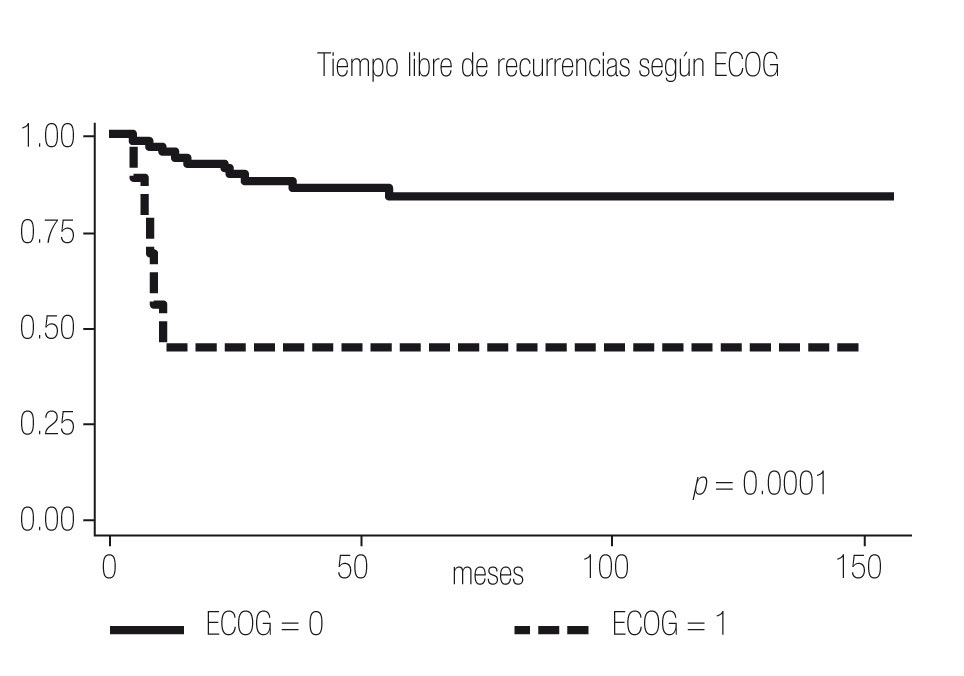
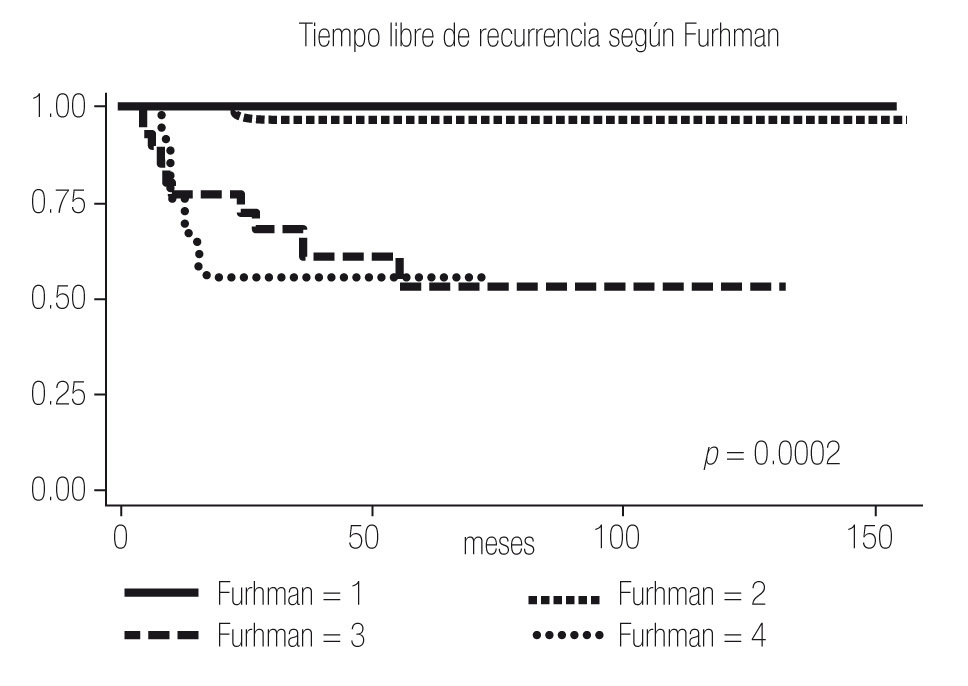
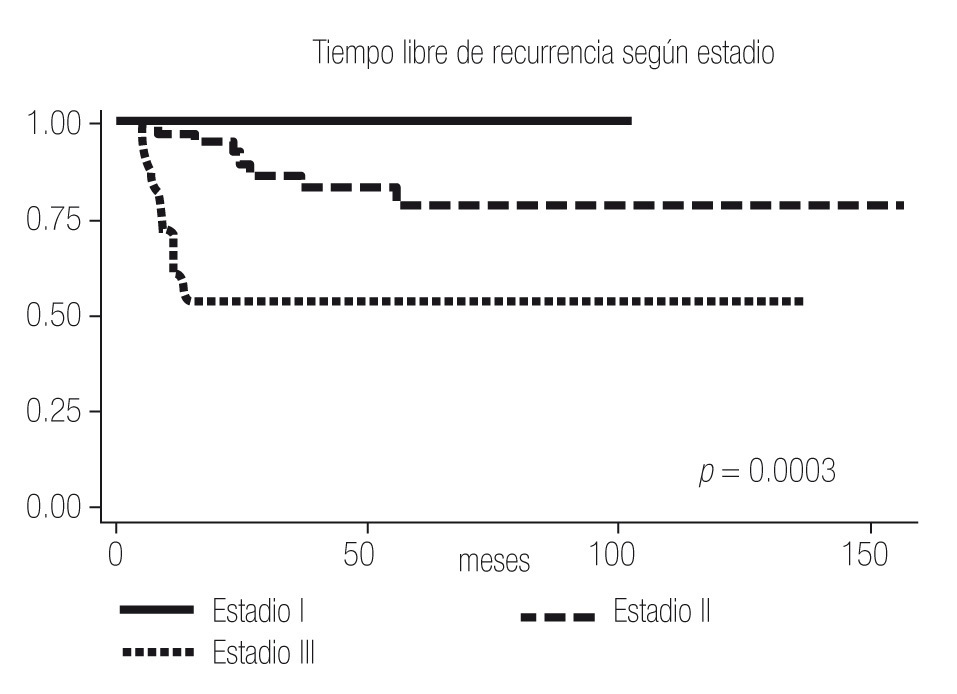
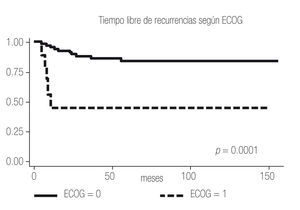
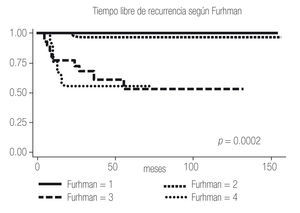
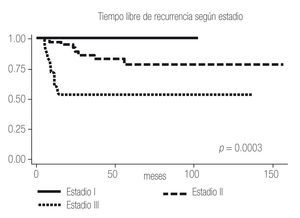
El tiempo libre de recurrencia demostró ser diferente entre los pacientes con ECOG PS 0 y ≥1, entre los pacientes con Fuhrman 1 - 2 y 3 - 4, y entre los pacientes con Estadios I, II y III (Imagen 2 a 4); todos los pacientes con Estadio IV debutaron como metastásicos por lo que fueron excluidos del estudio.
Imagen 2. Análisis de Kaplan-Meier sobre el tiempo libre de recurrencia en meses según ECOG PS.
Imagen 3. Análisis de Kaplan-Meier sobre el tiempo libre de recurrencia en meses según Furhman.
Imagen 4.Análisis de Kaplan-Meier sobre el tiempo libre de recurrencia en meses según estadio.
El sitio de recurrencia más frecuente fue el pulmón en 80% de los casos, seguido de la recurrencia local, hígado y hueso (Tabla 4), todos diagnosticados según estudios de imagen durante el tiempo de seguimiento, sólo uno de los pacientes presentó síntomas (dolor óseo) que indicó el estudio diagnóstico.
¿ DISCUSIÓN
A diferencia de la bibliografía internacional, sólo 10% de nuestros pacientes debutaron con enfermedad metastásica y la tasa de recurrencia fue ligeramente menor que la informada (16.8% vs. 20% a 40%),2 probablemente por el número pequeño de nuestra muestra en comparación a los grandes estudios de seguimiento reportados.1,2,15,16
Al igual que en la bibliografía, evidenciamos en nuestro estudio que tanto el ECOG PS, como el Fuhrman y el Estadio son factores que confieren pronóstico independiente a los pacientes, y se observa una diferencia estadísticamente significativa entre el ECOG PS 0 y 1, el Fuhrman 1-2 y el 3-4 y entre los Estadios I, II, III y IV (Imagen 1 a 4); por lo que el UISS parece conferir un pronóstico más certero que únicamente el Estadio al tomar en cuenta todos los factores de riesgo.
Luego de haber validado el sistema UISS, Lam y colaboradores17 realizaron el primer estudio aplicando éste con 365 pacientes de los que 93 (25%), 207 (56%) y 65 (19%) fueron clasificados como bajo, intermedio y alto riesgo respectivamente, obteniendo una tasa libre de recurrencia a cinco años de 90.4%, 61.8% y 41.9%, respectivamente. El tiempo promedio a la recurrencia fue de 28.9%, 17.8% y 9.5% meses, respectivamente para este estudio.17 Comparando los resultados con nuestro estudio vemos que también la mayor parte de nuestros pacientes (65%) pertenecen al grupo de riesgo intermedio y el número de pacientes de riesgo bajo fue de 25% al igual que el estudio de Lam, lo que nos indica que estamos diagnosticando tempranamente a la mayoría de nuestros pacientes, hecho positivo en términos de sobrevida. Llama la atención que ninguno de nuestros pacientes de bajo riesgo recurrió, probablemente por falta de seguimiento a más largo plazo en algunos de ellos, así como el menor número de pacientes incluidos en nuestro estudio. También observamos un peor pronóstico en nuestros pacientes de alto riesgo con una tasa libre de recurrencia a cinco años de 22% vs. 40% del estudio de Lam, probablemente por lo avanzado de la enfermedad a su momento de presentación así como a la falta de tratamiento coadyuvante en la mayoría de nuestros pacientes con enfermedad avanzada.
En general consideramos que el sistema UISS demostró ser útil en nuestros pacientes y podemos utilizarlo para optimizar su seguimiento, aunque se necesitan más estudios con mayor número de pacientes de diferentes instituciones para poder validarlo en la población mexicana.
¿ CONCLUSIONES
Existe diferencia en el pronóstico de nuestros pacientes con adenocarcinoma renal según la estratificación de grupos de riesgo del Sistema Universitario de Estadificación Integrado (UISS).
Existen factores pronósticos independientes como el Fuhrman y el ECOG PS, además del estadio, por lo que deben ser tomados en cuenta para el seguimiento.
Deberán hacerse más estudios con mayor número de pacientes de diferentes instituciones para validarlo en la población mexicana.
Correspondencia: Alejandro Urdiales Ortiz.
Calzada de Tlalpan 4800. Col Sección XVI,
Delegación Tlalpan. Distrito Federal. 14080.
Teléfono: 4000 3044.
Correo electrónico: aleurdiales@hotmail.com