¿ INTRODUCCIÓN
En el último año, 186 320 hombres en Estados Unidos y 345 900 hombres en Europa fueron diagnosticados con cáncer de próstata (CaP) y alrededor de 28 600 en Es tados unidos y 87 400 en Europa, murieron por esta condición.1 En México, el CaP ocupa el primer lugar de causa de muerte por neoplasias, superando al cáncer de tráquea, bronquios y pulmón.2
El antígeno prostático específico (APE) ha sido la herramienta más valiosa en la detección, estadificación y vigilancia de esta enfermedad. Aunque el uso rutinario del APE ha aumentado sin duda la detección de cáncer, uno de sus principales inconvenientes es la falta de especificidad, lo que se traduce en una tasa muy alta de biopsias prostáticas negativas, ya que una elevación del APE, no es un evento exclusivo del CaP, esto es especialmente cierto en pacientes con APE sérico entre 3 ng/mL a 10 ng/mL cuya tasa de biopsia negativa es de aproximadamente 60% a 75%.3 Sabemos que la especificidad del APE y el tacto rectal (TR) va de 24% a 37%.3 Sin embargo, continua existiendo un importante debate sobre los niveles óptimos del APE para la detección del CaP; con este propósito, se llevan a cabo mediciones alternas como el porcentaje de la fracción libre del APE, rangos del APE para la edad, la velocidad de duplicación del APE, pero estas se ven limitadas por sus similitudes con el propio APE. Aunque la biopsia de próstata se considera el estándar de oro para el diagnóstico de CaP, son necesarias pruebas más precisas que puedan estratificar a los pacientes según su riesgo de desarrollar CaP e identificar aquellos que requieren repetir la biopsia de próstata. La recomendación si persiste la sospecha de CaP es una biopsia de repetición,4,5 sin olvidar que, hasta 80% de éstas resultarán nuevamente negativas; el costo financiero y las complicaciones aso ciadas a las biopsias deben considerarse.6
El implemento de marcadores para CaP en fluidos corporales es necesario para mejorar la especificidad en el diagnóstico; uno de los bio-marcadores más analizados, por su potencial utilidad clínica, como una he rramienta para predecir el resultado de la biopsia es el PCA3.
Bussemaker en 1999, fue el primero en describir el gen del cáncer de próstata 3, llamado inicialmente DD3 y actualmente PCA3, el cual es uno de los genes más específicos para el cáncer de próstata. Su transcripción es un mRNA no codificante localizado en el cromosoma 9 (9q21.22) que es sobre expresado de 60 a 100 veces más en el CaP comparado con el tejido prostático benigno.7 9 En 2003, Hessels reportó que el PCA3 es sobre expresado en 95% de las células examinadas y demostró la potencial utilidad clínica de la prueba para PCA3 en orina generando un score con un punto de corte de 35.10 En la actualidad, existen varias pruebas en orina para PCA3 realizadas con diferentes metodologías, como fluorescencia resuelta en el tiempo (TRF), reacción en cadena en tiempo real cuantitativa de la polimerasa (RTPCR) y amplificación del RNA mediada por transcripción; esta última, con un primer valor de corte fijado en 50 mostró una sensibilidad de 69% y especificidad de 79%. La versión TRF arrojó una sensibilidad de 65% a 67%, especificidad de 66% a 83% y un valor predictivo negativo de 80% a 90%. La prueba uPM3 con un punto de corte de 0.5 mostró una sensibilidad de 66% a 82%, especificidad de 76% a 89%. Hasta el momento la prueba de PCA3 en orina no está considerada, por si sola, como escrutinio para CaP, su utilidad ha sido investigada en relación con el APE en la mayoría de los estudios realizados. Este gen muestra una especificidad superior al APE a diferentes cortes e incrementa la probabilidad de una biopsia de positiva, especialmente en la zona gris del APE.11 17
¿ OBJETIVO
Establecer la utilidad clínica mediante la medición de la especificidad de la determinación del PCA3 en orina para el diagnóstico de CaP en la biopsia de pacientes mexicanos en el Hospital General Dr. Manuel Gea González.
¿ MÉTODOS
Es un estudio prospectivo, experimental, longitudinal, de cohorte, realizado entre abril de 2008 y septiembre de 2010. Se incluyeron a 157 pacientes con un APE sérico elevado (mayor a 4 ng/mL) o tacto rectal anormal programados a biopsia prostática trans rectal guiada por ultrasonido (BxTRUS), sin importar primera serie o de repetición, siendo estos los criterios de inclusión. La aprobación fue obtenida por el Comité Institucional de Ética y por escrito el consentimiento informado de participación de cada paciente. Los pacientes con alguna manipulación transuretral reciente, retención aguda de orina, radioterapia, terapia hormonal, portadores de catéter transuretral permanente o infección urinaria aguda antes de la biopsia fueron excluidos del estudio.
Se recolectaron 20 mL a 30 mL de la primera orina posterior a masaje prostático, previo a la realización de la BxTRUS. Las BxTRUS fueron realizadas por urólo gos con un equipo de ultrasonido ALOKA Pro Sound SSD 400 plus tomando 12 cilindros en cada paciente y analizadas por el servicio de patología de la institución. Las muestras se depositaron en tubos que contenían 20 mL de una solución estabilizadora de ácidos nuclei cos y enviadas al INMEGEN en donde fueron procesa das y analizadas. Los tubos se centrifugaron a 3000 rpm, desechando el sobrenadante, el botón celular se lavó dos veces con solución amortiguadora de fosfa tos (PBS). Una vez obtenido el botón celular se inició la extracción de RNA total por medio del RNeasy Mini Kit (Qiagen). . La cuantificación de RNA obtenidos se llevó a cabo empleando el equipo espectrofotométrico NanoDrop ND 1000 Spectrophotometer (Thermo Fisher Scientific Inc). Se realizó la transcripción reversa (RT) para la obtención de cDNA. Se emplearon 6 μL del producto de la RT para realizar una reacción de pre-amplificación, con la finalidad de obtener un mayor número de copias de cDNA, lo que permite una mejor detección durante el análisis de expresión relativa. Se utilizaron 5 μL de cDNA pre amplificado para medir la expresión por PCR en tiempo real del gen PCA3 utilizando el equipo ABI 7900 y sondas Taqman (Applied Biosystems Con los datos de Ct obtenidos como resultados se procedió a hacer el análisis y la construcción de las Curvas ROC para establecer las condiciones de especificidad y sensibilidad de la prueba. La habilidad del puntaje de PCA3 para predecir el resultado de la biopsia fue evaluada y comparada con el APEt sérico, APE en zona gris.
¿ RESULTADOS
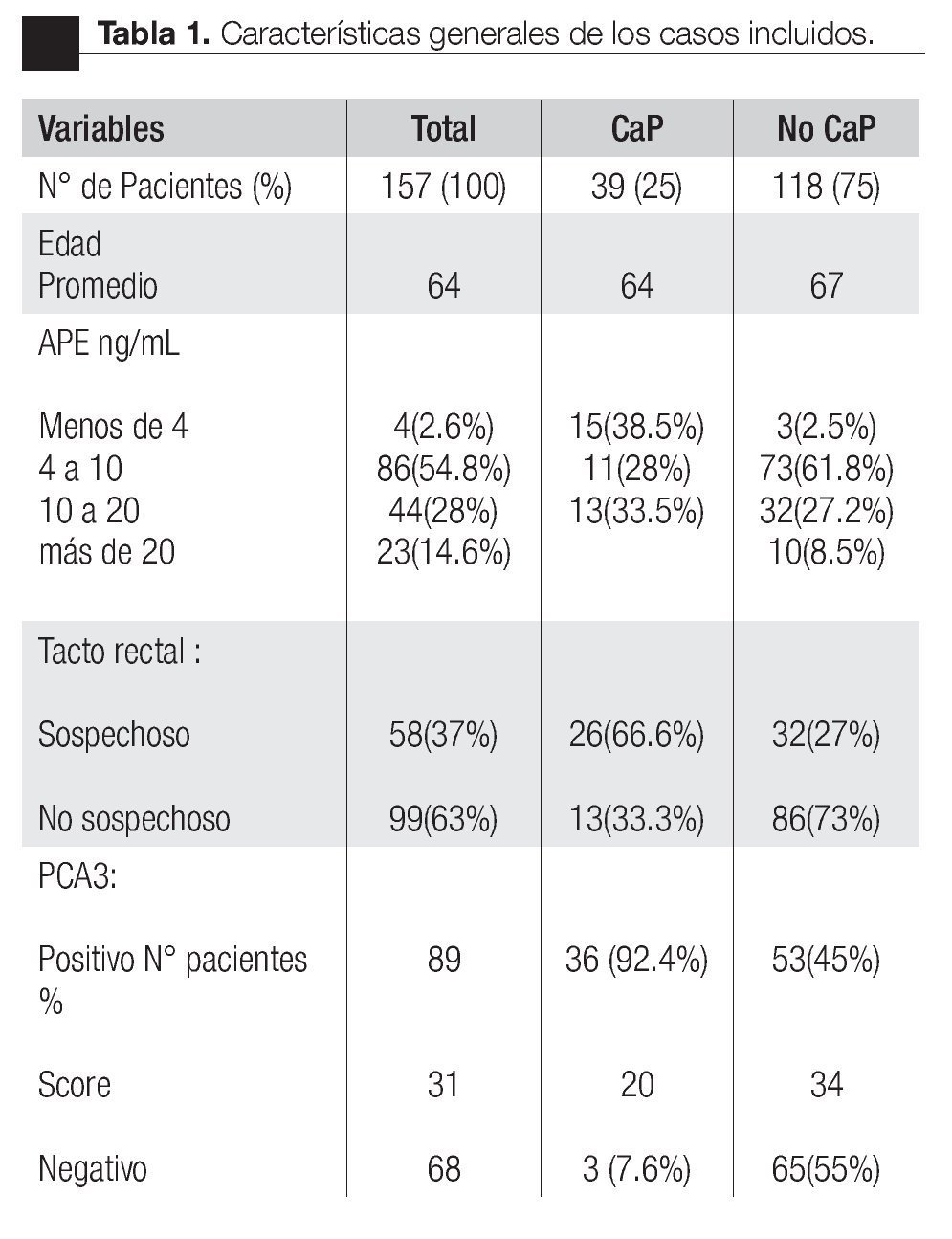
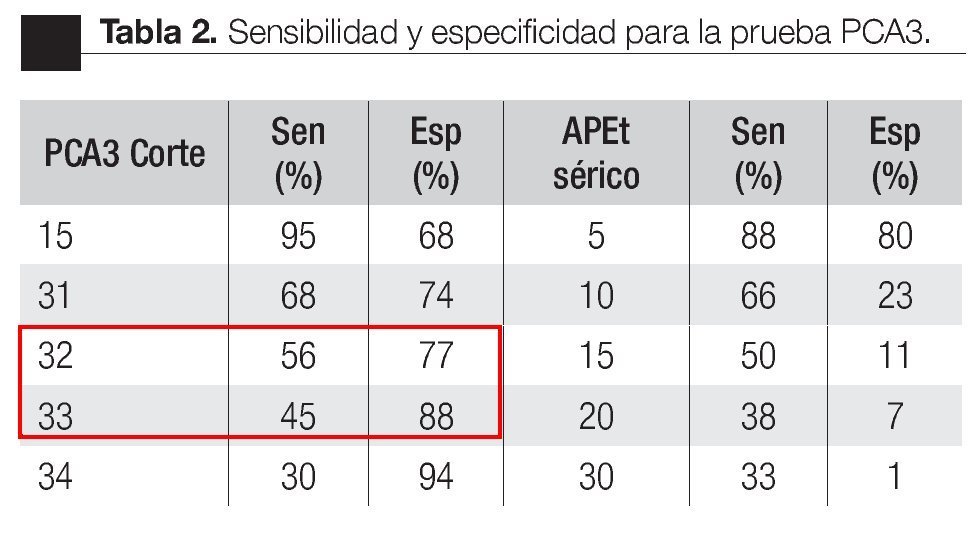
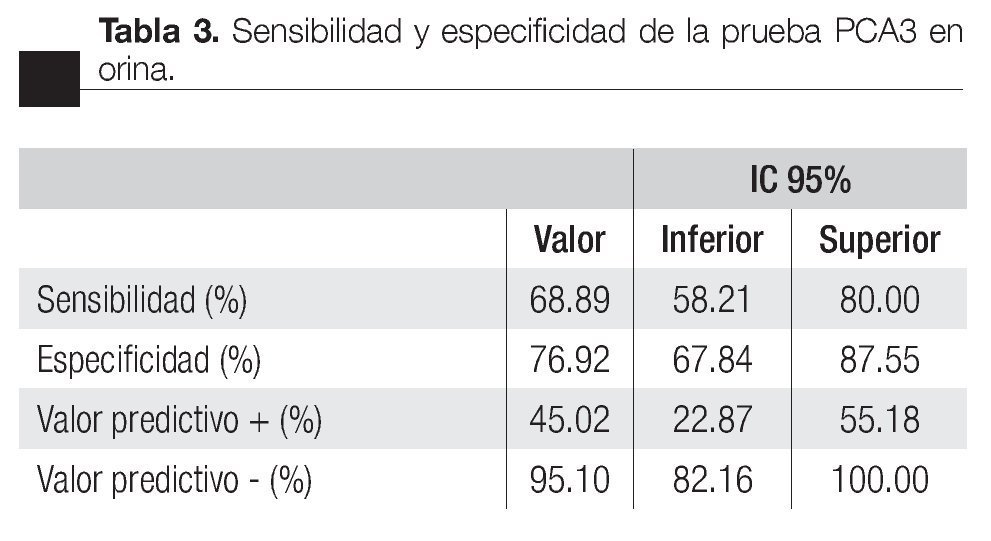
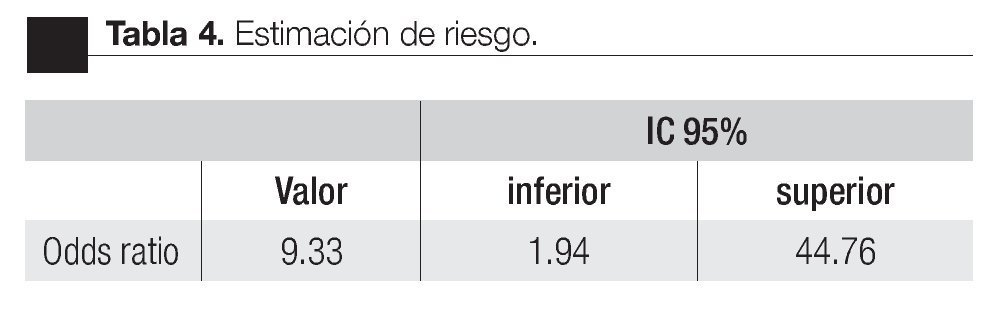
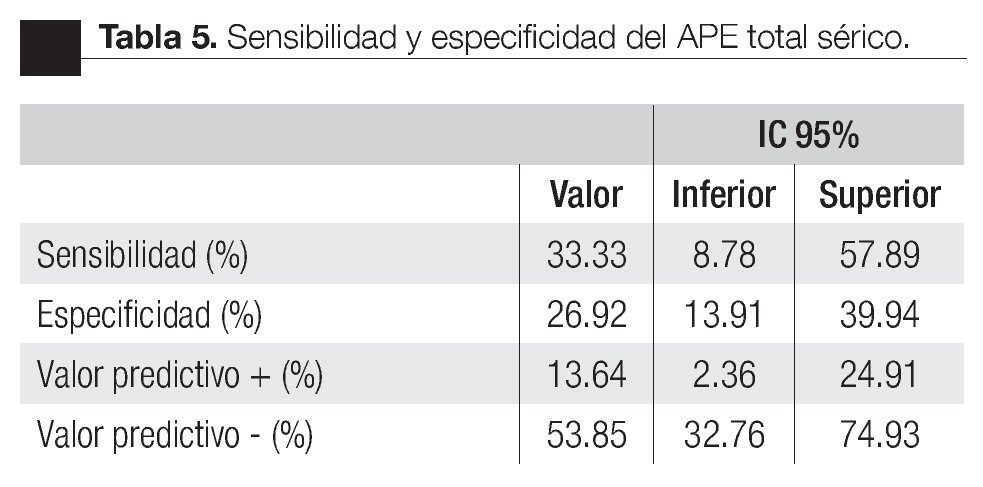
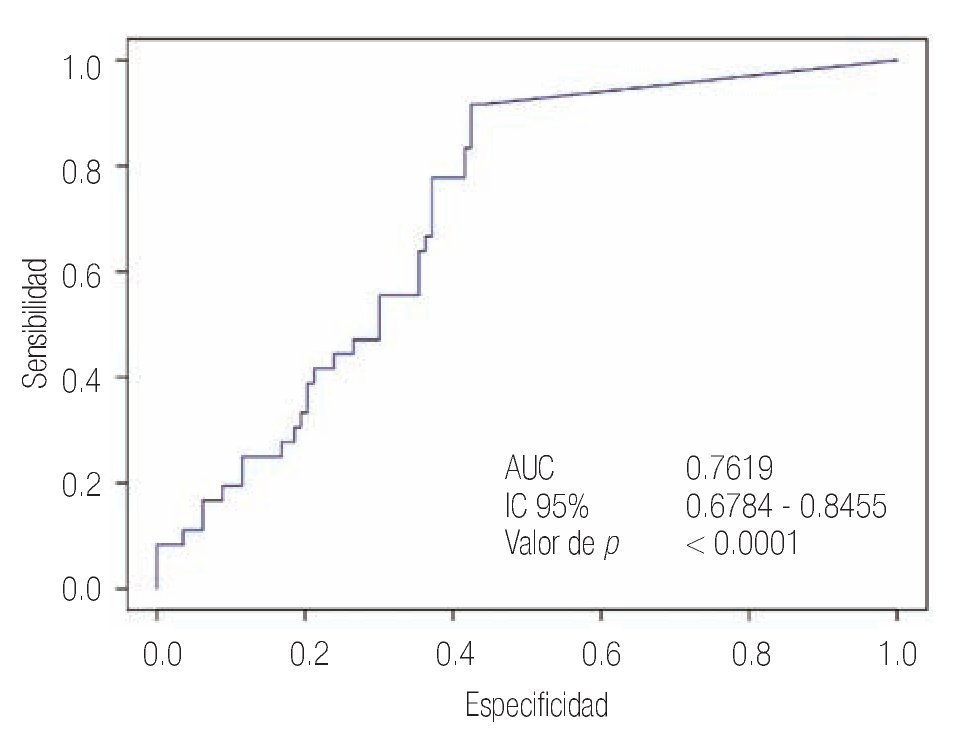
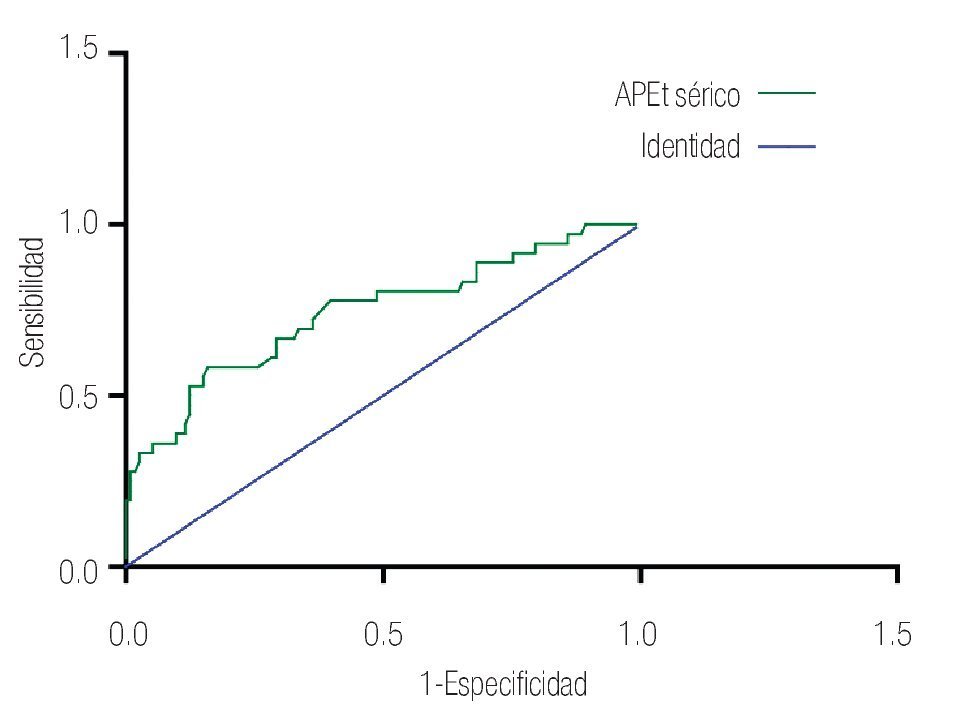
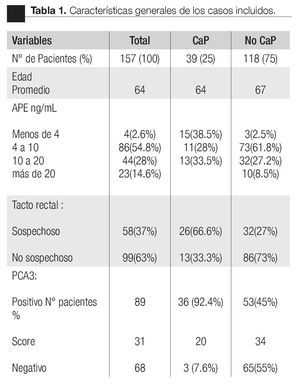
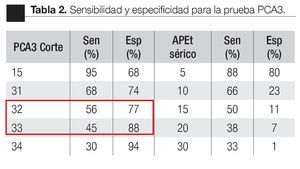
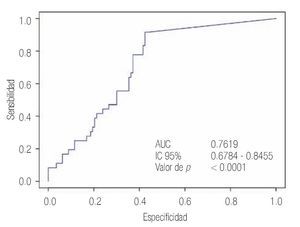
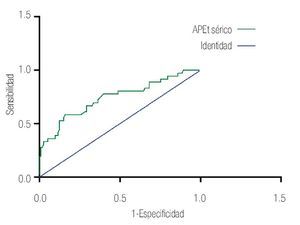
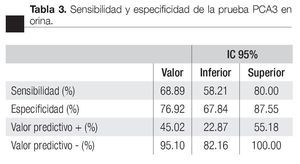
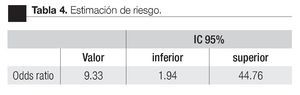
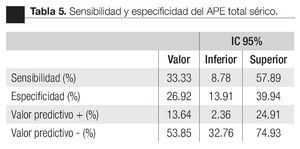
Las características de los pacientes se muestran en la Tabla 1. De los 157 pacientes sometidos a biopsias, el promedio de edad fue de 64 años, los rangos del APE fueron de 0.8 ng/mL a 1160 ng/mL (promedio: 30.9 ng/mL). Noventa y nueve pacientes (67%) tuvieron un tacto rectal no sospechoso, ocho pacientes tenían el antecedente de una biopsia previa, tres con dos series de biopsias previas negativas. La media del score para PCA3 fue 31 (7 a 39). El diagnóstico de CaP se realizó en 39 pacientes (25%), la distribución por el grado de Gleason se muestra en la Tabla 2. La suma de Glea son en la biopsia no se correlacionó con el score de PCA3. En los 118 pacientes (75%) negativos a cáncer, el diagnóstico histopatológico más común fue el de atrofia simple y parcial, seguido por inflamación crónica. El punto de corte en el análisis para evaluar la precisión en predecir el diagnóstico de CaP con la prueba PCA3 en orina fue 31, identificado como el corte o score estadísticamente más significativo comparado con el resultado de la biopsia como método de referencia (estándar de oro) (Imagen 1). La curva ROC mostró un área bajo la curva (ABC) para PCA3 de 0.76. (IC 95% 0.67 a 0.85) con una p = 0.0001 (Imagen 1). El ABC del APE total sérico fue de 0.69 (IC 95% 0.52 a 0.86) indicando una menor precisión para el diagnóstico de CaP en esta población. La sensibilidad y especifici dad para PCA3 en la curva ROC fue medida a diferentes puntos de corte; considerando el score de 31, la prueba mostró una sensibilidad de 68% y especificidad de 76% con un valor predictivo positivo (VPP) de 45%, y valor predictivo negativo (VPN) de 95%, con Odds ratio de 9.3 (Imagen 2 y Tablas 2 a 4). El APE mostró sensibilidad de 33%, especificidad de 26%, valor predictivo positivo de 13% y valor predictivo negativo de 53% (Tabla 5). De los 39 pacientes con biopsias positivas, 15 (38%) se encontraron con APE en zona gris. El promedio de edad fue de 64 años (rango 51 a 81), el APE promedio fue 7 ng/mL (rango 4.08 ng/mL a 9.8 ng/mL), la %flAPE promedio fue 13% (rango 7% a 28%). En los 39 pacientes el PCA3 amplificó y con un punto de corte de 26 mostró sensibilidad de 88% y especificidad de 74% con una ABC 0.76 (IC 95% 0.67 0.84; p = 0.0001).
Imagen 1.Curva ROC que muestra el ABC del PCA3.
Imagen 2.Antígeno prostático total sérico y su tendencia en su especificidad y sensibilidad.
¿ DISCUSIÓN
Existen varios trabajos publicados con metodologías diferentes para la obtención de la amplificación del mRNA PCA3, así como puntajes diferentes para éste, pero con una especificidad y sensibilidad similares. La metodología empleada para la prueba en este estudio y la cantidad de pacientes ya analizados muestran gran se mejanza con diversas investigaciones realizadas. En los pacientes con una biopsia positiva, el análisis de la curva ROC para PCA3 como indicador diagnóstico usando la biopsia como método de referencia, mostró una AUC de 0.76 (IC 0.67 - 0.84).
Chun y colaboradores en su análisis univariado y multivariado determinó al PCA3 como factor predictor independiente para riesgo de CaP con significancia esta dística (p <0 001 17 El análisis y la precisión diagnóstica del PCa3 es independiente del nivel de APE sérico y sin importar si el paciente se somete a una primera biopsia o una de repetición, existen controversias sobre las puntaciones de PCA3 y la correlación con el volumen prostático y la puntuación de Gleason en la biopsia, en nuestro estudio el score de PCA3 no se correlaciona con el Gleason en la biopsia. Otros análisis realizados con score de PCA3 y los resultados histopatológicos en la prostatectomía radical han abierto la posibilidad para determinar que pacientes podrían ser candidatos a vigilancia activa, esto podría ser útil en pacientes que persisten con APE elevados, ya con una serie de biopsia negativa y un score de PCA3 negativo o que sugiera canceres clínicamente insignificantes, por lo que en nuestra serie el seguimiento de pacientes con biopsia previa negativa y PCA3 positivo o negativo se está llevando a cabo.
Por el momento, la medición de PCA3 en orina es la primer prueba molecular en fluidos corporales que se está empleando como una herramienta valiosa para predecir el resultado de la biopsia, especialmente en hombres con elevación crónica del APE debido a inflamación crónica o prostatitis. El PCA3 puede ayudar a estratificar a los pacientes según su riesgo de desarrollar cáncer de próstata.
¿ CONCLUSIONES
Es indispensable un mayor número de pacientes para validar absolutamente esta prueba y con un seguimiento a largo tiempo en aquellos pacientes que amplificaron para PCA3 con biopsias negativas. Hasta este momento los resultados para la prueba PCA3 demuestran ser una prueba viable y que pueda ser considerada como apoyo en la detección de CaP en pacientes mexicanos.
Correspondencia: Dr. Dorian V. Saavedra Briones.
Calzada de Tlalpan 4800. Col. Sección XVI. Delegación Tlalpan. C. P. 14000, México. D. F.
Teléfono: 40003044.
Correo electrónico: valfre2000@yahoo.com.mx.