¿ INTRODUCCIÓN
El cáncer de células renales (CCR) representa de 3% a 4% de las neoplasias con 54 390 casos nuevos por año aproximadamente y con más de 13 000 muertes esperadas en el último año; el adenocarcinoma representa 90% de estas neoplasias. De los casos, 50% cursan asintomáticos y el diagnóstico es incidental; el resto de los pacientes pueden presentarse con hematuria macroscópica, dolor lumbar o una masa abdominal palpable.1
Al momento del diagnóstico, hasta 30% pueden tener enfermedad metastásica, 25% se presentan con una enfermedad localmente avanzada y 45% con enfermedad órgano-confinada.2 El creciente avance de los métodos de diagnóstico no invasivos, ha traído consigo un incremento en las tasas de detección del cáncer renal en estadio localizado y aunque actualmente se detectan más tumores en estadios tempranos, la mortalidad del CCR sigue siendo elevada (alrededor de 20% a 25%). La determinación precisa de los factores pronósticos es un paso esencial en la evaluación inicial de los pacientes con adenocarcinoma renal, no solamente para iniciar un tratamiento adyuvante, sino también para predecir la evolución de la enfermedad.
Como en la mayoría de los cánceres, la estadificación es uno de los principales factores pronósticos señalados en la bibliografía; la del CCR describe la extensión anatómica de la enfermedad, lo cual es determinante para el pronóstico y el seguimiento de los pacientes.
Es bien conocida la biología potencialmente agresiva del CCR, considerado el tumor urológico más letal, lo que obliga a conocer y proporcionar información más precisa acerca del pronóstico y la supervivencia, así como a mejorar nuestra comprensión del proceso de la enfermedad. Por ello, se ha trabajado en las últimas dos décadas con el fin de mejorar la clasificación y estadificación del CCR, además de identificar factores pronósticos ya sean clínicos o patológicos para predecir el comportamiento del tumor. La estadificación precisa también ayuda a la toma de decisiones clínicas y definir protocolos de vigilancia.
¿ HISTORIA DE LA ESTADIFICACIÓN DEL CCR
El sistema tumor, ganglios y metástasis (TNM) es un método de estadificación que se ha basado en grandes estudios multicéntricos con altos niveles de evidencia con el fin de facilitar decisiones terapéuticas. En los últimos años se han llevado a cabo múltiples revisiones de series de CCR con el fin de evaluar la validez de la clasificación TNM. Este sistema es una herramienta importante tanto para investigadores como para clínicos, siendo definido como uno de los predictores exactos de supervivencia más seguros en el CCR.
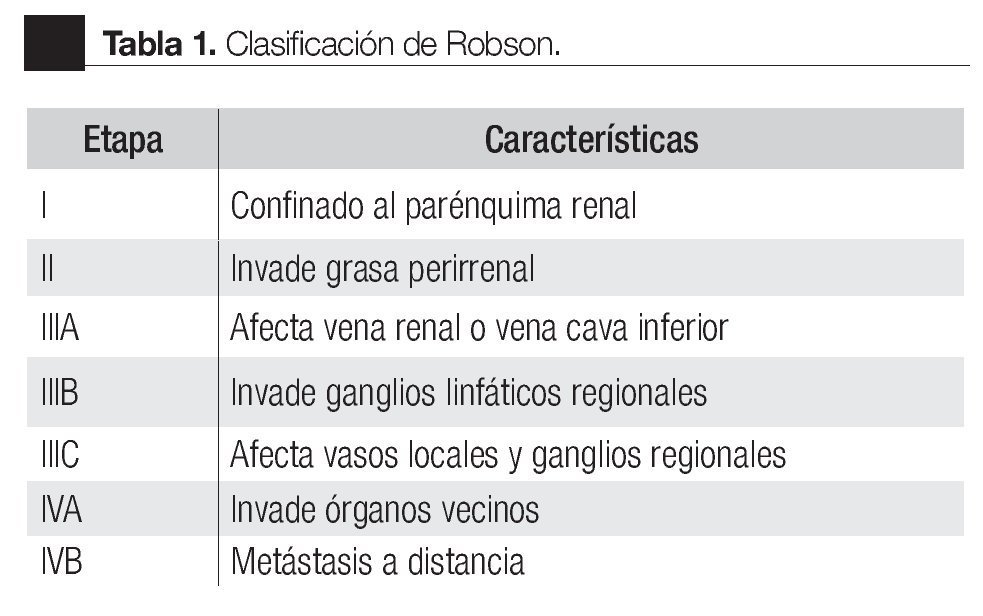
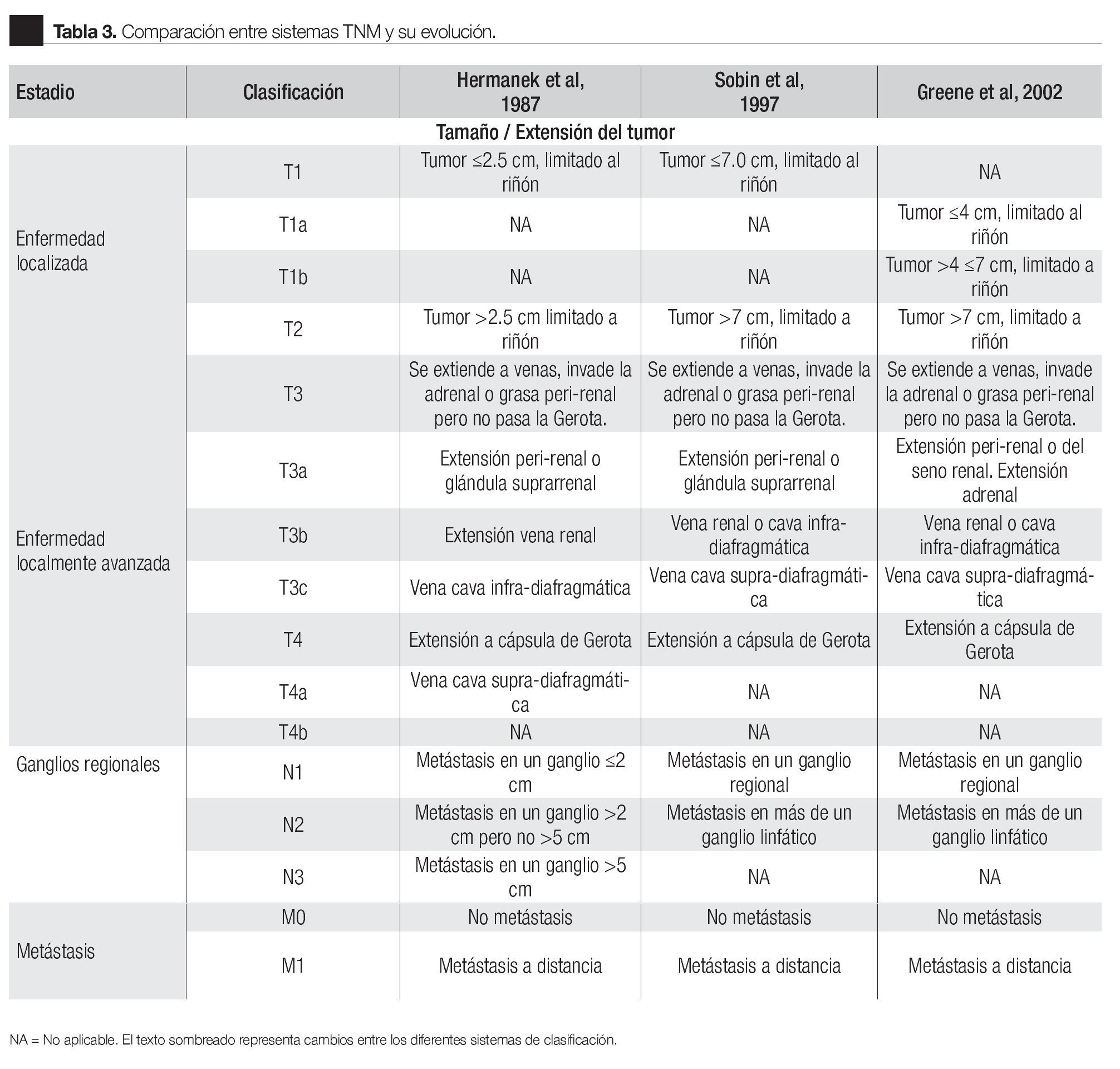
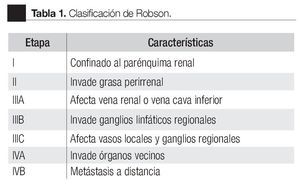
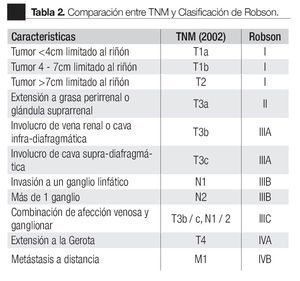
La clasificación TNM para tumores malignos se estableció en 1943. La primera estadificación del CCR fue realizada por Flocks y Kadesky en 1958 y se basó en características anatómicas y patrones de diseminación, posteriormente Petrovic publicó una clasificación similar en 1959 que subdividió a los tumores intrarrenales. Robson y colaboradores en 1969, realizaron una modificación de esta clasificación basada en hallazgos patológicos y factores pronósticos, con gran aceptación en la práctica clínica (Tabla 1).3,4 En 1978 la Union for International Cancer Control (UICC) formuló la primera clasificación por estadios basada en el sistema TNM, la cual inicialmente utilizó características subjetivas como el tamaño y patrón de crecimiento del tumor. En 1987 (la cuarta edición), la UICC junto con el American Joint Committee on Cancer (AJCC) realizaron la primer gran revisión del TNM. En las últimas dos décadas esta clasificación ha sufrido varias modificaciones (Tabla 2).5,6
En la quinta edición de la UICC/AJCC (1997), se estableció el punto de corte para clasificar un tumor como T1 o T2, dependiendo del tamaño tumoral fue de 2 cm, 5 cm o 7 cm. En 2002 se estableció la sexta revisión de la TNM.7,8 La clasificación del involucro vascular y ganglionar se realizaron también en 1997, así como la determinación del nivel de involucro vascular, los trombos infra-diafragmáticos pasaron de T3c a T3b, mientras la infiltración de la pared vascular y los trombos supradiafragmáticos quedaron como T3c.8
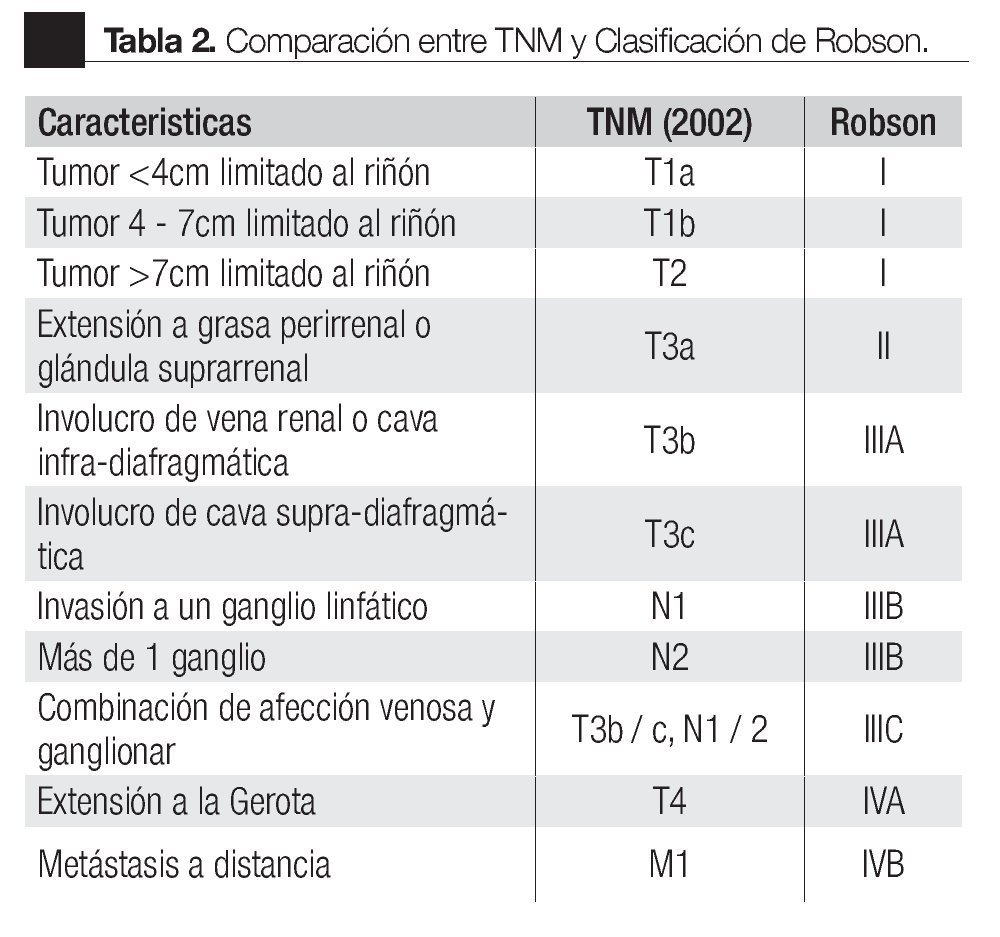
En relación con la quinta revisión de 1997, la revisión de 2002 hizo una sub-estadificación del tumor primario T1 en T1a (tumor ≤4 cm) y T1b (tumor entre 4 cm y 7 cm). Este nuevo punto de corte de los tumores T1a y T1b se estableció por ser el más recomendado en la cirugía parcial con preservación de órgano, ayudando al clínico a plantear la estrategia quirúrgica.
La clasificación clínica del tumor primario en T2 (tumor de diámetro máximo mayor de 7 cm, limitado al riñón), T3 (tumor que se extiende a las venas principales o invade la glándula suprarrenal o los tejidos peri-renales, pero sin atravesar la fascia de Gerota) y T4 (tumor que atraviesa la fascia de Gerota), no sufrió variación. La enfermedad ganglionar se simplificó a N1 en metástasis únicas y N2 para afección ganglionar múltiple.9-11
¿ ESTADIFICACIÓN DEL CCR LOCALIZADO (T1 - T2)
La importancia pronóstica del tamaño tumoral se ha investigado en diversos estudios. Como consecuencia, se han hecho diversas modificaciones a los puntos en el tamaño de tumores en estadio I y II, por ejemplo 4.0 cm, 4.5 cm, 5.5 cm, y 6.5 cm con una asociación significativa entre supervivencia y tamaño.10
En 1987 el TNM definió un punto de corte de 2.5 cm, asumiendo que tumores más pequeños presentaban muy bajo riesgo de metástasis. Posteriormente se observaron las fallas en esta clasificación ya que estos tumores tan pequeños sólo comprenden 1% a 8%.6 En el suplemento de 1993, la categoría T2 se amplió en cuatro subcategorías (T2a: >2.5 cm - 5 cm; T2b: >5 cm - 7.5 cm; T2c: >7.5 cm a 10 cm; T2d: >10 cm). Finalmente, en 1997 esta sub-clasificación fue sustituida recomendando que el punto de corte para T1 - T2 debe ser de 7 cm.7 La sexta revisión del TNM (2002) introdujo la subdivisión de los tumores T1 en T1a y T1b, con un punto de corte de 4 cm; en la actualidad, el punto de corte para determinar la idoneidad para la nefrectomía parcial es también los 4 cm.
Hafez y colaboradores realizaron un análisis retrospectivo de la cirugía conservadora de nefronas para el CCR en 485 pacientes. Los pacientes con tumores ≤4.0 cm mostraron significativamente mayor tiempo de supervivencia libre de recurrencia, en comparación con tumores más grandes. Otros datos sugieren la necesidad de una revisión de la categoría T de los tumores órgano-confinados. En 2004, dos estudios independientes reportaron una tasa similar de recidiva local y supervivencia en pacientes sometidos a nefrectomía radical o parcial en enfermedad T1b (4 cm a 7 cm) en comparación con los pacientes pT1a.12-14 Esto sugiere que la subdivisión de los tumores pT1 ya no sería necesaria si la cirugía preservadora de nefronas puede extenderse a los tumores con un diámetro de 4 cm a 7 cm.
Recientemente Frank y colaboradores, con 544 pacientes observaron que el aumento en el tamaño tumoral en 1 cm incrementó el riesgo de muerte en 8%, de manera que los tumores mayores a 10 cm mostraron una disminución en la sobrevida cáncer específica con p <0 001 por lo que los autores propusieron la subclasificación del t2 en t2a para tumores entre 7 cm y 10 t2b mayores de datos ya han sido publicados séptima edición tnm publicado ajcc 2010 15,16
¿ CCR LOCALMENTE AVANZADO (T3 - T4)
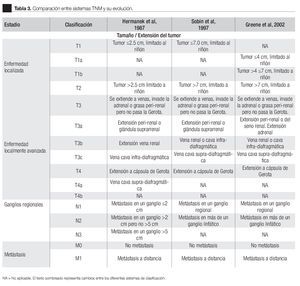
Para el grupo heterogéneo de CCR localmente avanzado (T3 - T4), con la participación diferentes estructuras anatómicas que rodean el riñón, la situación es muy diferente. Las clasificaciones publicadas en 1997 y 2002 no presentan grandes diferencias (Tabla 3); sin embargo, la categorización del CCR localmente avanzado y avanzado sigue siendo objeto de controversia.
Invasión de grasa peri-renal: El impacto pronóstico de la actividad frente a la infiltración de la grasa peri-renal ha generado controversia. Se ha descrito que los pacientes con lesiones clínicamente clasificados cT1 preoperatoriamente y finalmente clasificados como pT3a debido a la invasión peri-renal focales, tuvieron el mismo índice de supervivencia libre de recurrencia en pacientes con lesiones pT1 confirmada patológicamente. Por el contrario, Jung y colaboradores17 no encontraron diferencias entre la infiltración focal o extensa de la grasa peri-renal, por lo que se puede decir que el involucro de la grasa peri-renal no confiere un riesgo en sí.
Infiltración de la glándula suprarrenal: En 1978 la categoría T3 se dividió en cinco categorías, cabe destacar que la infiltración de la glándula suprarrenal no se consideró. Esta omisión se corrigió en 1987.6 En consecuencia, la invasión de la glándula suprarrenal o la invasión a los tejidos peri-renales (no más allá de la fascia de Gerota) se clasificó como T3a.
Thompson en 2005 se planteó la pregunta si la invasión directa de la glándula suprarrenal debe seguir siendo clasificada como un T3a. Estudió 697 pacientes y observó que en los pacientes con invasión adrenal aumentó el riesgo de muerte 2.9 veces, concluyendo que los tumores con invasión directa de la glándula suprarrenal se comportan más agresivamente que los tumores con involucro de la grasa perirrenal o del seno renal; notando un comportamiento similar a los tumores que se extienden hasta la Gerota (p = 0.0001), por lo que se propuso que la invasión a la glándula suprarrenal debe ser clasificada como T4.14,15 Ficarra en su estudio con 1969 pacientes, propuso dos grupos en pacientes con involucro de la glándula suprarrenal, uno con invasión directa y el otro con invasión vascular asociada y menciona que solamente estos últimos deben ser clasificados como T4;14 sin embargo, en la última edición del TNM 2010 la infiltración de la glándula suprarrenal ipsilateral se considera como T4.18-20
Trombosis de la vena renal y la vena cava: La importancia pronostica del nivel de afectación venosa (T3b) en el CCR también es controvertido. Basado en un estudio retrospectivo de Kim con 880 pacientes, los casos con trombosis de la vena cava sub-diafragmática se agruparon con los pacientes con trombosis de la vena renal ya que la supervivencia fue similar en pacientes con vena renal y la participación de la vena cava inferior por debajo del diafragma (T3b). Los pacientes con afectación de vena cava inferior por encima del diafragma (T3c) mostró una tasa de supervivencia significativamente menor. Por el contrario, otros estudios han demostrado que la supervivencia de los pacientes con trombosis de la cava sub-diafragmática es peor al compararla con los casos de trombosis de la vena renal. Leibovich y colaboradores propuso mejorar la clasificación T3 en relación al trombo tumoral del TNM 2002 en un estudio con 675 casos con CCR observó que los pacientes con trombos tumorales en niveles I, II y III (Clasificación de la Clínica Mayo) tenían más riesgo de morir por cáncer comparado con aquellos que involucraban solo el nivel 0 (vena renal) con p <0 0001 21-26 Con estos resultados la nueva clasificación coloca al involucro de la vena renal como T3a y los trombos infra y supra-diafragmáticos quedaron sin cambios en el nuevo TNM. 24
¿ ENFERMEDAD METASTÁSICA
Aproximadamente 10% de las metástasis por CCR son en ganglios regionales. En general, los pacientes con afectación exclusiva de los ganglios linfáticos muestran un pronóstico significativamente peor en comparación con los pacientes sin enfermedad metastásica.25-29 El TNM de 2002 distingue los pacientes con un ganglio linfático afectado (N1) y aquellos con múltiples ganglios afectados (N2) de acuerdo a su comportamiento a largo plazo. Sin embargo, otros estudios no han podido demostrar una diferencia significativa en la supervivencia entre N1 y N2.
En un estudio prospectivo aleatorizado fase 3 donde se compara la nefrectomía radical con y sin linfadenectomía, concluyendo que hay ventaja en la supervivencia de en pacientes con linfadenectomía. Cabe destacar que la tasa de micrometástasis en la linfadenectomía fue sólo 4%. En consecuencia, no se encontró ningún beneficio en supervivencia con la linfadenectomía en pacientes con ganglios positivos. Por otra parte, el realizar una linfadenectomía rutinaria después de la estadificación preoperatoria correcta daría lugar a un sobre-tratamiento innecesario de 96% de los pacientes.30-36
¿ DISCUSIÓN
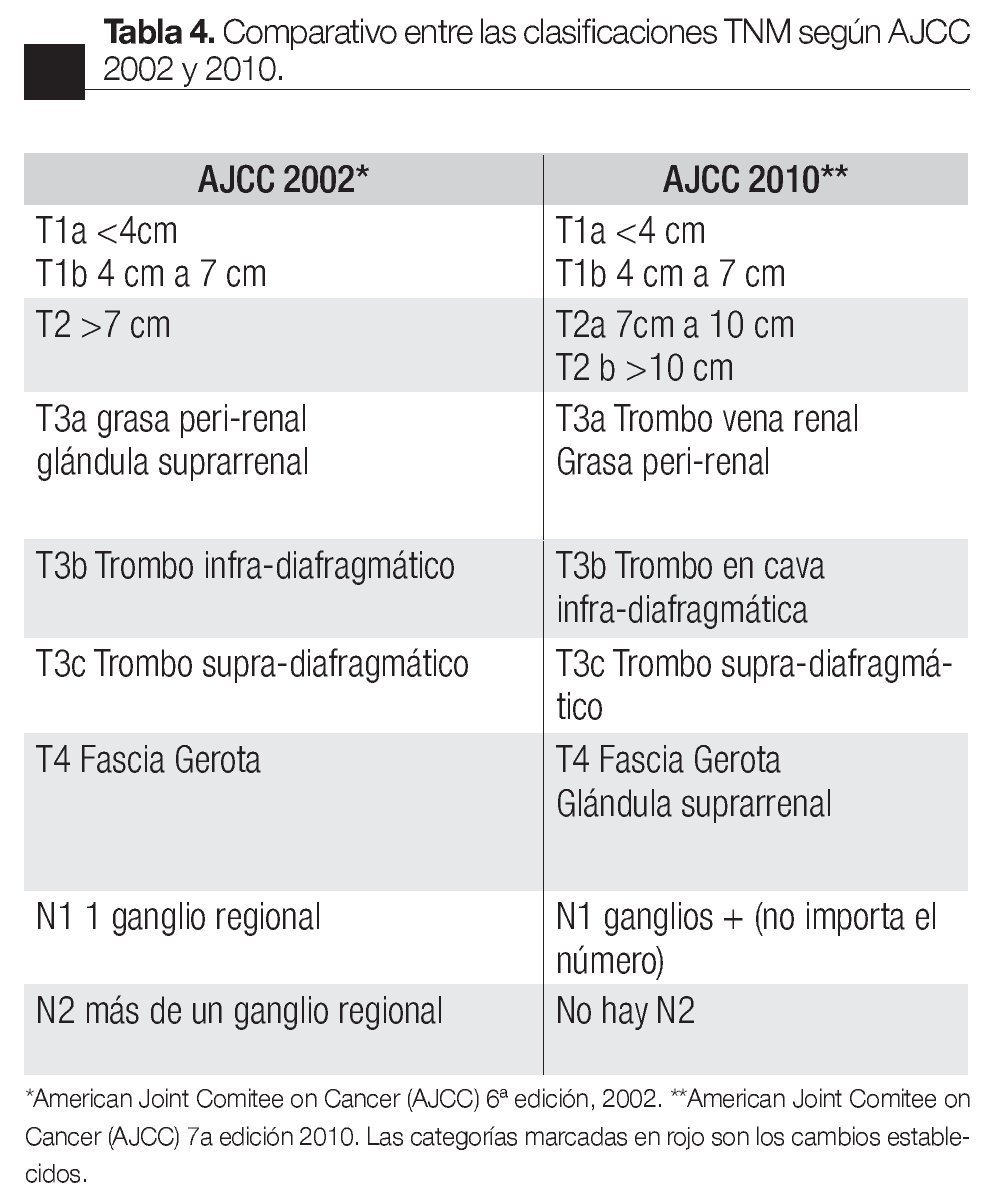
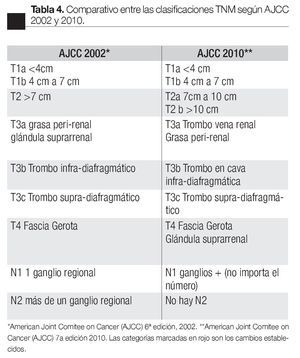
En las guías de la National Comprehensive Cancer Network (NCCN) 2010,25 se observa el sistema Tumor Ganglios Metástasis (TNM) publicado en las guías de la la estadificación del CCR según la American Joint Committee on Cancer (AJCC) en su sexta edición (2002);23 sin embargo, en su séptima edición publicada en 2010,24 en el capítulo IX muestra los cambios en la clasificación TNM de manera que el T2 se subdivide en T2a para tumores entre 7 cm y 10 cm de tamaño y T2b para los tumores mayores a 10 cm confinados al riñón. La infiltración de la glándula suprarrenal ipsilateral se reclasifica como T4 si es de manera contigua y como M1 si no es contigua. El involucro de la vena renal se reclasifica como T3a y el involucro de los ganglios se simplifica a N0 y N1 cuando son positivos independientemente del número (Tabla 4).
¿ CONCLUSIONES
La predicción de resultados para el CCR sigue siendo controvertida, y aunque muchos parámetros han sido probados para un significado pronóstico, pocos han logrado la aceptación general en la práctica clínica. La estadificación precisa del tumor en CCR es esencial para determinar un pronóstico. Debido a nuevos estudios multicéntricos, sabemos que el sistema TNM del CCR debe ser un método de clasificación que cambia continuamente.
Es importante conocer los cambios en el nuevo TNM publicado por la AJCC en 2010, así como la evolución y los estudios que avalan dichos cambios con el fin de estadificar y dar seguimiento a los pacientes con CCR.
Correspondencia: Dr. Zael Santana Ríos.
Calzada de Tlalpan 4800. Col. Sección XVI. 14080.
Teléfono: 4000 3044, 5604 5529, fax: 5688 8027.
Correo electrónico: zaelsantanar@yahoo.com