El enfoque y entendimiento del paciente masculino con síntomas del tracto urinario bajo (STUB) ha cambiado radicalmente en los últimos años. La visión simplista y centrada en el crecimiento prostático ha sido abandonada y sustituida por un enfoque que integra la función vesical, renal, neurológica y del tracto de salida como origen del problema. Ahora sabemos que la vejiga tiene un papel crucial en la presencia y características de los STUB, y que estos problemas pueden ser ocasionados por la obstrucción del tracto de salida vesical por el crecimiento prostático, y por cambios propios de la vejiga secundarios al envejecimiento e isquemia pélvica similares a los observados en mujeres sin ningún tipo de obstrucción.
Con esta nueva perspectiva, hemos incorporado a nuestro arsenal terapéutico numerosos agentes farmacológicos, que actúan en diferentes sitios del tracto urinario tanto superior como inferior, y el enfoque en el manejo del paciente con STUB ha pasado de ser quirúrgico, a una enfermedad crónico degenerativa que requiere de un manejo integral, que en ocasiones involucra una operación, y con la vasta variedad de medicamentos disponibles, podemos elegir un tratamiento a la medida para cada paciente.
El propósito de esta revisión, es proveer un enfoque integral y exponer todas las opciones disponibles actualmente para el manejo de pacientes con STUB, destacando las ventajas y desventajas de cada grupo, así como proporcionar las bases para elegir y formular las combinaciones necesarias para cada caso particular
There have been radical changes over the years in the approach to and understanding of the male patient with lower urinary tract symptoms (LUTS). The simplistic vision that centered on prostate growth has been abandoned and substituted by an integrated approach that includes bladder, renal, neurologic, and bladder outlet function as causal factors. We now know that the bladder pays a crucial role in the presence and characteristics of LUTS and that these problems can be caused by bladder outlet obstruction due to the growth of the prostate, as well as to characteristic bladder changes secondary to aging and pelvic ischemia, similar to those observed in women with no type of obstruction.
From this new perspective, we have incorporated numerous drugs into our armamentarium that act on different sites of both the upper and lower urinary tract. The management approach to the patient with LUTS is no longer a strictly surgical one and the disease is viewed as a chronic degenerative pathology that requires integrated management. Surgery remains an option in certain cases, but with the wide variety of available medication we can choose the treatment that best fits each patient.
The aim of our review was to describe an integrated approach to the management of the LUTS patient, presenting all the currently available options, pointing out their advantages and disadvantages. We also attempted to provide a basis for choosing and formulating the combinations enabling the individualized treatment of these patients.
El enfoque y entendimiento del paciente masculino con síntomas del tracto urinario bajo (STUB) ha cambiado radicalmente en los últimos años. La visión simplista y centrada en el crecimiento prostático ha sido abandonada y sustituida por un enfoque que integra la función vesical, renal, neurológica y del tracto de salida como el origen del problema1. Los términos que implican a la glándula prostática como la causa de la enfermedad, tales como crecimiento prostático, prostatismo o hiperplasia prostática deben ser abandonados, ya que excluyen las alteraciones que ahora reconocemos como la raíz y causa de este padecimiento2,3. Existe cuantiosa evidencia de que el tamaño prostático no se correlaciona con la cantidad de síntomas4, por lo que atribuir estos al tamaño prostático es incorrecto, ya que no existe una relación causal. De la misma manera, la forma de clasificar los síntomas ha evolucionado. En el pasado se hablaba de síntomas obstructivos y síntomas irritativos; sin embargo, ahora sabemos que la correlación existente entre los primeros y la obstrucción al tracto de salida vesical es muy baja5; por lo tanto, se deben llamar síntomas de vaciamiento, y en el caso de los segundos, en la mayoría no existe ningún tipo de irritación dentro del tracto urinario bajo, por lo que se deben llamar síntomas de almacenamiento2. Ahora sabemos que la vejiga tiene un papel crucial en la presencia y características de los STUB y que estos problemas pueden ser ocasionados tanto por la obstrucción del tracto de salida vesical por el crecimiento prostático como por cambios propios de la vejiga, secundarios al envejecimiento e isquemia pélvica similares a los observados en mujeres sin ningún tipo de obstrucción. Por otra parte, otro de los síntomas más prevalentes y molestos en el hombre es la nicturia, tradicionalmente atribuida a problemas prostáticos. Con base en estudios epidemiológicos, es muy claro que la nicturia presenta un incremento con la edad, aunque este fenómeno se observa tanto en hombres como en mujeres de manera muy similar6. Las causas de nicturia son muy variadas y dependientes de la edad, pero hoy sabemos que más del 70% de los casos tienen su origen en los riñones, y la causa detrás de esta es la poliuria nocturna7. Es esta la razón por la que en alrededor del 60% de los pacientes operados de resección transuretral de próstata no observamos una mejoría en este síntoma8,9.
Con esta nueva perspectiva, hemos incorporado a nuestro arsenal terapéutico numerosos agentes farmacológicos, que actúan en diferentes sitios del tracto urinario tanto superior como inferior, y el enfoque en el manejo del paciente con STUB ha pasado de ser quirúrgico, al de una enfermedad crónico-degenerativa que requiere de un manejo integral, que en ocasiones involucra un procedimiento quirúrgico, y para el que, gracias a la vasta variedad de medicamentos disponibles, podemos elegir un tratamiento a la medida para cada paciente10.
El propósito de esta revisión es proveer un enfoque integral y exponer todas las opciones farmacológicas disponibles actualmente para el manejo de pacientes con STUB, destacando las ventajas y desventajas de cada grupo, así como proporcionar las bases para elegir y formular las combinaciones necesarias para cada caso particular.
Fisiopatología de los síntomas del tracto urinario bajoUna revisión detallada acerca de la fisiopatología y etiología de los STUB va más allá del alcance de esta revisión; sin embargo, es importante recalcar ciertos aspectos con relación a esto. La presencia de síntomas urinarios está relacionada con diferentes causas:
- 1.
Obstrucción del tracto de salida vesical
- a.
Crecimiento prostático
- b.
Estenosis de uretra
- c.
Disfunción primaria del cuello vesical
- d.
Contracciones del suelo pélvico
- e.
Disinergia vesicoesfinteriana
- a.
- 2.
Hipoactividad del detrusor
- 3.
Hiperactividad del detrusor
- 4.
Trastornos de la sensibilidad vesical
- 5.
Poliuria nocturna
En la mayoría de los pacientes, el espectro clínico que encontramos está ocasionado por una mezcla de los factores enumerados y el tratamiento debe ir encaminado en relación con esto. El papel que desempeña cada uno de estos elementos solo puede ser determinado de manera objetiva por medio de estudios urodinámicos multicanal. Sin embargo, estos no son necesarios para iniciar el manejo médico y pueden ser estimados mediante los hallazgos clínicos y estudios básicos que incluyen la historia clínica, el diario miccional, una uroflujometría y medición de orina residual, examen general de orina y creatinina sérica. La determinación de antígeno prostático específico tiene un papel adicional al de estimación del riesgo de cáncer de próstata; nos permite predecir la posibilidad de éxito y de progresión de la enfermedad en este grupo de pacientes, por lo que se puede considerar su empleo en este contexto11.
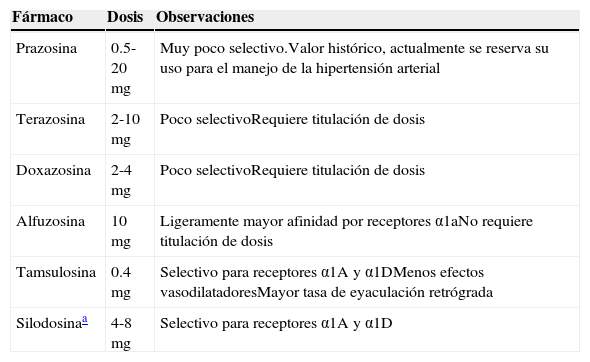
Grupos farmacológicosα bloqueadoresLos α bloqueadores son el tratamiento más común en los pacientes con STUB. Actúan sobre el componente dinámico de la obstrucción al tracto de salida mediante la relajación del cuello vesical y la próstata12. Existen 3 subtipos de receptores α1: los α1a que principalmente se encuentran en la cápsula prostática y el cuello vesical, los α1b que se encuentran en el músculo liso vascular, y los α1d, localizados en el detrusor y la médula espinal a nivel sacro12. La diferencia principal entre los distintos fármacos de este grupo radica en la selectividad hacia cada tipo de receptor. En la tabla 1 se enumeran los diferentes α bloqueadores con algunas características que destacan en ellos. En un metaanálisis realizado por Nickel et al.13 se demostró que la efectividad en cuanto a la mejoría del flujo máximo (Qmáx) es similar entre los diferentes fármacos de este grupo (+1.32ml/min sobre placebo), así como el decremento en el IPSS (siglas en inglés del cuestionario de Índice Internacional de Síntomas Prostáticos) (−1.92 versus placebo). Por lo tanto, la elección del α bloqueador dependerá del perfil de efectos adversos, que es en donde sí se demostraron diferencias. El efecto adverso más temido de este grupo farmacológico, es la hipotensión ortostática, con un riesgo relativo sobre placebo de 2.54 en general. Los medicamentos más selectivos presentan menos tasa de este problema, como son la tamsulosina y la silodosina, que no muestran una diferencia estadísticamente significativa frente a placebo. Sin embargo, estos 2 fármacos tienen tasas de eyaculación retrógrada más altas que los menos selectivos.
Diferentes tipos de α bloqueadores
| Fármaco | Dosis | Observaciones |
|---|---|---|
| Prazosina | 0.5-20mg | Muy poco selectivo.Valor histórico, actualmente se reserva su uso para el manejo de la hipertensión arterial |
| Terazosina | 2-10mg | Poco selectivoRequiere titulación de dosis |
| Doxazosina | 2-4mg | Poco selectivoRequiere titulación de dosis |
| Alfuzosina | 10mg | Ligeramente mayor afinidad por receptores α1aNo requiere titulación de dosis |
| Tamsulosina | 0.4mg | Selectivo para receptores α1A y α1DMenos efectos vasodilatadoresMayor tasa de eyaculación retrógrada |
| Silodosinaa | 4-8mg | Selectivo para receptores α1A y α1D |
Los inhibidores de la 5 α reductasa (I5AR) funcionan mediante la inhibición de la conversión de la testosterona a dehidrotestosterona. La razón para utilizar estos medicamentos en el manejo del crecimiento prostático es que la próstata es dependiente de la dehidrotestosterona durante el desarrollo embrionario. Los 2 medicamentos con los que contamos actualmente para estos fines son el finasteride y el dutasteride. El primero de ellos bloquea únicamente la 5 α reductasa tipo 2, mientras que el segundo bloquea tanto la tipo 2 como la tipo 1.
El finasteride a dosis de 5mg logra una reducción del volumen prostático de alrededor del 21% y su efecto máximo lo alcanza a los 6 meses de iniciada la terapia. El impacto que tiene sobre el IPSS es del 21% frente al −2% del placebo14. Por otro lado, el dutasteride ha mostrado una supresión del 90.2% de los niveles de dehidrotestosterona15. A pesar de esto, los efectos sobre IPSS, Qmáx y reducción de tamaño prostático son similares a los reportados para finasteride16. En los análisis de subgrupos de los diferentes estudios se ha mostrado que los pacientes que reciben un beneficio real del manejo con I5AR son aquellos con un volumen prostático por encima de los 30-40g y con antígeno prostático basal por arriba de 1.5ng/ml11.
En la clínica estos medicamentos se usan principalmente en para pacientes en riesgo de progresión a retención urinaria o necesidad de cirugía, y frecuentemente se utilizan en combinación con α bloqueadores (ver más adelante). La reducción del riesgo para retención urinaria es del 57% frente a placebo y para necesidad de cirugía es del 48%; esta reducción se mantiene hasta 4 años después del inicio del tratamiento17.
Los efectos adversos de los I5AR son principalmente de índole sexual. La disminución de la libido y la disfunción eréctil son sumamente frecuentes, una razón importante para abandono de estos medicamentos. Sin embargo, se ha observado que dichos efectos disminuyen a lo largo del tiempo, y tras un año se equiparan a los observados con placebo.
Inhibidores de fosfodiesterasa 5Los inhibidores de fosfodiesterasa 5 (IPDE5) surgieron inicialmente como medicamentos cardiovasculares, tal como lo hicieron los α bloqueadores. Durante los estudios iniciales, se detectó una mejoría no esperada muy importante en la función eréctil, y actualmente el uso principal de estos medicamentos es para esta indicación18. A lo largo del tiempo, se empezó a notar una mejoría en los STUB19,20. Esta mejoría ha sido demostrada por numerosos estudios con todos los tipos de inhibidores disponibles en el mercado, razón por la cual actualmente se encuentran incluidos como parte del arsenal terapéutico de las principales guías internacionales para el tratamiento de STUB11. Existen diversos mecanismos mediante los cuales los IPDE5 ejercen su acción en el tracto urinario bajo. El primero es la relajación del músculo liso de la cápsula prostática mediada por óxido nítrico; el segundo es la disminución de la hiperactividad del sistema nervioso autónomo, el tercero la relajación del detrusor mediante óxido nítrico y la inhibición de la rho-cinasa, y la disminución de la isquemia pélvica21–24.
Una de las limitaciones que se ha postulado para este grupo de fármacos es que en la mayor parte de los estudios la mejoría del Qmáx no representa una diferencia estadísticamente superior a placebo. A este respecto vale la pena mencionar 2 situaciones. La primera es que la mejoría observada con los α bloqueadores o los I5AR no es numéricamente importante; sin embargo, la mejoría en la percepción de la sintomatología y en el IPSS sí lo es, lo mismo que con los IPDE5. Segundo, un medicamento que mejore notablemente los parámetros urodinámicos mas no los clínicos carece de relevancia en el manejo del paciente con STUB, mientras que aquel medicamento que ofrezca una mejoría sintomática considerable es un arma terapéutica muy valiosa en esta enfermedad.
Dentro de este grupo farmacológico, contamos con 3 moléculas el sildenafil, el vardenafil y el tadalafil. Las 3 han sido estudiadas para su uso en el manejo de los STUB. No obstante, por la diferencia en la vida media de ellas, la única aprobada para el manejo de esta patología es el tadalafil a dosis de 5mg/24h. Todos los estudios realizados muestran una mejoría estadísticamente significativa en el IPSS, que oscila entre 2 y 3 puntos comparado con placebo. Oelke et al. encontraron mejorías similares tanto en el IPSS como en el Qmáx, en un estudio comparativo con tamsulosina, en donde se observaron mejorías similares tanto en IPSS como en Qmáx 25,26. Esta mejoría es independiente de la presencia o ausencia de disfunción eréctil, como lo demostraron Brock et al.27 o del tamaño prostático o severidad de los síntomas28.
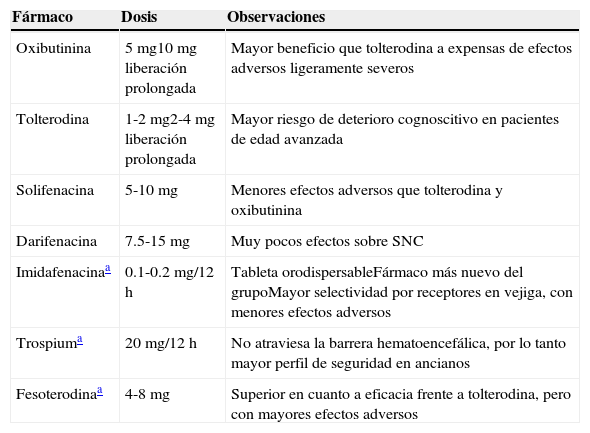
AntimuscarínicosLos antimuscarínicos se consideraron durante mucho tiempo contraindicados en pacientes con síntomas del tracto urinario, por el riesgo de precipitar retención urinaria. Esto era motivado por la visión centrada en la próstata como órgano causal de los STUB. Sin embargo, con el advenimiento de estos nuevos conocimientos, es bien sabido que un porcentaje de pacientes presentan problemas vesicales independientes de la presencia o ausencia de obstrucción urinaria, y que además, aquellos pacientes que presentan obstrucción del tracto de salida vesical generan de manera secundaria alteraciones en el funcionamiento de la vejiga. Por esta razón, el 40-50% de los pacientes con obstrucción al tracto de salida presentan hiperactividad del detrusor en estudios urodinámicos, que pueden derivar por cambios isquémicos en la vejiga o factores locales1. Los antimuscarínicos disponibles hoy en el mercado se enumeran en la tabla 2. El mecanismo de acción de este grupo es mediante el bloqueo de la acción de la acetilcolina sobre los receptores muscarínicos, en especial los tipos M3. En el pasado, se consideraba que este bloqueo prevenía la activación del detrusor cuando la acetilcolina estimulaba los receptores. Ahora sabemos que un gran porcentaje de pacientes con urgencia urinaria no tienen hiperactividad del detrusor confirmada por urodinamia y que el mecanismo por el cual presentan este síntoma la activación de receptores aferentes, los cuales también son bloqueados por los antimuscarínicos29,30.
Antimuscarínicos
| Fármaco | Dosis | Observaciones |
|---|---|---|
| Oxibutinina | 5mg10mg liberación prolongada | Mayor beneficio que tolterodina a expensas de efectos adversos ligeramente severos |
| Tolterodina | 1-2mg2-4mg liberación prolongada | Mayor riesgo de deterioro cognoscitivo en pacientes de edad avanzada |
| Solifenacina | 5-10mg | Menores efectos adversos que tolterodina y oxibutinina |
| Darifenacina | 7.5-15mg | Muy pocos efectos sobre SNC |
| Imidafenacinaa | 0.1-0.2mg/12h | Tableta orodispersableFármaco más nuevo del grupoMayor selectividad por receptores en vejiga, con menores efectos adversos |
| Trospiuma | 20mg/12h | No atraviesa la barrera hematoencefálica, por lo tanto mayor perfil de seguridad en ancianos |
| Fesoterodinaa | 4-8mg | Superior en cuanto a eficacia frente a tolterodina, pero con mayores efectos adversos |
La principal preocupación para no usar antimuscarínicos en hombres era el riesgo de precipitar retención urinaria en presencia de obstrucción o hipoactividad del detrusor. Numerosos estudios han demostrado la seguridad de este grupo farmacológico en hombres31. Abrams et al. evaluaron el efecto de la tolterodina en pacientes con obstrucción del tracto de salida vesical32, encontrando cambios similares en el Qmáx tanto en el grupo placebo como en los pacientes tratados con tolterodina, con un incremento de 25cc de orina residual frente a 0 para el grupo de tratamiento activo. Es de notar que el único episodio de retención aguda de orina se presentó en el grupo placebo. Esta tasa de retención urinaria (0.2%) se ha demostrado de forma consistente en numerosos estudios adicionales33–35, por lo que actualmente se recomienda únicamente precaución en pacientes con volumen residual mayor a 200ml11.
El uso de los antimuscarínicos como monoterapia ha sido evaluado en diferentes estudios. Los datos más importantes provienen del estudio TIMES, por Abrams y Kaplan. En este estudio, se encontró que los pacientes tratados con monoterapia con tolterodina de liberación prolongada (4mg) mostraron una mejoría importante en la puntuación sobre las preguntas de almacenamiento del IPSS, así como en los episodios de incontinencia de urgencia. Esta mejoría se observa solo en pacientes con síntomas de almacenamiento y en especial en pacientes con próstatas pequeñas32,36,37.
Los efectos adversos más comunes con este grupo de fármacos son la boca seca (20-30%), el estreñimiento (4-10%), la visión borrosa y el deterioro cognitivo38.
α bloqueadores+inhibidores de 5 α reductasaEsta combinación probablemente sea la más estudiada y empleada en el manejo de los pacientes con síntomas urinarios. Los datos más importantes provienen de 4 estudios, el estudio PREDICT39, el MTOPS40, el Veterans Affairs41 y el COMBAT42,43. Esta combinación tiene un papel principal en pacientes con síntomas moderados a severos, con factores de riesgo para progresión de la enfermedad. La mejoría en el IPSS, Qmáx y calidad de vida es mayor para la combinación que para cualquier monoterapia, aunque esto se observa únicamente en pacientes con próstatas grandes, por lo que debe reservarse para este grupo de pacientes.
Cuando se emplea esta combinación, se puede suspender el uso del α bloqueador una vez que se logre el efecto máximo del I5AR, es decir, entre 6 y 12 meses después.
α bloqueadores+antimuscarínicosEsta combinación farmacológica ha cobrado gran interés en estudios recientes. Un gran porcentaje de pacientes que se consideraban como casos de fallo del tratamiento médico, podrían ser rescatados al emplear esta combinación. Como se mencionó previamente, los α bloqueadores tienen un impacto modesto en los síntomas de almacenamiento, por lo que agregar antimuscarínicos a este grupo de pacientes puede lograr la mejoría sintomática buscada. Además, es importante recalcar que muchos pacientes que eran sometidos a cirugía por progresión sintomática, pueden presentar resultados desfavorables en la misma, ya que lo síntomas de almacenamiento persisten en un porcentaje importante de sujetos9.
El antimuscarínico más estudiado para esta combinación es la tolterodina, habitualmente en conjunto con la tamsulosina. Este fármaco ha sido evaluado en los estudios TIMES44, ADAM34 y por Athanasopoulos et al.45. La información más importante de la combinación de tamsulosina y solifenacina proviene del estudio NEPTUNE46, a partir del cual se ha desarrollado una formulación comercial que combina ambos fármacos47. Estos estudios han demostrado una mejoría en la tasa de respuesta con el tratamiento combinado, en especial en el apartado de síntomas de almacenamiento, con tasas de seguridad elevadas y riesgo de retención urinaria menor del 2%.
α bloqueador más inhibidores de fosfodiesterasa 5La combinación de estos 2 fármacos ha sido evaluada en diversos estudios. Ambos medicamentos actúan relajando la cápsula prostática y el cuello vesical por mecanismos diferentes. Además, los IPDE5 actúan sobre otros sitios del tracto urinario bajo, por lo que se esperaría que los efectos serían aditivos. Esto ha sido corroborado en todos los estudios hasta la fecha, en donde la combinación ofrece una reducción de 2 puntos adicionales sobre el IPSS en comparación con la monoterapia con α bloqueadores, así como una mejoría adicional de 1.5ml/s en el Qmáx. Esto se logra en adición a la obvia mejoría sobre la función eréctil ofrecida por el IPDE5, por lo que se puede considerar esta modalidad terapéutica en pacientes con pobre respuesta a cualquiera de las 2 formas de monoterapia48.
Inhibidores de fosfodiesterasa 5 más inhibidores de la 5 α reductasaEl interés por esta combinación surge de la necesidad de un tratamiento que impacte en la progresión de la enfermedad, sin tener una repercusión tan importante sobre la función sexual del paciente. Casabé et al. desarrollaron un estudio para evaluar la combinación de finasteride y tadalafil49. Sus resultados mostraron una reducción del IPSS mayor para la combinación que para la monoterapia con finasteride a lo largo de las 26 semanas del estudio, que inicialmente fue de 1.7 puntos y hacia el final fue de 1. Esto es similar a lo encontrado en los estudios MTOPS y COMBAT, en donde los α bloqueadores actúan al inicio de la terapia, mientras se alcanza el máximo efecto del I5AR. Como es de esperar, el efecto de la monoterapia con finasteride sobre la función sexual fue deletéreo; sin embargo, en el grupo de la combinación los efectos de tadalafil fueron muy superiores, produciendo una mejoría en el IIEF (siglas en Inglés del cuestionario del Índice Internacional de la Función Eréctil) de 4.7 puntos en comparación con finasteride solo.
Estos hallazgos hacen muy atractiva esta combinación para pacientes en riesgo para progresión de la enfermedad pero que desean mejorar o mantener la función sexual.
Integrando conceptos, confeccionando tratamientos a la medidaCon todas las opciones disponibles hoy en día, se pueden realizar combinaciones muy diversas que se adapten a las necesidades de cada paciente. Dichas combinaciones o elecciones de tratamiento están resumidas en la figura 1, a partir de la cual se pueden realizar las combinaciones pertinentes, y los puntos más importantes se detallan a continuación:
- 1.
Para pacientes en riesgo de progresión, el único grupo farmacológico que ha mostrado un efecto benéfico son los I5AR, por lo que deben ser incluidos en el manejo de todos estos pacientes.
- 2.
Los α bloqueadores y los IPDE5 ofrecen una mejoría sintomática similar, aunque el segundo grupo representa un costo económico más elevado, por lo que probablemente los α bloqueadores sean el tratamiento de primera línea para pacientes solo con síntomas urinarios.
- 3.
En sujetos sin mejoría suficiente en monoterapia con IPDE5 o α bloqueadores, la combinación ofrece una superioridad en mejoría sintomática y del Qmáx, por lo que debe ser considerada.
- 4.
En pacientes con disfunción eréctil y síntomas urinarios, la monoterapia con IPDE5 ofrece beneficio sintomático para ambos padecimientos, reduciendo el costo del tratamiento y la polifarmacia, y logrando resultados similares en la reducción de síntomas en ambas entidades. De la misma manera, los pacientes que no toleraron los efectos adversos de los α bloqueadores, pueden ser tratados con IPDE5 con los mismos resultados.
- 5.
Los antimuscarínicos constituyen la piedra angular en el manejo de los síntomas de almacenamiento, ya sea como monoterapia o en combinación con α bloqueadores, y son medicamentos seguros para usarse en hombres con riesgo de retención urinaria de alrededor del 1-2%.
- 6.
La nicturia es un fenómeno que se manifiesta como STUB, pero su abordaje y manejo es completamente independiente y va más allá del alcance de esta revisión; el manejo principal se basa en la desmopresina, que se puede combinar con cualquiera de los esquemas previamente mencionados.
No se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesEl Dr. Reyes-Vallejo es el asesor médico en urología de Eli Lilly, México