El sistema de nefrometría R.E.N.A.L., desarrollado como herramienta imagenológica de abordaje terapéutico para masas renales sólidas permite la evaluación reproducible y cuantitativa de sus características anatómicas.
MetodologíaSe analizaron retrospectivamente los resultados histopatológicos, así como las implicaciones quirúrgicas y complicaciones en 38 pacientes del CMN 20 de Noviembre, sometidos a cirugía preservadora de nefronas por masas renales sólidas. Se calculó el grado de complejidad de las masas renales de acuerdo al sistema de nefrometría R.E.N.A.L. subdividiendo la muestra en 3 subgrupos, baja (4-6), moderada (7-9) y alta complejidad (10-12)
ResultadosSe estableció una correlación positiva entre la complejidad radiológica de la masa tumoral con el grado histológico de Fuhrman (0.8283, IC 95% 0.6918-0.9076), con la cantidad de hemorragia transoperatoria (0.7073, IC 95% 0.5009-0.8376), el tiempo requerido de isquemia transoperatoria (0.6627, IC 95% 0.4352-0-0.8107) y la tasa global de complicaciones derivadas del procedimiento quirúrgico. (0.5944, IC 95% 0.3392-0.7681).
ConclusionesDe acuerdo a los resultados obtenidos, se evidencia la correlación de implicaciones quirúrgicas con el grado de complejidad radiológica en masas renales. Su reproductibilidad y accesibilidad la convierten en una herramienta útil para predicción de resultados quirúrgicos e incluso de impacto a nivel oncológico en el manejo de masas renales
The R.E.N.A.L. Nephrometry Scoring System was developed as an imaging tool in the therapeutic approach to solid renal masses that enables a reproducible and quantitative evaluation of their anatomic characteristics.
MethodsThe surgical implications, complications, and histopathologic results were retrospectively analyzed in 38 patients that underwent nephron-sparing surgery for solid renal masses at the CMN 20 de Noviembre. The grade of complexity of the renal masses was calculated according to the R.E.N.A.L. Nephrometry Scoring System, subdividing the sample into 3 tumor complexity subgroups: low (4 to 6), moderate (7 to 9), and high (10 to 12)
ResultsThere was a positive correlation between radiologic tumor complexity and the Fuhrman histologic grade (0.8283, 95%CI 0.6918-0.9076), intraoperative blood loss (0.7073, 95%CI 0.5009-0.8376), required intraoperative ischemia time (0.6627, 95%CI 0.4352-0-0.8107), and overall surgical complication rate (0.5944, 95%CI 0.3392-0.7681).
ConclusionsOur results showed a correlation between surgical implication and radiologic complexity grade in renal masses. The reproducibility of and access to this tool make it useful in the prediction of surgical results, along with its having an impact on renal mass oncologic management.
El hallazgo imagenológico de una masa renal sólida conlleva la necesidad de caracterizarla a través de estudios paraclínicos en función de su topografía, dimensiones y relaciones anatómicas con la finalidad de planificar el manejo definitivo.
Se estima que del 20-30% de las masas renales sólidas diagnosticadas de manera incidental mostrarán una histología benigna en el análisis definitivo. De igual forma, únicamente del 10-30% podrán tener un comportamiento clínico potencialmente agresivo1–4.
A pesar del incremento reciente en el uso de otras herramientas empleadas para la predicción del comportamiento clínico de las masas renales, las cuales incluyen la biopsia renal percutánea, su uso sistemático no es susceptible de ser aplicado debido a factores que incluyen el requerimiento de insumos y personal entrenado para su realización y la interpretación del material obtenido5–7.
El sistema de nefrometría R.E.N.A.L., desarrollado en 2009 como herramienta de abordaje terapéutico para masas renales sólidas en el Fox Chase Cancer Center de Philadelphia por Kutikov y Uzzo8, permite la evaluación reproducible y cuantitativa de las características anatómicas en masas renales sólidas. Existe evidencia creciente de la correlación entre la anatomía de masas renales con la histología y el comportamiento clínico de las mismas, así como en el riesgo de complicaciones derivadas del manejo definitivo9–11.
ObjetivoDeterminar la utilidad y el valor predictivo del puntaje obtenido por el sistema de nefrometría R.E.N.A.L., estableciendo de forma cuantitativa la complejidad anatómica de masas renales sólidas, con el resultado histopatológico definitivo y con implicaciones quirúrgicas que incluyen hemorragia transoperatoria, tiempo de isquemia y complicaciones derivadas del procedimiento en pacientes sometidos a nefrectomía parcial abierta y laparoscópica, pertenecientes al CMN 20 de Noviembre.
MetodologíaSe llevó a cabo un análisis retrospectivo de los resultados histopatológicos, así como de las implicaciones quirúrgicas y complicaciones en 38 pacientes del CMN 20 de Noviembre, sometidos a cirugía preservadora de nefronas por masas renales sólidas en un lapso de 36 meses (julio de 2012 a julio de 2014).
Los pacientes incluidos en el estudio requerían contar con estudios radiológicos disponibles para el cálculo del puntaje R.E.N.A.L., además de ser factibles de valorar en cortes axiales y reconstrucciones en el plano sagital y coronal. Se incluyeron únicamente pacientes con masas renales con reforzamiento significativo de su densidad (+20UH) en fase nefrográfica por tomografía computarizada o posterior a la administración de medio de contraste en resonancia magnética. Las características demográficas, así como el puntaje de acuerdo al sistema R.E.N.A.L. y los valores tenidos en cuenta para la correlación estadística se ilustran en las tablas 1 y 2.
Características demográficas de la población estudiada y resultados histopatológicos y quirúrgicos analizados
| Características demográficas |
| Sexo femenino (n=20) |
| Sexo masculino (n= 18) |
| Media de edad: 53.08 años (29–76) |
| Mujeres: 50.43 años (29-75) |
| Hombres: 57.2 años (40-76) |
| Tipo de cirugía |
| Nefrectomía parcial abierta (n=23) |
| Nefrectomía parcial laparoscópica (n=15) |
| Estadio T |
| T1a (n=23) |
| T1b (n=15) |
| Puntaje por nefrometría (R.E.N.A.L.) |
| 4 a 6 (n=21) |
| 7 a 9 (n=14) |
| 10 o mayor (n=3) |
| Masas de localización anterior (A): 18 |
| Masas de localización posterior (P): 13 |
| Masas de localización indefinida (X): 7 |
| 4 masas hiliares (H), todas en el grupo con puntaje de 7 a 9 |
| Histología |
| Benigna (n=17) |
| Oncocitoma (n=8) |
| Angiomiolipoma (n=4) |
| Leiomioma (n=2) |
| Pielonefritis focal (n=3) |
| Adenoma metanéfrico (n=1) |
| Fuhrman I y II (n=14) |
| Fuhrman III y IV (n= 8) |
| Media de hemorragia transoperatoria |
| Nefrectomía parcial abierta: 496ml |
| Nefrectomía parcial laparoscópica: 190ml |
| Media de tiempo de isquemia caliente |
| Nefrectomía parcial abierta: 10.65min |
| Nefrectomía parcial laparoscópica: 5 mina |
| Complicaciones |
| Necesidad de transfusión (n=13) |
| Fuga urinaria (n=1) |
aSe realizó isquemia únicamente en 4 pacientes del grupo tratado con NP laparoscópica.
Parámetros imagenológicos valorados por el sistema R.E.N.A.L. y el puntaje calculado por cada variable
| 1 punto | 2 puntos | 3 puntos | |
|---|---|---|---|
| (R) Radio (diámetro máximo en cm) | ≤4 | >4pero <7 | ≥7 |
| (E) Exofítico o endofítico | ≥50% | <50% | Completamente endofítico |
| (N) Nearness–cercanía con sistema colector o seno renal (mm) | ≥7 | >4pero <7 | ≤4 |
| (A) Anterior o posterior | No otorga puntaje; se agrega sufijo A, P o X | No otorga puntaje; se agrega sufijo A, P o X | No otorga puntaje; se agrega sufijo A, P o X |
Las letras en negrita corresponden al porcentaje del diámetro de la masa tumoral que es exofítico o endofítico en la TAC, o bien si la masa es completamente endofítica.A: anterior; P: posterior; X: no identificado o desconocido.
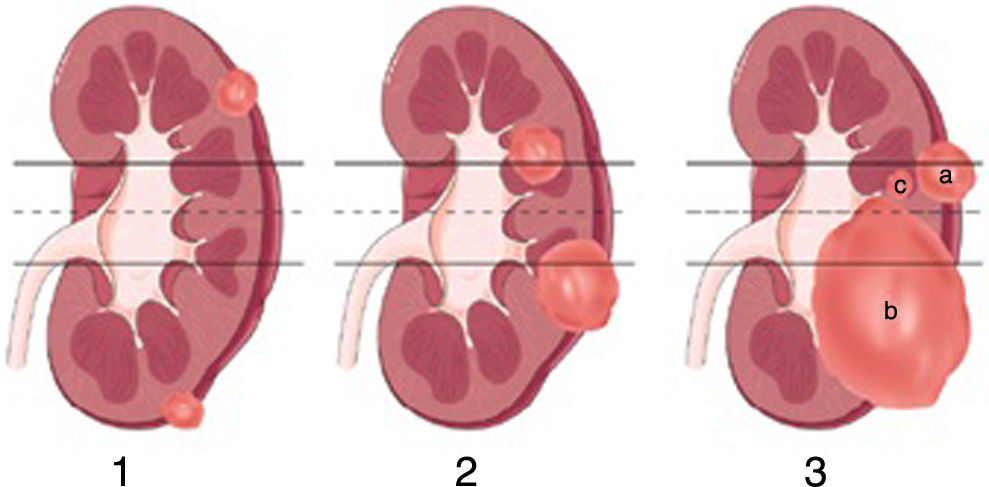
Una vez seleccionados, se calculó el puntaje de acuerdo al sistema de nefrometría R.E.N.A.L. con la revisión de los estudios imagenológicos correspondientes (35 tomografías con contraste y 3 resonancias magnéticas contrastadas). Es conveniente recordar los parámetros imagenológicos valorados por el sistema R.E.N.A.L. y el puntaje calculado por cada variable (fig. 1):
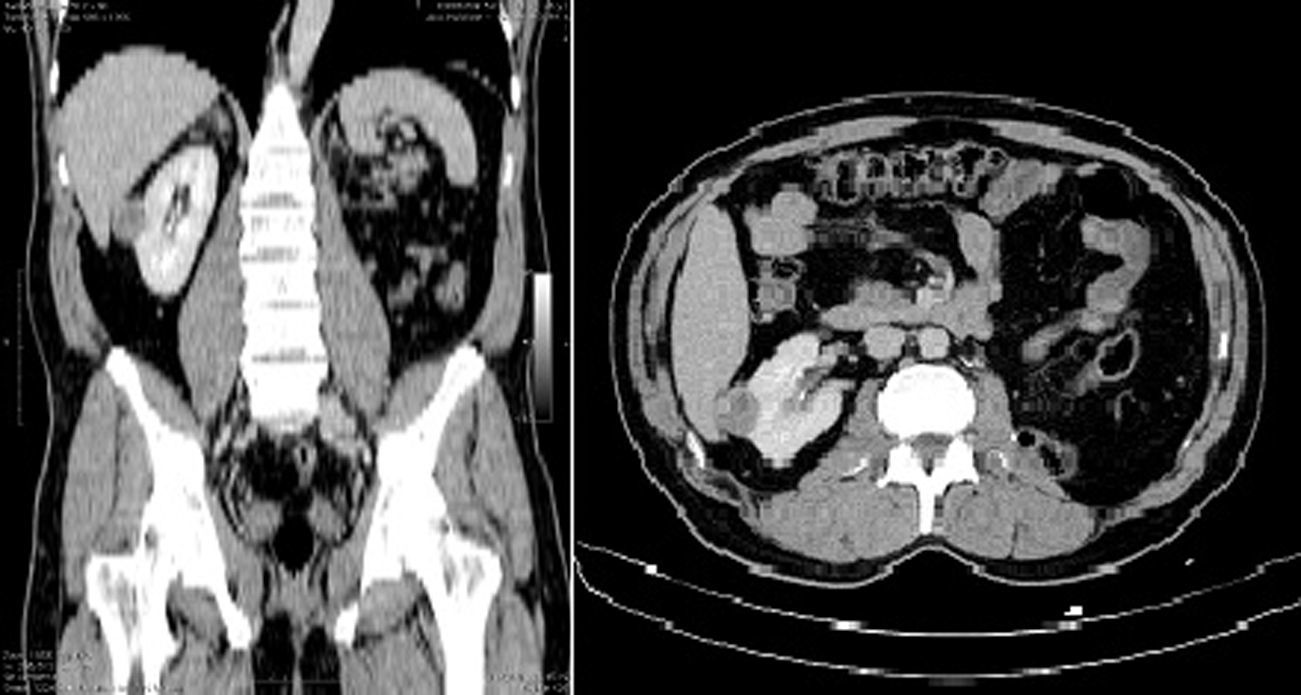
Se efectuó la subdivisión en 3 subgrupos de acuerdo al puntaje R.E.N.A.L.: baja complejidad (de 4-6; n=21); moderada complejidad (de 7-9; n=14), y alta complejidad (de 10-12; n=3). La muestra estuvo constituida por 20 mujeres y 18 hombres. La media de edad fue de 53 años. Quince pacientes fueron sometidos a nefrectomía parcial por laparoscopia y 23 con abordaje abierto. La figura 2 ejemplifica el análisis tomográfico tenido en cuenta para establecer la complejidad de los tumores evaluados.
A través del análisis de estos datos se pretendió establecer la correlación entre el grado de complejidad de las masas renales y el grado histológico nuclear de Fuhrman, el riesgo de hemorragia y requerimiento de isquemia transoperatoria, así como la presencia de complicaciones relacionadas con el evento quirúrgico. Para ello, se efectuó el análisis de la muestra mediante la prueba de coeficiente de correlación de Pearson estableciendo un intervalo de confianza de 95%, utilizando el software GraphPad Prism 6.0®.
ResultadosEl 42% (n=16) de los pacientes mostró histología benigna de la masa tumoral resecada, correspondiendo con angiomiolipoma (n=4), oncocitoma (n=8), pielonefritis focal (n=3) y leiomioma (n=1).
El 36.8% (n=14) mostró un informe histopatológico compatible con carcinoma renal de células claras de bajo grado histológico (Fuhrman I-II); y, finalmente, el 21% de los pacientes (n=8) un grado histológico alto (Fuhrman III y IV). La media de puntaje de acuerdo al sistema de nefrometría fue de 5.25 para las lesiones benignas, de 6.5 para los CCR con bajo grado histológico y de 7.62 para aquellos de alto grado histológico. Se observó correlación directa de la complejidad radiológica de la masa con el grado histológico (r=0.8283, IC 95% 0.6918-0.9076).
La media de hemorragia transoperatoria para las masas de baja complejidad fue de 226.1ml; 522ml para las lesiones de complejidad moderada y 850ml para las masas de alta complejidad. Se presentó correlación positiva entre la complejidad tumoral y el riesgo de hemorragia transoperatoria (r=0.7073, IC 95% 0.5009-0.8376). Al subclasificar la muestra de pacientes de acuerdo al procedimiento empleado (nefrectomía parcial abierta y laparoscópica) el coeficiente de correlación de Pearson estableció asociaciones significativas entre ambas variables (r=0.6841, IC 95% 0.3786-0.8551 para nefrectomía parcial abierta y r=0.6848, IC 95% 0.2658-0.8862 para procedimiento laparoscópico).
La media en tiempo de isquemia caliente requerido para las lesiones con complejidad baja fue de 3.09min (solo 3 pacientes precisaron isquemia), 14.6min para aquellas de moderada complejidad (9 pacientes la requirieron) y 26.6min para las lesiones complejas (se efectuó isquemia en la totalidad de los pacientes). En ningún paciente se empleó isquemia fría. Globalmente prevaleció una correlación del puntaje R.E.N.A.L. con el tiempo requerido de isquemia transoperatoria (r=0.6627, IC 95% 0.4352-0.8107). Al correlacionar de forma particular el puntaje por nefrometría con el tipo de procedimiento quirúrgico empleado (abierto o laparoscópico) se apreció una correlación positiva consistente en ambos subgrupos (r=0.6236; IC 95% 0.2845-0.8240 para nefrectomía parcial laparoscópica; r=0.7090, IC 95% 0.3090-0.8959 para nefrectomía parcial abierta), existiendo mayor asociación con el tiempo de isquemia empleado en cirugía abierta.
Se observó fuga urinaria en un paciente del grupo de alta complejidad, y fue necesario realizar transfusión en 5 pacientes del grupo de baja complejidad, en 6 del de complejidad moderada y en 2 del grupo de elevada complejidad. No se observó mayor número de complicaciones atribuibles al evento quirúrgico en el resto de los pacientes. La tasa global de complicaciones mostró una correlación presente aunque más débil con relación al resto de las variables en cuestión (0.5944; IC 95% 0.3392–0.7681).
DiscusiónLas masas renales sólidas, en particular aquellas con reforzamiento en su densidad tomográfica, constituyen una entidad heterogénea con variabilidad importante en relación con el comportamiento biológico. En la revisión llevada a cabo por Kutikov et al.12, la cual incluyó una muestra de 525 pacientes tratados mediante cirugía preservadora de nefronas, se demostró una correlación positiva entre la complejidad anatómica determinada por el sistema de nefrometría R.E.N.A.L. y los aspectos histopatológicos de masas renales, mostrando un área bajo la curva de 0.76 al comparar los informes histopatológicos de malignidad frente a aquellos benignos.
Existen otros sistemas de nefrometría similares a R.E.N.A.L., los cuales incluyen Preoperative Aspects and Dimensions Used for an Anatomical Classification (PADUA)13 y C-index14, que tienen en cuenta aspectos anatómicos similares al sistema R.E.N.A.L., y la segunda en particular considera la concentricidad tumoral como el aspecto determinante y definitorio de complejidad.
El papel de la biopsia renal como herramienta de evaluación preoperatoria del paciente sometido a tratamiento quirúrgico de una masa renal sólida aún es discutible Actualmente existe un aumento en el papel desempeñado por la biopsia renal en el abordaje de masas renales sólidas, debido a un incremento en su certeza diagnóstica y menor índice de complicaciones15,16. Cuando se evidencia malignidad en una biopsia percutánea, el valor predictivo positivo de esta última supera el 95%. El valor predictivo negativo en las series actuales resulta algo mayor al 80% con una tasa de resultados falsos positivos <5%. No obstante, el grado histológico tumoral, uno de los parámetros con mayor dificultad de evaluación en biopsia renal percutánea, no es evaluado en la mayoría de las series actuales de biopsia renal, y no obstante, continúa siendo establecido como un factor pronóstico independiente de supervivencia específica de cáncer17–20.
Algunas series actuales han demostrado una tasa de determinación de grado histológico tan bajas como del 62.7% en series de biopsias renales, y la subestimación del grado histológico ha sido tan elevada como del 55% en pacientes sometidos a biopsia percutánea previa a resección quirúrgica21,22.
En la serie analizada por Kutikov et al., el uso del sistema de nefrometría arrojó una capacidad predictiva del 70%12, que es similar a la que posee la biopsia renal percutánea, concluyendo la posibilidad de incorporar R.E.N.A.L. como una herramienta potencialmente reproducible y predictiva con respecto a resultados oncológicos, lo cual resulta de particular utilidad en pacientes con edad avanzada o riesgo cardiovascular elevado cuya morbilidad derivada del tratamiento quirúrgico específico puede superar a aquella determinada por las propiedades biológicas de la masa tumoral.
Una de las limitantes de nuestro análisis es el tamaño de la muestra; no obstante, el índice de correlación permitió establecer una asociación positiva en el grado de complejidad determinado por métodos radiológicos con distintos aspectos relevantes en cuanto a supervivencia específica de cáncer y a morbilidad derivada del manejo quirúrgico. Incluso teniendo en cuenta de manera individual el grupo de pacientes tratados por nefrectomía parcial abierta y aquellos tratados mediante abordaje laparoscópico, el grado de correlación con la complejidad anatómica prevalece, aunque estos resultados deben interpretarse teniendo presente el tamaño de la muestra, el cual debe incrementarse para aumentar la posibilidad de validez externa del estudio.
ConclusionesDe acuerdo a los resultados obtenidos, es evidente la correlación que existe entre el comportamiento clínico y algunas implicaciones quirúrgicas del manejo de masas renales sólidas en función de su complejidad determinada a través del sistema de nefrometría R.E.N.A.L. Hay evidencia creciente en la literatura en cuanto a la utilidad del uso de sistemas de nefrometría para la planificación de tratamiento quirúrgico de masas renales sólidas, así como las implicaciones de su complejidad anatómica con los resultados quirúrgicos y el grado de control oncológico, en particular cuando se planifica un tratamiento preservador de nefronas. Su reproductibilidad y accesibilidad la convierten en una herramienta útil para predicción de resultados quirúrgicos e incluso de impacto a nivel oncológico en el manejo de masas renales sólidas. Su sistematización en cuanto a la planificación quirúrgica, en particular de pacientes sometidos a cirugía preservadora de nefronas, permitiría establecer estrategias de manejo de mayor diversidad que garanticen resultados satisfactorios en el rubro de control oncológico así como modular el impacto en la morbilidad quirúrgica derivada del tratamiento específico, en particular cuando existe un riesgo cardiovascular elevado.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.