Numerosas investigaciones sobre las bases moleculares del cáncer de próstata se basan en el papel de los andrógenos. Sin embargo, se demostró que los estrógenos se vinculan con el desarrollo y progresión del cáncer de próstata. En este artículo revisamos las evidencias de laboratorio y clínicas, demostrando que los estrógenos pueden ser la causa del desarrollo y progresión de la hiperplasia prostática y el cáncer de próstata. También, investigamos los mecanismos más significativos que estaban relacionados con la acción de estos, que incluyen: genotoxicidad directa, hiperprolactinemia, inflamación y la acción mediada por receptores. Además, investigamos las funciones de los receptores de estrógenos conocidos (α y β) en las enfermedades prostáticas. Las evidencias observadas indican que el receptor α desempeña un papel primordial en el desarrollo de la próstata normal y el cáncer. El receptor β está relacionado con la diferenciación del tejido epitelial prostático y numerosas acciones antiproliferativas en el cáncer de próstata. Sin embargo, algunas de sus isoformas se asocian a mecanismos de iniciación y progresión del cáncer. Finalmente, sugerimos que deberán realizarse más investigaciones relacionadas con la acción de los estrógenos, que nos permitan dilucidar el papel de estos en el desarrollo del cáncer de próstata.
Numerous studies on the molecular basis of prostate cancer focus on the role of androgens, but estrogens have been shown to be linked to prostate cancer development and progression. In the present article, we reviewed the laboratory and clinical evidence, demonstrating that estrogens can be the cause of the development and progression of prostatic hyperplasia and prostate cancer. We also studied the more significant mechanisms related to estrogen action, which include: direct genotoxicity, hyperprolactinemia, inflammation, and receptor-mediated action. In addition, we analyzed the functions of the known estrogen receptors (alpha and beta) in diseases of the prostate. The evidence observed suggests that estrogen receptor alpha plays an essential role in the development of both the normal prostate and the cancer, whereas estrogen receptor beta is related to the differentiation of the prostatic epithelial tissue and numerous antiproliferative actions in prostate cancer. Nevertheless, some of their isoforms are associated with mechanisms of cancer initiation and progression. Finally, we believe that more studies related to estrogen action should be carried out to better understand the role estrogens play in the development of prostate cancer.
El cáncer de próstata es la cuarta enfermedad maligna diagnosticada en general, y la segunda más común en el hombre, representando aproximadamente el 15% de los tumores diagnosticados en el hombre. Esta enfermedad es la quinta causa de mortalidad en el hombre (representa el 6.6% del total de las muertes) y el número de fallecidos es mayor en los países menos desarrollados que en los desarrollados (165,000 y 142,000, respectivamente)1.
En Cuba, según datos del Anuario estadístico de salud del 2013, este tipo de tumor es el segundo en incidencia (tasa ajustada 33.3) y mortalidad (tasa 50.1).Esta elevada tasa de mortalidad puede explicarse por el incremento en el diagnóstico en etapas avanzadas2.
La próstata es como una inmensa red de interacción homeostática, y la función de este órgano está muy vinculada con el eje hipotálamo-hipófisis-testículo. Se planteó que el papel de los andrógenos en la carcinogénesis prostática es solo una cara del problema, ya que el desarrollo tumoral comúnmente ocurre en edades avanzadas, donde los niveles de la testosterona (T) están en declive3. En contraste, los niveles de estradiol (E2) no se reducen con la edad, de manera que permanecen sin cambios o se incrementan ligeramente4. La disminución en la razón T-E2 se relacionó con el desarrollo del cáncer de próstata5,6. También se demostró una asociación entre el riesgo al cáncer prostático y: a) el polimorfismo en los genes involucrados en el metabolismo del 17 β estradiol7,8, b) el incremento en la expresión de la aromatasa así como en el accionar de las diferentes isoenzimas metabolizadoras9,10, c) la alteración marcada en la expresión de los receptores de estrógenos (RE)11–14 y d) la relación con los niveles del E2 en sangre5,12,15–17.
Hasta la fecha, existe un número creciente de evidencias que muestran que los estrógenos y sus receptores pueden regular el desarrollo de la próstata, la iniciación del cáncer y su progresión. Con el siguiente trabajo nos proponemos describir los principales mecanismos a través de los cuales los estrógenos afectan la glándula prostática, e inducen la carcinogénesis y la progresión del tumor.
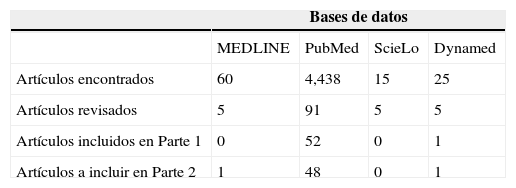
MétodosSe realizó una búsqueda en bases de datos especializadas en temas médicos como: MEDLINE, PubMed, ScieLo y Dynamed. Se evaluó la información recuperada siendo celosos en la confiabilidad de la fuente, objetivo, alcance, audiencia, prestigio y factor de impacto de la revista, el año de publicación y nivel de acceso a la información, para obtener una revisión actualizada de los últimos 10 años. Se procedió a redactar una revisión sistemática a tenor de la información recuperada siguiendo los siguientes descriptores: estrógenos, receptor de estrógenos, niveles en suero de estrógenos, mecanismo de los estrógenos, hiperplasia prostática benigna (HPB), cáncer de próstata. El proceso de selección de los artículos se realizó en colectivo y por consenso. La elección incluyó las revisiones sistemáticas, los artículos originales y los metaanálisis. En las bases de datos de artículos en idioma español aparecieron una menor cantidad artículos que cumplían con los requerimientos propuestos (tabla 1), por lo que más del 95% de los artículos utilizados para esta revisión provienen de la base PubMed.
El 17 β-estradiol (E2) es una hormona sexual del grupo de los estrógenos, que participa en el desarrollo sexual de la mujer en un mayor espectro que en el hombre. También, es un componente vital de la fisiología masculina ya que se sintetiza a partir de la T principalmente en las células de Leydig de los testículos de mamíferos, por algunas células germinales y por las células de Sertoli de mamíferos inmaduros. La función principal del E2 es evitar la apoptosis de las células germinales18.
Relación de los estrógenos con la glándula prostática normalEl papel de los estrógenos en la próstata no está completamente elucidado. Se planteó que estos se involucran en el crecimiento prostático, sobre todo en el desarrollo de las células estromales y en eventos morfogénicos tempranos. La exposición a niveles elevados de estrógenos (mayores a los 60pg/mL) durante el periodo crítico del desarrollo embrionario puede provocar alteraciones en la morfogénesis prostática y la diferenciación celular, conocida como estrogenización. Estas perturbaciones pueden ocurrir con la edad avanzada y se asocian con el incremento en la incidencia de lesiones prostáticas correlacionadas con la edad como es la HPB10,19.
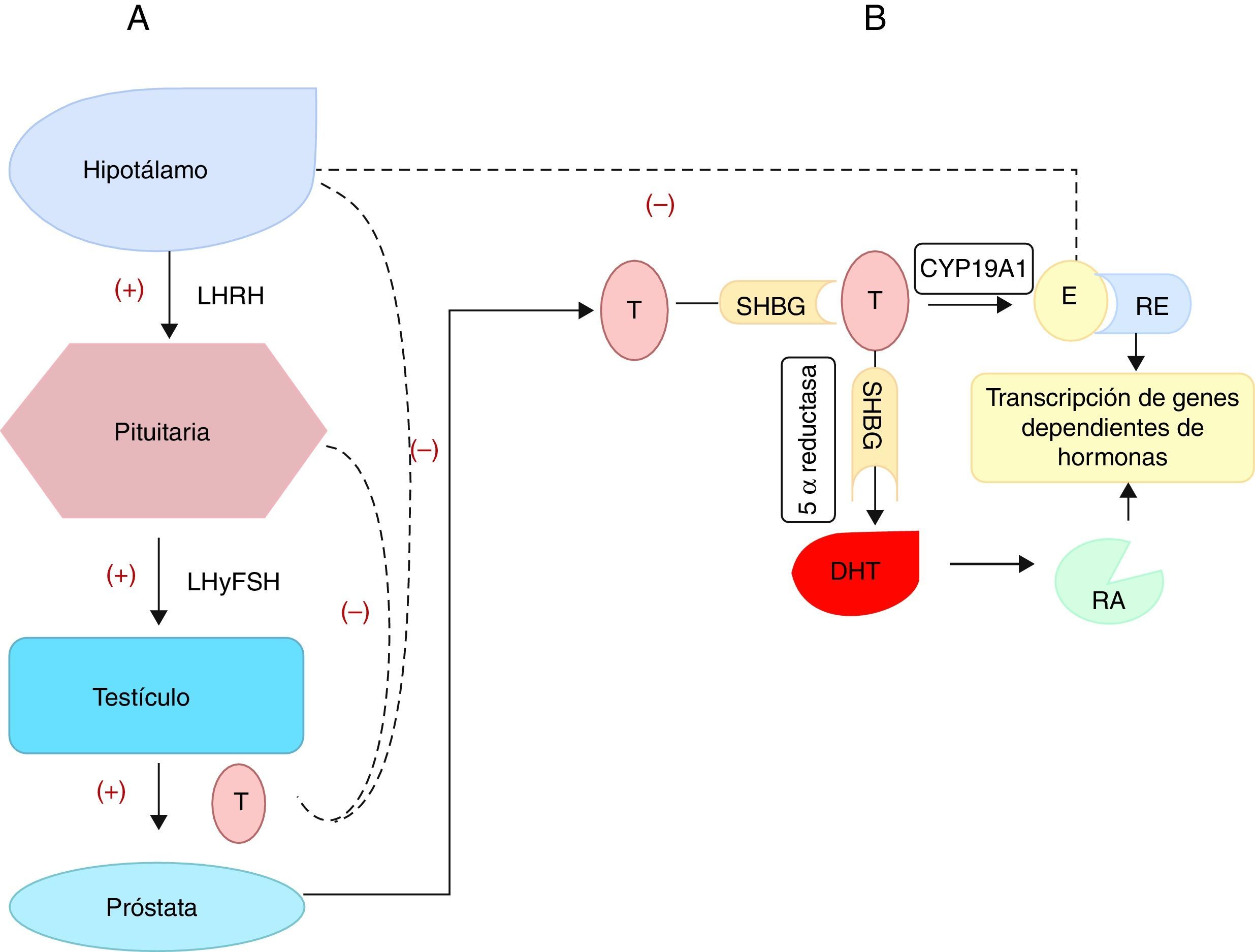
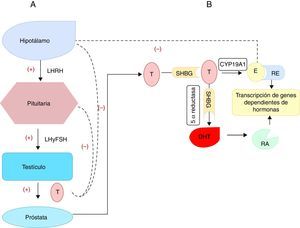
Uno de los mecanismos propuestos para explicar el crecimiento prostático dependiente de E2 es a través de la prolactina (PRL) liberada por la glándula pituitaria. Aunque, no todos los efectos estrogénicos pueden ser atribuibles a la acción directa de la PRL sobre la glándula prostática20. Se conoce que la PRL promueve el crecimiento21 y la inflamación de la glándula prostática normal20. Además, el E2 hace un lazo de retroalimentación negativo sobre el eje hipotálamo-hipófisis-testículo, bloqueando la secreción de la hormona luteinizante y su liberadora. Finalmente promueve la esteroidogénesis de los andrógenos mediado por la aromatasa específica CYP19A1 de las células estromales prostáticas. Esta regulación negativa fue la base para emplear la terapia con estrógenos a altas dosis en el tratamiento primario del cáncer de próstata (castración química)11 (fig. 1).
Síntesis de las hormonas esteroideas que actúan sobre la próstata.
A) Representa la regulación de la síntesis y liberación de la testosterona (T) por los testículos, a través del eje hipotálamo-hipófisis-testículo. Las líneas continuas representan la activación (+) y promoción de la liberación de las hormonas. Las líneas discontinuas representan una retroalimentación negativa, dada por la liberación de la T cuyos niveles inhiben negativamente la liberación de la hormona liberadora de la hormona luteinizante (LHRH), de la hormona luteinizante (LH) y la estimulante de folículos (FSH).
B) Se representa la síntesis prostática de la dihidrotestosterona (DHT) gracias a la acción de la enzima 5 α reductasa a partir de la testosterona. Una porción de la T y de la DHT se unen en el plasma a la proteína de unión a las hormonas sexuales (SHBP). La DHT se une al receptor de andrógenos (RA) y esta unión hormona-receptor se transloca al núcleo para unirse a los elementos de respuesta en el ADN para ejercer su acción. También existe una conversión de T a estradiol (E2), gracias a la acción de la aromatasa citocromo P450 prostática (CYP19A1). Este estradiol se une a su receptor (RE) y al igual que sucede con el receptor de andrógenos, se une a sus elementos de respuesta en el núcleo lo que promueve la transcripción de los genes dependientes de estas hormonas.
Con la edad, el nivel de producción de T por las células de Leydig disminuye, al bajar la respuesta ante el estímulo de la hormona luteinizante hipofisiaria, y aumenta ligeramente el nivel de estrógenos por incrementos en acción de la enzima aromatasa19,22. Se produce entonces, una alteración en el equilibrio de E2-T, favorable a los primeros5,6.
Un estudio desarrollado en ratones sugirió que el E2 puede contribuir al incremento de los síntomas urinarios bajos, a través de su efecto sobre la uretra y la vejiga23. En humanos, existen evidencias de la asociación entre los niveles basales del E2 elevados con el menor riesgo a recibir cirugía debido a la HPB24. Además, el rápido declive de los niveles de E2 con la edad correlaciona con el incremento del volumen prostático y de los síntomas obstructivos urinarios, así como la razón E2-T elevada se asoció con el bajo riesgo para desarrollar los síntomas de la HPB24.
La acción de los estrógenos está mediada por su receptor nuclear específico (RE), el cual regula la transcripción de los genes blancos a través de la unión con sus elementos de respuesta y la regulación genómica25. La interacción ligando-receptor es el segundo mecanismo propuesto de la acción del E2. La próstata expresa 2 subtipos fundamentales: el α (REa) y el β (REb).
El rol fisiológico del REb se involucró con la regulación del metabolismo de la glucosa y su homeostasia, la señalización de la insulina y la modulación de la inmunidad a través del control de la inflamación y la muerte celular programada (apoptosis)13. El REb es, además, el regulador negativo del REa y modula la expresión génica en dependencia del tipo de tejido26. Ambos receptores tienen una disposición específica en la próstata. El REa se expresa mayormente en el compartimento estromal y ocasionalmente en las células epiteliales basales o luminales (solo el 10% es positivo) y su expresión se asoció con las señales de proliferación celular27. El REb está en las células epiteliales basales y algunas veces en la luminales.
En roedores, la exposición prolongada (prenatal o neonatal) a los estrógenos causa drásticas modificaciones en el tejido epitelial prostático, inhibiendo el crecimiento y el funcionamiento aberrante del mismo. Todo esto conduce a la HPB fenómeno mediado fundamentalmente por la presencia del REa28, ya que se observan deficiencias en la diferenciación del compartimento estromal prostático29.
Relación de los estrógenos con la carcinogénesis prostáticaEn el estudio con ratones deficientes de la aromatasa CYP19A (ratón ArKO), la exposición de estos a andrógenos y estrógenos exógenos (niveles comparables con los niveles al envejecer) reduce la incidencia del cáncer de próstata respecto a los ratones en condiciones naturales. Esto sugirió la producción in situ de estrógenos, y que esta es un componente fundamental para la carcinogénesis prostática9. Además, en células LnCaP (línea celular de cáncer de próstata hormono-sensible) transformadas a un fenotipo más agresivo, se observó una disminución de la actividad e incremento de la actividad reductora de la enzima 17 β hidroxiesteroide deshidrogenasa; la cual cataliza la interconversión de los esteroides más activos, p. ej., E2 y T en los menos activos estrona y androstanediona7. Además, los estrógenos pueden inducir la sobreexpresión de la subunidad catalítica de la telomerasa humana y el incremento de la actividad de esta en líneas celulares prostáticas humanas, evento que se asocia con una proliferación celular ilimitada por vía de la acumulación de mutaciones30.
Evidencias epidemiológicasLos niveles de E2 en suero se mantienen sin alteración con la edad. Sin embargo, el cambio en el perfil intraprostático es hacia predominio de los estrógenos según se envejece. Además, los niveles de E2 en sangre mostraron diferencias en cuanto a la raza y etnia, ya que los afroamericanos (mayor incidencia y mortalidad), mostraron niveles de E2 más elevados que los de raza blanca, aunque están dentro del rango normal hasta 60pg/mL8,12; mientras, los niveles de T son comparables entre ambos31.
Los datos epidemiológicos comprenden resultados contradictorios referentes a los niveles de E2 en suero (tabla 2), ya que unos reflejan la asociación directa entre sus niveles elevados en sangre y el riesgo al cáncer3,6,15,17,31–33. Otros mostraron un resultado opuesto, un riesgo elevado con la disminución creciente en niveles del E25. Sin embargo, otros reportaron una disminución en el riesgo al cáncer respecto al incremento en los niveles de E2 en sangre34,35.
Estudios epidemiológicos sobre la relación entre los niveles de estradiol en sangre y el riego para cáncer de próstata en los últimos 10 años
| Autores | Año | Resultado | Ref. |
|---|---|---|---|
| Severi et al. | 2006 | Niveles de E2 elevados (casi el doble del rango normal), se asociaron a un 30% de disminución en el riesgo a sufrir cáncer prostático y fue inversamente proporcional a la aparición del tumor de alto grado | 36 |
| Rohrmann et al. | 2007 | Reportaron diferencias entre los niveles en suero de E2 según las etnias. Los individuos de origen afroamericanos son los de niveles más altos de E2 circulantes asociado con la mayor incidencia de cáncer de próstata. Los hispanos mostraron valores intermedios y los de raza blanca los niveles más bajos | 32 |
| Roddam et al. | 2008 | En el metaanálisis realizado no se encontró asociación entre los niveles circulantes de hormonas y el riesgo para cáncer de próstata | 37 |
| Giton et al. | 2008 | Encontraron una asociación entre los niveles de E2 en suero y el riesgo para cáncer prostático que presentara un grado de Gleason>4+, relacionándose, además, con un mal pronóstico | 33 |
| Sher et al. | 2009 | Realizaron un estudio de cohorte, donde en análisis univariado no se observó relación entre el carcinoma de alto grado, determinado por biopsia posterior a cirugía (prostatectomía radical), y los niveles de E2 total y T total, así como la razón T:E2 | 38 |
| Daniels et al. | 2010 | Estudio de cohorte que observó correlación entre los altos niveles de estrona en suero y el carcinoma de alto grado, pero no encontró asociación entre el cáncer y los niveles de E2 en suero | 34 |
| Yao et al. | 2011 | Estudio para la prevención del cáncer de próstata, no encontró asociación entre los niveles en suero E2 y el riesgo para cáncer de próstata en el grupo placebo; mientras en el grupo tratado con finasteride encontraron un riesgo moderado para el desarrollo al cáncer con Gleason<7 en pacientes con E2 elevado | 16 |
| Salonia et al. | 2011 | Los niveles de E2 en suero≤50pg/mL se observaron en la mayoría de los pacientes con cáncer. Sin embargo, los que tenían niveles>50pg/mL tuvieron 3.24 más posibilidad de riesgo de carcinoma de alto grado. Concluyeron que los niveles de E2 en suero sirven como un marcador predictivo independiente del tumor de alto grado | 15 |
| Salonia et al. | 2012 | Estudio de cohorte, donde los pacientes con cáncer de alto riesgo mostraron bajos niveles de T, E2 y la razón T:E2 (todos p≤0.02) y estos niveles se asociaron en análisis univariado con el riesgo al cáncer de alto grado (todos p≤0.006). | 5 |
| Tsilidis et al. | 2012 | Estudio de cohorte que no encontró asociación entre los niveles de E2, T y el riesgo al cáncer de próstata | 39 |
| Abd Elmageed et al. | 2013 | En pacientes con cáncer encontraron correlación entre los niveles elevados E2 en suero y el alto grado de Gleason (p=0.043) y estos son significativamente superiores en descendientes de afroamericanos en comparación con los descendientes de caucásicos | 12 |
| Qin et al. | 2013 | La recuperación de los niveles de E2 y el incremento en la razón T:E2 se asoció con el riesgo al fallo de la terapia de bloqueo androgénico, en especial en pacientes resistentes a la castración (p<0.001) | 6 |
| Usuro et al. | 2015 | Los pacientes con cáncer africanos tienen niveles de E2 más elevados que los de HPB o controles (p<0.05), ellos además exhibieron los niveles más bajos de la razón T:E2. Se observó una fuerte asociación entre los niveles de E2 y el riesgo a enfermedad prostática (cáncer e HPB) | 17 |
E2:estradiol; HPB: hiperplasia prostática benigna; T: testosterona; T:E2: razón testosterona:estradiol.
Por otra parte, los estudios aleatorizados grandes y los metaanálisis no encontraron asociación con el riesgo para el cáncer16,36–38 (tabla 2). Estos últimos tienen como talón de Aquiles que no se tomaron en cuenta las variaciones diurnas (ciclo circadiano) de estas hormonas al realizar la toma de sangre, la cual fue a diferentes tiempos en el día39, lo que pudo influir en los resultados negativos.
También se plantea que las divergencias en las conclusiones de los estudios epidemiológicos se deben en parte a que los tejidos prostáticos tienen la habilidad de producir de manera intracrina los esteroides a partir de andrógenos40. En los tejidos transformados, la aromatasa (CYP19) se comienza a expresar en las células epiteliales y no en las estromales, con una inducción en su producción en estos tejidos. Esto conlleva al rango alterado de T-E2, el cual se asoció a la transformación maligna19,22. También, la expresión de la isoenzima CYP19A1 es 30 veces más elevada en los tejidos metastásicos, comparada con los tumores primarios41.
Teoría del efecto genotóxico directo del estradiol en la glándula prostáticaSe ha sugerido que los estrógenos poseen un efecto genotóxico sobre la próstata. El mecanismo propuesto es la conversión de los estrógenos a catecol-estrógenos, que es una hidroxilación mediada por las enzimas (CYP1A1 y CYP1B1). Hasta que ellos no se detoxifican, estos catecol-estrógenos pueden desarrollar un proceso de oxidación-reducción, que contribuye a la formación de especies reactivas del oxígeno causando el daño al ADN y contribuyen a la peroxidación lipídica y a la formación de metabolitos intermediarios que directamente forman un complejo molecular con el ADN, conduciendo a la mutagénesis42. Los tejidos prostáticos humanos que expresan elevadas cantidades de la isoenzima CYP1B1, son los más propensos a presentar cáncer43. Además, se conoce que esta variante está más expresada en los tejidos prostáticos de la zona periférica, donde se desarrollan el mayor número de los tumores. Asimismo, en pacientes con cáncer de próstata existe un incremento del rango estrógenos-aductos del ADN y metabolitos conjugados, los que promueven la iniciación del cáncer44.
Tomando a consideración toda esta información, tenemos una noción de cómo los metabolitos estrogénicos pueden ser agentes genotóxicos y de esta forma contribuir a la carcinogénesis prostática.
HiperprolactinemiaLa acción directa de la PRL en el cáncer de próstata es controvertida, ya que los niveles en sangre de esta hormona no se relacionan con el incremento para el riesgo al cáncer de próstata45. Aunque, en estudios in vitro se demostró que existe un incremento en la señal de la PRL intraprostática a través de su receptor21 y de la activación mediada por este, que se asoció con el riesgo al cáncer de próstata21.
En un modelo de carcinogénesis inducida desarrollado en rata, con administración exógena de T y E2, se observó que la mayoría de los cambios en la expresión génica fueron atribuidos a la hiperprolactinemia inducida solo por el E221. Además, Dagvadorj et al. demostraron que en pacientes con cáncer de próstata la señal inducida por la PRL es un factor fundamental en la transformación neoplásica46. Todos estos hallazgos enfatizan que son los niveles de PRL locales y no los plasmáticos los más significativos en la carcinogénesis prostática.
Cambios mediados por el receptor de estrógenos y la desregulación hormonalRicke et al. demostraron en un ratón deficiente de la expresión REa (ratón ERαKO) que el tratamiento con T y E2 no inducía lesiones intraepiteliales de alto grado, ni cáncer de próstata; mientras que el ratón deficiente de la expresión del REb (ratón ERβKO) mostró un comportamiento similar al ratón normal, por lo que sí desarrolló tumor9. Un estudio similar pero en ratas, demostró que la T por sí sola no es suficiente para el desarrollo de lesiones intraepiteliales de alto grado, que solo se desarrollaban con el tratamiento con agonistas del REa y no con agonistas para REb47. En tejido prostático humano el REa se detecta en el tejido epitelial de las lesiones intraepiteliales de alto grado, cáncer y en el fenotipo hormono-refractario14,48, por lo que se relaciona con la proliferación celular y la supervivencia de la célula tumoral22.
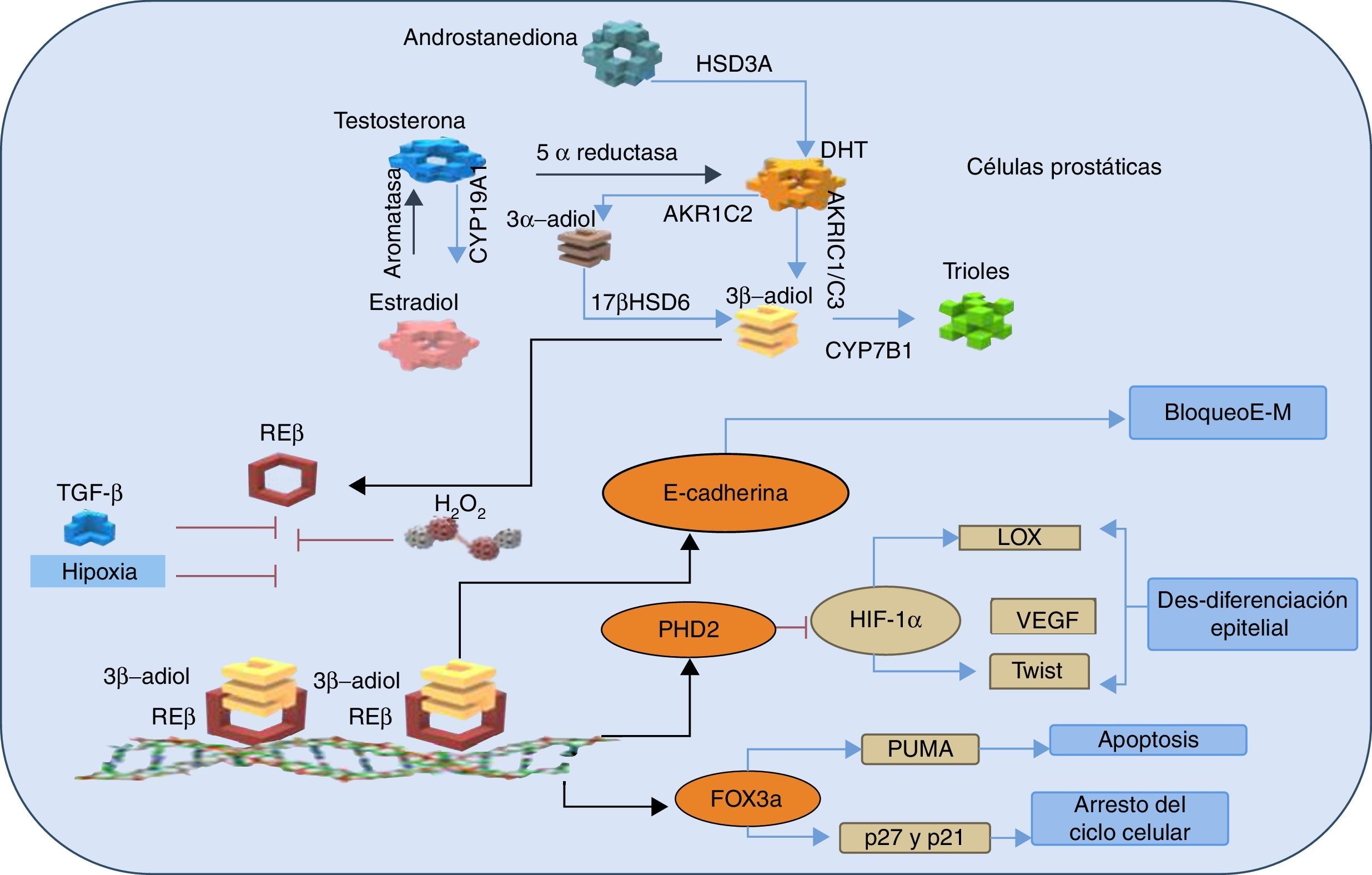
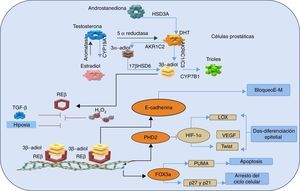
Se planteó entonces que el paradigma que rodea al papel de los RE en la próstata es precisamente que el REa es procarcinogénico como discutimos arriba; mientras, que el efecto del REb es predominantemente protector, anticarcinogénico, proapoptótico22 y previene la invasión del cáncer, ya que evita la transición de tejido epitelial a mesenquimal26,49 (fig. 2).
Representación esquemática de las vías antitumorales mediadas REβ, ante la síntesis intratumoral de andrógenos y estrógenos.
La dihidrotestosterona (DHT) se produce a partir de la androstanediona y así la DHT es suficiente para activar al receptor de andrógenos (síntesis de novo). Esto ocurre gracias a la acción de la enzima hidroxiesteroide deshidrogenasa (HSD3A). La aromatasa convierte el estradiol en testosterona, que se convierte a su vez en DHT por la acción de la 5 α-reductasa. La DHT se metaboliza a 3β-adiol de 2 maneras; se produce la reducción de 3-ceto de DHT a 3 β-adiol, por las enzimas de la familia aldo-ceto reductasas AKR1C1 (o AKR1C3) o, alternativamente, la reducción de 3-ceto de DHT a 3 α-adiol por AKR1C2 seguido de la transformación del 3-ceto3α- a 3β-, gracias a la acción de la enzima hidroxiesteroide deshidrogenasa B17b (17βHSD6). Sin importar su origen, el 3β-adiol se metaboliza a trioles por la citocromo (CYP7B1). Los 3β-adiol se convierten en el sustrato del receptor de estrógenos β (REβ), el cual se une a su sustrato y se dimeriza, y se trasloca al núcleo para unirse a sus elementos de respuesta en el ADN. Después de la dimerización del receptor, REβ aumenta la expresión de E-cadherina, una proteína que mantiene la integridad del epitelio mediante el bloqueo de la transición de tejido epitelial a mesenquimal (E-M). Además, REβ regula positivamente la transcripción de PHD2 y Fox3α. A su vez, PHD2 marca al factor inducible de hipoxia (HIF-1α) para su destrucción, lo que resulta en la supresión de los genes oncogénicos de la lisil oxidasa (LOX), el factor de crecimiento del endotelio vascular (VEGF) y la proteína Twist. Por lo tanto, esta acción previene la desdiferenciación epitelial, la invasión y las metástasis. REβ a través de Fox3α, induce la apoptosis por el factor proapoptótico (PUMA) y la regulación positiva de las proteínas reguladoras del ciclo celular p21 y p27. Los efectos del REβ antitumorales son inhibidos por el estrés oxidativo y las señales paracrinas incluyendo la señalización del factor de crecimiento transformante (TGF-β) y la hipoxia. Adaptada de Christoforou et al.49.
Se observó que existe una disminución del REb en las células prostáticas que están sujetas a una transformación neoplásica y que desarrollaron cáncer de alto grado, lo que apoya la idea del papel supresor de este receptor26. Además se demostró que el ligando específico para este receptor (el 5α-androstane-3β,17β-diol [3β-adiol)) puede suprimir la transformación del tejido epitelial en el mesenquimal inducido por el factor de crecimiento transformante β o por la hipoxia, por lo que las células mantienen su fenotipo epitelial en el cáncer de próstata27,50 (fig. 2). Además, existió un efecto inhibitorio del REb sobre la activación de la angiogénesis, ya que inhibió la transactivación del receptor de andrógenos, por lo que se plantea que actúan como corregulador de este (fig. 2)49. Esta interacción hace que disminuya el tamaño tumoral y la concentración del antígeno prostático específico27.
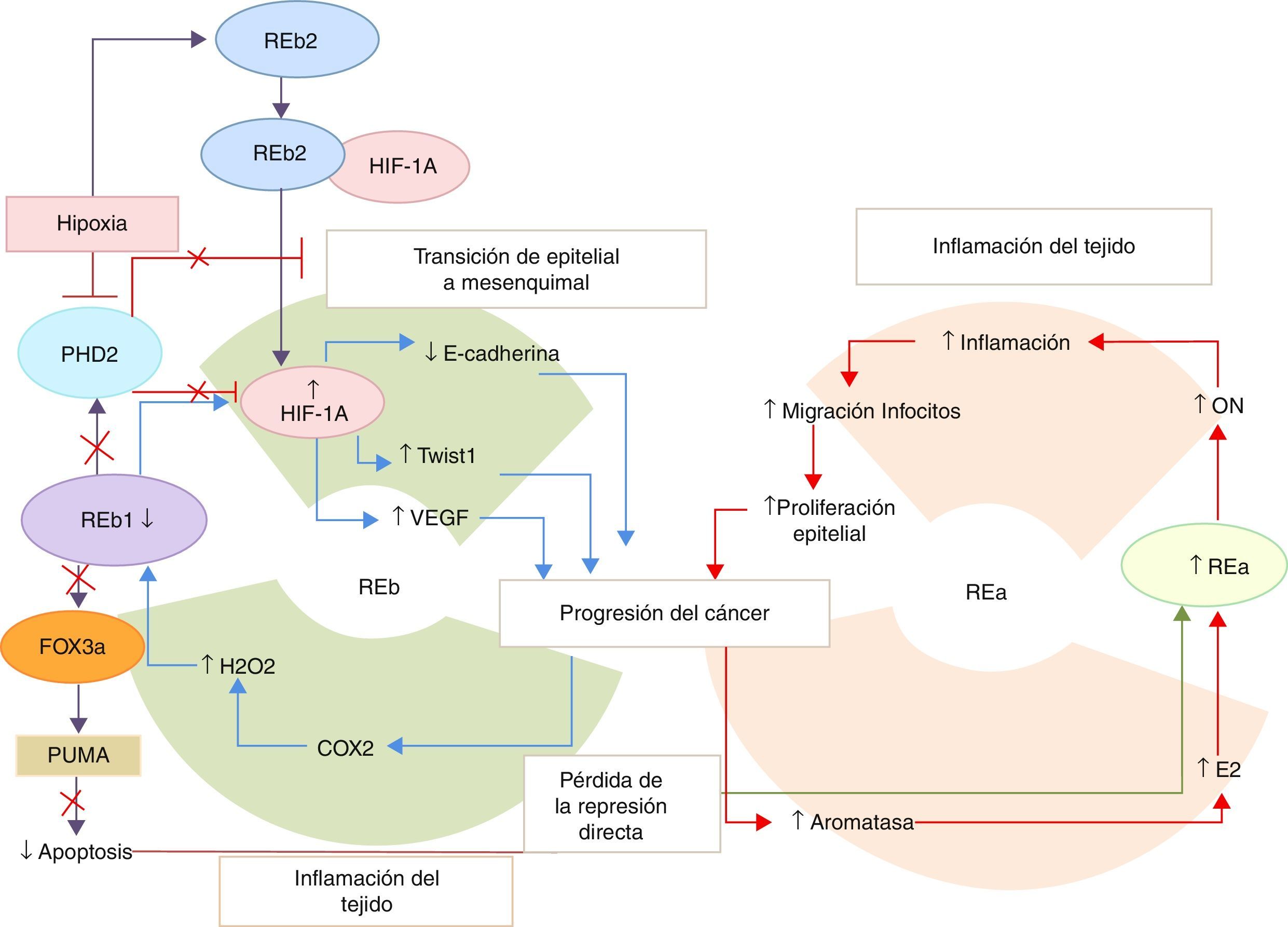
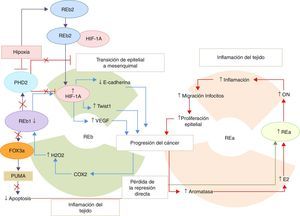
Sin embargo, existen evidencias de la presencia del REb en hueso y ganglios mestastásicos51. Asimismo, las isoformas del REb (REb2 y REb5), correlacionan con el mal pronóstico27. Además, el REb1 también actúa como oncogén en células hormono-refractarias que tienen niveles de castración de T y bajo tratamiento de E2. Esto demuestra que existe un mecanismo por el cual los estrógenos facilitan la proliferación en este tipo de células, lo que posiblemente medie el cambio de hormono-sensible a hormo-refractario27, ya que contribuyen a la proliferación tumoral, a través de favorecer la transición del tejido epitelial al mesenquimal en colaboración con el REa52 (fig. 3). Por lo tanto, existe un cambio en el paradigma convencional del mecanismo mediado por los RE sobre el cáncer de próstata, que será ampliamente discutido en la segunda parte de esta revisión.
Representación de los eventos que conducen a la progresión del cáncer de próstata.
Existe un lazo de retroalimentación positiva proinflamatorio para la progresión del cáncer de próstata, centrado en la función del receptor de estrógeno α (REa) y los receptores de estrógenos β 1 (REb1) y β 2 (REb2). En respuesta a la inflamación del tejido, existe una disminución de la expresión del REb1 y se regulan de manera positiva los genes involucrados en la transición del tejido epitelial al mesenquimal (TEM), los que conducen a las metástasis del cáncer de próstata. Además, la inflamación de los tejidos conlleva a una mayor expresión de la aromatasa y al aumento de la infiltración de las células epiteliales inflamatorias. La disminución de la transcripción de los genes del REb1 también puede deberse al incremento en los niveles de estradiol que estimula la expresión de los genes del REa.
En la figura 2 se representó el papel protector del REb1, ya que induce la apoptosis e inhibe la TEM, gracias a la regulación positiva del PHD2. Esta proteína suprime los niveles del HIF-1a, inhibiendo las vías relacionadas con él. Sin embargo, ante un estímulo de hipoxia se inhibe la expresión del PHD2 y por ende las funciones de este. Conjuntamente con este evento existe un corte y empalme diferencial en los genes del REb que hace que se incremente la expresión del REb2, el cual se une al HIF-1a y lo estabiliza evitando así su hidroxilación y degradación. De esta forma, el REb2 contribuye a la TEM y a la progresión del cáncer de próstata.
COX2: ciclooxigenasa-2; E2: estradiol; Fox3a: forkhead box; HIF-1a: factor inducible de hipoxia; H2O2: peróxido de hidrógeno; ON: óxido nítrico; PHD2: dominio 2 de la prolil-hidroxilasa; PUMA: factor proapoptótico; TWIST: factor transcripcional; VEGF: factor de crecimiento del endotelio vascular.
El conocimiento de la función de los estrógenos en la patogénesis, prevención y tratamiento del cáncer de próstata está en evolución. A través de los diferentes estudios que revisamos pudimos constatar que el papel de los andrógenos en la progresión del cáncer de próstata es solo una cara de la transformación maligna. En los estudios realizados in vitro y en animales, fuimos capaces de identificar una serie de mecanismos, en los que participan los estrógenos, potencialmente carcinogénicos, incluyendo la genotoxicidad directa, la hiperprolactinemia, la inflamación crónica y los cambios en el balance hormonal mediados por los receptores de estrógenos. Referente a estos últimos, pudimos comprobar cómo la activación del REa puede disminuir la producción de andrógenos, lo cual contribuye a largo plazo a la génesis de la HPB producto de la inflamación y al cáncer. Además, no debemos olvidar que existe una conversión de andrógenos en estrógeno, lo que provoca un desbalance en la proporción T-E2 favorable al desarrollo del cáncer prostático. También, encontramos evidencias de que el REb puede tener un efecto dual: protector contra el desarrollo del cáncer e inductor del cambio de hormono-sensible a hormono-refractario. Esto explica los resultados discordantes en los estudios epidemiológicos, para probar la relación entre los estrógenos y el riesgo al cáncer prostático.
La limitación principal de esta revisión estuvo dada por el número reducido de bases de datos consultadas, debido al bajo nivel de acceso a la información científica.
No obstante, consideramos que se deben desarrollar un mayor número de investigaciones, sobre todo epidemiológicas con diseños más consistentes que propicien estudiar la relación compleja y multifactorial entre los estrógenos, andrógenos y el desarrollo del cáncer de próstata.
FinanciaciónLos autores no recibieron ningún patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
A la Dra. Regla Cañas y a la MsC. Elizabeth Cuétara, por ayudarnos en la revisión del artículo.