Se revisa la posible participación de las interneuronas en los mecanismos de acción de la neuromodulación por electroestimulación del nervio tibial posterior para tratamiento del síndrome de vejiga hiperactiva. Se incluye una breve revisión de la neurofisiología del tracto urinario inferior, del síndrome de vejiga hiperactiva, de las diferentes técnicas de neuromodulación para el tracto urinario bajo y de la participación de las interneuronas en el ciclo continencia-vaciamiento vesical. Se concluye que el potencial antidrómico generado por la electroestimulación para la neuromodulación, específicamente la electroestimulación del nervio tibial posterior, tiene efecto inhibitorio en el detrusor a través de las interneuronas medulares y que los cambios medulares (cambios en la expresión génica, neuropéptidos, entre otros) pueden prolongar su efecto, teniendo una sinergia de inhibición por los cambios plásticos supramedulares, también ocasionados vía interneuronas. La plasticidad del sistema nervioso central podría explicar el efecto crónico de la electroestimulación del nervio tibial posterior y de otras técnicas de neuroelectroestimulación para el tratamiento de la vejiga hiperactiva.
The possible participation of interneurons in the mechanisms of action of neuromodulation through posterior tibial nerve stimulation for the treatment of overactive bladder syndrome is reviewed. A brief review of the neurophysiology of the lower urinary tract, overactive bladder syndrome, the different neuromodulation techniques for the lower urinary tract, and the participation of the interneurons in the storage-voiding cycle of the bladder are included. We conclude that the antidromic action potential generated by the electrical stimulation for neuromodulation, specifically posterior tibial nerve stimulation, has an inhibitory effect on the detrusor muscle through the spinal interneurons and that the medullary changes (in gene expression and neuropeptides, among others) can prolong its effect. A synergistic inhibition is the result of supraspinal plastic changes, also occurring via the interneurons. Central nervous system plasticity could explain the chronic effect of posterior tibial nerve stimulation and other electrical neurostimulation techniques for the treatment of overactive bladder.
El circuito nervioso que controla la micción madura en el periodo posnatal, de manera que la vejiga no inhibida de la infancia desaparece con el paso del tiempo, al madurar el sistema nervioso central y su complejo sistema continencia-micción, facilitando la vida social1,2. Las características del ciclo llenado-vaciamiento vesical pueden variar a lo largo de la vida de un individuo, por factores biológicos o patológicos3–5. Tanto los procesos degenerativos asociados al envejecimiento6,7 como las enfermedades y lesiones del sistema nervioso en el adulto pueden causar reaparición de las micciones involuntarias, llegando con frecuencia a la incontinencia urinaria1,2. El síndrome de vejiga hiperactiva (SVH) ha sido definido por la Sociedad Internacional de Continencia como urgencia urinaria, habitualmente con frecuencia urinaria y nicturia, con o sin incontinencia urinaria de urgencia, en ausencia de infección o cualquier otra enfermedad obvia8,9. El SVH es un problema de salud con una prevalencia elevada que incapacita a quien lo padece para la vida diaria, es una condición médica crónica que altera de manera significativa la calidad de vida de los pacientes10,11.
La primera línea de tratamiento para esta disfunción miccional es la rehabilitación por reentrenamiento de los músculos del piso pélvico12 y el reentrenamiento vesical13.
La segunda línea de tratamiento, los medicamentos agonistas β3-adrenérgicos y antimuscarínicos13, son la forma de tratamiento más utilizada, sin embargo, provocan numerosos efectos adversos14,15 que impiden su uso debido a enfermedades concomitantes o por el peligro de efectos adversos devastadores. Se han reportado efectos adversos como la sequedad de mucosas, trastornos gástricos, estreñimiento, retención urinaria, visión borrosa, glaucoma y taquicardia, entre otros13. Otras desventajas del uso de medicamentos son su costo elevado y empleo crónico. No se recomienda su uso en pacientes debilitados o con fragilidad13,15.
La tercera línea de tratamiento del SVH incluye el uso de onabotulinum toxina A por inyección intradetrusor, electroestimulación del nervio tibial posterior (ENTP) y neuromodulación sacra13,15. La inyección intradetrusor de la onabotulinum toxina A (100 unidades) ha sido ampliamente utilizada para el control sintomático del SVH14,16. Se trata de una toxina producida por la bacteria Clostridium botulinum que tiene 7 subtipos, de ellos el subtipo A, que tiene mayor duración de acción, es clínicamente más relevante. De las 3 formas comerciales abobotulinum toxina A, incobobotulinum toxina A, la onabotulinum toxina A tiene mayor potencia. El mecanismo de acción incluye la escisión de las proteínas de unión involucradas en el mecanismo de fusión de las vesículas sinápticas a la membrana del citoplasma, necesaria para la liberación del neurotransmisor. Las proteínas de unión (el complejo SNARE) incluye SNAP25, sinaptobrevina (proteína de membrana asociada a vesícula) y sintaxina. La onabotulinum toxina A escinde el SNAP25, representando al complejo SNARE inactivo. En el músculo estriado, se produce parálisis por inhibición de la liberación de acetilcolina desde las terminaciones nerviosas motoras colinérgicas. En la vejiga humana se ha demostrado expresión de SNAP25 en las fibras parasimpáticas, simpáticas y fibras sensoriales. El bloqueo de la liberación de acetilcolina desempeña un papel esencial en la hipocontractilidad o en la acontractilidad del detrusor que sigue a la inyección de onabotulinum toxina A en la vejiga. Aproximadamente la mitad de las fibras sensoriales peptidérgicas vesicales expresan SNAP25 y son afectadas por la onabotulinum toxina A, de tal manera que puede inhibir la liberación desde las fibras sensoriales del sistema nervioso central y periférico, y se ha encontrado que reduce el disparo de las aferentes vesicales y la liberación antidrómica de neuropéptidos14. Aunque no se ha observado inmunorreactividad a SNAP25 en las células uroteliales, su función se modifica después de la inyección de onabotulinum toxina A, se ha demostrado que inhibe la liberación urotelial de ATP, al disminuir la expresión de receptores para ATP, el receptor P2X3, así como del receptor de capsaicina el receptor TRPV114,16,17. Las desventajas incluyen elevado costo, duración del efecto de solo 6 meses y retención de orina posterior a la inyección.
NeuromodulaciónLa neuromodulación ha mostrado resultados alentadores con escasos o nulos efectos adversos, por lo que ha sido una modalidad terapéutica ampliamente aceptada en la actualidad15. Dependiendo de la técnica empleada se han observado efectos duraderos a largo plazo18,19 como el caso de la ENTP, donde se ha observado una duración del efecto hasta de 24 meses, especialmente en la frecuencia urinaria y la nicturia15,20.
La neuromodulación es una propiedad del sistema nervioso para regular o modificar los impulsos eléctricos que fluyen a través del tejido nervioso, excitándolos o inhibiéndolos21. El mecanismo de acción de la neuromodulación no ha sido entendido del todo, sin embargo su acción ha sido ubicada en las diferentes vías ascendentes/descendentes y las regiones supraespinales, afecta especialmente las áreas de actividad de aprendizaje, y el efecto crónico de la neuromodulación puede resultar en plasticidad del sistema nervioso central con efectos clínicos aun después de la desactivación de la neuromodulación22. Ingersoll y Jones, en 1957, analizaron el efecto de la estimulación nerviosa sobre la actividad vesical de animales de laboratorio; Stenberg en 1967 reporta los primeros casos de pacientes tratados con electroestimulación. Hoy día existen diferentes dispositivos y técnicas de neuromodulación eléctrica de órganos pélvicos para el tratamiento de disfunciones urinarias femeninas. Para inducir la micción en pacientes con problemas de vaciamiento vesical la corriente eléctrica se aplica directamente a la vejiga urinaria; al urotelio (electroestimulación intravesical) o al músculo detrusor (electroestimulación vesical). La corriente eléctrica provoca una sensación miccional urgente, contracción del detrusor y micción espontánea18. Para tratar a pacientes con incontinencia urinaria asociada a vejiga hiperactiva se realiza estimulación eléctrica transvaginal desde 1977; después se desarrollaron otras técnicas como la electroestimulación del clítoris, de raíces sacras y del nervio tibial posterior18: En la electroestimulación transvaginal la corriente eléctrica activa las neuronas sensoriales del nervio pudendo, las cuales a nivel central hacen sinapsis con circuitos que inhiben al detrusor y activan las neuronas simpáticas inhibitorias del hipogástrico. La electroestimulación del clítoris inhibe la contracción vesical sin afectar la presión vesical, por lo que se presume que con esta técnica se estimula el sistema simpático β-adrenérgico, o las interneuronas espinales que liberan neurotransmisores inhibitorios como encefalina, glicina o ácido gama-amino-butírico18, la principal desventaja de esta técnica es que requiere de elevados niveles de intensidad de electroestimulación, produciendo incomodidad y en ocasiones dolor. La electroestimulación de raíces sacras requiere de la implantación quirúrgica de electrodos de aguja en el foramen sacro 3, y de un estimulador subcutáneo, que al ser activado inhibe circuitos espinales y supraespinales involucrados en el reflejo de la micción18,22,23. La neuromodulación sacra requiere un dispositivo especial y un procedimiento quirúrgico costosos, mientras otras de las técnicas descritas han mostrado un efecto positivo en pacientes con vejiga hiperactiva a un costo menor.
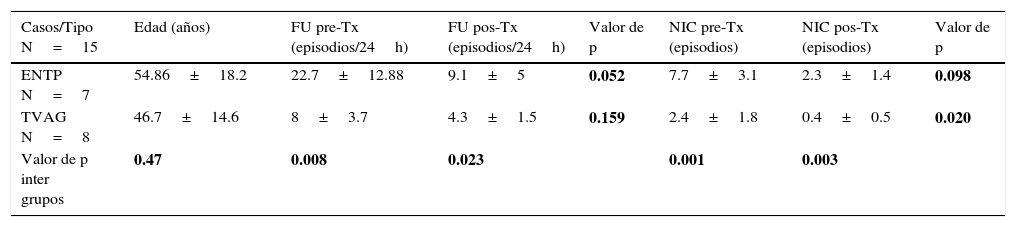
La ENTP es una técnica alternativa que ha mostrado también ser efectiva como terapia de continencia urinaria en pacientes con vejiga hiperactiva. Descrita por McGuire et al. en 1983, quienes estudiando electroestimulación en primates con sección medular observaron que estimulación del nervio tibial provocó inhibición del detrusor, después aplicaron esta técnica en enfermos neurológicos con hiperactividad del detrusor con buenos resultados24. Se ha observado su efecto inmediato inhibiendo el detrusor y elevando el umbral del primer deseo miccional desde 145.2cc hasta 244.7cc, mientras la capacidad vesical se elevó desde 204.8cc hasta 301.2cc durante la neuro-stimulación y urodinamia simultáneas6. Este nervio contiene fibras mixtas sensitivomotoras que se originan en los segmentos espinales L5-S3, que son los mismos segmentos espinales de la innervación parasimpática de la vejiga25. El efecto de este tratamiento sobre la continencia urinaria ha sido positivo, con una mejoría objetiva del 60.6% (IC 95%, 49.2-74.7)26. Se ha reportado duración del efecto hasta de 24 meses, especialmente en la frecuencia urinaria y la nicturia20. Al comparar el efecto de la ENTP con antimuscarínicos no se observaron diferencias estadísticamente significativas en el control de los síntomas, pero sí en la satisfacción y efectos curativos reportados mejores en la ENTP, que además tiene efectos adversos prácticamente nulos27; sin embargo no se conoce su mecanismo de acción y el protocolo de tratamiento no ha sido estandarizado. Nuestro grupo ha trabajado casos con electroestimulación transvaginal y del nervio tibial posterior; aquí reportamos 15 casos de mujeres con hiperactividad del detrusor tratadas durante el año 2015 en nuestro centro con estas técnicas y mostramos el efecto en 2 variables representativas(tabla 1). No se encontró diferencia estadísticamente significativa en la edad entre ambos grupos, las pacientes del grupo de ENTP fueron más sintomáticas. En ambos grupos, el efecto de la neuromodulación para inhibir el detrusor fue notable, pero en el grupo de ENTP fue estadísticamente significativo para el control de la frecuencia urinaria, con reducción de 22.7±12.88 micciones en 24h hasta 9.1±5 micciones (p=0.052), mientras que la electroestimulación vaginal fue más eficaz para controlar la nicturia al reducir de 2.4±1.8 micciones por noche a 0.4±0.5 micciones por noche (p=0.020).
Reporte de 15 mujeres tratadas con 2 diferentes técnicas de neuromodulación para disfunción miccional
| Casos/Tipo N=15 | Edad (años) | FU pre-Tx (episodios/24h) | FU pos-Tx (episodios/24h) | Valor de p | NIC pre-Tx (episodios) | NIC pos-Tx (episodios) | Valor de p |
|---|---|---|---|---|---|---|---|
| ENTP N=7 | 54.86±18.2 | 22.7±12.88 | 9.1±5 | 0.052 | 7.7±3.1 | 2.3±1.4 | 0.098 |
| TVAG N=8 | 46.7±14.6 | 8±3.7 | 4.3±1.5 | 0.159 | 2.4±1.8 | 0.4±0.5 | 0.020 |
| Valor de p inter grupos | 0.47 | 0.008 | 0.023 | 0.001 | 0.003 |
ENTP: electroestimulación del nervio tibial posterior; FU: frecuencia urinaria; N: número; NIC: nicturia; TVAG: electroestimulación transvaginal; Tx: tratamiento.
Los valores representan las medias de la variables.
Analizado por T-test con un 95% de IC.
Finazzi-Agro et al. han demostrado respuesta de la corteza cerebral a la ENTP28. Estudios en ratas han mostrado (Chang et al.29) que la instilación intravesical de ácido acético al 1% provoca la expresión del protooncogene c-fos, que es uno de los 50 a 100 genes inmediatos tempranos que se codifican cuando las neuronas reciben estímulos nocivos. La proteína fos es un componente, en los mamíferos, del factor activador de transcripción de proteína-1 (AP-1), el cual regula la expresión génica y los cambios desarrollados a largo plazo en la célula nerviosa. El marcado inmunohistoquímico con anticuerpos anti c-fos puede usarse para identificar neuronas activadas en la médula espinal. Chang demostró que la ENTP en ratas disminuyó la expresión de c-fos en el centro espinal de la micción29.
Existen estudios, en animales y seres humanos, que analizan los sitios cerebrales activados durante el ciclo miccional o durante la neuroelectroestimulación. Algunos de ellos han usado tomografía de emisión de positrones30, resonancia magnética funcional31–33, espectroscopia funcional cercana-infrarrojo34 o electroencefalogramas con potenciales evocados somatosensoriales para caracterizar los sitios cerebrales que se activan en la micción normal, así como los cambios neurofuncionales en pacientes con disfunción miccional o el efecto de la neuromodulación eléctrica23. Con estas técnicas se ha demostrado la duración del efecto en los centros supraespinales hasta 24h después de suspender la ENTP28.
Similitudes anatómicas y funcionales del sistema nervioso autónomo y somáticoLa vejiga, el esfínter uretral interno, el rabdoesfínter, y el piso pélvico se afectan recíprocamente, inhibiéndose o estimulándose, e interactuando con otros músculos como los del tronco y músculos respiratorios, teniendo influencia en los cambios posturales y la presión intraabdominal, para lograr la continencia y vaciamiento vesical35–37. La semejanzas en estructura y función del sistema nervioso autónomo y el somático a nivel lumbosacro y su interacción funcional pueden explicar en parte el efecto de la neuromodulación por ENTP para el control de la hiperactividad del detrusor:
Inervación autónomaLa inervación de la vejiga humana involucra múltiples nervios mixtos como el nervio pélvico (parasimpático sacro), el nervio hipogástrico (simpático toracolumbar) y la cadena simpática, además del nervio pudendo (somático sacro)2,6. El principal impulso excitatorio de la vejiga es del parasimpático sacro (S2-S4). Las neuronas preganglionares de la columna intermedio-lateral o núcleo parasimpático sacro38 (láminas v y vii) de la sustancia gris de la médula espinal sacra, envían axones a través de los nervios pélvicos hacia las neuronas ganglionares del plexo pélvico y de la pared vesical. A su vez, las células ganglionares envían un impulso del tipo colinérgico muscarínico, provocando contracción del músculo detrusor y un impulso nitraérgico, originando liberación de oxido nítrico que causa inhibición del músculo liso uretral39. Las neuronas sensoriales parasimpáticas se encuentran en los ganglios de las raíces dorsales de los segmentos espinales sacros S2, S3 y S4. El impulso inhibitorio al domo del detrusor vesical se debe al simpático toracolumbar (T11,T12,L1 y L2) que envía un impulso adrenérgico (noradrenalina) estimulando receptores β3. Las neuronas preganglionares del asta lateral (columna lateral) de la sustancia gris de la médula toracolumbar viajan al tracto urinario inferior por medio de la cadena ganglionar simpática lumbosacra así como por el ganglio mesentérico inferior a través de los nervios pélvico e hipogástrico40. También envían impulso excitatorio al cuello y base vesical, estimulando receptores α1, así como impulso facilitatorio y/o inhibitorio en los ganglios parasimpáticos vesicales40,41. Las neuronas sensoriales simpáticas residen en los ganglios de las raíces dorsales de los segmentos medulares T11, T12 y L1.
Inervación somáticaEl impulso eferente somático del tracto urinario inferior es provisto por el nervio pudendo. Las neuronas motoras del nervio pudendo se localizan en el asta anterior en el núcleo somático de Onuf (núcleo ventromedial, lámina ix) en los segmentos sacros S2, S3 y S4, que inervan el piso pélvico, incluyendo el rabdoesfínter uretral a través de terminaciones colinérgicas que estimulan receptores nicotínicos en el esfínter uretral externo2,42. El tracto piramidal desde la corteza cerebral corre a través del funículo lateral de la médula espinal e inerva el esfínter uretral externo. Las vías descendentes desde la región-L corren a través del funículo ventral y del funículo lateral del lado opuesto, mientras que la vía desde el área pontina inhibitoria de la micción o formación reticular rostral del puente corre a través del funículo ventral43. Sus neuronas sensoriales se encuentran en los ganglios de las raíces dorsales, en los segmentos sacros S2, S3 y S4. El nervio tibial posterior es un nervio somático, la rama principal del nervio ciático, contiene fibras mixtas sensitivomotoras que se originan en los segmentos medulares L5-S3, que son los mismos segmentos espinales de la innervación parasimpática de la vejiga y del nervio pudendo25,44. Las neuronas motoras del nervio tibial posterior se encuentran en el asta anterior de la médula espinal de los segmentos medulares L5-S3, que reciben impulsos del sistema piramidal por medio de tracto corticoespinal lateral desde la pirámide del bulbo raquídeo donde se cruza y viaja en el funículo lateral de la médula espinal. El sistema piramidal también contiene fibras originadas en la franja de corteza sensitivomotora que rodea al surco central y que llegan a los núcleos gracilis y cuneatus, y después al asta posterior de la sustancia gris. A través de esta vía descendente la corteza facilita o inhibe la trasmisión de información de las neuronas sensitivas secundarias al tálamo y corteza sensorial.
Corpúsculos sensoriales (similitud funcional entre sistema nervioso autónomo y somático)Los paraganglios localizados en la pelvis humana de fetos y neonatos inducen la formación de terminaciones nerviosas sensoriales especializadas llamadas corpúsculos de Timofeew semejantes en morfología a los corpúsculos de Pacini42,45,46, y se mantienen juntas hasta la etapa neonatal, persistiendo en el adulto pero como estructuras separadas. Los corpúsculos de Timofeew proveen información aferente para el mecanismo de control sensorial vesical principalmente en el control mecanorreceptor, mientras que las células paraganglionares de la vejiga forman un sistema miniendocrino en la pared vesical correlacionado con la expresión de neuropéptidos. Se ha observado este complejo paraganglionar-corpúsculos principalmente en el tejido conectivo de la adventicia vesical más que en el detrusor45. Estudios en animales han mostrado que la fibra nerviosa de cada corpúsculo contiene sustancia P y péptido relacionado con el gen de la calcitonina que es consistente con las fibras nerviosas sensoriales, mientras que el hallazgo de que la fibra nerviosa central del corpúsculo de Timofeew presenta óxido nítrico sintetasa sugiere su papel en la transmisión aferente vesical45. Previamente se ha demostrado la inmunorreactividad a la óxido nítrico sintetasa en las neuronas aferentes de los ganglios de las raíces dorsales lumbosacras y el asta posterior de la médula espinal en varias especies47. En humanos se ha demostrado que la fibra nerviosa central de los corpúsculos de Timofeew es reactiva a neuropéptido Y y a tiroxina hidroxilasa, indicando su naturaleza catecolaminérgica relativa a su probable papel modulador como mecanorreceptor3,45. La velocidad de conducción de nervio pudendo (45m/s) es el doble que la del nervio pélvico (20m/s). Se ha encontrado que las aferentes del nervio pudendo y del nervio pélvico tienen diferentes propiedades receptoras46. Las aferentes del nervio pudendo responden al flujo de orina, algunos conectados a corpúsculos semejantes a Pacini (o de Timofeew) de las capas musculares uretrales y de porciones profundas de la mucosa uretral, que presentan un patrón de disparo de lenta adaptación, mientras las aferentes uretrales mielinizadas del nervio pélvico se conectan a receptores de adaptación rápida. De tal manera que las fibras mielinizadas A del nervio pudendo que inerva la uretra distal son de mayor tamaño que las fibras mielinizadas A y fibras C de la uretra proximal y la vejiga inervadas por el nervio pélvico46. La estimulación de las fibras aferentes somáticas en animales produce inhibición del detrusor. Mientras que la estimulación de las fibras A disminuye la contracción vesical en ratas, la estimulación de fibras C produce hiperactividad48. Es probable que las fibras A contenidas en las aferentes vesicales estén involucradas en la inhibición de la fibras pequeñas C, pues se ha observado que la neuromodulación sacra en ratas produce disminución de los neuropéptidos (sustancia P y neurocinina A) contenidos en las aferentes vesicales primarias de L648,49.
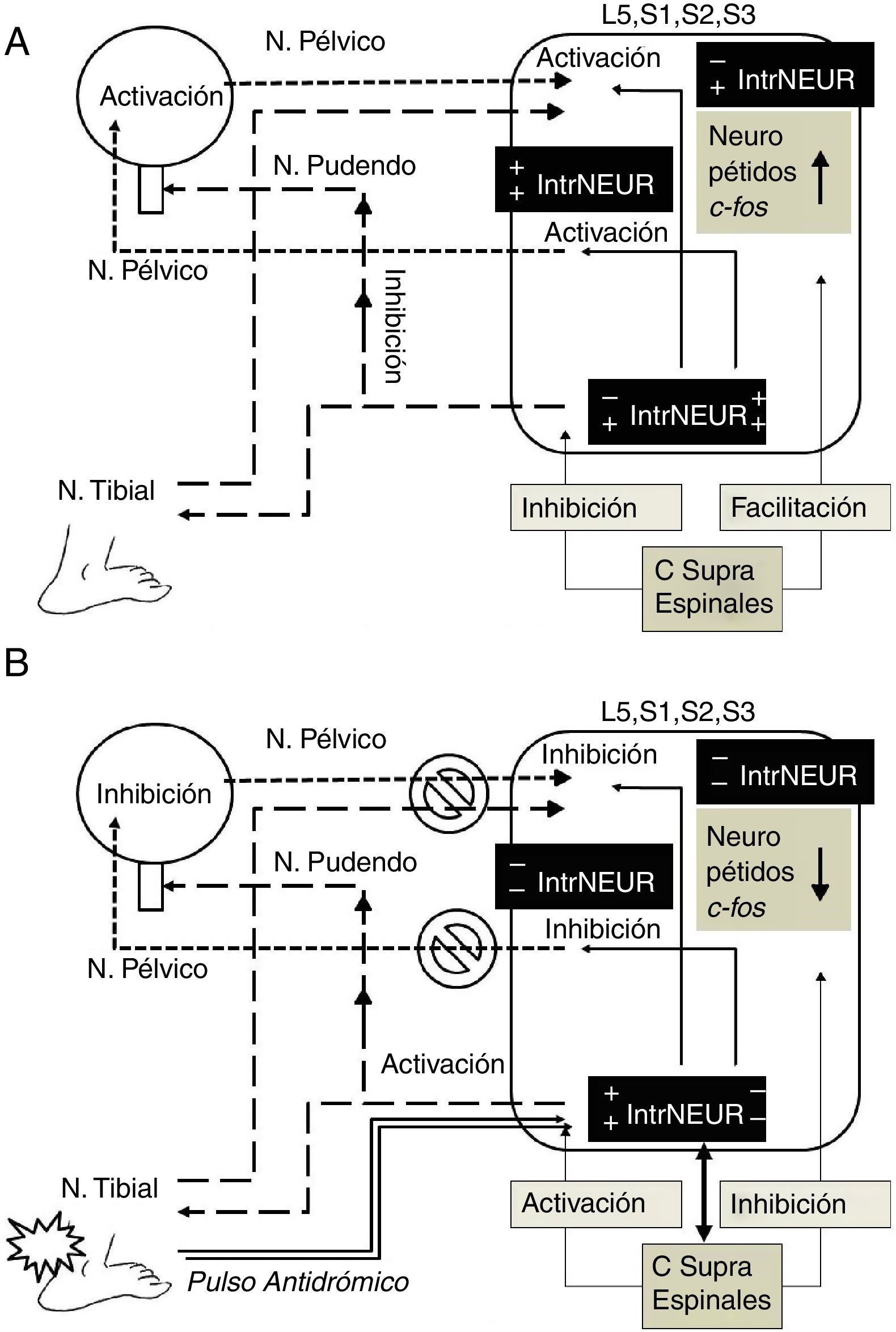
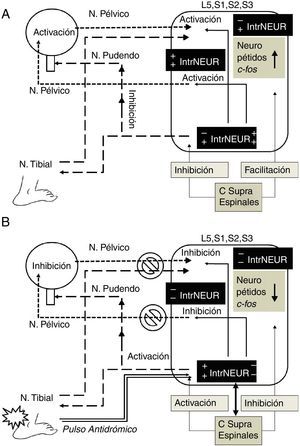
Papel de las interneuronasLa células de Renshaw son interneuronas medulares inhibitorias especializadas que reciben impulsos desde motoneuronas a través de brazos colaterales excitatorios. Las proyecciones desde las células de Renshaw hacia las motoneuronas completan el circuito recurrente de retroalimentación inhibitorio cuya principal función es la de «modulador de ganancia variable» para optimizar la contracción de un grupo específico de motoneuronas entre un amplia variedad de fuerzas50. La estimulación de las fibras preganglionares de las raíces ventrales sacras provoca un impulso antidrómico de inhibición recurrente de las neuronas parasimpáticas sacras mediante la activación sináptica de interneuronas parasimpáticas equivalentes a las células de Renshaw somáticas38. También se ha encontrado que el tallo cerebral modula el impulso simpático lumbar por medio de impulsos espinales hacia neuronas preganglionares simpáticas o a interneuronas medulares51. Estudios en ratas machos castradas han demostrado cambios tróficos en los núcleos motores, núcleos parasimpáticos, células gliales e interneuronas de los segmentos medulares relacionados con los músculos del piso pélvico, estructuras sexuales y vías urinarias, que se restablecen con el reemplazo hormonal, lo que demuestra la estrecha interrelación funcional de estas estructuras52. La irritación química del tracto urinario inferior en ratas provoca expresión del gen C-fos en neuronas lumbosacras que puede ser marcado por inmunorreactividad29. Se ha encontrado expresión de C-fos en el asta posterior lateral y medial superficial, en el núcleo parasimpático sacro y en la lámina x alrededor del canal central, así como en áreas supraespinales (hipotálamo y tallo cerebral) y en neuronas preganglionares e interneuronas medulares53,54. La electroestimulación del nervio pélvico provocó expresión de C-fos en numerosas neuronas aferentes de todos los órganos pélvicos29,53. Interneuronas de la comisura dorsal de la sustancia gris y del asta posterior han sido implicadas en la función del tracto urinario bajo52. Usando marcaje retrógrado con virus de seudorrabia se han identificado las interneuronas que intervienen en el ciclo continencia-vaciamiento por su efecto de inhibición-excitación-inhibición simpática-parasimpática. Por medio de interneuronas de L6-S1, la información aferente de la vejiga conecta con neuronas preganglionares parasimpáticas que proveen la inervación eferente vesical. Las terminales aferentes se localizaron en estrecha aposición a las interneuronas ubicadas dorsalmente a las neuronas preganglionares parasimpáticas marcadas retrógradamente55. Usando gangliectomía o rizotomía de L6-S1 se marcaron solo interneuronas pero no neuronas preganglionares parasimpáticas; estas interneuronas que reciben terminales aferentes de la vejiga, se proyectan también a neuronas preganglionares simpáticas en los segmentos L1-L256. Usando marcaje de receptores para factor neurotrópico de células gliales, se han identificado 3 diferentes tipos de fibras aferentes pélvicas, una fuera de la lámina ii, la vía lateral-colateral, asociada a interneuronas parasimpáticas y neuronas preganglionares parasimpáticas; la segunda solo dentro de la lámina ii; y la tercera dentro de la lámina i, alrededor de la vía lateral-colateral e interneuronas asociadas57. Todo lo anterior pone en evidencia la función de interconexión somática-autonómica y simpática-parasimpática de las interneuronas medulares. Esta evidencia apoya fuertemente el papel esencial de las interneuronas en los mecanismos de acción de la neuromodulación por electroestimulación de órganos pélvicos y del nervio tibial posterior como se observa en la figura 1.
Mecanismo de acción hipotético de la neuromodulación por electroestimulación del nervio tibial posterior. A. Activación por pulso ortodrómico. En la hiperactividad del detrusor el impulso aferente vesical y la activación del núcleo parasimpático sacro (N. pélvico) son facilitadas a nivel espinal por la elevación de neuropéptidos (sustancia P, neurocinina A, etc.) y de c-fos, así como por el efecto de los centros supraespinales (hipotálamo, tallo cerebral, etc.) a través de interneuronas semejantes a células de Renshaw (signos+en IntrNEUR), que también inhiben el núcleo somático de Onuf (N. pudendo) contribuyendo a la presencia de incontinencia de urgencia (signos−en IntrNEUR). B. Inhibición por pulso antidrómico de la electroestimulación del nervio tibial posterior. El pulso antidrómico bloquea la trasmisión aferente vesical e inhibe el pulso eferente del núcleo parasimpático sacro (signos−en IntrNEUR), activando a su vez el núcleo somático de Onuf hacia N. pudendo por medio de interneuronas (signos+en IntrNEUR), provocando disminución de neuropéptidos y c-fos. El pulso antidrómico a través del N. tibial, afecta también por vía de interneuronas, los centros supraespinales (flecha bidireccional), que a su vez inhiben al núcleo parasimpático sacro (signos−en IntrNEUR) hacia N. pélvico, provocando inhibición recurrente, posiblemente por neuroplasticidad espinal y supraespinal. C Supra Espinales: centros supraespinales; IntrNEUR: interneuronas; L5, S1, S2, S3: segmentos medulares involucrados en la neuromodulación..
El conocimiento actual del papel de las interneuronas en la interacción somática-autonómica en el sistema nervioso central hace pensar que el impulso antidrómico generado por la electroestimulación para la neuromodulación, específicamente la ENTP, tiene efecto inhibitorio en el detrusor a través de las interneuronas medulares y que los cambios medulares (cambios en la expresión génica, neuropéptidos, entre otros) pueden prolongar su efecto, teniendo una sinergia de inhibición por los cambios plásticos supramedulares, también ocasionados vía interneuronas. La plasticidad del sistema nervioso central podría explicar el efecto crónico de la ENTP y de otras técnicas de neuroelectroestimulación para el tratamiento de la vejiga hiperactiva.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.