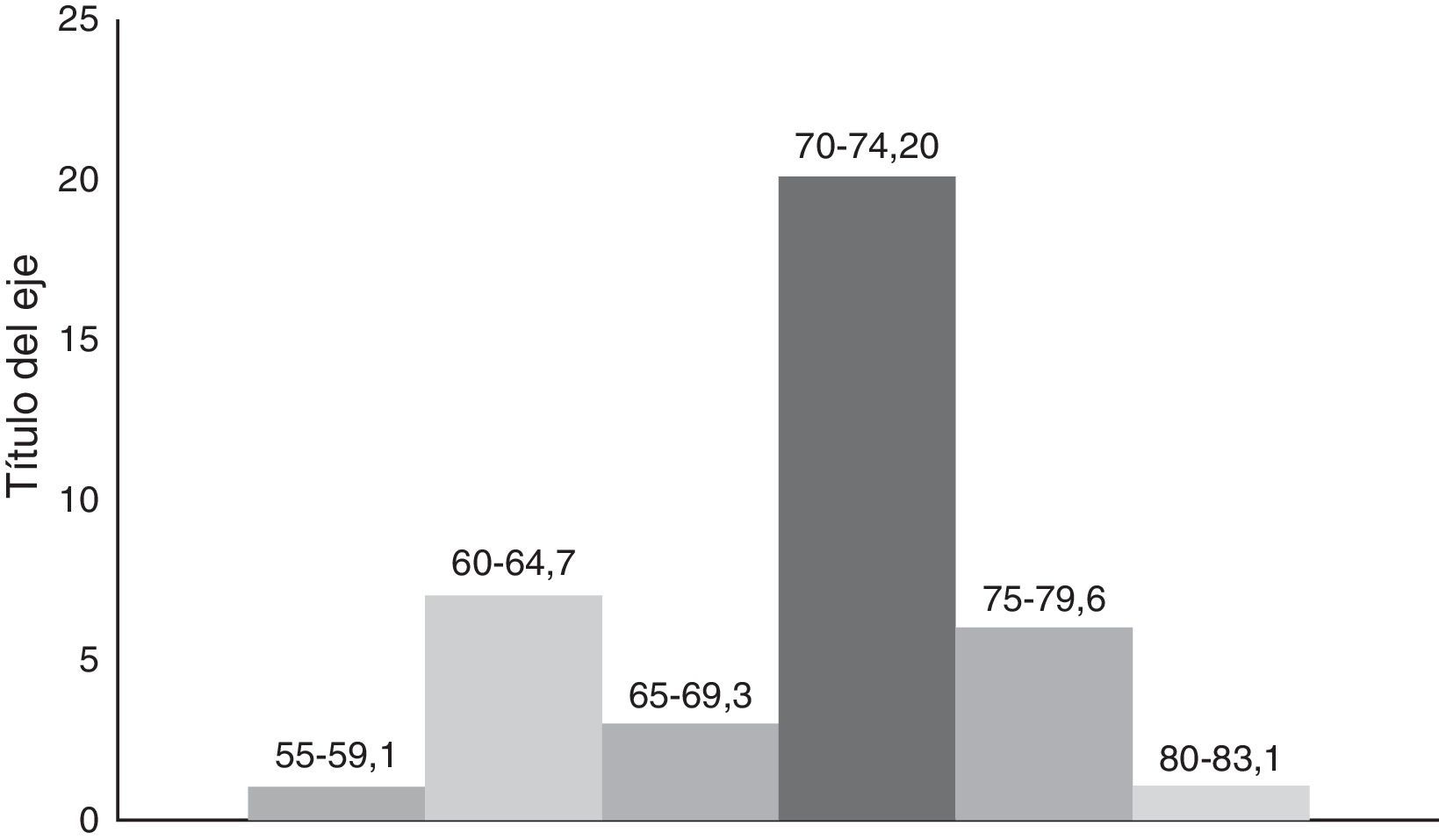En este trabajo se mencionan los cambios y evolución de la radioterapia para el tratamiento de cáncer de próstata en las últimas décadas con la aplicación de tecnología avanzada incorporando sistemas de imágenes y computadoras a los nuevos aceleradores lineales diseñados para aplicar altas dosis de radiación a la próstata y así disminuir en forma importante la toxicidad de los tejidos circunvecinos.
ObjetivosSe analizan algunos resultados de la literatura internacional, en donde han considerado aumentar las dosis de radiación con las técnicas de RTEC-3D y RTIM, mejorando así, la supervivencia libre de FBQ y supervivencia global sobre todo en pacientes con cáncer de próstata clínicamente localizado de riesgo intermedio y alto. Además de agregar a la radioterapia, tratamiento hormonal en forma neoadyuvante, concomitante y adyuvante.
Material y métodosSe presenta la experiencia personal de 38 pacientes tratados en la práctica privada de cáncer de próstata clínicamente localizado, con radioterapia externa y tratamiento hormonal, como tratamiento primario y de 46 pacientes con enfermedad PT3 posterior a prostatectomía radical quienes recibieron tratamiento adyuvante, radioterapia externa y tratamiento hormonal.
ResultadosAunque este estudio de investigación clínica incluye un número pequeño de pacientes constituye probablemente el primer y único informe en la literatura nacional sobre el empleo y beneficio del tratamiento combinado, radioterapia externa y tratamiento hormonal en el tratamiento primario del cáncer de próstata clínicamente localizado y en el tratamiento combinado adyuvante en los pacientes con enfermedad pT3 posterior a prostatectomía radical.
In this work the changes in and evolution of radiotherapy for the treatment of prostate cancer in the last decades are described. This includes the application of advanced technology that incorporates imaging and computer systems into the new linear accelerators designed to apply high doses of radiation to the prostate, significantly diminishing the toxicity to the surrounding tissues.
AimsResults found in the international literature are analyzed that consider increasing the radiation doses with the 3D-CRT and IMRT techniques, and in this manner improve biochemical failure-free survival and overall survival, especially in intermediate and high-risk patients with clinically localized prostate cancer, as well as adding radiotherapy and neoadjuvant, concomitant, and adjuvant hormone therapy.
Materials and methodsPresented herein is the personal experience that included 38 patients with clinically localized prostate cancer treated in private practice with external beam radiotherapy and hormone therapy as primary treatment, as well as the experience including 46 patients with pT3 disease after radical prostatectomy that received adjuvant treatments of radiotherapy and hormone therapy.
ResultsEven though this clinical study includes a small number of patients, to the best of our knowledge it is the first and only report in the national literature on the use and benefits of the combined treatment of external beam radiotherapy and hormone therapy as primary treatment of clinically localized prostate cancer and as combined adjuvant treatment in patients with pT3 disease after radical prostatectomy.
Las recomendaciones para el tratamiento del cáncer de próstata (CaP) clínicamente localizado deben ser en función de evidencias científicas en medicina. El objetivo final sobre el cual se toma una decisión terapéutica es la supervivencia causa específica.
La prostatectomía radical (PR) y la radioterapia externa (RTE) son los procedimientos más empleados como tratamientos primarios del CaP clínicamente localizado. Ambos tratamientos están asociados a una supervivencia global a largo tiempo.
Con el empleo del antígeno prostático específico (APE) se inició un punto de referencia para valorar la RTE en el tratamiento del CaP.
Aunque la RTE ha sido empleada por décadas para el tratamiento del CaP, esta especialidad tardó tiempo en desarrollarse.
A finales de la década de los años de 1960 aparecen los primeros aceleradores lineales y aun hasta 1970 los radiooncólogos trataban el cáncer de la próstata sin tener un conocimiento preciso de la localización anatómica de esta glándula en el cuerpo. El campo de radiación lo aplicaban de acuerdo a la simetría del esqueleto y los campos los centraban sobre la sínfisis del pubis y con límites a las cabezas de fémur.
Con el advenimiento de la TAC en 1980 se tiene un método directo para localizar la próstata dentro de la pelvis y mejorar el blanco de radiación.
En 1990 se inicia la era de la localización tridimensional de la próstata y la planeación del tratamiento, y la localización con precisión de la próstata y las estructuras adyacentes (recto, vejiga, cuerpos cavernosos, cabezas de fémur). Con el empleo de la RTE conformal escalada tridimensional (RTEC-3D) se aplican mayores dosis de radiación empleando varios campos (3) conformando los haces de radiación y aplicándolos en forma escalonada reduciendo la dosis de radiación a las estructuras adyacentes; esto permitió incrementar las dosis de radiación de 64 a 78Gy.
Sin embargo, el progreso real de la radioterapia (RT) se ha logrado con la terapia de intensidad moderada (RTIM). Constituye un método muy sofisticado que utiliza programas de información muy avanzados, personal especializado y equipo computarizado y de imágenes adaptado al acelerador lineal, lo que permite conformar y modular la intensidad del haz de radiación durante el tratamiento, condición que no se logra con la RTC-3D, disminuyendo en forma la toxicidad de los órganos en riesgo adyacentes.
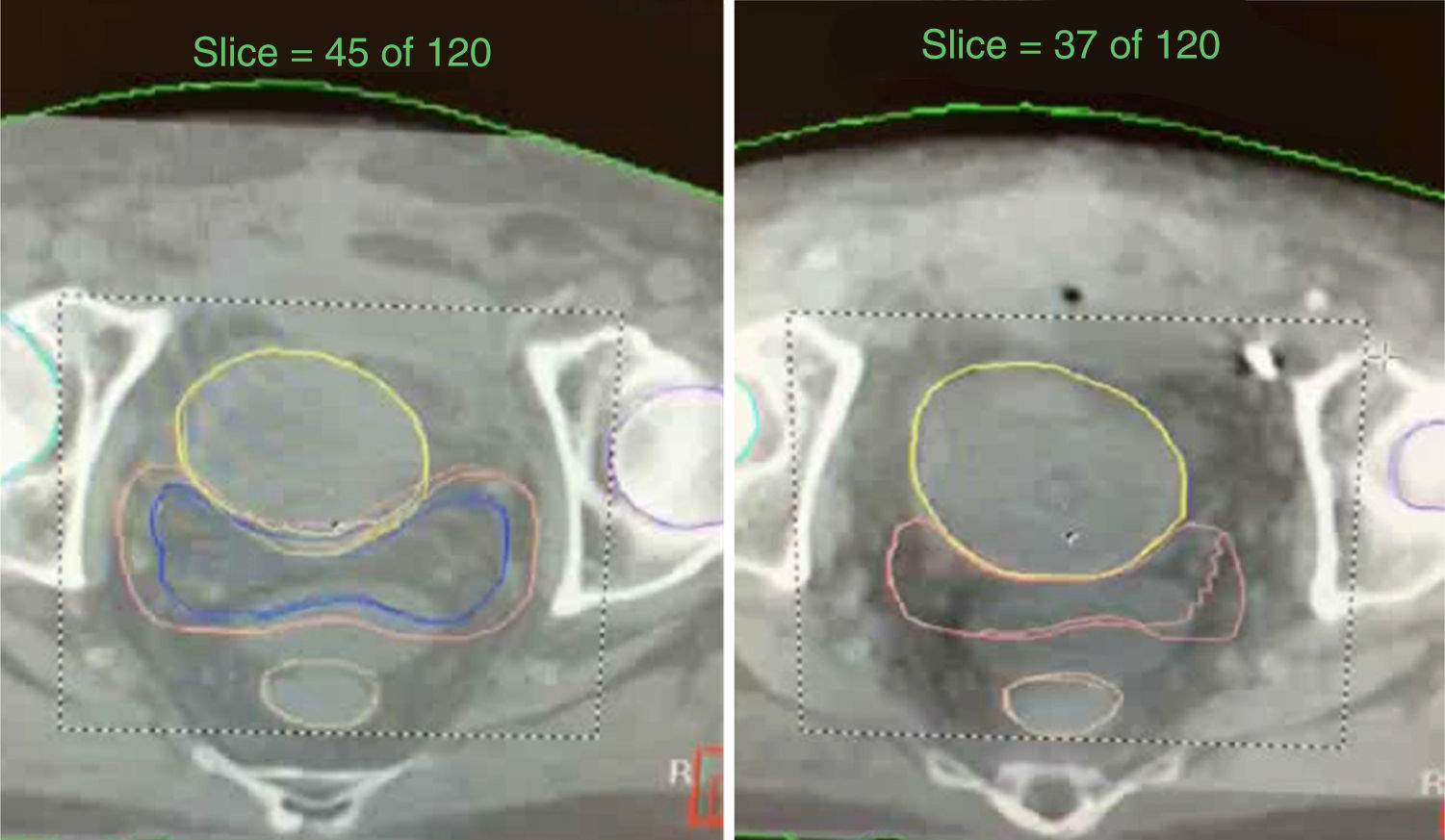
Una vez efectuado el estudio de simulación con la TAC con el paciente fijo en decúbito supino las imágenes son enviadas al sistema de cómputo del acelerador lineal donde se planea el volumen del blanco prostático y las dosis diarias en los órganos de riesgo (fig. 1).
Utiliza de 5-8 campos fijos colocados de forma isocéntrica. El volumen del blanco prostático incluye un margen de 8mm alrededor del tejido prostático identificando en la TAC en un plano axial en todas sus dimensiones, excepto posteriormente en la región de la interface prostatorrectal en que el margen es de 5mm. En la parte superior incluye un área de 1.5cm. de la mitad proximal de las vesículas seminales (VS) (fig. 2).
En los años recientes se han desarrollado variantes en la técnica de intensidad modulada destacando la terapia en arco volumétrica modelada (VMAT, por sus siglas en inglés Volumetric Modulated Arc Theraphy) y la tomoterapia helicoidal1–3.
En la VMAT existen 3 variantes mecánicas:
- a)
La rotación de un cabezal en 360°.
- b)
Un colimador de los haces de radiación con múltiple hojas de movimiento lo que permite ampliar el campo de radiación.
- c)
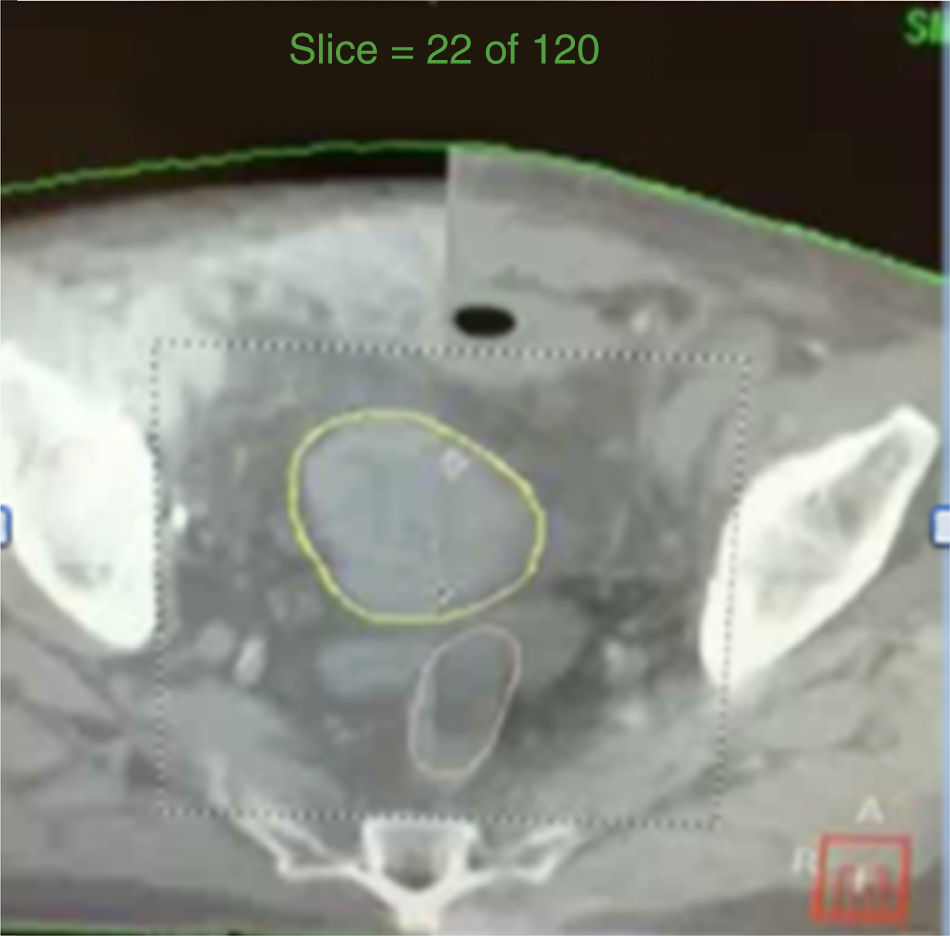
Modulación de las dosis de radiación en forma continua durante rotación (fig. 3).
La VMAT ha demostrado ser más eficiente en la terapia de radiación de la próstata. Permite liberar más fácilmente dosis altas de radiación (86.4Gy) en forma conformal y reducir las dosis de radiación a los órganos vecinos. El campo de radiación es más amplio, como de 50cm, comparado con los campos fijos de RTIM que es de 20cm. El tiempo de radiación es de 120seg a diferencia de 4-6min con la RTIM.
El tiempo más corto de radiación disminuye los riesgos de movilidad de la próstata.
El riesgo de cáncer secundario es reducido del 3% de la RTIM al 1.4 en VMAT.
VMAT constituye la mejor técnica de radiación en comparación en las otras variantes de intensidad moderada4.
Factores pronósticos pretratamientoConocidos son los factores para valorar el pronóstico y predecir la falla bioquímica (FBQ) y recurrencia de la enfermedad: a) Valor del APE, b)grado o suma de Gleason de la biopsia y c) etapa clínica de la enfermedad.
Combinando estos factores de riesgo D’Amico5 estableció un sistema de 3 grupos de riesgo para los pacientes tratados con RTE que tuvieron enfermedad clínicamente localizada: bajo riesgo: APE≤10ng/ml, Gleason 6 o menos y etapa clínica T1c–T2a; riesgo intermedio: APE>10-20ng/ml, Gleason 7, etapa clínica T2b; alto riesgo: APE>20ng/ml, Gleason 8-10, etapa clínica T2c.
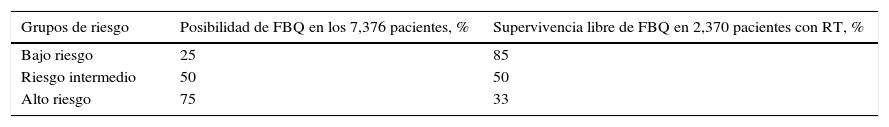
D’Amico et al., en un análisis de datos de 44 instituciones de los EE. UU. de 1988 a 2000, a 7,376 pacientes con CaP en etapa clínica T1c-T2 N0M0 (4,946 fueron tratados con PR y 2,370 con RTE), los estratifico en su sistema de riesgo6.
El objetivo del trabajo fue predecir la posibilidad de FBQ y muerte específica en CaP a 5 años (tabla 1).
Posibilidad de falla bioquímica en prostatectomía radical y radioterapia según factores de riesgo en pacientes con cáncer de próstata clínicamente localizado
| Grupos de riesgo | Posibilidad de FBQ en los 7,376 pacientes, % | Supervivencia libre de FBQ en 2,370 pacientes con RT, % |
|---|---|---|
| Bajo riesgo | 25 | 85 |
| Riesgo intermedio | 50 | 50 |
| Alto riesgo | 75 | 33 |
FBQ: falla bioquímica; RT: radioterapia.
Informes de la literatura han mostrado que el 30-60% de los pacientes sometidos a PR en etapa clínica T1-T2 tienen etapa patológica pT3 y el 60% de los pacientes en la etapa clínica T2 tienen etapa patológica pT37,8.
Con estos informes se puede inferir que cerca del 50% de los pacientes con riesgo intermedio y el 75% de alto riesgo son etapa clínica T3 (localmente avanzados) y en un gran número de ellos se involucran las VS y ganglios linfáticos regionales, existiendo la posibilidad de micrometástasis no detectables clínicamente.
El papel de la monoterapia, PR y o RTE en este grupo de pacientes es incierto y gran número de ellos van a morir por cáncer prostático.
Varios estudios aleatorizados han mostrado aumento en la supervivencia global y supervivencia causa específica cuando se combina la RTE con el tratamiento hormonal (TH) de supresión androgénica comparándola con RTE sola, en pacientes con CaP clínicamente localizados con factores de riesgo desfavorables y en el CaP localmente avanzado.
La supresión androgénica y la RTE parecen tener un efecto aditivo sobre el control local por la inducción de apoptosis, como se ha demostrado en estudios de investigación experimental y clínicos9,10.
En estudios experimentales usando tumores de próstata de ratas Dunning R 3327-G se demostró una interacción supraaditiva entre la supresión androgénica y radiación, y que el mecanismo es a través de la modulación de la apoptosis. Los efectos eran superiores cuando la supresión androgénica precedía a la radiación.
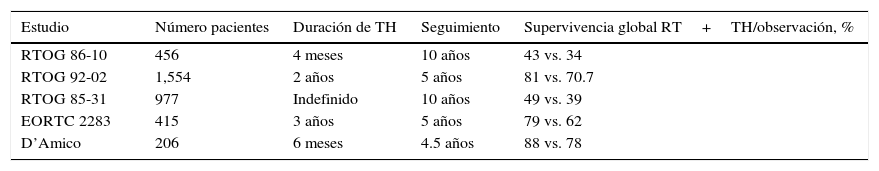
Estudios clínicos aleatorizados realizados por el Grupo Oncológico de Radioterapia (RTOG) como son el RTOG 86-1011–13, RTOG 85-3114 y RTOG 92-0215, así como el de la Organización Europea para la Investigación y Tratamiento de Cáncer (EORTC 2283)16 y un estudio de D’Amico et al.17 mostraron los beneficios de la combinación de la RT y el TH en la supervivencia libre de enfermedad a los pacientes con CaP en etapa clínica T3 (tabla 2).
Beneficios del tratamiento hormonal adyuvante a la radioterapia
| Estudio | Número pacientes | Duración de TH | Seguimiento | Supervivencia global RT+TH/observación, % |
|---|---|---|---|---|
| RTOG 86-10 | 456 | 4 meses | 10 años | 43 vs. 34 |
| RTOG 92-02 | 1,554 | 2 años | 5 años | 81 vs. 70.7 |
| RTOG 85-31 | 977 | Indefinido | 10 años | 49 vs. 39 |
| EORTC 2283 | 415 | 3 años | 5 años | 79 vs. 62 |
| D’Amico | 206 | 6 meses | 4.5 años | 88 vs. 78 |
RT: radioterapia; TH: tratamiento hormonal.
Es importante señalar que las dosis de radiación empleadas fueron de 60-64Gy con técnica convencional excepto en el estudio de Dr. D’Amico que aplicó 68Gy en forma escalada.
Se hizo evidente que la dosis estándar de 60-66Gy empleada en muchos centros de RT alrededor del mundo era insuficiente para conseguir un control de la enfermedad. Esto contribuyo a las altas tasas de recurrencia y fallas en el control local de la enfermedad en el pasado.
Sobre la base en reportes clínicos se tiene la información de que dosis de radiación de por lo menos 78Gy y aun mayores son necesarias para obtener los mejores resultados y control de la enfermedad. Limitante a estas dosis era el potencial riesgo de aumentar a largo plazo la toxicidad en el tracto intestinal y genitourinario.
La destrucción del epitelio glandular prostático parece ser dependiente de la dosis de radiación.
Pollack et al.18 comparando dosis de 70 y 78Gy, evidenciaron que el 80% de los pacientes alcanzaron un nadir de APE de 0.5ng/ml con dosis de 78Gy, y con 70Gy solo el 67% alcanzaron este nadir. El APE declina lentamente después de completar la RT. El tiempo promedio informado por varios autores para los pacientes que no tienen evidencia de enfermedad fluctúa entre 18 y 36 meses18. El nadir del APE promedio en los pacientes sin evidencia de enfermedad en la mayoría de los pacientes tratados con RT es de 0.4-0.5ng/ml.
La lenta disminución del APE en un largo tiempo para alcanzar el nadir es explicable porque la RT no causa muerte celular inmediata. La rotura de la doble cadena del ADN del cromosoma celular no es inmediatamente fatal, pero no permite una reproducción celular exitosa. La muerte celular posmitótica no se expresa hasta que la célula intenta reproducirse; dado el largo tiempo para duplicarse la célula maligna en la mayoría de los cánceres prostáticos, una célula fatalmente dañada puede sobrevivir de 18-24 meses, antes de que ocurra un intento sin éxito de la división celular y muerte.
El paciente tratado con RT aun conserva la glándula prostática; no se alcanzan valores indetectables del APE. Hay marcada atrofia y reducción en el tamaño y número de las glándulas no malignas.
Nadires altos están asociados a una disminución de la supervivencia libre de enfermedad. En pacientes que alcanzan un nadir de 0.5ng/ml o menos del APE la supervivencia libre de FBQ fue del 80-90%.
La Asociación Americana de Radioterapia Oncológica (ASTRO) propuso la definición de FBQ cuando hay 3 elevaciones sucesivas del APE, después de alcanzar el nadir; el APE debe tomarse cada 3 meses y esperar 3 elevaciones para considerar la FBQ, y esto retardaría el diagnóstico de la misma. Algunos autores consideran como FBQ cuando el APE excede en 2ng/ml el nadir alcanzado (Consenso Houston).
Cuando los pacientes reciben TH combinado con la RT, generalmente tienen un APE indetectable; no es posible establecer el verdadero nadir. La recaída se valora de acuerdo al consenso de la ASTRO y/o el Consenso Houston.
Informes de la literatura que a continuación se describen permiten demostrar el beneficio de las altas dosis de radiación que pueden generar los nuevos aceleradores lineales, sobre la supervivencia libre de FBQ y la supervivencia libre de progresión en los pacientes de alto y riesgo intermedio, y la importante disminución de la toxicidad en los tractos intestinal y urinario.
Pollack et al. informaron de un estudio aleatorizado fase iii en 301 pacientes con CaP etapa T1-T3 N0M0 para comparar la eficacia de la RTC-3D a dosis de 70 y 78Gy con seguimiento medio de 60 meses, en el Centro del Cáncer M.D. Anderson Houston Tex.18. Las características clínicas de los pacientes APE, Gleason y Etapa Clínica fueron muy similares.
El objetivo final del estudio fue la supervivencia libre de progresión, supervivencia libre de FBQ valorada por 3 evaluaciones sucesivas del APE después de alcanzar el nadir.
De los 301 pacientes, 150 fueron tratados con 70Gy y 151 con 78Gy. La supervivencia media libre de progresión fue del 64% para los pacientes que recibieron 70Gy vs. 70% para los pacientes con dosis de 78Gy. La dosis escalada a 78Gy benefició más a los pacientes con APE pretratamiento>10ng/ml. La supervivencia libre de FBQ fue del 62% para los pacientes con 78Gy vs. 43% para los pacientes de 70Gy. No hubo diferencias de la supervivencia libre de FBQ en ambos grupos que tenían APE≥10ng/ml, la cual fue de alrededor del 75%. Aunque no hubo diferencias en la supervivencia global, la supervivencia libre de metástasis en los pacientes con APE>10ng/ml fue mayor en los pacientes tratados con 78Gy vs. 70Gy y fue del 78% vs. 88% respectivamente a 6 años. La toxicidad rectal grado 2 fue del 12% en el grupo de 70Gy y del 26% en el grupo de 78Gy. Las complicaciones vesicales fueron similares en ambos grupos (del 10%).
En 2001, Zelefsky et al.19 realizaron otro informe sobre los resultados del tratamiento de 1,100 pacientes con CaP clínicamente localizado en etapa clínica T1c-T3 tratados con altas dosis de radiación comparando la RTC-3D con la RTIM. Los pacientes fueron estratificados por grupos de riesgo y la FBQ se valoró de acuerdo al consenso ASTRO y la toxicidad según la escala del RTOG. La supervivencia libre de FBQ a 5 años para los pacientes de bajo, intermedio y alto riesgo fue del 85, 58 y 38%, respectivamente.
La dosis de radiación fue el factor más poderoso que impactó en la supervivencia libre de FBQ en cada grupo de riesgo. La supervivencia libre de FBQ actuaria a 5 años en el grupo de riesgo bajo que recibieron de 64.8-60.2Gy fue del 77%, comparado al 90% cuando recibieron dosis de 75.6-86.4Gy; del 50-70% en los pacientes de riesgo intermedio; y del 21-47% en los pacientes de alto riesgo con estas 2 dosis diferentes de radiación.
En cuanto a la posibilidad de riesgo de biopsias positivas a 2.5 años o más después del tratamiento, según la dosis de radiación, 4 de 41pacientes (10%) que recibieron 81Gy fueron positivas; 27 de 119 pacientes (23%) tuvieron biopsias positivas cuando recibieron 75.6Gy; 23 de 68 pacientes (34%) cuando recibieron 70.2Gy y 13 de 24 pacientes (54%) cuando la dosis fue de 64.8Gy.
La toxicidad rectal varió según la técnica y dosis de radiación aplicada. En pacientes que recibieron RTC-3D con dosis de 75.6Gy la toxicidad grado 2 fue del 14% comparada con el 5% si las dosis de radiación fueron bajas (64.8Gy). Cuando se aplicó RTIM a dosis de 81Gy la toxicidad rectal grado 2 fue del 2%. La toxicidad urinaria fue muy similar con ambas técnicas de radiación y varió entre el 13 y 16%.
Otro informe es el de Zelefsky et al. en el año 2006 en el Centro del Cáncer Memorial Sloan Kettering20, sobre los resultados a largo plazo en 561 pacientes con CaP localizado tratados con dosis altas de radiación, 81Gy con RTIM entre 1996 y 2000; seguimiento promedio de 7 años (5-9 años). Fueron enrolados 203 pacientes de bajo riesgo, 255 de riesgo intermedio y 103 pacientes de alto riesgo. La supervivencia libre FBQ a 8 años según los grupos de riesgo fue del 85, 76 y 69% respectivamente según el Consenso ASTRO (3 aumentos sucesivos del APE después del nadir) y del 89,78 y 67% respectivamente en los grupos de riesgo según el Consenso Houston (2ng/ml del APE arriba del nadir). La toxicidad rectal grado 2 fue del 1.6% y la de grado 3 (transfusiones, cauterización) fue<1%.
Cahlon et al. en el año 200821 informan de un grupo de 478 pacientes tratados con dosis altas de radiación, 86.4Gy con RTIM entre 1997 y 2004 con CaP clínicamente localizado. La supervivencia libre de FBQ (actuaria a 5 años) y de acuerdo con el Consenso Houston fue del 98, 85 y 70% para los pacientes de bajo riesgo, intermedio y alto respectivamente. La toxicidad intestinal aguda grado 2 se presentó en 37pacientes (8%); la de grado 3 en ningún paciente. La toxicidad tardía grado 2 en 16 pacientes (3%), y grado 3 en 2 pacientes (<del 1%). La toxicidad urinaria aguda grado 2 en 105 pacientes (22%) y tardía grado 2 en 60 pacientes (13%), y grado 3, 12 pacientes(<del 3%). Este reporte representa una de las más grandes series de pacientes tratados con dosis muy altas de radiación, 86.4Gy con RTIM para CaP clínicamente localizado, con una buena tolerancia y excelente control bioquímico de la enfermedad.
Algunos autores22–24 han señalado que la RTIM puede estar asociada a una mayor tendencia de cánceres secundarios (2-5 veces que el tratamiento convencional).
A la fecha los autores no han observado cánceres secundarios en este grupo de pacientes tratados, pero consideran que debe existir un seguimiento más largo para confirmar esta observación.
En años recientes algunos autores han cuestionado el papel de la RTE para pacientes con enfermedad de alto riesgo y localmente avanzada. Esto en función de los reportes históricos ya mencionados11,17 y de reportes previos25,26 en los que el 40% de los pacientes presentaron recurrencia local de la enfermedad, tratados con técnicas convencionales, razón por lo cual justifican la PR para tener control local de la enfermedad.
Algunos cirujanos argumentan que al resecar la próstata se reduce la posibilidad de que el paciente tenga obstrucción urinaria baja o renal en el futuro. Si esto llega a ocurrir, no es en más del 15% de los pacientes si la próstata no es extirpada. La PR en este grupo de pacientes es difícil y laboriosa; debe realizarse por un cirujano experimentado. El cirujano trata de resecar la glándula con un margen de tejido normal y generalmente este margen no existe. La glándula cancerosa se adhiere íntimamente al recto y puede ocurrir lesión del mismo o bien dejar tejido maligno adyacente a la pared rectal. Estos cánceres no curan con la cirugía27–29.
Una extensa cirugía que generalmente involucra a ambos paquetes neurovasculares y el ápex, la disfunción eréctil y la incontinencia urinaria son frecuentes. La linfadenectomía extensa obligada en estos pacientes no solo incluye los ganglios de la fosa obturatriz, sino también los de la iliaca interna y presacros.
Esto aumenta la morbilidad: linfocele, linfoedema, trombosis venosa profunda, tromboembolia30. La PR en estos pacientes no los va a curar, y además implica un aumento de las complicaciones peri- y postoperatorias. Requieren tratamientos multidisciplinarios, RT adyuvante (RTA), TH prolongado (riesgo de osteoporosis, anemia, diabetes, eventos cardiovasculares, etc.), quimioterapia con la morbilidad consecutiva para lograr mejorar la supervivencia.
En el año 2008 Zelefsky et al.31 informaron de los resultados obtenidos a largo plazo para el control de la enfermedad y supervivencia en pacientes en etapa clínica T3 de CaP tratados con altas dosis de RTC-3D y RTIM (examen digital rectal, ultrasonido transrectal y biopsia, resonancia magnética con bobina intrarrectal). Enrolaron 296 pacientes entre 1998 y 2000, 201 fueron tratados con RTC-3D y 95 con RTIM; 189 pacientes recibieron un curso de TH neoadyuvante de 3 meses, para disminuir el tamaño de la próstata o en pacientes con factores desfavorables de alto riesgo; 107 no lo recibieron. El seguimiento promedio fue de 8 años. De los 296 pacientes 130 se consideraron en etapa clínica T3a (extensión extracapsular) y 163 en etapa clínica T3b (invasión VS). Setenta y ocho pacientes tenían el APE entre 10 y 20ng/ml y 119 pacientes un APE>20ng/ml. La dosis de radiación en 92 pacientes fue de 70.2Gy y en 109 pacientes la dosis fue de 75.6Gy con RTC-3D, y 95 pacientes recibieron≥81Gy con RTIM. Los ganglios regionales no fueron tratados en los pacientes de este estudio.
La supervivencia libre de FBQ en 5 y 10 años fue del 69 y 44% en los pacientes con T3a y del 49 y 32% en los pacientes con T3b respectivamente. En forma global todos los pacientes estuvieron libres de FBQ a 5 y 10 años en el 57 y 37% respectivamente y libres de progresión local el 87 y 83%. En los pacientes que recibieron TH, el 92% estuvieron libres de progresión local a 10 años vs. 68% que no recibieron TH.
La supervivencia libre de metástasis para todos los pacientes fue del 78 y 64% respectivamente a 5 y 10 años. En los pacientes con pT3a la supervivencia fue del 85 y 73% y con los pacientes T3b del 73y 63% respectivamente a 5 y 10 años.
En los pacientes que recibieron TH y 81Gy, 49 pacientes en T3a y 46 en T3b, la supervivencia libre de metástasis fue del 89% para los pacientes T3a y del 66% para los pacientes T3b a 10 años.
Factores importantes para mejorar la supervivencia libre de FBQ, así como el control local de la enfermedad y retardo en la aparición de metástasis fueron las dosis de radiación y curso en corto de TH.
Los resultados son comparables a los obtenidos en pacientes seleccionados sometidos a PR por cirujanos experimentados en etapa clínica T3. El papel de la RTE con altas dosis con las tecnologías actuales, combinada con la TH, se considera la terapia estándar en el CaP de alto riesgo y localmente avanzado.
Estudios aleatorizados han mostrado que el empleo de la TH combinada durante 2-3 años es necesario para reducir el riesgo de metástasis en este grupo de pacientes11–17.
Las guías practicas clínicas en oncología de la National Comprehensive Cancer Network (NCCN) 201232 consideran que el tratamiento para el CaP clínicamente localizado de alto riesgo es RTC-3D/RTIM y TH neoadyuvante, concomitante y adyuvante por 2-3 años (categoría 1). Otra opción terapéutica en este grupo de pacientes es la RTC-3D/RTIM más braquiterapia intersticial permanente con I125 o paladio 103, o altas dosis de braquiterapia con la inserción temporal de una fuente de radiación, iridio 192 y bloqueo androgénico por 6 meses. Dos estudios recientes al respecto mostraron:
Bittner et al.33, supervivencia libre de progresión a 9 años en el 87% y supervivencia causa específica del 91%(BrT+RTEC-3D+TH).
Martinez-Monge et al.34 informan de una supervivencia libre de progresión del 86.1% a 5 años y supervivencia causa específica del 75.7% a 9 años (BrT+RTEC-3D+TH).
En casos muy seleccionados en que la próstata sea móvil la PR más TH sería otra opción de acuerdo con estas guías.
La RTE se puede aplicar como: a)tratamiento primario en pacientes CaP clínicamente localizado; b) RTA después de la PR a pacientes con margen positivos, pT3a, pT3b; c) radioterapia de salvación (RTS) al tiempo de la recurrencia, FBQ o clínica y d) tratamiento paliativo de las metástasis óseas.
Ventajas de la TH neoadyuvante frente a la RT: a) reducción de volumen tumoral; b) sensibilizar a las células cancerosas al efecto letal de la radiación; c) aumentar la dosis de radiación al tejido tumoral con probabilidad de erradicarlo y d) menor toxicidad a tejidos circunvecinos.
Ventajas de la TH adyuvante frente a la RTE: elimina células malignas supuestamente dañadas por la radiación y se pueden eliminar micrometástasis ocultas (enfermedad sistémica).
El presente trabajo pretende hacer una revisión del tema y presentar la experiencia en pacientes con CaP clínicamente localizado, en la práctica clínica privada, tratados con RTE y TH de los años 1993 a 2013 evaluando la supervivencia libre de FBQ, supervivencia global y muerte específica y otras causas. Además, valorar los mismos parámetros en pacientes con CaP clínicamente localizado sometidos a prostatectomía radical retropúbica neuroconservadora (PRRN) y linfadenectomía pélvica, en quienes en la pieza quirúrgica se encontró evidencia de extensión extraprostática y o invasión de VS y fueron tratados con RTA y TH.
Material y métodosDespués de hacer la revisión del tema, se revisaron los expedientes clínicos de 38 pacientes tratados con RTE y TH como tratamiento primario de los años 2003 a 2012.
También los expedientes de 46 pacientes de 105 sometidos a PRRN que tuvieron etapa patológica pT3 y que recibieron RTA y TH con datos clínicamente consistentes para su evaluación y seguimiento hasta julio de 2015. Fueron incluidos en el trabajo todos los pacientes que reunieron las características de estadio y en manejo específico.
Las técnicas de radiación fueron con técnica convencional del acelerador lineal de los años 2003 a 2010 y posteriormente RTC–3D y RTIM.
La dosis de radiación en las primeras etapas fue de 60-64Gy y posteriormente con RTC–3D y RTIM de 68-76.6Gy. Se realizaron pruebas estadísticas, en medias y porcentajes.
ResultadosLos resultados del grupo de pacientes con CaP clínicamente localizado sometidos a RTE y TH como tratamiento primario son los siguientes:
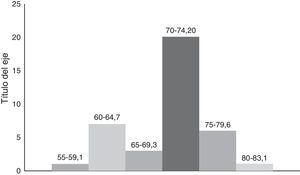
La edad en este grupo de 38 pacientes, tuvo una mínima de 58 años y una máxima de 83 años con promedio de 74.6 años. Excluyendo los 2 pacientes extremos, la edad promedio fue 71.6 años (fig. 4).
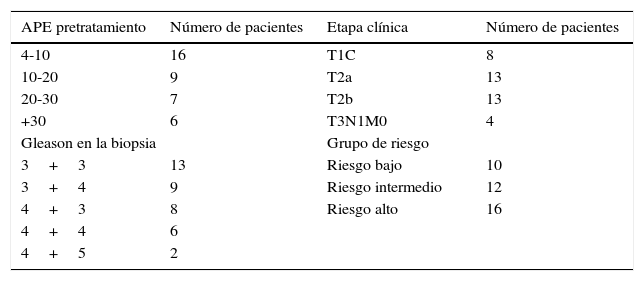
Las características clínicas de los 38 pacientes son las siguientes: 16 paciente con un APE de 4-10ng/ml; 9 pacientes con APE entre 10 y 20ng/ml, 7 pacientes de 20-30ng/ml y 6 con más de 30ng/ml; 16 pacientes con Gleason de alto riesgo, 4+3 a 4+5; 26 pacientes con lesión palpable y de estos 4 con ganglios regionales positivos (linfadenectomía previa a PR que no se realizó). Estratificados por grupos de riesgo, 10 pacientes en riesgo bajo, 12 intermedio y 16 en riesgo alto (tabla 3). A todos los pacientes se les practicó gammagrafía ósea con tecnecio 99 y tomografía abdominopélvica para descartar enfermedad metastásica por estos métodos. Se clasificaron en 3 grupos de riesgo:
Características clínicas de 38 pacientes con CaP clínicamente localizado tratados en forma primaria con radioterapia externa y tratamiento hormonal
| APE pretratamiento | Número de pacientes | Etapa clínica | Número de pacientes |
|---|---|---|---|
| 4-10 | 16 | T1C | 8 |
| 10-20 | 9 | T2a | 13 |
| 20-30 | 7 | T2b | 13 |
| +30 | 6 | T3N1M0 | 4 |
| Gleason en la biopsia | Grupo de riesgo | ||
| 3+3 | 13 | Riesgo bajo | 10 |
| 3+4 | 9 | Riesgo intermedio | 12 |
| 4+3 | 8 | Riesgo alto | 16 |
| 4+4 | 6 | ||
| 4+5 | 2 | ||
APE: antígeno prostático específico; CaP: cáncer de próstata.
Del grupo de 10 pacientes con bajo riesgo tratados con RTE y TH. Nueve pacientes sin FBQ (de un paciente se perdió el control a los 6 años sin FBQ); en un paciente con FBQ a los 7 años; vivo hasta los 14 años de RTE y TH (85 años de edad) con Ca refractario con abiraterona, con APE actual 0.3ng/ml. Dos pacientes fallecieron: uno por neumonía (84 años); uno por infarto de miocardio (79 años) sin FBQ a los 11 y 8 años y medio después del tratamiento. La supervivencia en este grupo de 10 pacientes de bajo riesgo fue de 6-15 años, promedio 10 años, y la edad de los pacientes vivos entre 74 a 85 años con promedio de 80 años.
Del grupo de 12 pacientes de riesgo intermedio tratados con RTE y TH. Once pacientes están vivos sin FBQ; en uno se perdió control a los 5 años (APE 0.0mg/ml). La supervivencia es de 3-10 años y medio; promedio 6 años (en 5 pacientes es de 3-3 años y medio desde que iniciaron tratamiento). La edad de los pacientes en el último control es de 69-86 años, con promedio 78 años.
Del grupo 16 pacientes de alto riesgo. En 7 pacientes hubo FBQ que se presentó entre 2 años y medio y 7 años; de estos: 6 pacientes han fallecido; 5 por CaP refractario y uno por Ca pulmonar y un paciente está vivo con TH intermitente. La supervivencia de estos 7 pacientes fue de 6-13 años; promedio 7.2 años.
En los restantes 9 pacientes de alto riesgo sin FBQ, la supervivencia es de 3-14 años, promedio 7.3 años. Edad actual al último control de los pacientes vivos es de 71-85 años, promedio 77 años. De los 4 pacientes en etapa T2N1N0 tratados con RTE ciclo pélvico y TH a 2 años, 3 pacientes clínicamente en riesgo intermedio fueron programados para PRR. En la linfadenectomía pélvica ganglios +. No se hizo PR. Un paciente previamente operado en otra institución con prostatectomía suprapúbica, con lesión de 8mm, Gleason 3+3 en pieza quirúrgica, recibió 3 meses de bicalutamida.
Es visto en consulta 4 años después con APE 15.5ng/ml y con síntomas obstructivos bajos con próstata indurada; RTU biopsia Gleason 4+5; PET con actividad en tejido prostático y ganglios iliacos derechos. En realidad en este paciente la RTE y TH fueron de salvamento.
De los 4 pacientes T2N1N0 tratados con RTE, conformal y ciclo pélvico y TH 2 años: 3 pacientes con FBQ a los 2, 4 y 5 años tratados con TH intermitente; 2 fallecieron por Ca refractario y uno aun con TH. Supervivencia 4 años y medio, 6 y 7 años.
El paciente restante, con 10 años sin FBQ; actualmente con Ca invasivo de vejiga, y metástasis con insuficiencia renal en riesgo de muerte.
El tipo y dosis de radiación puede observarse en la tabla 4.
Dosis y tipo de radiación en 38 pacientes con RTE y TH adyuvante
| Riesgo | Convencional, n.o pacientes | RTC-3D, n.o pacientes | RTIM, n.o pacientes | Dosis, Gy |
|---|---|---|---|---|
| Bajo | 2 | 10 | - | 60-64 |
| Intermedio | 1 | 9 | 2 | 68-76.6 |
| Alto | 4 | 20 | 2 | 72-78 |
RTC-3D: radioterapia externa conformal escalada tridimensional; RTE: radioterapia externa; RTIM: radioterapia de intensidad moderada; TH: tratamiento hormonal.
De los 38 pacientes tratados con RTE y TH, uno de 10 pacientes (10%) tuvo FBQ; de los 12 pacientes en riesgo intermedio en ninguno se documento FBQ. La supervivencia en 38 pacientes tratados con RTE y TH puede observarse en la tabla 5.
Todos los pacientes recibieron tratamiento hormonal adyuvante entre 12-24 meses. En los primeros años de este estudio, flutamida 250mg, 1 cada 8h, posteriormente análogos de aplicación mensual y trimestral por 18-24 meses. El tratamiento intermitente en FBQ consistió en la aplicación de análogos trimestrales en ciclos de 3 aplicaciones iniciando con un mes de antiandrógenos, y el tiempo sin tratamiento varió entre 6 y 9 meses.
ToxicidadSe presentó toxicidad grado 2 en 8 pacientes (diarrea, y en 2 pacientes proctitis hemorrágicas que se controlaron con tratamiento médico). Toxicidad urinaria grado 2 en 2 pacientes (cistitis hemorrágica posradiación). Un paciente presentó carcinoma vesical de bajo grado que ha sido recurrente (¿posradiación?).
Del grupo de pacientes con CaP localmente localizado sometidos a PRRN y linfadenectomía pélvica, en quienes se encontró en la pieza quirúrgica evidencia de extensión extraprostática y/o invasión de VS fueron tratados con RTA y TH.
En el año del 2011 el autor presentó su experiencia personal en un grupo de 105 pacientes sometidos a PR retropúbica en una institución privada35. Todos los pacientes fueron operados por el mismo cirujano (EZF) con la misma técnica quirúrgica, PRRN intrafascial y el estudio histopatológico fue realizado por la misma patóloga (AZO) con un mismo formato para el procesamiento de la pieza quirúrgica, en que la glándula prostática fue seccionada en montaje completo con cortes transversales cada 3mm, lo que permite detectar con más seguridad la extensión y tamaño del proceso tumoral. En los pacientes que tuvieron enfermedad localmente avanzada (pT3) se efectuó tratamiento adyuvante combinado, RTE y TH, que se mencionará más adelante. La RT fue realizada por los mismos radiooncólogos (MGS y ALZ).
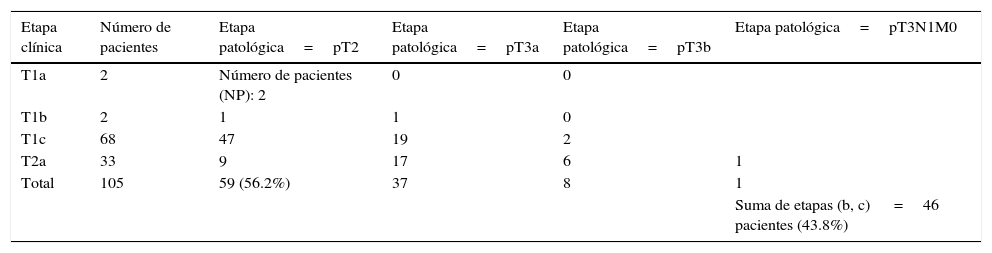
En la tabla 6 puede observarse la correlación entre la etapa clínica y etapa patológica de estos 105 pacientes sometidos a PR, mostrándose que 46 de ellos (43.8%) tuvieron etapa patológica pT3.
Correlación entre la etapa clínica y patológica en 105 pacientes sometidos a prostatectomía radical retropúbica neuroconservadora
| Etapa clínica | Número de pacientes | Etapa patológica=pT2 | Etapa patológica=pT3a | Etapa patológica=pT3b | Etapa patológica=pT3N1M0 |
|---|---|---|---|---|---|
| T1a | 2 | Número de pacientes (NP): 2 | 0 | 0 | |
| T1b | 2 | 1 | 1 | 0 | |
| T1c | 68 | 47 | 19 | 2 | |
| T2a | 33 | 9 | 17 | 6 | 1 |
| Total | 105 | 59 (56.2%) | 37 | 8 | 1 |
| Suma de etapas (b, c) =46 pacientes (43.8%) |
En la tabla 7 se muestran las características clínica con relación al APE preoperatorio y Gleason de la biopsia de los 46 pacientes que tuvieron pT3.
Antígeno prostático específico preoperatorio y Gleason de la biopsia de los 46 pacientes que tuvieron etapa pT3
| Número de pacientes | APE ng/ml | Número de pacientes pT3 (%) | pT3a | pT3b | pT3a (N1M0) | Número de pacientes | Gleason | Etapa patológica pT3a | Etapa patológica pT3b |
|---|---|---|---|---|---|---|---|---|---|
| 8 | <4 | 4 (50) | 4 | - | - | 24 | 3+3 | 22 | 2 |
| 77 | 4.1-10 | 28 (36) | 23 | 4 | 1 | 12 | 3+4 | 10 | 2 |
| 20 | 10.1-17.5 | 14 (75) | 10 | 4 | - | 8 | 4+3 | 5 | 3 |
| 2 | 4+4 | 1 | 1 | ||||||
| Total 105 | Total 46 | Total 37 | Total 8 | Total 1 | Total 46 | Total 38 | Total 8 |
APE: antígeno prostático específico.
Puede observarse que el 36% de estos pacientes con APE con valores de 4.1-10ng/ml tuvieron enfermedad pT3 y el 75% con APE entre 10.1-17.5 que fue el valor máximo del APE en este grupo de pacientes tuvieron enfermedad pT3.
De los 46 pacientes con pT3, 38 tuvieron pT3a (extensión extraprostática) y 8 fueron pT3b (invasión a VS). Del análisis de los 38 pacientes con pT3a tratados con RTE y TH, 6 fallecieron 4 sin FBQ por causas ajenas al CaP (un paciente cáncer de cerebro, 2 por infarto de miocardio y uno por leucemia) y la supervivencia fue de 15, 5, 10 y 12 años respectivamente.
Los otros 2 que fallecieron tuvieron FBQ a los 3 y 4 años y uno falleció por CaP refractario a los 6 años y otro por infarto a los 8 años. La supervivencia fue de 5-15 años, promedio 8.4 años.
De los 32 pacientes restantes con pT3a conocidos vivos, en uno se pierde el control a los 7 años sin FBQ. Un paciente con FBQ con CaP refractario actualmente con tratamiento de abiraterona está vivo a 11 años y con APE de 0.3ng/ml. En los 30 restantes actualmente vivos (último control julio 2015) la supervivencia es: en 6 pacientes de 18-20 años, en 9 pacientes de 11-15 años, en 14 pacientes de 8-10 años y en un paciente de 7 años.
Resumiendo podemos señalar que de los 38 pacientes con pT3a tratados con RTE y TH, 34 pacientes no tuvieron FBQ (se incluyen 4 pacientes fallecidos sin FBQ y un paciente sin control vivo sin FBQ). La supervivencia en este grupo es de 5-20 años, promedio 11.5 años.
De los 8 pacientes pT3b tratados con RTE y TH, 3 pacientes fallecieron por CaP refractario a los 5, 12 y 14 años; otro paciente falleció por infarto de miocardio sin FBQ a los 9 años.
Los 4 pacientes restantes están vivos sin FBQ a los 9, 9, 10 y 12 años. Importante señalar que 2 de estos pacientes tuvieron foco microscópico de Ca en la pared muscular de la VS con el cáncer confinado; el comportamiento y pronóstico de estos pacientes es similar a los pT3a.
El paciente que tuvo pT3a N1M0 presentó en la pieza quirúrgica una lesión voluminosa de 4cm con reporte histopatológico de carcinoma ductal en el 90% y 10% adenocarcinoma 4+3. Recibió RTC-3D con 72Gy y 2 años de TH; presentó FBQ a los 2 años y 4 meses, y falleció 4 años después de la intervención quirúrgica.
Toxicidad. Seis pacientes presentaron toxicidad grado 2 (diarrea) y un pacientes toxicidad urinaria grado 2 (cistitis hemorrágica posradiación); un paciente estuvo a los 10 años sin FBQ, actualmente un carcinoma invasivo metastásico e insuficiencia renal.
Los 46 pacientes con pT3a recibieron tratamiento adyuvante combinado. Las dosis de RT con acelerador lineal convencional fue entre 64 y 68Gy, y en los últimos 7 años, esta fue RTC-3D, con dosis de 68-72Gy.
El TH de los pacientes en los primeros 2 años de este estudio fue con flutamida de 250mg una cada 8 horas por un año. Posteriormente se aplicaron análogos de depósito, inicialmente mensual vía subcutánea y posteriormente trimestral por 18-24 meses. La razón para indicar los 24 meses se basó en administrarla a los pacientes de alto riesgo, es decir aquellos con APE preoperatorio alto, suma de Gleason 7 o más y cuando existía penetración establecida en varios focos o invasión a VS.
DiscusiónExiste falta de consensos en el tratamiento de los pacientes con FBQ después de PR; el 50% de los urólogos recomiendan observación de los pacientes difiriendo la RT hasta demostrar recurrencia clínica local; el 30% recomienda alguna forma de supresión androgénica y un 20% RT36.
Los registros del Comité de Investigación Estratégica para el Cáncer de Próstata37 (CAPSURE) indican que menos del 50% de los pacientes con FBQ posterior a la prostatectomía reciben RTS: la mayoría recibe TH que no ofrece posibilidades de curación.
La RT se ha empleado como tratamiento adyuvante (RTA) 3 meses después de la PR en pacientes con APE indetectable post-PR con signos patológicos como márgenes quirúrgicos positivos, extensión extraprostática establecida e invasión a VS.
Se ha empleado como RTS al tiempo de la recurrencia bioquímica o clínica
Para la mayoría de los urólogos que se enfrentan a un paciente con pT3a post-PR, con APE indetectable la estrategia más común es esperar a que el APE alcance un umbral determinado. La Sociedad Americana de Radio-Ontología Terapéutica (ASTRO)38 considera como punto de corte para iniciar una terapia de salvación 1.5ng/ml; este abordaje es obsoleto y puede colocar al paciente en alto riesgo de metástasis y muerte. Sin embargo, la indicación de la RTS en la forma más temprana, esto es, al inicio de la elevación del APE por arriba de los niveles detectables, 0.2ng/ml a 0.4ng/ml, ha mostrado tener mejores resultados en la supervivencia libre de FBQ o clínica.
Un nivel de APE pre-RT mayor de 2ng/ml estuvo asociado con progresión de la enfermedad después de RTS. Stephenson et al.39 reportaron un estudio de 1,540 pacientes de 1987 a 2005, que recibieron RTS con seguimiento medio de 4.5 años. Todos los pacientes tenían de APE 0.2ng/ml o más; en los pacientes con APE 0.2-0.5 la SVLR fue del 48% en tanto que en los pacientes con APE de 1.5ng/ml o más la SVRL fue del 18%.
En el año 2011 en el Congreso Europeo de Urología en Viena, Austria, Briganti et al.40 presentaron los resultados de un estudio aleatorizado multiinstitucional europeo, mismo que presentaron en 2012 en la reunión anual de la Asociación Americana de Urología, en Washington D.C, en pacientes con CaP localmente avanzado post-PR y linfadenectomía pélvica, a un grupo de los cuales se les aplicó RTA y a otro grupo «radioterapia temprana de salvamento» (RTTS) para valorar la supervivencia libre de FBQ.
Basados en estudios clínicos prospectivos aleatorizados, ya publicados y que se informan más adelante en este artículo, que mostraron un beneficio significativo de la RTA en presencia de márgenes quirúrgicos positivos o CaP localmente avanzado post-PR, los autores sustentan su estudio para determinar si resultados similares pudieran ser obtenidos con la administración temprana de RTS.
Inicialmente 515 pacientes en pT3N0M0, 313 pacientes recibieron RTA con APE indetectable post-PR y 105 pacientes en el brazo de RTTS cuando el APE fue de<0.3ng/ml y/o<0.5ng/ml.
El reporte final fue de 232 pacientes de los cuales 143 recibieron RTA y 89 pacientes fueron tratados con RTTS. El análisis comparativo de los factores de riesgo (APE preoperatorio, etapa patológica y Gleason de la pieza quirúrgica) fueron similares en ambos grupos; el seguimiento promedio fue de 78.5 meses y las dosis de radiación fueron de≤66Gy.
En el análisis para valorar la supervivencia de FBQ en pacientes que recibieron RTA vs. RTTS cuando el APE era<de 0.5ng/ml, en los 143 pacientes con RTA la supervivencia libre de FBQ fue del 82% y del 73.9% a 5 y 8 años respectivamente. En los 89 pacientes con RTTS la supervivencia libre de FBQ fue del 65% y del 45.5% a 5 y 8 años respectivamente.
En el análisis de pacientes con APE<0.3ng/ml la supervivencia libre de FBQ en 110 pacientes tratados con RTA fue del 78.2% y del 70.7% a 5 y 8 años respectivamente. En 65 pacientes que recibieron RTTS la supervivencia libre de FBQ fue del 63.4% y del 44.2% a 5 y 8 años.
Los autores concluyeron que la RTTS en este estudio comparativo demostró tener un efecto desventajoso en la supervivencia de FBQ en comparación con la RTA.
A la fecha los estudios clínicos no han demostrado que la RTS después de la PR reduzca el riesgo de metástasis o mejore la supervivencia global.
Estudios de la Universidad del Johns Hopkins41 mostraron que menos del 20% de los hombres permanecen libres de FBQ dentro de los 5 años siguientes a la RTS lo cual cuestiona la utilidad de este abordaje.
En la estrategia de esperar a la FBQ, aunque los pacientes tienen una inicial superior calidad de vida y pocos recibirían RT, al ocurrir la recaída estarán expuestos a una mayor carga de tratamientos, lo que afectaría su salud y tendrán una peor calidad de vida.
Pacientes que han sido sometidos a PR deben ser informados que un APE≤0.2ng/ml confirmado en un segundo estudio constituye una evidencia de recurrencia y que tiene alto riesgo de progresión de su enfermedad asociado a desarrollar metástasis y morir.
En el año 2005 aparecen los informes de 3 estudios clásicos fase iii aleatorizados para valorar la utilidad de la RTA en pacientes sometidos a PR retropúbica con MQ+, extensión extraprostática establecida y/o invasión a VS.
El estudio EORTC 22911 realizado por Bolla et al.42, el ARO 96-02/AUO AP 09/95, estudio alemán realizado por Wiegel et al.43 y el del Grupo Oncológico del Sur Oeste (SWOG 8794) realizado por Thompson et al44,45 demostraron sin ambigüedad que la RTA fue significativamente mejor que la observación o vigilancia con tratamiento retardado hasta la FBQ (tabla 8).
Estudios aleatorizados comparando radioterapia adyuvante (RTA) vs. observación (O) en pacientes con prostatectomía radical en etapa pT3
| Estudio | Supervivencia libre de falla bioquímica (RTA vs. O), % | Supervivencia libre de progresión clínica, % |
|---|---|---|
| EORTC 22911 Bolla et al. | 74 vs. 52 | 85 vs. 75.5 |
| ARO 96-02/AUO AP 09/95) Wiegel et al. | 81 vs. 50 | 81 vs. 60 |
| SWOG S8794 Thompson et al. | 61 vs. 38 | 84 vs. 69 |
Las conclusiones de estos investigadores indican que la RTA después de la PR en pacientes con pT3N0M0 reduce significativamente el riesgo de recurrencia del APE, metástasis y mejoran la supervivencia libre de progresión clínica.
Del análisis de estos estudios hay algunas observaciones: en el grupo de observación del SWOG 8794 y EORTC 22911, el 35% y el 15% de los pacientes tenían APE detectable post-PR; poblaciones muy heterogéneas respecto a las variables de clasificación; grados de Gleason más altos con relación a estudios contemporáneos; volumen tumoral de las décadas 1980-1990 mayores que en los pacientes actuales (T1c); dosis modestas de radiación 60-64Gy con técnica convencional. En más del 30% de los pacientes de los estudios SWOG 8794 y EORTC 22911 no hubo segunda revisión histopatológica de la pieza quirúrgica.
En el grupo de observación EORTC 22911 el 56% de los pacientes no tuvieron recaída y en el SWOG el 38%; probablemente el 50% se estaría sobretratando con los efectos adversos de RT con mayores costos.
Los estudios SWOG 8794 y el EORTC 22911 evaluaron los resultados en los pacientes con niveles indetectables y detectables post PR (4-6 semanas). Pacientes que recibieron RTA con niveles detectables de APE, la supervivencia libre de FBQ, progresión de la enfermedad y metástasis fueron inferiores a los pacientes que recibieron RTA con niveles indetectables.
Aunque hubo respuesta de los pacientes con diferentes grupo de riesgo, los estudios EORTC 22911 y ARO 96-02/AUO AP 09/95 son de seguimiento corto para evaluar el efecto de la RTA en la supervivencia global. En el estudio SWOG 8794 sí hubo evidencia del beneficio sobre la supervivencia global y supervivencia libre de metástasis.
Se ha demostrado que el TH adyuvante e inmediato a la cirugía radical de la próstata en los pacientes con CaP localmente avanzado, es decir pT3a, pT3b y N1M0, ha sido efectivo en el pronóstico de estos pacientes.
La supresión androgénica y la RT externa parecen tener un efecto aditivo sobre el control local por la inducción de apoptosis, como se ha demostrado en estudios de investigación experimental y clínicos9,10.
En el estudio RTOG 85-3114 se hizo el análisis de un subgrupo de hombres en los que se realizó PR; 139 pacientes tenían indicación para tratamiento adyuvante (extensión extraprostática e invasión a VS). De estos, 71 recibieron tratamiento adyuvante con RT, 60-65Gy y supresión androgénica con análogos por 6 meses y 68 solo RT.
La supervivencia libre de FBQ a 5 años fue del 65% para el grupo combinado vs. el 42% para el grupo que solo recibió RT.
Otro estudio clínico retrospectivo no aleatorizado es el realizado por Eulau et al. de la Escuela de Medicina de la Universidad de Stanford46 para evaluar si el TH con RTA a la PR en pacientes con cáncer localmente avanzado tenía impacto en la supervivencia de FBQ, en la supervivencia libre de recurrencia clínica y supervivencia global.
Se revisaron los expedientes de 105 pacientes consecutivos tratados con RTA después de PRR entre 1985 y 1995 con un seguimiento medio de 4.5 años.
De estos 105 pacientes, 31 recibieron supresión androgénica con análogos LHRH y antiandrógenos por 6 meses, iniciados 2 meses antes de la RTA, y 74 pacientes solo RT. La dosis de esta última fue de 60-70Gy para la fosa prostática.
La supervivencia libre de FBQ en el grupo de tratamiento combinado fue mayor, 56 vs. 37%. La supervivencia libre de recurrencia clínica también fue mayor para el grupo combinado, 100 vs. 70% a 5 años.
En un estudio clínico prospectivo aleatorizado realizado por el ECOG-EST 3886 (Grupo Oncológico Cooperativo del Este), Messing et al.47 encontraron que la supervivencia media libre de FBQ y la supervivencia global mejoró significativamente en los pacientes en etapa pT3a, pT3b y en algunos con 1-2 ganglios positivos de la linfadenectomía pélvica bilateral, cuando recibieron TH adyuvante inmediato a la PR (orquiectomía bilateral o análogos en forma continua), que aquellos que se vigilaron y recibieron el TH diferido al tiempo de la FBQ o clínica (tabla 9).
Estudio ECOG- EST 3886, 98 pacientes etapa clínica T1b-T2 con PR y LPB con ganglios positivos. Seguimiento medio 11.9 años
| Resultados | Grupo 1 PR y TH inmediata, 47 pacientes | Grupo II PR y observación TH diferida, 51 pacientes |
|---|---|---|
| Supervivencia media libre de falla bioquímica | 13.9 años, 22 pacientes (47%) | 2.4 años, 44 pacientes (88%) |
| Evidencia clínica de recurrencia y APE | 13.9 años, 19 pacientes (40%) | 4.1 años, 38 pacientes (75%) |
| Pacientes fallecidos | 17 pacientes (36%) | 28 pacientes (55%) |
| Muertes por cáncer de próstata | 7 pacientes (15%) | 25 pacientes (48%) |
| Supervivencia global | 64% | 45% |
LPB: linfadenectomía pélvica bilateral; PR: prostatectomía radical; TH: tratamiento hormonal.
Con toda esta información detallada basada en conocimientos científicos no se puede negar que los tratamientos combinados, es decir, cuando se agrega RT y/o TH a los pacientes con cánceres patológicamente localmente avanzados (pT3a-pT3b), estos pacientes tienen un mejor pronóstico.
Basados en estos mismos conocimientos científicos, RT y TH adyuvantes en pacientes con pT3a- pT3b pueden ser una opción válida. Estudios prospectivos al respecto son necesarios.
ConclusionesEn pacientes con CaP localizado T1c-T2-N0M0, RTC-3D y RTIM es recomendada aun en pacientes jóvenes que no aceptan la intervención quirúrgica, y en pacientes con cirugía prostática previa por HPB. Hay evidencias consistentes de que en pacientes con riesgo intermedio y alto la RTC-3D y RTIM, combinado con bloqueo androgénico aumentan la supervivencia libre de FBQ y supervivencia global.
Para pacientes con CaP localmente avanzado T3 estas técnicas de radiación y TH por 2 años tienen influencia favorable en la supervivencia global aun superior a la sola PR.
Múltiples estudios han confirmado que la RTIM es la forma más segura de liberar dosis altas de radiación a la próstata.
La RTIM ha reducido en forma considerable la toxicidad rectal y ha permitido la aplicación escalada de dosis de radiación a la próstata a niveles anteriormente irrealizables.
La RTIM debe ser considerada como el estándar de tratamiento para el CaP clínicamente localizado. Los márgenes quirúrgicos + son predictores de recurrencia local, y estos pacientes son los que mejor responden a la RTA.
La RTA para pacientes con CaP, pT3 reduce significativamente el riesgo de progresión bioquímica y clínica.
Las evidencias basadas en el conocimiento científico han mostrado que la RT y TH en pacientes con enfermedad patológica pT3 tienen un impacto positivo en la supervivencia libre de falla bioquímica, supervivencia libre de recurrencia clínica y supervivencia global.
Basados en estos mismos conocimientos RT y TH adyuvantes en pacientes con pT3a-pT3b pueden ser una opción válida. Estos tratamientos deben ser discutidos con los pacientes y manejados según la preferencia de los mismos. Como algunos autores lo han expresado «el mejor tratamiento para el cáncer es aquel que sea el mejor para cada paciente en particular».
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.