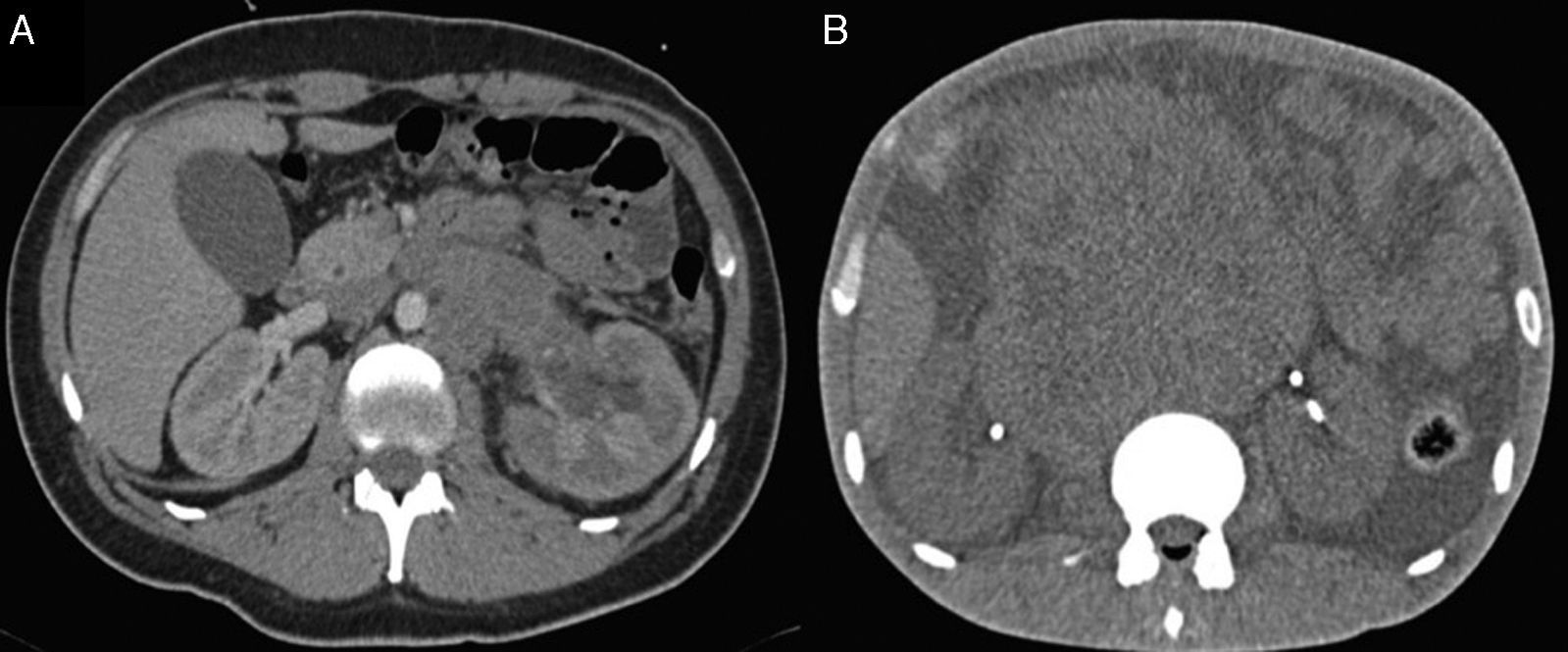
Durante la evolución del cáncer testicular, la actividad retroperitoneal puede condicionar compresión urinaria, especialmente en etapas avanzadas. Cuando se presenta requiere derivación urinaria.
ObjetivoDescribir la presentación clínica de la uropatía obstructiva (UO) asociada al cáncer testicular al momento del diagnóstico, correlacionando variables de la neoplasia para establecer asociaciones entre ambas entidades.
Material y métodosEstudio retrospectivo de julio de 2010 a junio de 2015. Se incluyeron 98 pacientes valorando la presencia de UO con tomografía abdominal y análisis estadístico a fin de establecer asociaciones significativas entre las variables.
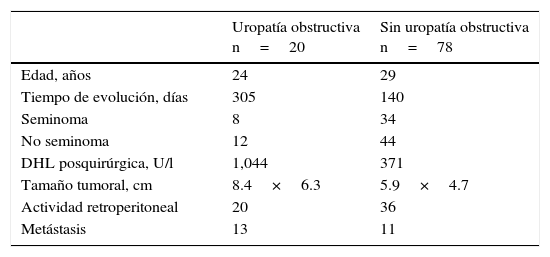
ResultadosVeinte pacientes (20.2%) con UO, promedio de edad 24 años, ECOG 1, tiempo de evolución 305 días. Ocho pacientes con tumor seminomatoso (40%), 12 no seminomatoso (60%) de los cuales la histología más frecuente fue senos endodérmicos (66%), seguido de carcinoma embrionario y teratoma (50%, respectivamente). Tamaño promedio del conglomerado ganglionar 4.3cm, el 65% tenían metástasis al diagnóstico, estadio clínico más frecuente IIIC (50%). El 40% presentaron elevación de creatinina.
No hubo resultados significativamente estadísticos entre el desarrollo de enfermedad retroperitoneal e histología (p=0.72), tiempo de evolución (p=0.44) ni el lado (p=0.44).
El tamaño tumoral testicular se correlacionó con el desarrollo de UO (p<0.05), lo mismo que el estadio pT (p<0.05), etapa N (p<0.05), las metástasis (p=0.001), la DHL (p<0.05), la etapa clínica (p<0.05) y la edad joven (p<0.05)
ConclusionesLa UO es una comorbilidad asociada al cáncer germinal testicular y suele implicar etapas avanzadas. Pacientes jóvenes en mal estado funcional, con tumores voluminosos y niveles elevados de DHL tras orquiectomía deben evaluarse para descartar compresión urinaria.
During testicular cancer progression, retroperitoneal activity can condition urinary compression, especially in advanced stages. When this presents, it requires urinary diversion.
AimTo describe the clinical presentation of obstructive uropathy (OU) associated with testicular cancer at the time of diagnosis, correlating the variables of the neoplasia to establish associations between the 2 entities.
Material and methodsA retrospective study encompassing the time frame from July 2010 to June 2015 was conducted that included 98 patients with testicular cancer, evaluating the presence of OU through abdominal tomography and statistical analysis for the purpose of establishing significant associations between the variables.
ResultsTwenty patients (20.2%) presented with OU, with a mean age of 24 years, ECOG 1, and a progression time of 305 days. Eight patients had seminomatous tumor (40%) and 12 had nonseminomatous tumor (60%), of which the most frequent histology was endodermal sinuses (66%), followed by embryonal carcinoma and teratoma (50%, respectively). The mean size of the lymph node conglomerate was 4.3cm, 65% of the patients had metastasis upon diagnosis, and the most frequent clinical stage was IIIC (50%). Forty percent of the patients had elevated creatinine.
There were no statistically significant results between the development of retroperitoneal disease and histology (P=0.72), progression time (P=0.44), or laterality (P=0.44).
Testicular tumor size was correlated with the development of OU (P<0.05), the same as was stage pT (P<0.05), stage N (P<0.05), metastases (P=0.001), LDH (P<0.05), clinical stage (P<0.05), and young age (P<0.05)
ConclusionsOU is a comorbidity associated with germ cell testicular cancer that usually involves advanced stages. Young patients with poor functional status, with large tumors, and elevated LDH levels after orchiectomy should be evaluated to rule out urinary compression.
Los avances en el tratamiento del cáncer testicular han cambiado radicalmente en los últimos 50 años; entonces la posibilidad de morir de la enfermedad una vez que esta se volvía metastásica era del 90% en el primer año, en la actualidad la cura se consigue en el 95% de los casos de cáncer testicular no metastásico y en más del 80% de los metastásicos1. Durante la evolución natural del cáncer de testículo, la actividad tumoral en retroperitoneo que condiciona compresión urinaria es una causa relativamente frecuente de morbilidad, especialmente en etapas avanzadas de la enfermedad2.
La obstrucción al flujo urinario puede ocurrir en cualquier parte del tracto. La uropatía obstructiva (UO) puede ser parcial o completa, uni- o bilateral, aguda o crónica, intrínseca o extrínseca a la vía urinaria. Su reconocimiento oportuno resulta fundamental debido a que es reversible si se corrige rápidamente. De no tratarse oportunamente, la UO predispone desde a una infección del tracto urinario hasta a una urosepsis y eventualmente a enfermedad renal crónica terminal3.
ObjetivoDescribir la presentación clínica de la UO asociada al cáncer testicular así como su relación con determinadas variables de la neoplasia a fin de establecer una posible asociación entre ambas entidades eminentemente urológicas.
Material y métodosMediante un análisis retrospectivo, se revisaron los registros médicos de 126 pacientes con diagnóstico preoperatorio de cáncer de testículo, establecido mediante historia clínica, exploración física, exámenes preoperatorios incluyendo marcadores tumorales, así como ultrasonido testicular2 los cuales se llevaron a orquiectomía radical (OR) abierta vía inguinal entre el período del 3 de julio de 2010 al 19 de junio de 2015 en el Hospital General «Dr. Manuel Gea González». Una vez establecido el diagnóstico de cáncer testicular se realizó tomografía axial computarizada (TAC), ya sea previo a la OR en los casos altamente sugestivos de malignidad o en las primeras 3 semanas de postoperados, a fin de establecer la etapa clínica de la enfermedad y estudiar la presencia de adenopatías retroperitoneales y su posible UO asociada. Se incluyeron aquellos pacientes con diagnóstico histopatológico de tumor primario del testículo de células germinales con tomografía dentro del período establecido, excluyéndose aquellos que tuvieron tumor testicular secundario o de etiología no germinal, así como masas testiculares no cancerígenas o a los que no se les realizó TAC en las primeras 3 semanas de postoperados o que presentaron UO no asociada a actividad tumoral retroperitoneal (litiasis, estenosis ureteral, etc.). Se realizó un análisis estadístico utilizando el software SPSS (versión 22.0, IBM) comparando los grupos con y sin UO así como sus variables clínicas y paraclínicas particulares y herramientas estadísticas como la t de Student, X2 o U de Mann-Whitney según se tratara de variables cuanti- o cualitativas.
ResultadosSe trataron 126 pacientes con OR, se encontraron 117 con tumor primario del testículo de células germinales, los 9 restantes consistieron en: 4 necrosis coagulativas o infecciosas, 3 linfomas no Hodgkin, un paciente con tumor de Sertolli-Leydig y uno con liposarcoma paratesticular por lo que se excluyeron del análisis.
De los 117 pacientes con tumor germinal primario, 19 se excluyeron al no cumplir criterios para ser incluidos en el análisis, ya sea por pérdida del seguimiento, o carencia de TAC para evaluar la UO en las primeras 3 semanas tras la cirugía, así como extravío multifactorial de la información clínica, convirtiendo dichos casos en poco confiables o evaluables.
Los 98 pacientes restantes que cumplieron los criterios de inclusión se dividieron en 2 grupos: pacientes con UO secundaria a actividad tumoral retroperitoneal por cáncer testicular germinal y pacientes sin actividad tumoral retroperitoneal. En ambos grupos se estudiaron variables tanto clínicas, como la edad, talla, estado funcional (evaluada mediante el sistema del Eastern Cooperative Oncology Group [ECOG], también llamada de Zubrod o escala de la OMS), lado del tumor primario (izquierdo, derecho, bilateral) y tiempo de evolución desde el inicio de la sintomatología hasta el momento de la OR; así como paraclínicas: nivel de creatinina, marcadores tumorales pre- y postoperatorios, TAC toracoabdominal (contrastada cuando los niveles de azoados lo permitieron), reporte histopatológico (tamaño del tumor, presencia de invasión linfovascular). A todos los pacientes se les clasificó de acuerdo al sistema TNM para cáncer de testículo y se les asignó una etapa clínica así como un grupo pronóstico (tabla 1).
Se encontraron 20 pacientes con UO que representaron el 20.4% de los casos y 78 pacientes sin UO (79.5%) y se compararon las distintas variables en ambos grupos.
TallaSe ha señalado una posible asociación entre parámetros antropométricos como la talla y el riesgo de cáncer de testículo4, reportándose en algunas series la talla muy alta como un factor de riesgo incrementado de tumores germinales de testículo, mientras una talla corta pareciera ser factor protector4,5. El promedio de la talla de nuestros pacientes fue de 1.69m, moviéndose en un rango de 1.50-1.90m. Comparando este indicador según la ocurrencia de UO, no se detectó diferencia estadísticamente significativa en las tallas promedio de los pacientes de ambos grupos: (sin UO: 1.69m, con UO 1.70m) (t=−0.434, gl=27.448, p>0.05).
EdadLa edad promedio de los pacientes fue de 27.5 años, habiéndose observado edades que van de los 14 a los 73 años. Comparando los promedios de edad según la ocurrencia de UO, se detecta una diferencia estadísticamente significativa en ambos grupos, es decir, la edad promedio del grupo con UO es menor (promedio 24.05) que la del grupo sin UO (28.41), observándose que el rango de edades del primer grupo va de 19 a 36 años, a diferencia de los que no presentaron UO, en donde el rango de edades va de 14 a 73 años (t=2.901, gl=83.062, p<0.05).
Tiempo de evolución a partir del diagnósticoEl tiempo de evolución del padecimiento se midió a partir del inicio de los síntomas y hasta el momento del diagnóstico, el promedio de tiempo en nuestros pacientes fue de 6.8 meses; el tiempo de evolución máxima a partir del diagnóstico fue de 61 meses: aun cuando se observa un tiempo máximo de evolución mayor en el grupo con UO (61 meses en comparación con 49 en el grupo sin UO) comparando los grupos, la mayor proporción de los pacientes tuvo un tiempo de evolución hasta el diagnóstico de entre 1 y 12 meses, siendo mayor el tiempo de evolución en aquellos que desarrollaron UO. A pesar de ello no se encontró diferencia estadísticamente significativa entre ellos, es decir, el comportamiento en cuanto al tiempo de evolución es semejante entre ambos (X2=0.591, gl=1, p>0.01).
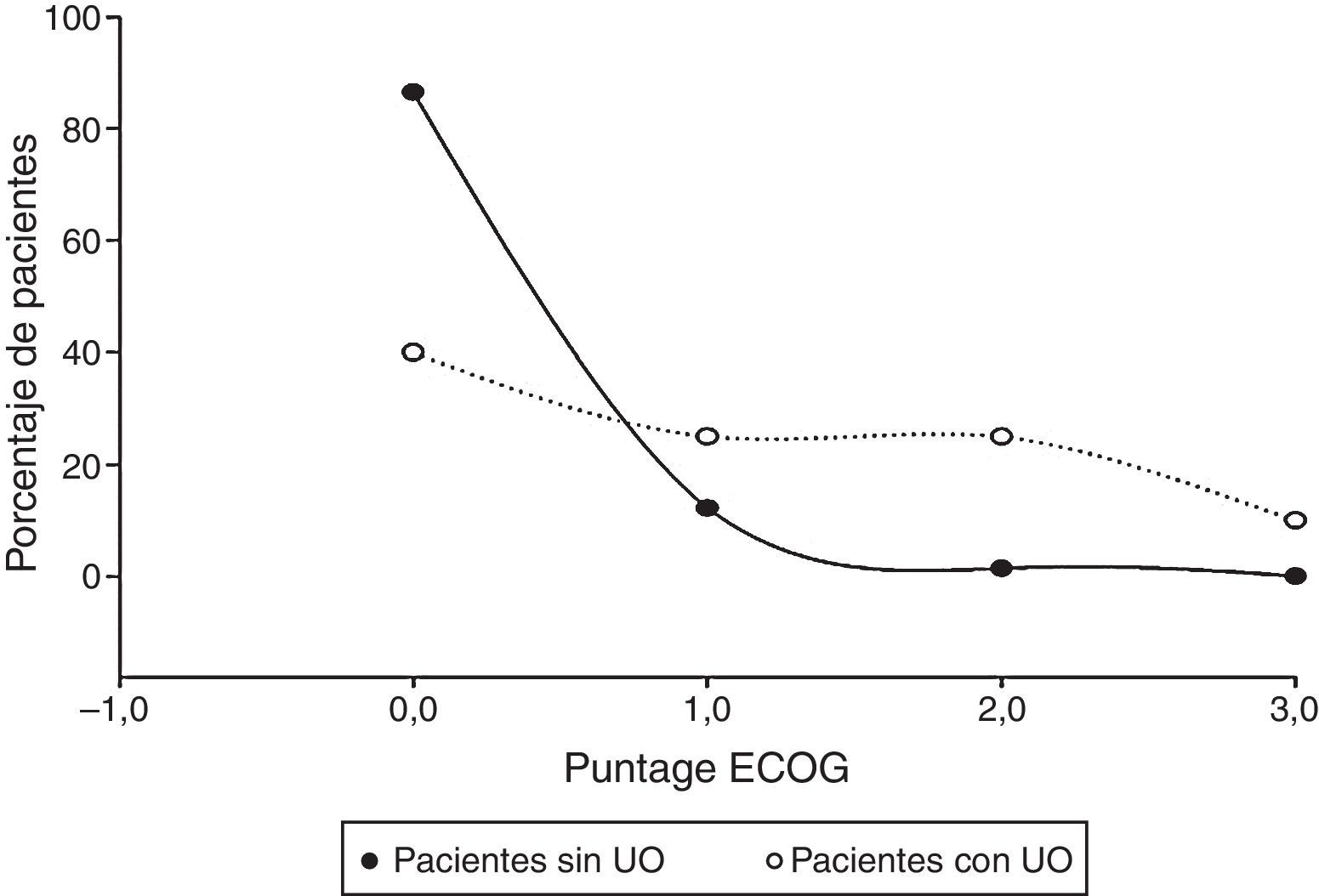
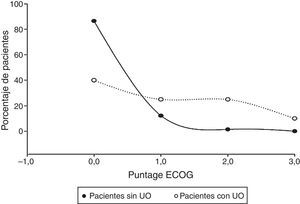
Estado funcional del pacienteLos pacientes fueron evaluados al momento de su presentación mediante la escala ECOG, descrita por Oken et al. en 19826 que mide la evolución de las capacidades del paciente oncológico en su vida diaria, en una escala de 0 a 5. Los pacientes estudiados tuvieron puntajes ECOG entre 0 y 3, ninguno de ellos llegó al rango 4 de la escala, la mayoría de los pacientes se ubicaron en el 0, sin embargo, los pacientes con UO presentaron puntajes promedio más altos (66.20%), a diferencia de aquellos sin UO (42.45%), traduciendo una diferencia estadísticamente significativa en los puntajes de los pacientes con UO (0-3) que en aquellos que no la presentaron (0-2) (U de Mann-Whitney: Z=−4.671, p<0.05) (fig. 1).
Reporte histopatológicoClásicamente el cáncer testicular germinal se clasifica en seminoma y no seminoma. Se asoció dicha variable con la presencia o no de UO. Del total (n=20), un 58% fueron no seminoma; comparando el tipo histológico de aquellos pacientes con y sin UO (tabla 2), las proporciones de ambos tipos son similares, no resultando ser estadísticamente significativas en ambos grupos de pacientes (X2=.035, gl=1, p>0.05).
De los 78 pacientes sin UO 33 resultaron seminomas (42%) y 45 no seminoma (57%) de los cuales el componente más frecuente fue el carcinoma embrionario en el 36%, seguido del componente de teratoma en el 34% y senos endodérmicos en el 30% de los casos.
Lado afectadoEl lado afectado en mayor proporción fue el derecho en poco más de la mitad de los casos (54%), el mismo comportamiento fue observado en los grupos con y sin UO, no habiendo diferencia estadísticamente entre ellos (X2=0.413, gl=2, p>0.05), por lo que no hay asociación entre el lado afectado y la posibilidad de desarrollar UO. Solo un paciente del grupo con UO ya había tenido tumor en el testículo contralateral previamente mientras que en el grupo sin UO se identificaron 2 pacientes con tumor bilateral metacrónico.
Marcadores tumorales preoperatoriosAlfafetoproteínaLa alfafetoproteína es una glucoproteína producida por el hígado, que se eleva en condiciones no malignas como embarazo, hepatitis viral y cirrosis. En el caso del cáncer de testículo no seminomatoso, esta se eleva hasta en el 70% de los pacientes7,8.
Las cifras de alfafetoproteína previa y posterior a la OR fueron mayores en la primera medición, sin embargo estas diferencias no fueron estadísticamente significativas como predictor de UO (t=0.200, gl=81, p>0.05).
Deshidrogenasa lácticaEl valor de la deshidrogenasa láctica (DHL) se ha relacionado con la carga tumoral. Suele estratificarse como valor de S (serum marker), cuyos rangos van de S0 a S3 en función del resultado postoperatorio. En términos generales, la mayor proporción de los pacientes se ubicó en el nivel S0 (75%), seguido por el nivel S2 con el 18.8% de estos. Al comparar el resultado de la DHL en cada grupo (con y sin UO), se observa que en ambos se registraron pacientes en los 4 niveles (S0 a S3), sin embargo, en aquellos sin UO, la mayor proporción se registra en el nivel S0, a diferencia de aquellos con UO, en donde la mayor proporción de pacientes están en el nivel S2 (60%) seguidos del nivel S0 en donde se ubica el 26% de los pacientes. Las diferencias observadas entre los grupos se confrontaron con una prueba U de Mann-Whitney, que permite asegurar con un 95% de confianza que existe una diferencia estadísticamente significativa entre la distribución de las proporciones de pacientes con los diferentes niveles de DHL postoperatorios entre los grupos (Z=−5.425, p<0.05)
Tamaño de la tumoraciónDadas las dificultades que implica cuantificar el tamaño tumoral en 3 dimensiones, se decidió estimar la superficie tumoral en base al reporte de las dimensiones del tumor medidas por el patólogo al momento del corte de la pieza. Las tumoraciones en promedio midieron 34.9cm2, con tamaños que van desde menos de 1cm2 a 170cm2, aunque la mitad de ellas dieron más de 23cm2.
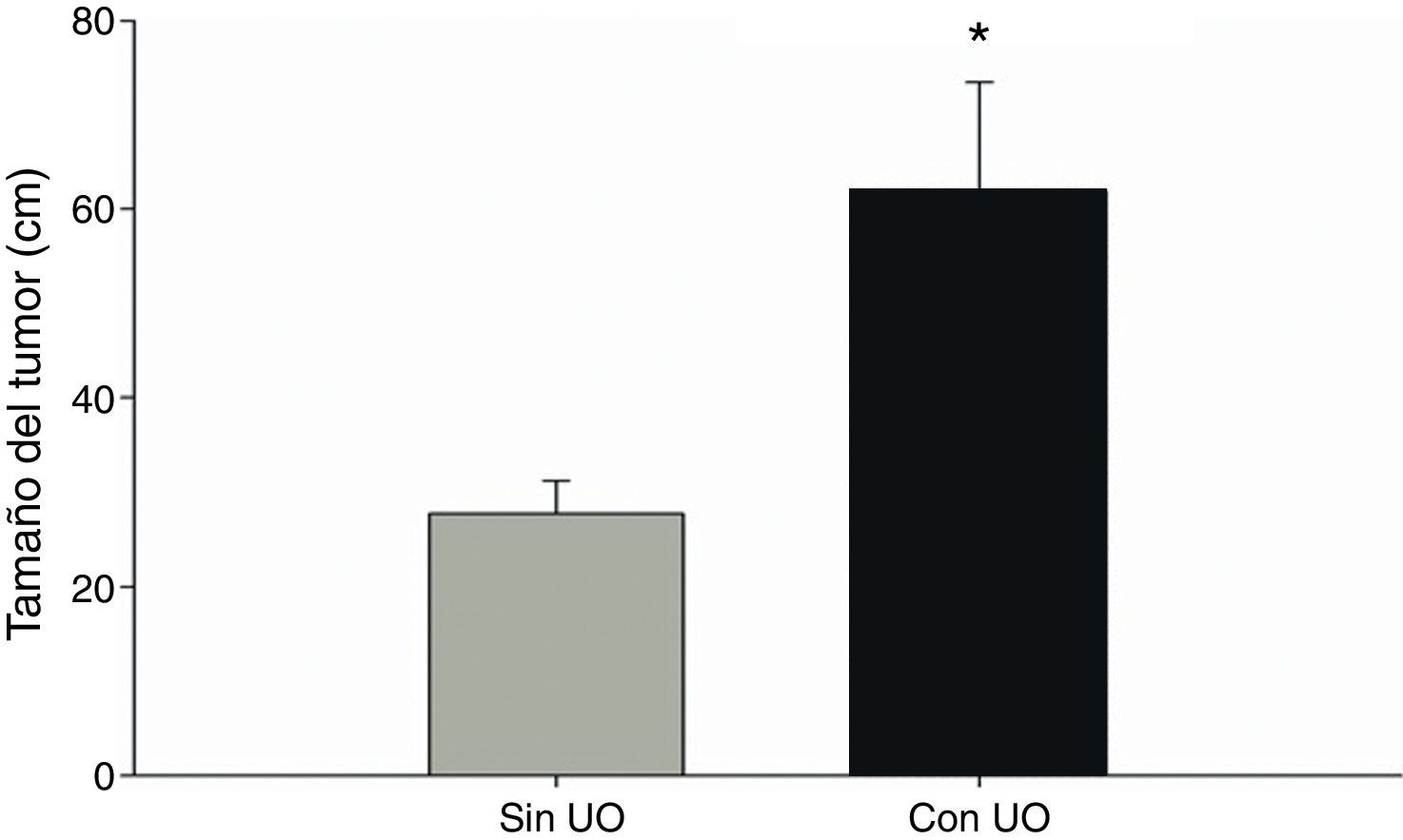
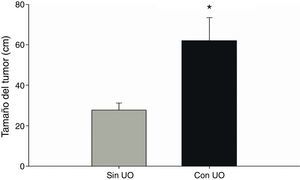
Al analizar los parámetros en cada grupo, se observó que las tumoraciones de mayor tamaño corresponden a los pacientes con UO: el tamaño promedio en estos pacientes fue de más del doble de los del otro grupo (61.9cm2 vs. 27.8cm2), en aquellos con UO la mitad del grupo midió 51.5cm2 o más y el mayor tamaño registrado fue de 154cm2, a diferencia del otro grupo en donde la mitad de ellos midió 16cm2 o menos y el mayor tamaño registrado fue de 170cm2, es decir, mayores tamaños tumorales se asociaron al desarrollo de UO.
Estas diferencias fueron estadísticamente significativas, de acuerdo a la prueba t de Student (t=-2.820, gl=20.210, p<0.05) (fig. 2).
Grado de invasión testicular (pT)La invasión del tumor dentro y fuera del testículo se califica en grados que van de 1 a 4, de acuerdo a el sistema TNM9,10. En general, en el grupo de pacientes estudiados, la mayor proporción de pacientes registraron una invasión T2 (56.7%), seguido por T1 en el 32%. Si analizamos por grupo, se observó que aquellos con UO tuvieron grados de invasión mayores (T2 y T3), que aquellos sin UO (T1, T2). Las diferencias observadas fueron evaluadas con la prueba U de Mann-Whitney, a partir de la cual con un 95% de confianza es posible asegurar que existe una diferencia estadísticamente significativa en los grados de invasión testicular en uno y otro grupo, a expensas de los mayores grados de invasión registrados en los pacientes que desarrollaron UO (Z=−4.580, p<0.05).
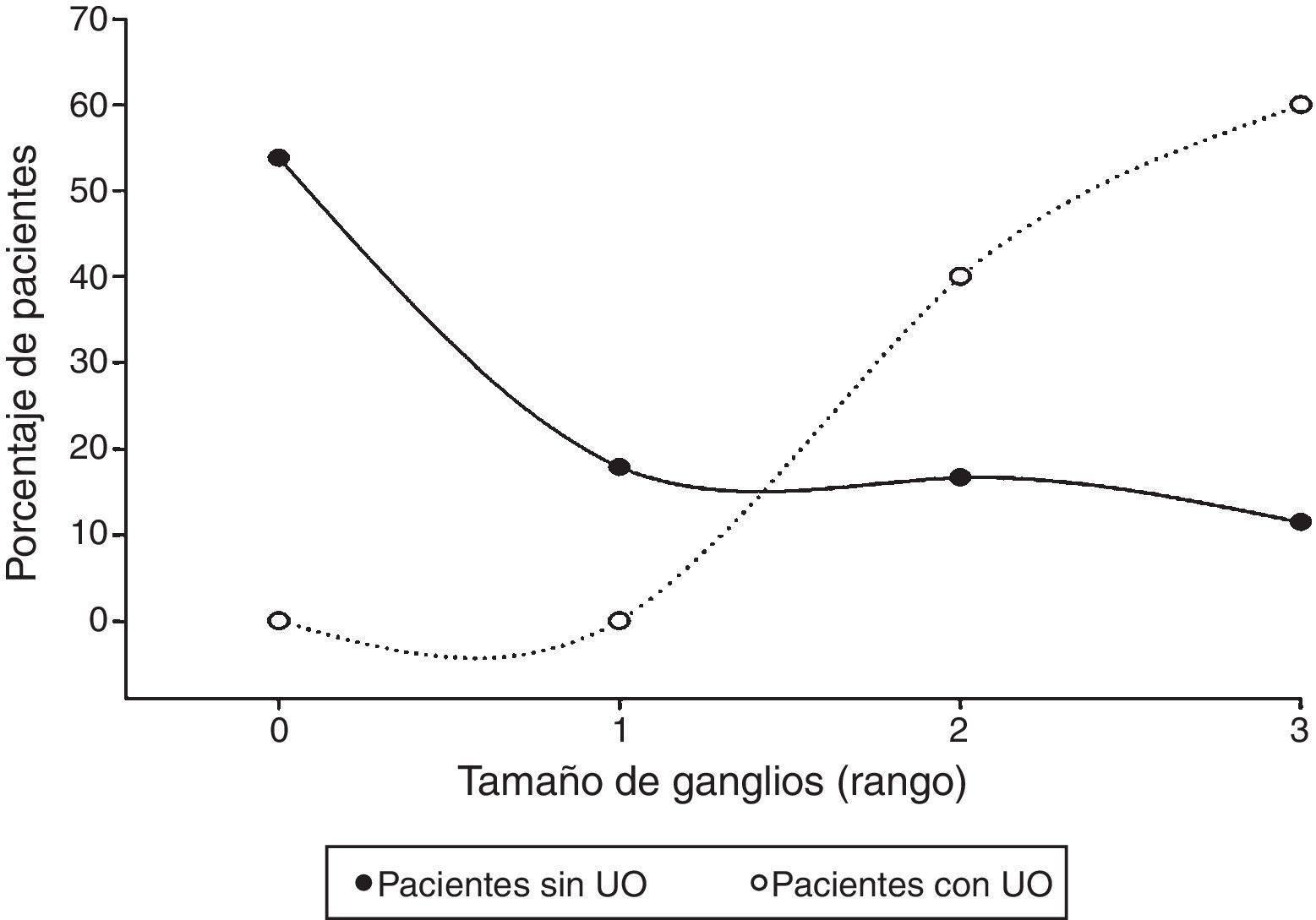
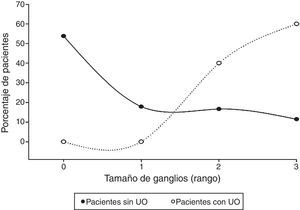
Actividad tumoral retroperitoneal (N)Con excepción del coriocarcinoma, la vía más común de diseminación de la enfermedad son los canales linfáticos desde el tumor primario hasta los ganglios retroperitoneales y de ahí a otros sitios. El retroperitoneo es el sitio inicial de metástasis en el 70-80% de los pacientes con tumor de células germinales; para los tumores del testículo derecho el drenaje son los ganglios interaortocavos infrarrenales seguido de los paracavales, mientras que para el lado izquierdo la zona primaria son los paraaórticos seguidos de los interaortocavos11. El tamaño de los ganglios fue categorizado de acuerdo a los sistemas de clasificación de invasión linfática (N) en cáncer de testículo9,10,con los rangos que van del 0 al 3; en términos generales, 4 de cada 10 pacientes presentaron N0, y 4 de cada 10 fueron>N2.
Al comparar este indicador según el desarrollo de UO, es posible observar que más de la mitad no presentaron UO (N0), a diferencia de quienes desarrollaron UO, en donde 6 de cada 10 pacientes tuvieron ganglios N3 (mayores de 5cm). Estos datos se confrontaron mediante una prueba U de Mann-Whitney, la que con un 95% de confianza determinó que existe una diferencia estadísticamente significativa entre ambos grupos, a expensas del tamaño de los ganglios del grupo que desarrolló UO (Z=−5.597, p<0.05) (fig. 3).
Metástasis (M)La actividad metastásica ocurre con relativa frecuencia, siendo agresiva y letal si no se trata oportunamente12. Las metástasis se presentaron en el 24% de los pacientes estudiados. El mayor porcentaje de metástasis (65%) ocurrió en el grupo con UO; en el otro grupo, solo el 14.1% de los pacientes la presentaron. Estos resultados se compararon mediante X2, encontrándose diferencia estadísticamente significativa a expensas de la proporción de poco más de 4 veces mayor en el grupo con UO con respecto al otro grupo (X2=22.300, gl=1, p<0.05, IC 95%)13,14.
El sitio de metástasis más común para el grupo con UO fue pulmón, seguido de hígado, sistema nervioso central, ganglios cervicales y mediastino; un paciente presentó metástasis atípicas a riñón y al plexo celiaco, mientras que en el grupo sin UO nuevamente pulmón e hígado fueron los sitios más comunes.
Creatinina al diagnósticoEl 8% de los pacientes presentaron elevación de azoados con creatinina>1.1. El valor promedio de la creatinina en los pacientes estudiados fue de 0.93, habiéndose observado valores desde 0.54 hasta 2.46. Si se comparan los grupos, los valores mayores se registraron en el grupo con UO; sin embargo, al comparar los datos estas diferencias no resultaron estadísticamente significativas. (t=−0.55, gl=96, p>0.05), lo que demuestra que la creatinina no predice UO en cáncer testicular
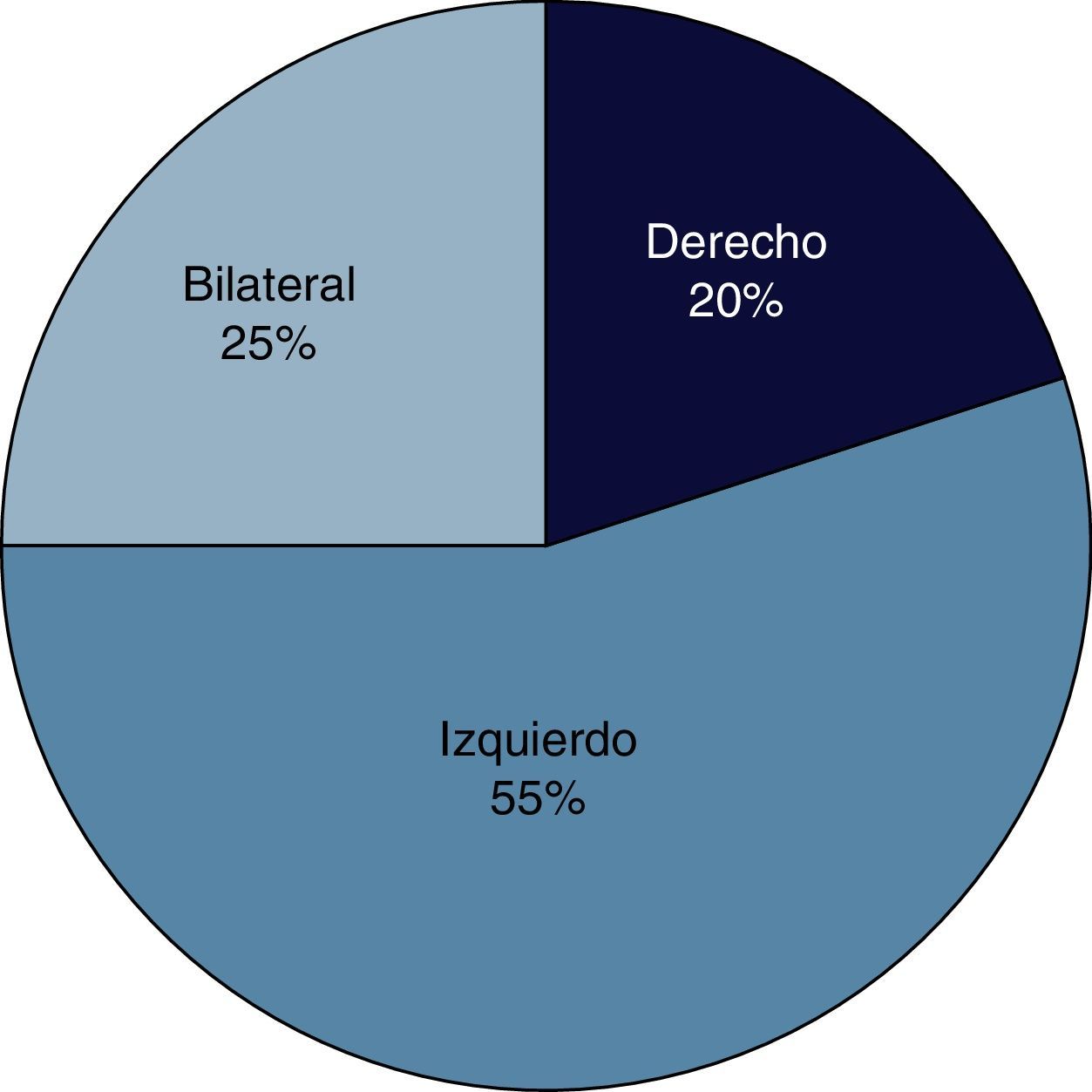
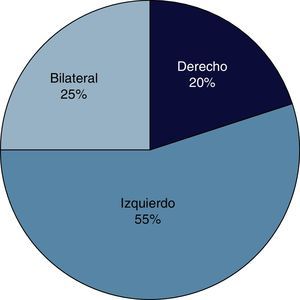
Localización de la uropatía obstructivaEn más de la mitad de los pacientes con UO la obstrucción se localizó del lado izquierdo y solo en una cuarta parte de los casos ocurrió en forma bilateral (fig. 4).
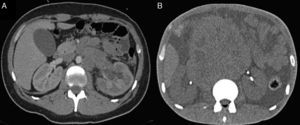
DiscusiónLa obstrucción extrínseca de la vía urinaria superior asociada a neoplasias es un fenómeno relativamente frecuente en los centros oncológicos15. Entre los tumores que más frecuentemente condicionan este padecimiento se encuentran cáncer cervicouterino, colorrectal, próstata, vejiga, linfomas y testículo, que comprimen la vía urinaria cuando las masas se encuentran en retroperitoneo o pelvis. El cáncer de testículo origina UO debido a la infiltración de los ganglios retroperitoneales, aumentándolos de volumen y causando compresión extrínseca a la vía urinaria16 (fig. 5A y B).
Los estudios recomendados en el abordaje diagnóstico incluyen: creatinina sérica, nitrógeno ureico y electrólitos séricos así como ultrasonido renal y tomografía17.
Las opciones de manejo incluyen18,19:
- 1.
Manejo expectante: Pacientes con pobre pronóstico, aquellos que se encuentran asintomáticos con función renal normal, especialmente si no se planea mayor tratamiento. No se recomienda en pacientes sintomáticos.
- 2.
Colocación endoscópica de catéter ureteral: Es el manejo de primera línea. Puede colocarse vía anterógrada o retrógrada.
- 3.
Nefrostomía percutánea: Se recomienda cuando no es posible colocar un catéter ureteral. Los cuidados y precauciones necesarias son mayores así como las posibles complicaciones.
Cuando la actividad retroperitoneal y la compresión urinaria son muy intensas el paciente puede llegar a requerir nefrectomía paliativa o por exclusión20.
De acuerdo a nuestros resultados, es posible sospechar la presencia de compresión urinaria en los pacientes con cáncer de testículo al momento que los diagnosticamos. La edad joven, un estado funcional deteriorado, así como el tamaño tumoral abultado y niveles elevados de DHL tuvieron una correlación estadísticamente significativa con la posibilidad de compresión urinaria, por lo que deben llevar al clínico a sospechar metástasis ganglionares que comprometan el tracto urinario y requieran una evaluación más extensa al momento del diagnóstico.
Los pacientes más viejos, con buen estado funcional y tumores testiculares menos voluminosos, podrían no tener compromiso de la vía urinaria por lo que su evaluación por técnicas de imagen puede realizarse en segundo término. Especial mención, y a manera de excepción, se encuentra el coriocarcinoma, tumor cuyo comportamiento biológico suele dar metástasis tempranas vía hematógena y a tejidos extranodales (sistema nervioso, piel)21.
Asimismo, estudios paraclínicos como los marcadores tumorales, se recomiendan de manera pre- y postoperatoria con especial interés en la DHL que sugiere actividad tumoral intensa22.
A pesar de no haber sido estadísticamente significativas para el desarrollo de UO variables como el reporte histopatológico, el lado tumoral, los marcadores preoperatorios y la creatinina, permiten predecir el comportamiento de la enfermedad y en ocasiones ayudan a normar la conducta terapéutica. Aun cuando no está claro si la talla es un factor de riesgo para cáncer germinal de testículo, en nuestra serie no tiene relevancia como factor de riesgo para el desarrollo de UO.
Si bien los pacientes con UO tuvieron tiempos de evolución mayores que sus homólogos sin UO y algunos de ellos se presentaron con un peor estado funcional y masas más voluminosas, el tiempo no tuvo una correlación estadística con el desarrollo de UO, al menos no directamente. Aún así los pacientes con tumores testiculares de larga evolución podrían presentar otro tipo de complicaciones.
No parece haber una asociación clara entre el desarrollo de UO y una histología en especial, aunque los tumores germinales mixtos no seminomatosos parecen presentarse con mayor frecuencia, especialmente cuando está presente el componente de carcinoma embrionario, teratoma o saco vitelino. En nuestra serie fueron más frecuentes los tumores del testículo derecho que los del izquierdo, lo cual no es factor determinante para el desarrollo de UO.
ConclusionesEn los pacientes con cáncer testicular en etapa clínica avanzada debe sospecharse UO y considerar esta entidad como un factor negativo que deteriora la calidad de vida y puede requerir tratamiento.
La UO puede encontrarse con relativa frecuencia en el cáncer testicular germinal, identificándose hasta en el 20% de nuestra población al momento del diagnóstico.
En pacientes jóvenes, en mal estado funcional, con tumores voluminosos y altos niveles de DHL debe sospecharse UO y obtener un estudio de imagen que permita corroborarlo tempranamente.
Se requiere una muestra de pacientes mayor que permita realizar una regresión logística más precisa y determine el impacto definitivo que estas entidades eminentemente urológicas tienen una sobre la otra. Se requieren estudios prospectivos que evalúen el impacto que la UO parece tener en el pronóstico de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónNinguna
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todos los autores y colaboradores por su invaluable aportación