El plasma rico en plaquetas ha emergido como una alternativa en la terapia periodontal. Hoy tenemos una curva de aprendizaje basada en la evidencia que nos muestra una primera etapa donde se utilizó como biomaterial cementante y como estimulante de la regeneración de tejido óseo. En una segunda etapa actual se aplica para la curación de heridas en tejidos blandos basado y fundamentado en la evidencia biológica, lo que ha generado grandes expectativas en varias especialidades médicas, entre las que se encuentra la odontología. Método: Se presenta un caso clínico de una paciente de 29 años de edad, no fumadora y sin enfermedad sistémica, la cual fue captada en la DEPeI de la UNAM. El diagnóstico fue una periodontitis agresiva localizada. Después de la fase I se le realizó una cirugía por colgajo con PRP y aloinjerto óseo. Resultados: Se valoró a la paciente a los 6 y 12 meses después del tratamiento y se clasificó como paciente de bajo riesgo a la recurrencia de enfermedad periodontal durante el mantenimiento con base en los seis parámetros del Dr. Lang y Tonetti. Conclusiones: El clínico de hoy entiende cada vez más la necesidad de tomar decisiones basadas en la evidencia científica. Hasta este momento, sabemos que biológicamente es posible que una concentración más alta de plaquetas puede ayudar en la cicatrización.
Platelet-rich plasma (PRP) has emerged as an alternative in periodontal therapy. Presently, there is an evidencebased learning curve showing a first stage when it was used as cementing biomaterial as well as bone tissue regeneration stimulant. In a second current stage based and substantiated on biological evidence, it is applied for soft tissue wounds healing. This has elicited great expectations in several medical specialties, including dentistry. Method: The case here presented is of a healthy, nonsmoker, 29 year old female patient who attended the Graduate and Research School, National School of Dentistry, National University of Mexico (UNAM). Diagnosis emitted was localized aggressive periodontitis. After phase I, the patient was subjected to flap surgery with PRP and bone allograft. Results: The patient was assessed 6 and 12 months after treatment. Based on the six maintenance parameters established by Drs. Lang and Tonetti, she was classified as presenting low risk of periodontal disease recurrence. Conclusions: Today's clinical operator increasingly understands the need of making decisions based upon scientific evidence. To the present date we recognize that it is biologically possible for a higher platelet concentration to foster healing.
Las enfermedades periodontales son infecciones endógenas mixtas causadas por microorganismos que colonizan y producen la destrucción progresiva de los componentes del periodonto, provocando la formación de bolsas, recesiones o ambas.1
Dichas enfermedades fueron clasificadas en el Encuentro Internacional para la Clasificación de las Enfermedades y Condiciones Periodontales en 1999, donde se denominó y caracterizó por primera vez a la periodontitis agresiva.
La periodontitis agresiva se presenta en pacientes sistémicamente sanos, principalmente jóvenes. Se caracteriza por una rápida pérdida de adherencia y destrucción ósea, inconsistente con la cantidad de depósitos microbianos presentes. En estos casos, la flora es específica, con una elevada proporción de Aggregatibacter así como P. gingivalis, y los fagocitos pueden estar afectados. Además de que otros miembros de la familia pueden presentar también dicha enfermedad.1
La periodontitis agresiva se subclasifica en localizada cuando involucra primeros molares e incisivos centrales.1
A lo largo de la historia han existido diversas técnicas para tratar esta enfermedad, ya sea reparando o regenerando los daños causados, teniendo como objetivo mejorar las condiciones periodontales, así como mantener la función y la estética. Esto no quiere decir que una técnica sea mejor que otra, sino que cada una tiene una indicación precisa. En este caso clínico se decidió reparar los daños causados por la enfermedad periodontal con plasma rico en plaquetas (PRP) combinado con aloinjerto óseo.
Como antecedente, el PRP fue reportado por primera vez por M. Ferrari en 1987 como un componente autólogo utilizado en una cirugía cardiaca a corazón abierto con la intención de disminuir el sangrado.2
Desafortunadamente, en esos años sólo podía obtenerse el PRP por medio de un separador de células o máquina de plasmaféresis. Estos aparatos son grandes y costosos. Por lo tanto, el uso inicial del PRP se limitó al quirófano, principalmente para cirugías mayores.2
La aplicación en curación de heridas mostró la posible utilización para promover el crecimiento de tejidos blandos, lo que generó grandes expectativas y un gran número de publicaciones de variadas especialidades médicas (Cuadro I).3
Especialidades médicas que han publicado el uso de plasma rico en plaquetas
| Odontología |
| • Reconstrucción mandibular |
| • Injertos óseos |
| • Implantes dentales |
| Traumatología |
| • Artroplastia, prótesis e implantes |
| • Injertos óseos |
| • Fusión espinal |
| • Tratamiento de fracturas y defectos óseos |
| • Infiltraciones intraarticulares |
| • Regeneración condroarticular |
| Oftalmología |
| • Cierre de incisiones |
| • Reparación de heridas, úlceras, abrasiones y quemaduras |
| Neurocirugía |
| • Reparación de duramadre |
| • Craneotomía en general |
| • Cirugía de tumores pituitarios |
| Cirugía cardiovascular |
| • Prótesis e injertos vasculares |
| • Aneurismas aórticos abdominal, torácico o toracoabdominal |
| • Cirugía de carótida |
| • Úlceras venosas |
| Dermatología |
| • Regeneración de dermis y epidermis |
| • Injertos de piel |
| • Quemaduras |
| • Implantes bulbares y mesoterapia |
| • Mesoterapia facial y corporal con fines reparadores y estéticos |
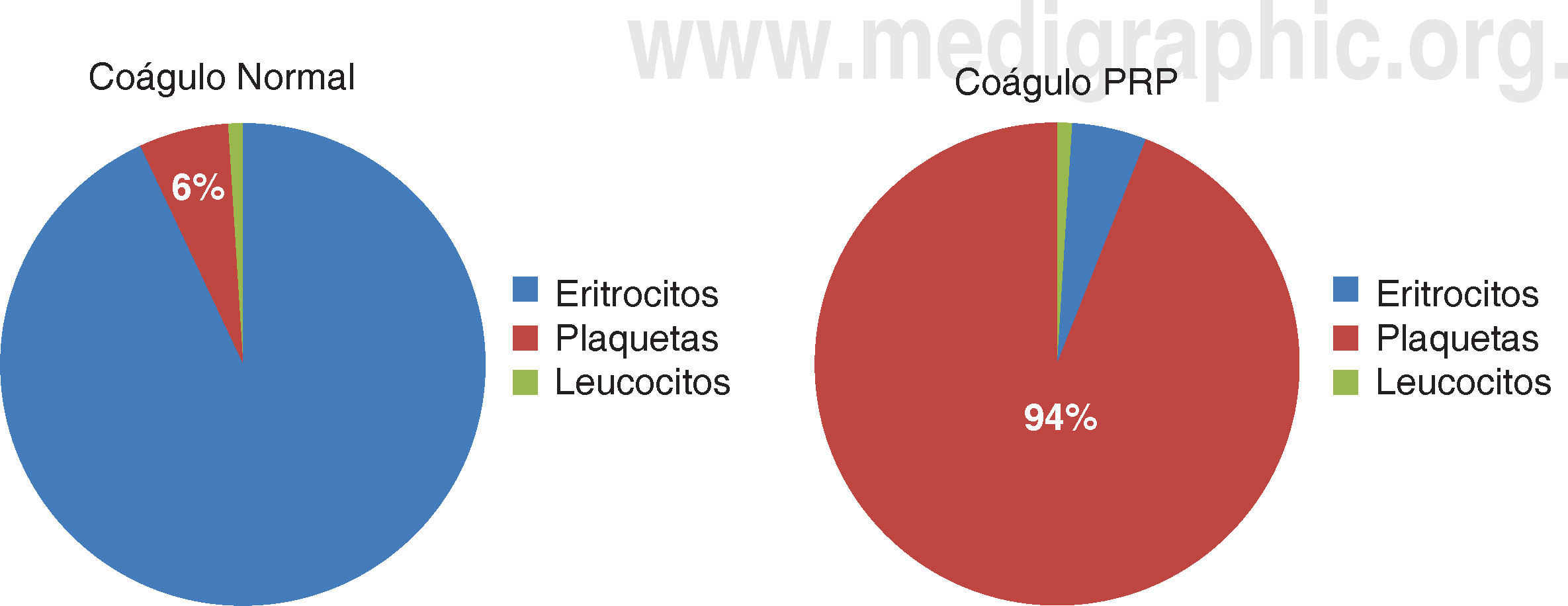
El PRP es un coágulo sanguíneo autógeno que contiene un número altamente concentrado de plaquetas. La cuenta plaquetaria mínima de este coágulo es de un millón de plaquetas/microlitro. Lo que representa de 4 a 7 veces más la cuenta normal que es de 200,000 plaquetas/microlitro.
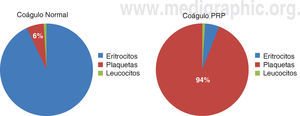
Un coágulo sanguíneo normal contiene un 94% de eritrocitos, un 6% de plaquetas y menos del 1% de leucocitos. En contraste, un coágulo sanguíneo de PRP contiene 94% de plaquetas, sólo el 5% de eritrocitos y 1% de leucocitos (Figura 1).2
Las plaquetas surgen de la fragmentación citoplásmica del megacariocito en la médula ósea. Entran a la circulación como elementos anucleares y por lo tanto, tienen una vida limitada de 7 a 10 días.4
La plaqueta tiene numerosos pseudópodos, invaginaciones de su membrana celular y vesículas internas (gránulos de almacenamiento).5 Las vesículas están compuestas por tres tipos de gránulos: lisosomales, densos y alfa.4,5 Los gránulos alfa son los gránulos de almacenamiento de los factores de crecimiento.
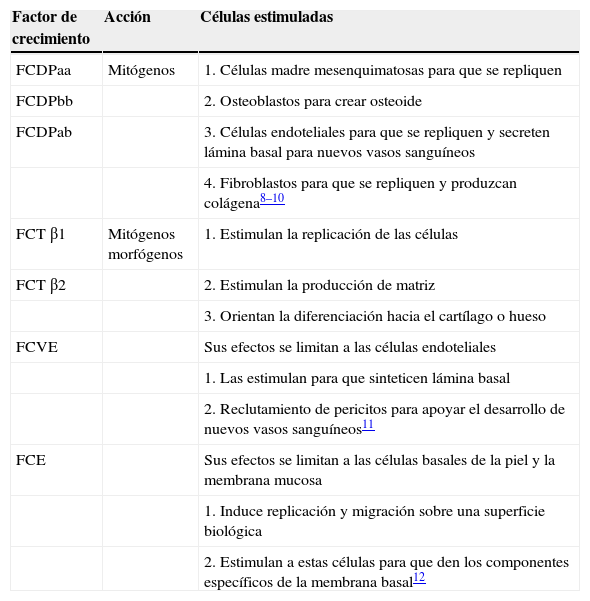
Los factores de crecimiento son proteínas señalizadoras que regulan acontecimientos claves en la reparación de un tejido, como la proliferación y diferenciación de las células, así como de su mantenimiento.6,7
Los factores de crecimiento contenidos en estos gránulos son:
- 1.
Factor de crecimiento derivado de las plaquetas isómero FCDPaa, isómero FCDPbb e isómero FCDPab.
- 2.
Factor de crecimiento transformante beta uno y dos (FCTβ-1 y FCTβ-2).
- 3.
Factor de crecimiento vascular endotelial (FCVE).
- 4.
Factor de crecimiento epitelial (FCE) (Cuadro II).
Cuadro II.Función de los factores de crecimiento.7
Factor de crecimiento Acción Células estimuladas FCDPaa Mitógenos 1. Células madre mesenquimatosas para que se repliquen FCDPbb 2. Osteoblastos para crear osteoide FCDPab 3. Células endoteliales para que se repliquen y secreten lámina basal para nuevos vasos sanguíneos 4. Fibroblastos para que se repliquen y produzcan colágena8–10 FCT β1 Mitógenos morfógenos 1. Estimulan la replicación de las células FCT β2 2. Estimulan la producción de matriz 3. Orientan la diferenciación hacia el cartílago o hueso FCVE Sus efectos se limitan a las células endoteliales 1. Las estimulan para que sinteticen lámina basal 2. Reclutamiento de pericitos para apoyar el desarrollo de nuevos vasos sanguíneos11 FCE Sus efectos se limitan a las células basales de la piel y la membrana mucosa 1. Induce replicación y migración sobre una superficie biológica 2. Estimulan a estas células para que den los componentes específicos de la membrana basal12
Los estudios sugieren que, además, las plaquetas contienen abundantes citoquinas; este término se usa para describir a un grupo de moléculas que regulan la comunicación celular como: las interleucinas que fueron agrupadas de la IL1 a la IL15, interferones, tres factores de necrosis tumoral, tres factores estimulantes de colonias y un grupo diverso de citoquinas como la osteopontina, oncostatina, linfotactina entre otras.3
Las plaquetas no contienen factor de crecimiento insulínico (FCI1 o FCI2) ni proteína morfogenética ósea (BMP).2
El fundamento de la utilización de PRP es la existencia de factores de crecimiento y otras citoquinas en los gránulos alfa de estos elementos celulares.3
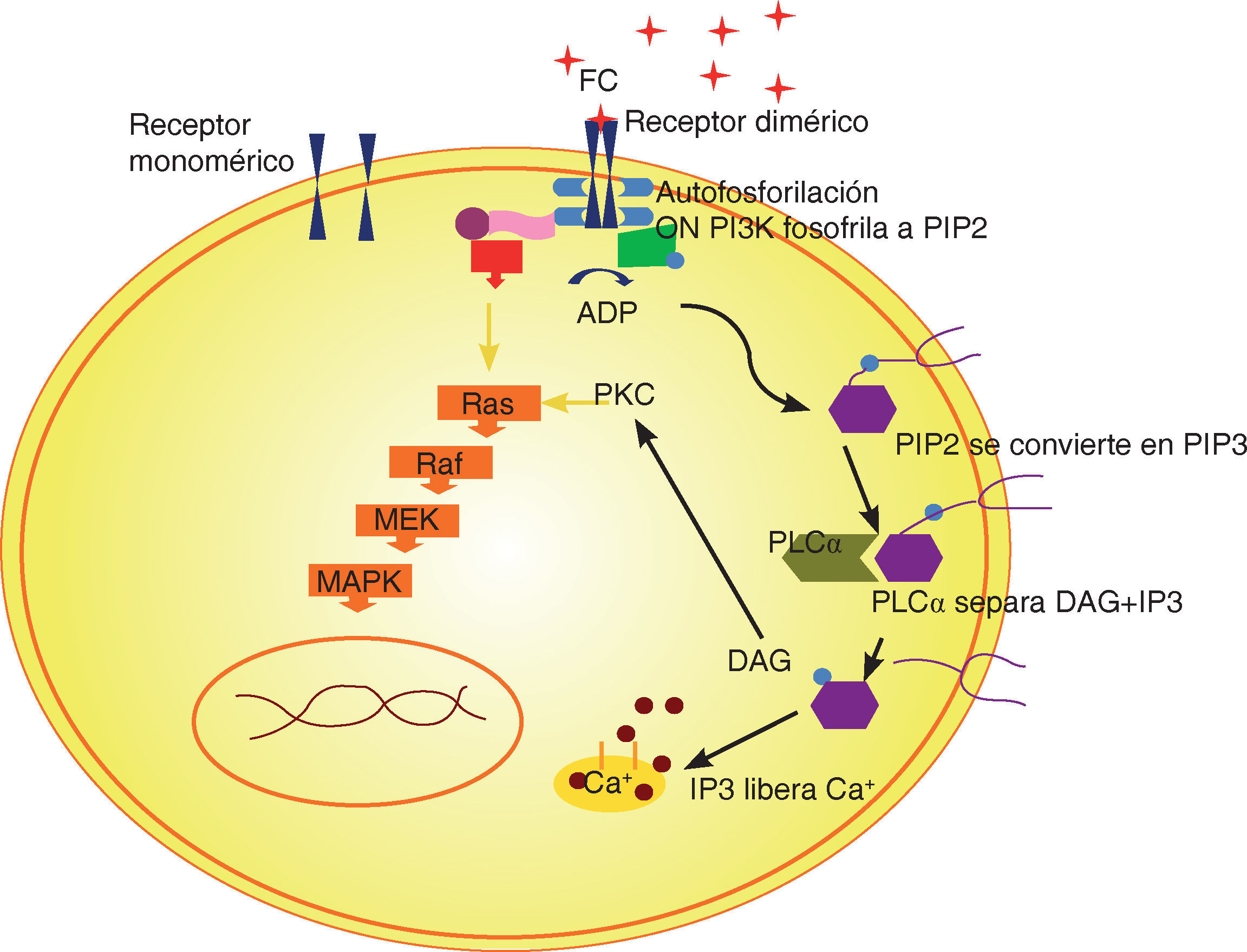
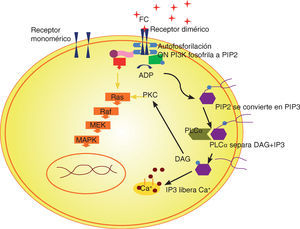
Mecanismo de acción del PRPLos gránulos alfa contenidos en las plaquetas, ya sea en un coágulo sanguíneo normal o en un coágulo de PRP, comienzan a degranularse en un lapso de 10 minutos. Secretan más del 90% de sus factores de crecimiento preempacados en menos de una hora.2,5
Los factores de crecimiento secretados se unen a la superficie externa de la membrana celular en el injerto, colgajo o herida vía receptores transmembranales. Los estudios han demostrado que las células madre mesenquimatosas adultas, los osteoblastos, los fibroblastos, las células endoteliales y las células epidérmicas, expresan los receptores para los factores en su membrana celular.12
Estos receptores transmembranales, a su vez, inducen la activación de una proteína de señalización interna que se dirige hacia el núcleo (Figura 2).
En el núcleo, la proteína transductora desbloquea una secuencia genética específica para una función celular regulada, tal como mitosis, síntesis de colágena, producción de osteoide, etcétera.
Después de la liberación inicial de factores de crecimiento relacionados con el PRP, las plaquetas sintetizan y secretan factores de crecimiento adicionales durante los siete días restantes de su vida. Una vez que la plaqueta se agota y muere, el macrófago asume la función de regulación de la cicatrización de la herida al seguir secretando factores de crecimiento.5,8
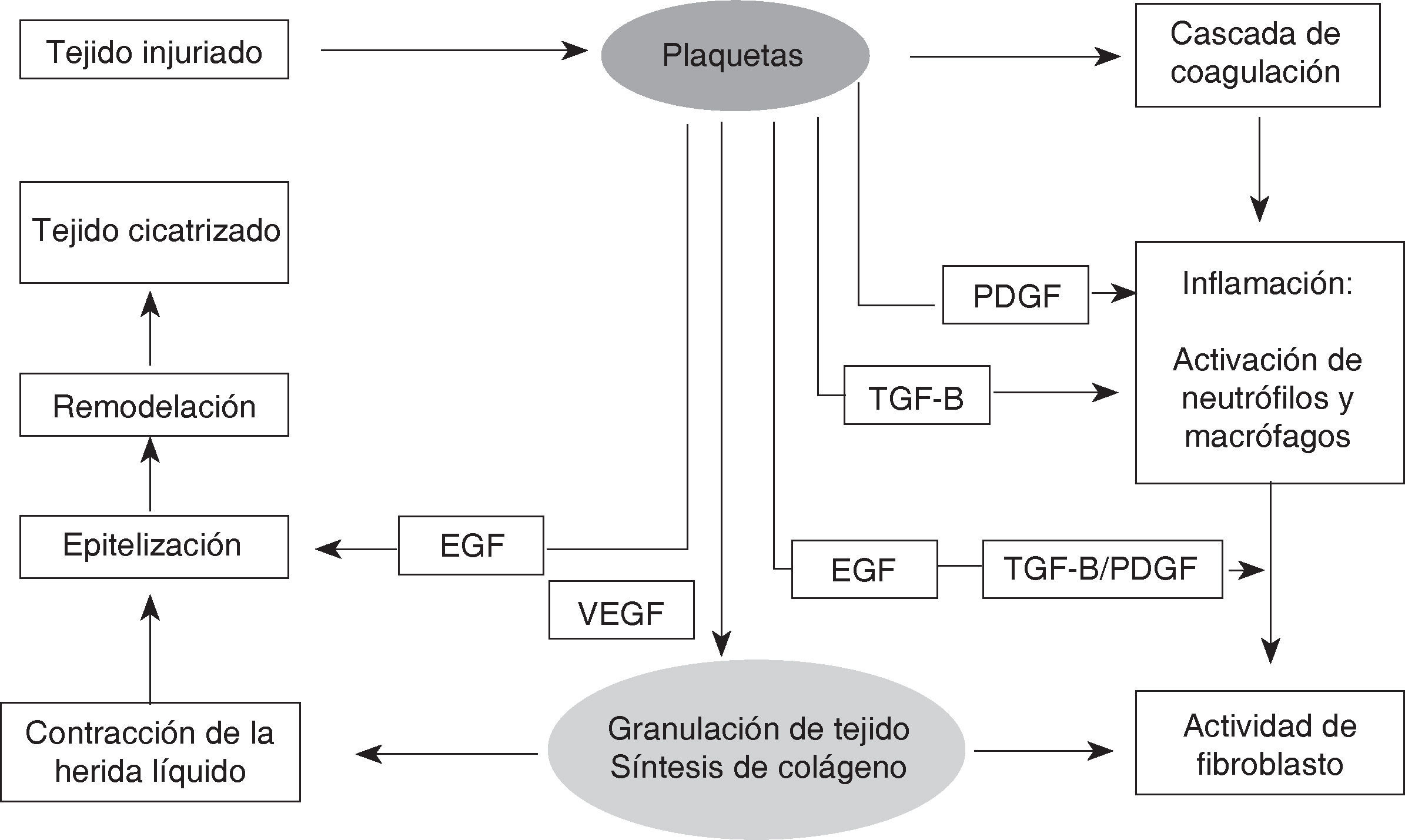
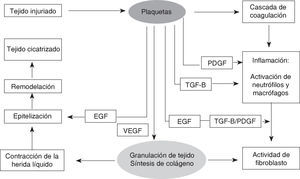
Cómo actúa el PRP en el proceso de cicatrización. Intervención de los factores de crecimientoLos factores de crecimiento son los encargados de ordenar la regeneración y reparación de los tejidos. Este accionar depende de la liberación de estos principios activos en el momento y lugar indicados para dar comienzo a una secuencia de eventos que tiene como fin la restauración de la arquitectura normal del tejido en que se encuentran (Figura 3).3
Cómo actúa el PRP con el aloinjerto óseoDebido a la mayor concentración de plaquetas, el PRP inicia una respuesta celular más rápida en el injerto de hueso que el coágulo sanguíneo normal. La cicatrización del injerto óseo ocurre durante las primeras tres semanas y está caracterizada por el crecimiento capilar, proliferación y actividad celular.
De 3 a 6 semanas las células osteoprogenitoras han proliferado y se han diferenciado lo suficiente para producir osteoide.
En la tercera fase el osteoide, débil y elástico, sufre resorción por los osteoclastos, los cuales liberan BMPs, IL1 e IL2 (interleucina uno y dos), y éstos a su vez inducen a los osteoblastos y células madre mesenquimatosas adyacentes a diferenciarse y producir un hueso de reemplazo más maduro con arquitectura lamelar y sistemas haversianos no presentes en el osteoide.
Esta regeneración del hueso continúa durante toda la vida del injerto con un ritmo normal de recambio de resorción-remodelación igual que el resto del esqueleto (aproximadamente 0.7% por día).2
Las plaquetas y el PRP actúan en la primera fase bioquímica inicial de una secuencia de regeneración del hueso en tres fases.
Estudios recientes sobre el PRP, han demostrado su eficacia, cuando es combinado con materiales sustitutos de hueso.8
Los sustitutos óseos forman hueso nuevo vía la osteoconducción de células osteoprogenitoras adyacentes, mientras que el injerto autógeno forma hueso nuevo por trasplante de células osteoprogenitoras desde un sitio distante.2
El propósito de presentar este caso clínico es dar una alternativa para el tratamiento de periodontitis agresiva localizada con PRP y aloinjerto óseo mostrando los resultados obtenidos a los 6 meses y a los 12 meses.
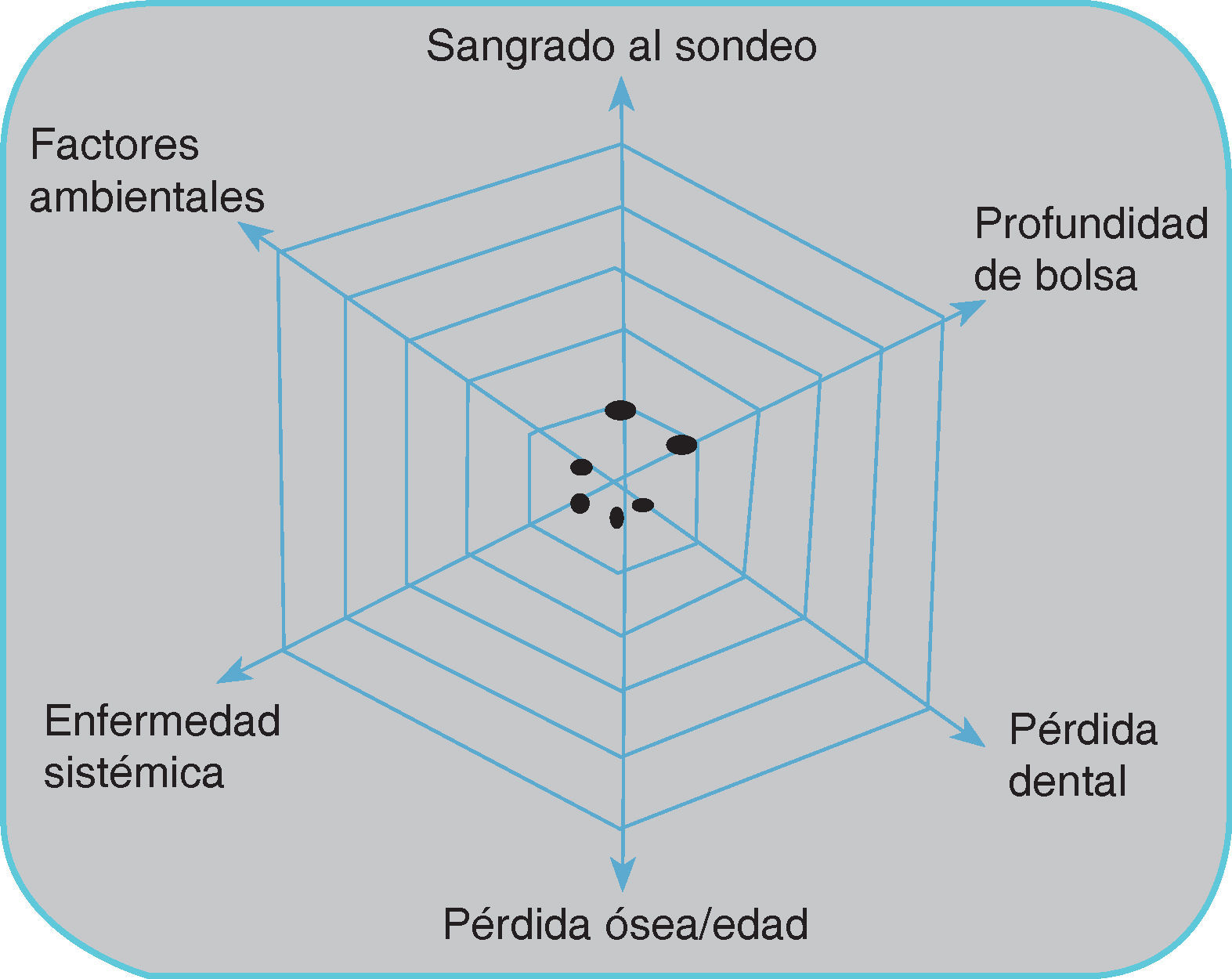
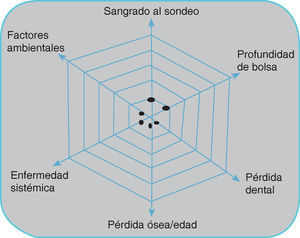
La evaluación del riesgo de recurrencia de periodontitis en este paciente se determinó con base en el modelo de valoración de riesgo individualizado. Con este propósito se tomó el diagrama propuesto por Lang y Tonetti en el 2003 que incluye los siguientes aspectos:
- 1.
Porcentaje de sangrado al sondeo.
- 2.
Prevalencia de bolsas residuales superiores a 4 mm.
- 3.
Pérdida de dientes.
- 4.
Pérdida de soporte periodontal en relación con la edad del paciente.
- 5.
Estado general y condiciones genéticas.
- 6.
Factores ambientales, como el tabaquismo.
Se presenta un caso clínico de una paciente de 29 años de edad, quien fue captada en la División de Estudios de Postgrado e Investigación de la UNAM.
La paciente refirió como antecedente dental que dos años atrás le habían iniciado tratamiento de ortodoncia, sin haber diagnosticado la enfermedad periodontal.
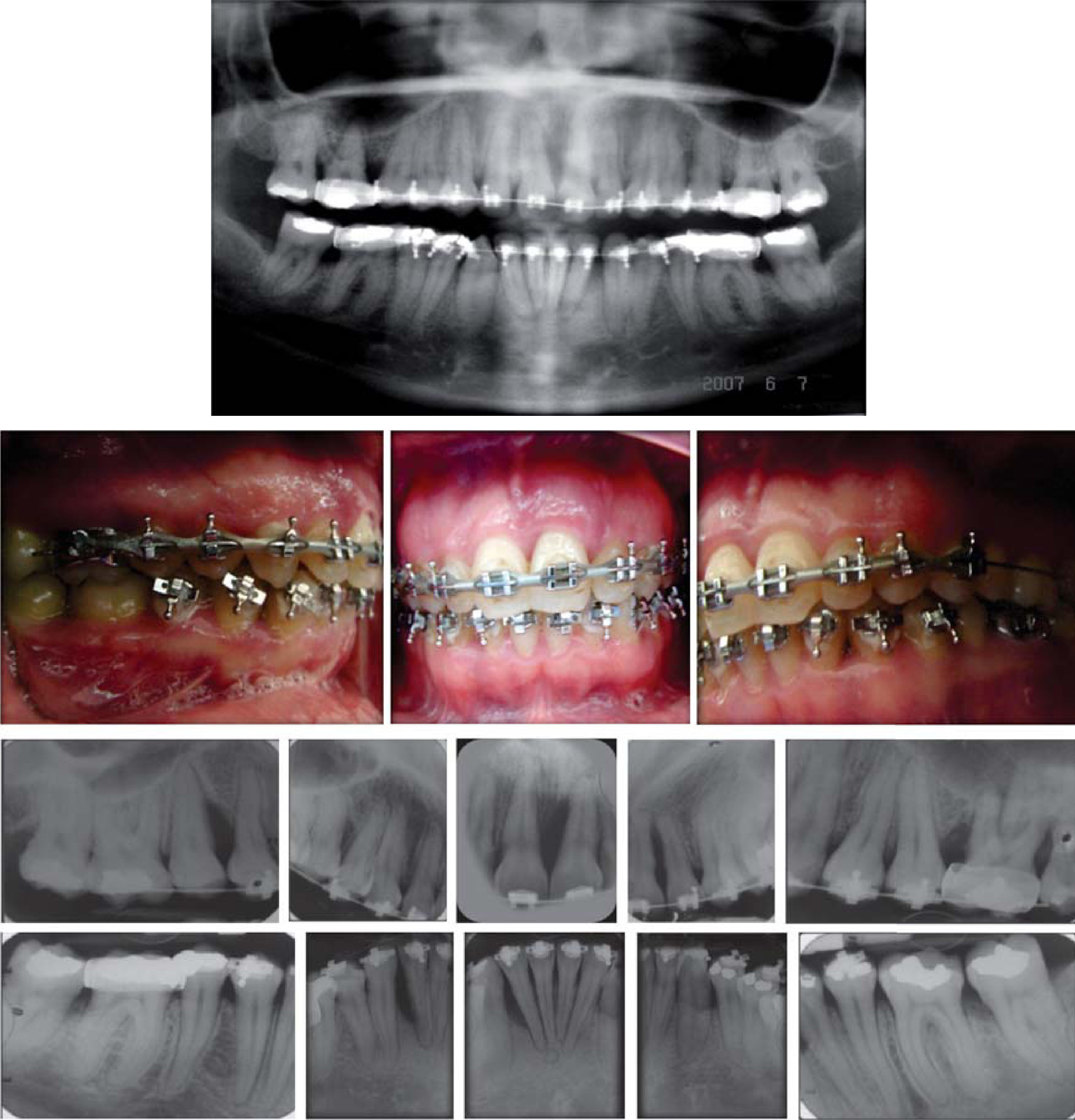
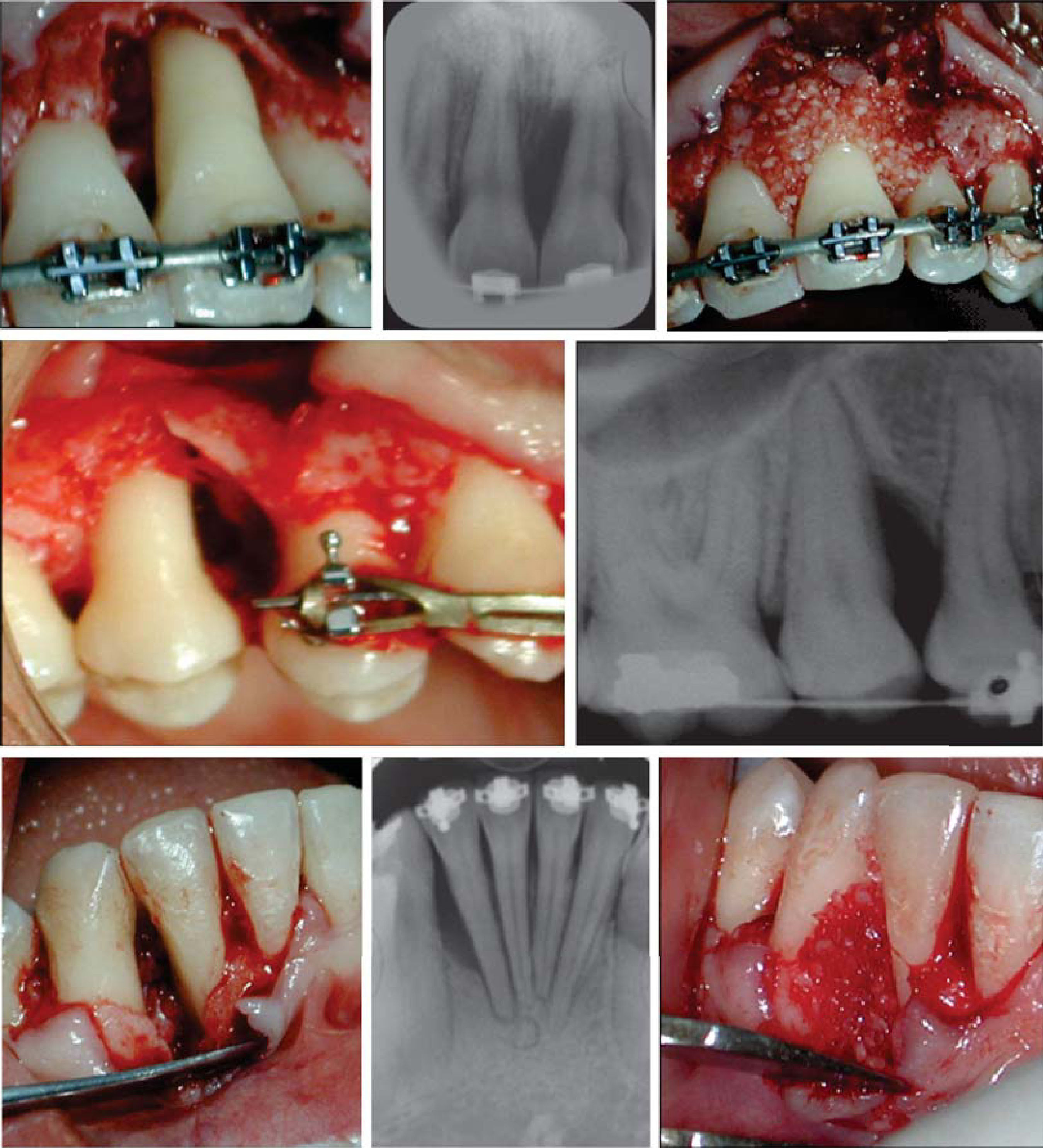
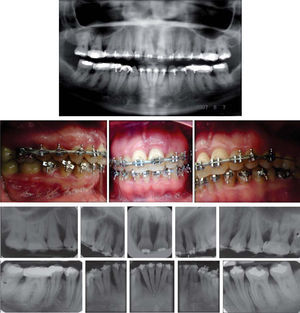
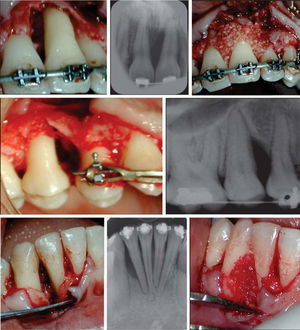
En la Clínica de Periodoncia de la DEPeI se le diagnosticó periodontitis agresiva localizada y se inició su tratamiento después de fi rmar el consentimiento informado (Figura 4).
Inicialmente, se realizó la fase I periodontal.
Procedimiento prequirúrgicoEl PRP se obtiene antes de la cirugía en un banco de sangre siguiendo el protocolo establecido por la Norma Oficial núm. 003 de la Secretaría de Salud en México.9,10
El procedimiento consiste en la toma de una muestra de 10 mL de sangre con la cual se llevan a cabo los exámenes preliminares de hepatitis y VIH, entre otros.9,10
Una vez realizados estos estudios se procede a la toma de 450 mL de sangre para la obtención del PRP. Dado que la sangre se coagula inmediatamente, la bolsa deberá contener anticoagulante (citrato de sodio) para impedir la coagulación.
Para separar y concentrar las plaquetas, se requieren dos centrifugaciones: en la primera, se separan el plasma y los elementos formes, a una velocidad de 1,800 rpm y a una temperatura de entre 18-22 grados centígrados por un tiempo de 10 minutos. Una vez que ha concluido esta primera centrifugación se obtiene una bolsa con elementos formes y otra con el plasma pobre en plaquetas; esta última bolsa es llevada a una máquina que se denomina Optipress para separar por gradientes de concentración el plasma y los elementos celulares.
Después, en una segunda centrifugación a una velocidad de 3,500 rpm y con una temperatura de 18-22 grados centígrados durante 10 minutos, se obtienen 60 mL aproximadamente de plasma rico en plaquetas.
El PRP permanecerá en estado líquido hasta que se active durante la cirugía.
Procedimiento quirúrgicoSe realizó un procedimiento de desbridamiento por colgajo. Se hizo una incisión intrasurcal que se extendió más allá del sitio del defecto para permitir levantar el colgajo y visualizar todo el defecto. Se hidrató el aloinjerto óseo con el PRP mientras se desbridó el defecto y se rasparon y alisaron las superficies radiculares (Figura 5).
Al PRP se le agregó trombina bovina mezclada con gluconato de calcio en proporción 1:6 para iniciar su activación. Esto permite que las moléculas de adhesión celular unan el aloinjerto óseo y den un compuesto de trabajo que será más fácil de manipular.
Una vez que el PRP se combina con el aloinjerto óseo, el cirujano puede usar el material de varias formas. En este caso clínico se utilizó también en forma de membrana, colocándose en el sitio varias capas de PRP coagulado (esta membrana tiene una duración de aproximadamente 5 a 7 días). Esto permite que los factores de crecimiento se fi ltren fuera del coágulo y penetren en el injerto.
Se reposicionaron los colgajos y se suturó con seda negra de tres ceros con puntos suspensorios utilizando los brackets de la paciente para evitar una mayor contracción del tejido. Cabe mencionar que durante esta etapa el tratamiento de ortodoncia se mantuvo inactivo.
Cuidado postoperatorioEl cuidado postoperatorio consistió en enjuague bucal de clorhexidina al 0.12%, dos veces al día, durante ocho días sin aseo mecánico en las áreas quirúrgicas.
Las suturas se removieron ocho días después de la cirugía. Esta fase de cicatrización se completó con control personal de placa, cada dos semanas, durante los dos primeros meses.
Después de este periodo, la paciente fue puesta bajo un programa de mantenimiento cada seis meses.
RESULTADOSLos resultados de la valoración clínica a los seis meses nos muestran condiciones compatibles con salud en cuanto al color, forma, consistencia, textura y sangrado al sondeo, manteniéndolos a lo largo de 12 meses.
En la etapa de mantenimiento se valoró el estado de riesgo de la paciente tomando en cuenta seis parámetros después de un año:11,12
- 1.
Sangrado al sondeo en el diente número 15 en la cara distal.
- 2.
Bolsa periodontal de 5 mm de profundidad en el diente número 15 en la cara distal.
- 3.
No hay pérdida de dientes durante este periodo.
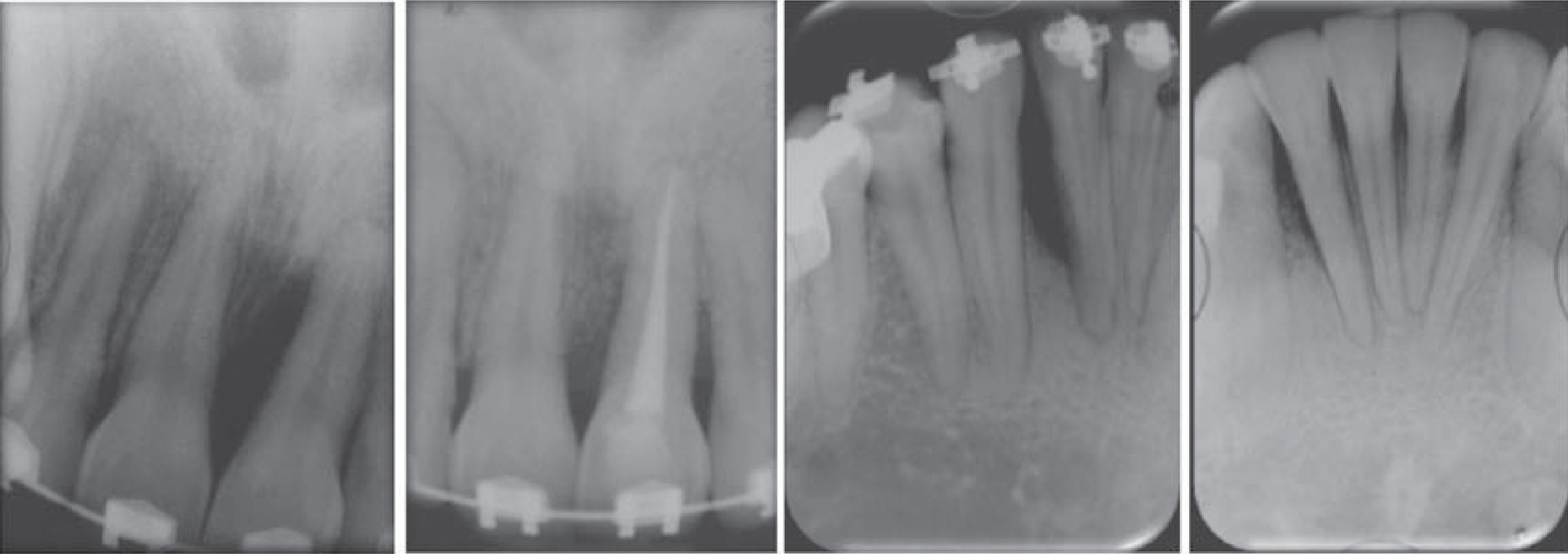
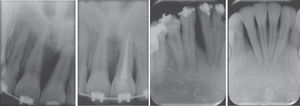
- 4.
No hay pérdida ósea; por el contrario, el estudio radiográfico nos muestra un llenado óseo en todos los sitios con defectos verticales (Figura 6).
- 5.
El estado de salud sistémico de la paciente es bueno.
- 6.
Los factores ambientales como el tabaquismo y restauraciones se valoraron para no comprometer la estabilidad periodontal lograda.
Con base en los seis parámetros anteriores, podemos decir que la paciente tiene bajo riesgo de recurrencia de enfermedad periodontal a un año del tratamiento inicial (Figura 7).
DISCUSIÓNEn 1998, el Dr. Marx y cols. fueron los primeros en realizar un estudio formal y dar a conocer a la comunidad científica odontológica el potencial del plasma rico en plaquetas.13 Desde ese momento los clínicos y los investigadores se dedicaron a publicar un sin fin de artículos relacionados con el PRP.
Desgraciadamente, en el camino se presentó una confusión de términos referente a los sistemas para la obtención de este plasma rico en plaquetas y muchos estudios fueron realizados con plasma pobre en plaquetas (PPP).
Las técnicas usadas para obtener el PRP en los diversos estudios pueden influir sobre el éxito, ya que algunas técnicas de aislamiento contribuyen a la degranulación temprana y prematura de las plaquetas.
Hoy tenemos una curva de aprendizaje basada en la evidencia que supera los problemas citados con anterioridad y dentro de la evolución del uso clínico del PRP, se tiene una primera etapa donde se utilizó como biomaterial cementante y como estimulante de la regeneración de tejido óseo.
En una segunda etapa actual se aplica para la curación de heridas en tejidos blandos, con base y fundamento en la evidencia biológica, lo que ha generado grandes expectativas en varias especialidades médicas, entre las que se encuentra la odontología.3
CONCLUSIONESEl clínico de hoy entiende cada vez más la necesidad de tomar decisiones basadas en la evidencia científica y no en relación con las recomendaciones y alternativas de tratamiento que existen en la industria dental.
El PRP parece aumentar la velocidad del proceso de cicatrización ya que biológicamente es posible que una concentración más alta de plaquetas pueda ayudar en la cicatrización de heridas debido a la mayor concentración de plaquetas e iniciar una respuesta celular más rápida que el coágulo sanguíneo normal. 14,15