Definiciones
De acuerdo con la definición de la Global Initiative for Asthma (GINA), los pacientes que experimentan síntomas diarios, frecuentes exacerbaciones, frecuentes síntomas nocturnos, limitación de actividades físicas y limitación funcional (volumen espiratorio forzado en el primer segundo [FEV1] o PEF menor del 60% del predicho o variabilidad de ambos del 30%) antes del inicio del tratamiento deberían clasificarse como asma grave persistente1,2. Una vez instaurado el tratamiento, se establece el grado de control según la respuesta al mismo: algunos pacientes permanecen asintomáticos mientras otros permanecen mal controlados. De este modo el diagnóstico de asma grave o asma severa refractaria se basa tanto en los datos clínicos como en la medicación diaria que el paciente precisa. Debe tenerse en cuenta que la respuesta al tratamiento puede ser lenta o, por el contrario, parecer responder inicialmente y presentar recaídas. Por ello se precisa un periodo de monitorización relativamente largo antes de etiquetar como asma grave, periodo durante el cual deben además investigarse otros posibles diagnósticos3.
Algunos autores han definido el asma grave, como asma refractaria, a aquella difícil de controlar a pesar de una reevaluación diagnóstica y de monitorización estrecha de más de 6 meses por un especialista en asma4,5.
La Sociedad Española de Patología del Aparato Respiratorio y Cirugía Torácica (SEPAR) adopta el término de asma de control difícil (ACD)6 y la define como asma insuficientemente (o mal) controlada a pesar de una estrategia terapéutica apropiada y ajustada al nivel de gravedad clínico. Este término aglutina variantes o fenotipos de la enfermedad tales como el asma muy grave, de riesgo vital, inestable, dependiente de corticoides o resistente a corticoides.
Se acepta que un 5% de los enfermos asmáticos padecen ACD7.
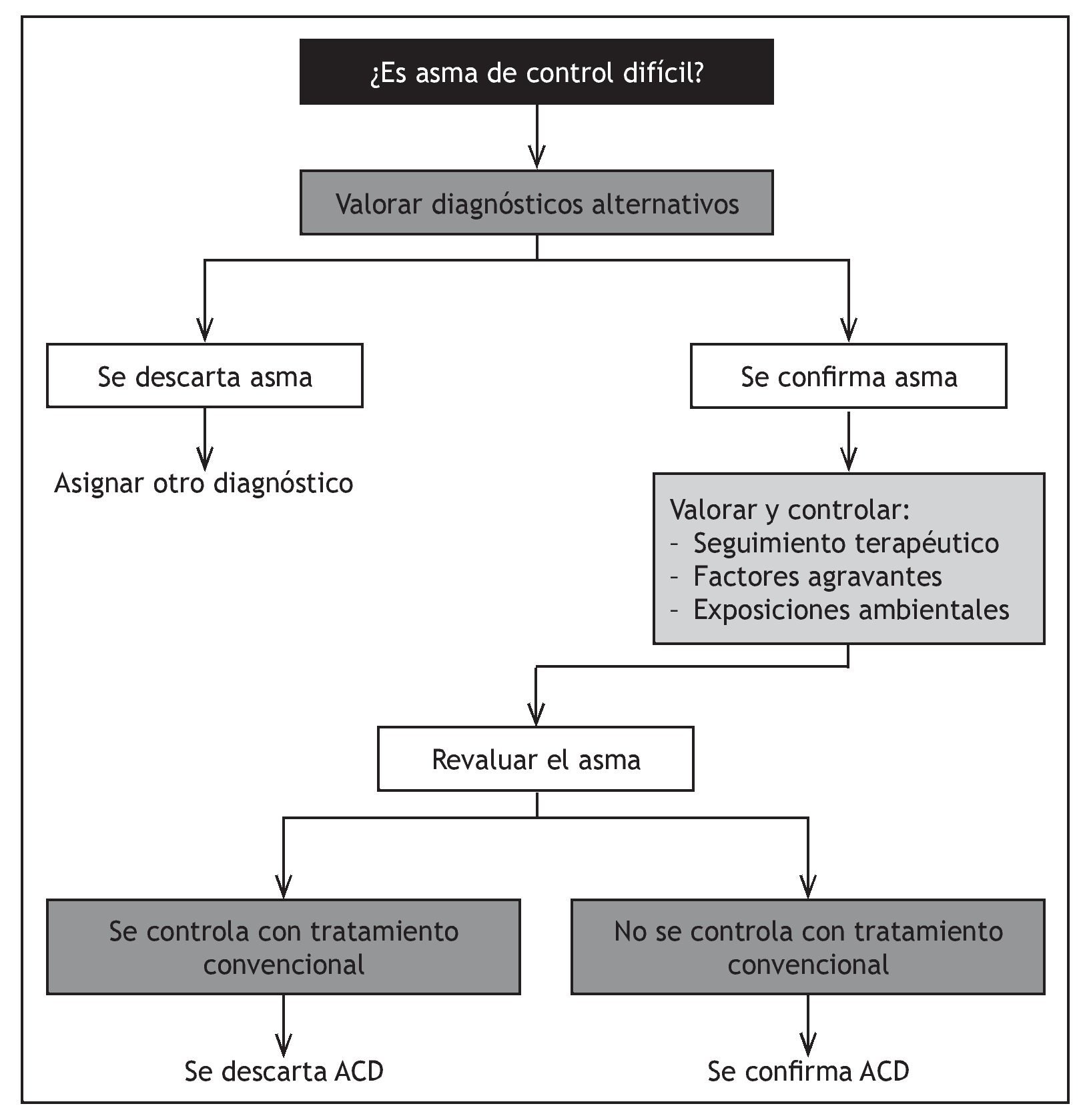
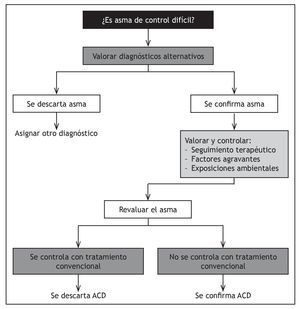
La Guía Española para el Manejo del Asma (GEMA 2009)8 establece que el diagnóstico final de ACD exige tres condicionantes previos: verificar que el tratamiento antiasmático es el adecuado y se cumple correctamente, descartar otras enfermedades que se asemejan al asma y asegurar el control de los factores agravantes de la enfermedad, para lo cual hay que evaluar otras causas habitualmente ajenas a la enfermedad que conllevan una escasa respuesta terapéutica (fig. 1).
Figura 1 Algoritmo para el diagnóstico de asma de control difícil. GEMA 2009. ACD: asma de control difícil.
La normativa SEPAR establece determinados criterios diagnósticos, y considera el diagnóstico de ADC cuando, una vez descartada una falsa ACD, se cumplen 2 criterios mayores, o bien, uno de estos con dos de los criterios menores. (tabla 1).
Se ha estimado que sólo un 55% de los enfermos con sospecha inicial de ACD confirman el diagnóstico9, una vez descartados otro tipo de problemas, que se han englobado bajo el término de falsa ACD, tales como factores agravantes no controlados, mala adhesión al tratamiento, o diagnóstico de asma incorrecto (tabla 2).
Factores agravantes
Como factores agravantes se han descrito tanto enfermedades coexistentes con el asma como factores intercurrentes que dificultan el control del asma. En realidad se trata de factores que condicionan una falsa ACD, y que deben descartarse antes de confirmar el diagnóstico (tabla 3).
Son factores que habitualmente vamos a encontrar asociados al asma mal controlada en la práctica clínica.
El paciente con asma puede presentar enfermedad obstructiva de la vía aérea superior, bronquiectasias, ansiedadhiperventilación, hipertiroidismo, obesidad, nasosinupatía y/o reflujo gastroesofágico que al no ser evaluados y tratados condicionan una mala situación clínica.
El 75-80% de pacientes con asma presenta rinitis estacional o perenne, y el 7-15% tiene poliposis nasal. En dos estudios realizados en España se ha encontrado una prevalencia de rinitis en asmáticos del 71% y del 89,5%10,11. Padecer rinitis agrava el asma y aumenta el consumo de recursos sanitarios12 . Se ha postulado que su adecuado tratamiento mejora los síntomas de asma13 sin embargo una revisión sistemática no confirmó que dicha mejora fuera estadísticamente significativa14.
La prevalencia de enfermedad por reflujo gastroesofágico entre los asmáticos es muy variable en las series y oscila en tre el 15 y el 72% según el procedimiento empleado para su diagnóstico (clínico, pHmetría, manometría esofágica)15. Los pacientes con asma y reflujo presentan un peor control del asma si bien no está claro que el tratamiento del reflujo mejore el asma.
Un estudio reciente con 412 pacientes con asma mal controlada sin síntomas de reflujo encuentra hasta un 40% de reflujo gastroesofágico mediante pHmetría. Sin embargo el tratamiento con esomeprazol no mejoró el control del asma en dichos pacientes16.
En cuanto a los factores intercurrentes que dificultan el control de la enfermedad se destaca la exposición permanente a alérgenos, fundamentalmente mascotas, ácaros y hongos ambientales así como irritantes como consumo de tabaco, inhalación de cocaína y exposiciones ocupacionales. Debe además descartarse el consumo de fármacos desencadenantes de asma; en especial deben evitarse los bloqueadores beta, tanto por vía oral como tópica (conjuntival), ocasionalmente los inhibidores de la enzima convertidora de la angiotensina, y el ácido acetilsalicílico y otros antiinflamatorios no esteroideos (AINE). Estos últimos están contraindicados en pacientes que presentaron episodios previos de intolerancia y se recomienda evitarlos en los asmáticos adultos, puesto que entre el 4 y el 28% son susceptibles de presentar exacerbaciones en relación con estos fármacos, particularmente los afectados de poliposis nasal. Por último otros factores agravantes del asma son el estrés y la ansiedad y en algunos casos, el estado premenstrual. Se han descrito cambios relacionados con el ciclo menstrual en mujeres sanas que podrían verse amplificados en las mujeres asmáticas y tener relación con episodios de obstrucción del flujo aéreo, con variaciones en el flujo aéreo y la difusión pulmonar que presentan un nivel pico durante la menstruación para posteriormente disminuir hasta el nivel más bajo al inicio de la fase lútea17.
Etiología del asma de control difícil
Los factores etiológicos que contribuyen a la auténtica ACD no son bien conocidos. Se han establecido asociaciones por determinadas alteraciones genéticas y varios factores ambientales.
Factores genéticos
Es difícil implicar a un gen determinado ya que el asma es una enfermedad compleja que afecta a múltiples genes, sin embargo se han descrito las siguientes alteraciones:
Mutaciones del gen IL-4 y su receptor14 parecen tener relación con la pérdida de función pulmonar y con episodios de asma de riesgo vital18.
Factor de transformación del crecimiento-β1 (TGF-β1) y la proteína quimiotáctica del monocito (MCP-1) ambos posibles promotores de reacciones fibróticas, se han relacionado con la gravedad del asma19,20.
Mutaciones de los receptores para β2-adrenérgicos21, particularmente aquellas en las que se sustituye la arginina en la posición 16, se han asociado con peor evolución clínica en estudios prospectivos. Este polimorfismo está presente aproximadamente en un 15% de la población blanca y en un 25% de la población afroamericana. Ya que hay evidencia documentada de abuso de agonistas β en grupos de nivel socioeconómico más bajo, la existencia de diferencias genéticamente determinadas en la respuesta a esta medicación podría conducir a un peor pronóstico en ciertos grupos étnicos en comparación con la población general.
Mutaciones de los receptores de los glucocorticoides se han descrito en diversos tipos de asma que con frecuencia se comportan como ACD: el asma corticorresistente, el asma corticodependiente y el síndrome ASA (as ma severa, poliposis nasosinusal e intolerancia a los AINE)22,23.
La resistencia a tratamiento esteroideo afecta a uno de cada 1.000 a 10.000 pacientes asmáticos y se define por respuesta sobre el FEV1 menor del 15% y 200 ml tras un ciclo de 2 semanas de 40 mg/día (en 2 tomas) de prednisona o prednisolona. Si el paciente no responde, la dosis debe doblarse y monitorizarse durante 2 semanas más, ya que algunos pacientes con asma grave no cumplen los criterios de resistencia a esteroides, pero desarrollan una respuesta a dosis más altas que las esperadas.
Se han implicado diversas alteraciones en la resistencia a glucocorticoides.
Los monocitos y los linfocitos T aislados de estos pacientes tienen una respuesta disminuida a glucocorticoides in vitro. En algunos de ellos existe una disminución en la afinidad del receptor glucocorticoideo (RG) por el glucocorticoide, y esta se puede reproducir incubando las células T con IL-2 e IL-4, lo que lleva a una inhibición funcional de los efectos del glucocorticoide24. Existe además una disminución de los efectos inhibitorios de los glucocorticoides sobre la activación del factor AP-1 y la expresión de citocinas, probablemente secundaria a una activación aumentada de las vías del AP-1 y JNK25. La mayor activación del AP-1 puede derivar en un secuestro del RG, lo que impide su interacción con otras proteínas y, por tanto, que se produzca resistencia a los glucocorticoides, lo cual sucede sólo en el lugar de la inflamación lo que explicaría por qué estos pacientes son resistentes a los efectos antiinflamatorios y no lo son a los efectos secundarios de los glucocorticoides.
Factores ambientales
En cuanto a los factores ambientales que se han asociado con la gravedad del asma se han descrito la exposición continua a alérgenos (fundamentalmente ácaros, alternaria y cucaracha), el tabaquismo, la intolerancia a los AINE y las infecciones por virus sincitial respiratorio, por clamidias y por micoplasma.
Por otra parte, hasta el 10% de los casos de ACD tienen problemas psiquiátricos mayores26.
Patología
Los mecanismos patológicos que determinan el ADC no están aclarados en su totalidad.
Habitualmente se ha descrito el remodelado de la vía aérea con engrosamiento de la membrana basal, hipertrofia del músculo liso e hiperplasia glandular, así como inflamación del bronquiolo terminal.
La inflamación es un hallazgo importante del asma grave; se han descrito diferentes fenotipos inflamatorios que pueden caracterizarse por la persistencia de infiltrado eosinofílico o neutrofílico, además se encuentran linfocitos T, mastocitos y macrófagos. En un estudio realizado con biopsias bronquiales y lavado broncoalveolar de pacientes con asma grave a pesar de tratamiento con altas dosis de esteroides, se propusieron dos patrones patológicos diferenciados en función de la presencia o ausencia de eosinófilos27. El perfil de los pacientes con un número elevado de eosinófilos pulmonares se asociaba a un mayor engrosamiento de la membrana basal y al incremento de linfocitos CD3, CD4, CD8, macrófagos, mastocitos y TGF-α. Desde el punto de vista clínico, los enfermos con este patrón presentaban mayor número de episodios de fracaso respiratorio grave. Sin embargo, otro estudio aleatorizado, controlado y doble ciego cuestiona el fenotipo eosinofílico como fenómeno refractario, al constatar la normalización de los eosinófilos en el esputo tras el tratamiento con altas dosis de esteroides parenterales (triamcinolona)28. El asma severa puede también asociarse con inflamación neutrofílica pero el papel de los neutrófilos permanece sin aclarar. El estudio ENFUMOSA (European Network For Understanding Mechanisms of Severe Asthma)29 encuentra que el asma severa se caracteriza por inflamación de predomino neutrofílico. Así, en todos los casos de asma grave se ha identificado un incremento de neutrófilos, pero su significación patológica es controvertida.
La neutrofilia puede representar un continuo flujo de células debido a una estimulación antigénica continua o puede estar producida por las altas dosis de tratamiento esteroideo. Podría reflejar la acción del tratamiento esteroideo por inhibición de la apoptosis de estas células, y se desconoce si representan algún papel en la fisiopatología de la enfermedad. Varios mediadores ligados a los neutrófilos (leucotrienos LT B, IL-8, y factor de necrosis tumoral TNF-α están aumentados en el asma severa30.
También se encuentra elevado el receptor del factor epidérmico de crecimiento (EGFR) en proporción a la severidad de la enfermedad, como marcador de daño epitelial. Su expresión se correlaciona con la IL-8, por lo que puede contribuir a la inflamación neutrofílica31.
Las formas no severas de asma se caracterizan por una inflamación mediada por T-helper (Th) 2, que dirigen el reclutamiento de células inflamatorias y sus mediadores. Sin embargo en el asma severa, además se observa una alteración en los elementos TH1, en los T reguladores, con una activación mixta de los Th1/Th2.
La persistencia de inflamación también puede deberse a deficiencias en el proceso endógeno homeostático que promueve la resolución de la inflamación. En ese sentido se ha detectado una menor biosíntesis de lipoxinas en el asma severa mediante muestras de lavado broncoalveolar y biopsias bronquiales, que detectan niveles disminuidos de lipoxina A4 y de su receptores, que es un mediador derivado del ácido araquidónico que sirve como un agonista para resolución de la inflamación32.
Además los macrófagos alveolares de pacientes con asma severa muestran una disminución de la producción de otros mediadores potencialmente protectores como la prostaglandina PGE2 y el ácido 15-hidroxieicosatetraenoico (15-HETE)33.
EpidemiologíaSe estima que del 5 al 10% de los asmáticos sufren asma severa, lo que conlleva unos costes indirectos y directos muy elevados.
El estudio TENOR (The Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens) demostró que los costes de estos pacientes eran más del doble que los de los pacientes controlados34, y que el coste se incrementaba de forma directamente proporcional a la falta de control. En este estudio se encuentran además como factores de riesgo para la exacerbación e ingresos hospitalarios el sexo femenino, la edad más joven, la obesidad, no ser de raza blanca, FEV1 postbroncodilatador menor del 70% del teórico, historia de neumonía, diabetes, cataratas, intubación por asma previa y tres o más ciclos de esteroides en los 3 meses previos35. Mediante un modelo de regresión logística establecen una puntuación de riesgo de 0 a 18 puntos que demostró ser altamente predictivo de hospitalización o visita a Urgencias en estos pacientes. Una puntuación de 0 a 4 representa un riesgo bajo, de 5-7 moderado y de 8 alto riesgo (tabla 4). Los mismos autores usaron el cuestionario Asthma Therapy Assessment Questionnaire (ATAQ), para examinar el nivel de control y mostraban que un cuestionario validado puede ayudar a identificar los pacientes que requieren intervención para prevenir futuras crisis.
Otro estudio epidemiológico, el estudio ENFUMOSA, mostraba que el sexo femenino, la obesidad y la falta de atopia se asociaban con mayor severidad de la enfermedad, mientras que no identificó factores de riesgo en la infancia36.
Sin embargo el estudio TENOR mostraba un alto porcentaje de pruebas cutáneas positivas y niveles elevados de inmunoglobulina E (IgE), que se asociaban con severidad de asma en los pacientes más jóvenes.
Se han identificado también comorbilidades asociadas con exacerbaciones frecuentes tales como trastornos psicológicos, sinusitis, reflujo gastroesofágico, infecciones por Chlamydia, apnea del sueño y enfermedad tiroidea37.
El estudio Severe Asthma Research Program of the National Heart, Lung and Blood Institute (SARP) propone una definición funcional del asma grave y encuentra que son factores de riesgo independientes para esta forma de manifestación, un FEV1 disminuido, historia previa de neumonía y menor número de pruebas cutáneas positivas38.
En cuanto a los factores de riesgo asociados con el desarrollo de una obstrucción fija de la vía aérea en datos procedentes del estudio TENOR se han detectado la edad, el sexo femenino, raza negra, historia de tabaquismo , intolerancia a la aspirina y asma de larga evolución, mientras que el ser de raza hispana, mayor nivel cultural, historia familiar de dermatitis atópica, la presencia de mascotas en el domicilio y la sensibilización al polvo son factores protectores39. La ingesta de aspirina, asimismo, se ha asociado con ataques graves de asma y remodelado.
Otro estudio reciente mediante tomografía axial computarizada determina atrapamiento aéreo en los pacientes asmáticos e identifica un grupo de individuos de alto riesgo para enfermedad severa, que incluye a pacientes con historia de neumonía, inflamación neutrofílica y atopia40.
Conclusión
Debe tenerse en cuenta que el asma severa es una condición heterogénea que engloba varios fenotipos entre los que se incluyen el asma ocupacional, el asma aguda, premenstrual, corticodependiente o resistente, e inducida por aspirina. Asimismo se ha propuesto otra clasificación en fenotipos clínicos según se caracterizase por frecuentes síntomas, exacerbaciones frecuentes u obstrucción fija de la vía aérea. Desde otro punto de vista se ha clasificado según patrones inflamatorios. En la actualidad permanecen sin identificar claramente fenotipos definidos basados en parámetros clínicos y fisiopatológicos así como factores de riesgo que sean útiles para elaborar unas guías específicas de tratamiento. Se necesitan claramente más estudios para poder comprender completamente los mecanismos del ACD.
*Autor para correspondencia.
Correo electrónico:mgsalmones@fhalarcon.es (M. García-Salmones Martín).