Introducción
Los linfomas primarios en pulmón son una entidad de poca frecuencia, más aún el subtipo llamado MALT (linfoma de tejido linfoide asociado a mucosas), el cual nos concierne. Así, representa el 3-4% de los linfomas no Hodgkin de localización extranodal y el 0,5-1% de todos los tumores malignos pulmonares1. Su diagnóstico es difícil tanto por la escasa incidencia como por la ambigüedad de la clínica que presenta. Para el diagnóstico de linfoma pulmonar primario es necesario cumplir los criterios establecidos por Saltzstein2: afectación pulmonar uni- o bilateral, con o sin adenopatías mediastínicas o hiliares y sin evidencia de enfermedad extratorácica en los 3 meses siguientes al diagnóstico.
La afectación única a nivel pulmonar como forma de presentación de estos tumores es muy rara, lo que dificulta aún más el diagnóstico.
Presentamos 3 casos de linfomas primarios pulmonares MALT diagnosticados entre 1995 y 2009 (tabla 1). El diagnóstico se realizó tras cirugía y estudio patológico. La forma de presentación fue como nódulo/masa, con diagnóstico definitivo tras la extirpación.
Casos clínicos
Caso 1
Mujer de 73 años con diabetes mellitus insulinodependiente desde 1990, con frecuentes ingresos por descompensaciones. Monorrena por nefropatía no filiada. Ulcus péptico en tratamiento con anti-H2. Remitida por su médico de cabecera al Servicio de Urgencias por dificultad en el control de su glucemia. No refiere ningún tipo de sintomatología torácica y no presenta síntomas de linfoma B. La exploración física fue anodina.
El hemograma básico estaba dentro de la normalidad. Velocidad de sedimentación globular (VSG) 42 mm/hora; bioquímica: glucemia 650 mg/dl; el resto hasta 16 parámetros evaluados se encuentran dentro de la normalidad. La coagulación básica es normal, en la gasometría destaca PO2 de 67 mmHg y no se realizan ni proteinograma ni b2 microglobulina.
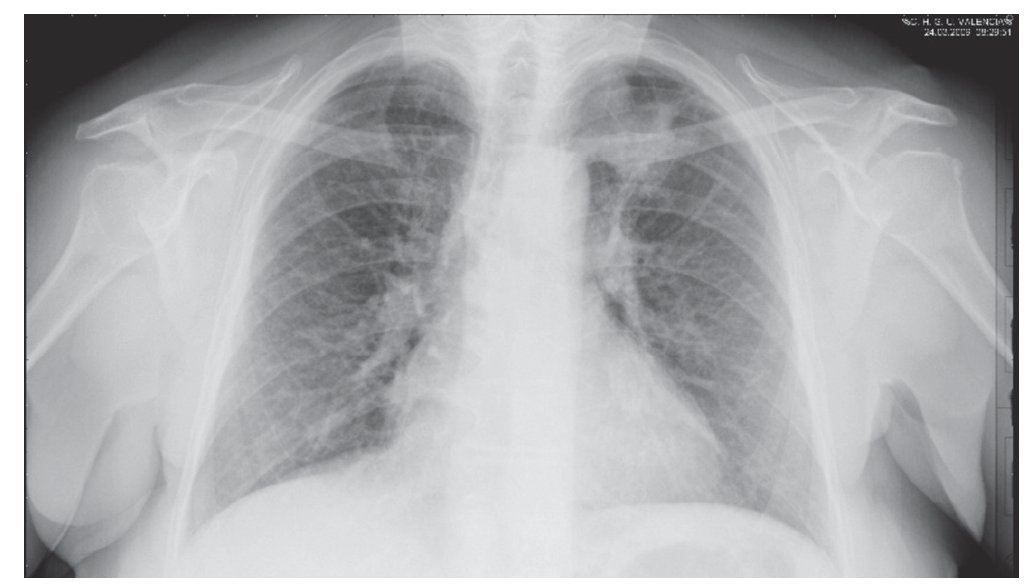
En la radiografía de tórax se apreció una opacidad de contornos irregulares y mal definidos en el lóbulo medio (fig. 1). Se indicó una tomografía axial computarizada (TAC) toracoabdominal que reveló la existencia de un nódulo pulmonar de 3 x 3 cm con contornos espiculados en el segmento medial del lóbulo medio, con superficie de contacto con pleura pero sin invasión parietal (fig. 2). Existen tractos fibrosos de localización apical y no se presentan adenopatías mediastínicas. La fibrobroncoscopia visualizó estenosis del bronquio posterior izquierdo, con ectasias de bronquios lingulares y signos diseminados de bronquitis crónica atrófica. El lavado broncoalveolar fue negativo para bacilos ácido-alcohol resistentes y la punción transtorácica (dos ocasiones) presentó ausencia de malignidad.
Figura 1. Radiografía de tórax en estudio diagnóstico. Se aprecia un nódulo heterogéneo en el vértice pulmonar izquierdo compatible con neoformación pulmonar.
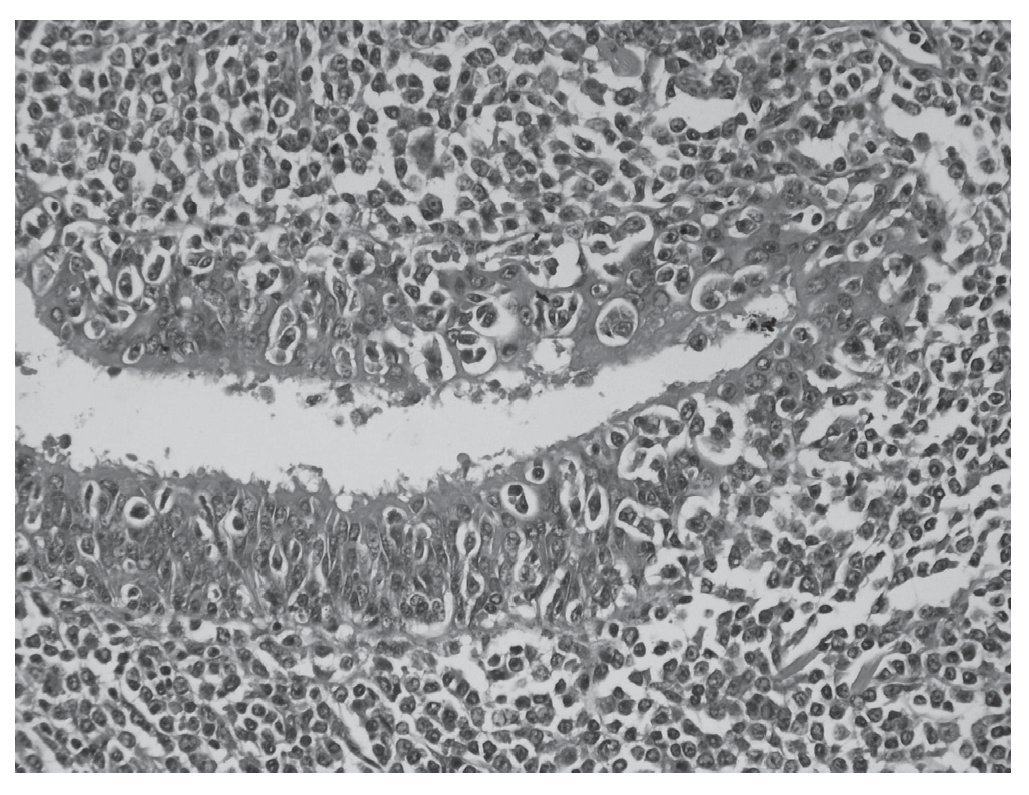
Figura 2. Imagen de microscopia a mayor aumento de linfoma MALT primario pulmonar: Proliferación linfocítica de localización submucosa bronquiolar asociada a lesión linfoepitelial, linfocitos reactivos y presencia de células plasmáticas. Imagen correspondiente al caso clínico n.º 3.
Con el diagnóstico de nódulo pulmonar solitario no filiado se practicó una toracotomía posterolateral derecha, encontrando un nódulo de localización parenquimatosa en el lóbulo medio en contacto con la pleura parietal pero sin invasión. La biopsia extemporánea informó de nódulo linfoplasmocitoide. El postoperatorio no presentó incidencias. El informe anatomopatológico definitivo fue de linfoma MALT de bajo grado de malignidad, tipo linfoplasmocitoide.
La analítica postoperatoria, hemograma, bioquímica y proteinograma, estaba dentro de la normalidad. La VSG era de 65, la serología para el virus de la inmunodeficiencia humana (VIH) fue negativa negativa y la b2 microglobulina de 2.726 ng/ml. Se administró un tratamiento poliquimioterápico en 3 ciclos con CHOP (ciclofosfamida, doxorrubicina, vincristina y prednisona) en dosis e intervalo convencionales. En la actualidad la paciente ha finalizado el tratamiento, encontrándose asintomática.
Caso 2
Mujer de 61 años con antecedentes de histerectomía, apendicectomía y artritis reumatoide tratada con 2 mg de metilprednisolona cada 24 horas. Remitida al Servicio de Urgencias por presentar un cuadro de febrícula, tos seca y afectación del estado general de 15 días de evolución. En la exploración física, destacó la existencia de una palidez cutaneomucosa. Presentaba deformidad articular en las manos y en la auscultación pulmonar se detectaron sibilantes aislados. No presentaba adenopatías periféricas y el resto de la exploración fue anodina.
El resultado de las analíticas realizadas al ingreso fue el siguiente: discreta anemia microcítica; velocidad de sedimentación globular (VSG) 109 mm/hora; ferritina: 7.779 ng/ ml; proteína C reactiva (PCR) 254 mg/l; proteinograma normal; coagulación básica normal; en el análisis de orina se aísla Proteus mirabilis; esputos negativos para malignidad; bacilo ácido-alcohol resistente (BAAR) negativo; memocultivos negativos.
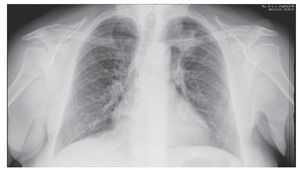
La radiografía torácica muestra una silueta cardíaca normal; se aprecia condensación basal izquierda y no se existen alteraciones óseas. En el perfil se aprecian los senos costofrénicos. La gammagrafía de perfusión revela probabilidad escasa de tromboembolismo pulmonar, con ausencia de perfusión en segmentos anterior y basal izquierdos.
En la fibrobroncoscopia se apreciaron una tráquea y un árbol bronquial derecho normales. En el lado izquierdo, se observó una estenosis del bronquio inferior, por abombamiento de una pared mucosa friable. Las biopsias y el broncoaspirado fueron negativos para células malignas. En la TAC toracoabdominal se observó una masa de 10 x 11 cm en el lóbulo inferior izquierdo, sin cavitación ni broncograma aéreo, ni presencia de adenopatías mediastínicas. La punción aspiración con aguja fina (PAAF) pulmonar mostró un material no representativo.
Con el diagnóstico de masa pulmonar no filiada, se practicó una toracotomía posterolateral izquierda, hallando una masa en el lóbulo inferior, en contacto con el diafragma, aunque sin invadirlo. Se realizó una lobectomía inferior. En el postoperatorio no se presentaron incidencias. El informe anatomopatológico estableció el diagnóstico de linfoma B de célula grande de alto grado de malignidad que afecta a la pleura visceral, pero con bordes de resección libres de tumor. Valorada por la unidad de oncología médica, se administraron 3 ciclos de quimioterapia (CHOP).
Caso 3
Mujer de 75 años con antecedentes de enfermedad de Morton, hernias discales a nivel cervical y hallux valgus. En 2007 le fue diagnosticado un carcinoma ductal infiltrante de mama derecha (pT1aN0M0) que se trató con cirugía conservadora (tumorectomía) más ganglio centinela con posterior radioterapia y hormonoterapia (letrozol).
Durante los siguientes meses, en los controles postoperatorios se detecta una elevación del marcador CA15.3 (35,4 U/ml), solicitándose una radiografía de tórax donde se observa una lesión nodular en lóbulo superior izquierdo (LSI) pulmonar, tras aumentar su tamaño en el control evolutivo se amplía estudio con una PET-TC en la que se detecta una masa pulmonar en el LSI de 42 x 21 mm, con intenso hipermetabolismo (SUVmáx: 4,4) sugestiva de malignidad.
La fibrobroncoscopia no produjo ningún hallazgo patológico. La PAAF de la lesión resultó positiva para adenocarcinoma.
La paciente se encontraba sin ningún tipo de sintomatología torácica y sin síntomas B. La exploración física fue anodina. Las pruebas de laboratorio fueron normales.
Ante una masa pulmonar [cT2N0M0] con citología de adenocarcinoma se practicó una toracotomía posterolateral izquierda, encontrando una masa en LSI que no invadía otras estructuras, ante lo que se realizó una lobectomía superior izquierda y un muestreo ganglionar. El postoperatorio no presentó incidencias. La analítica realizada al alta se encontraba dentro de la normalidad. El informe anatomopatológico (fig. 2) e inmunohistoquímico diferido estableció el diagnóstico de linfoma B de la zona marginal extranodal asociado a mucosa (BALT) de alto grado de malignidad que afecta a la pleura visceral, pero sin afectación tumoral de los bordes de resección (T2N0M0).
La unidad de oncología administró quimioterapia adyuvante (CHOP 3 ciclos).
Discusión
El origen del linfoma pulmonar primario parece hallarse en el tejido linfoideo asociado a la mucosa bronquial3. Se ha sugerido la posibilidad de un agente infeccioso como origen del linfoma MALT pulmonar de forma análoga al Helicbacter pylori en el estómago4.Se distingue entre bajo y alto grado de malignidad, con una frecuencia del 85% para los de bajo grado y un 15% para los de alto grado de malignidad.
Los pacientes con linfoma de bajo grado a menudo permanecen asintomáticos. Los sintomáticos lo son de forma inespecífica. Así, la tos, la disnea, la hemoptisis y el dolor torácico son frecuentemente descritos. El estudio de amplias series de enfermos concluye que la presentación clínica en los linfomas de bajo grado suele ser asintomática5, ocurriendo lo contrario en los casos de linfomas de alto grado. En los pacientes estudiados los casos 1 y 3 eran linfomas de bajo grado, siendo un hallazgo casual su enfermedad. El caso 2 sí presentó síntomas (febrícula y pérdida de peso), tratándose de un linfoma B de alto grado de malignidad.
Su descripción radiológica es difícil de precisar, tanto por la variedad de las presentaciones como por el abanico de términos utilizados por los distintos autores en su descripción. Debe considerarse la posibilidad de linfoma MALT pulmonar como posible diagnóstico cuando la TAC muestra áreas de baja atenuación dentro de las lesiones, independientemente de sus patrones6. Una masa de márgenes mal delimitados y broncograma aéreo son los más frecuentemente descritos. Este patrón hace que el principal diagnóstico diferencial sea planteado con el carcinoma bronquioloalveolar7. La existencia de cavitación en los linfomas es extremadamente rara, al igual que la afectación pleural. Pueden aparecer atelectasias asociadas con estenosis bronquiales. Iconográficamente, los pacientes presentaban un nódulo pulmonar solitario y una masa pulmonar, ambos sin broncograma aéreo.
El estudio del árbol traqueobronquial con el fibrobroncoscopio pone de manifiesto una infiltración linfomatosa en el 50% de los casos8. La afectación endobronquial de los linfomas no hodgkinianos ocurre, sobre todo, en presencia de una enfermedad diseminada9. El lavado broncoalveolar hace evidente una infiltración linfoide en cerca del 65% de los casos10. Realizamos dicha prueba a uno de los pacientes, sin que resultara diagnóstica.
En algunos pacientes, es posible aislar proteínas monoclonales. Dicha asociación se ha establecido en un 16% de los casos. Cuando esto ocurre, se recomienda el estudio detallado del sujeto en busca de enfermedad linfoproliferativa sistémica, ya que la existencia de un pico monoclonal con nódulo pulmonar solitario es considerada casi patognomónica de la enfermedad11. Además, es más frecuente en linfomas de bajo grado de malignidad. En los pacientes estudiados no encontramos ningún pico monoclonal; sí buscamos enfermedad linfoproliferativa sistémica, sin hallarla.
El diagnóstico definitivo de linfoma pulmonar se hace, con frecuencia, tras el análisis de la pieza quirúrgica. En algunas series este hecho alcanza el 64% de las ocasiones7, lo que hace que las resecciones pulmonares sean más amplias de lo exigido, ya que el principal diagnóstico diferencial se establece con el carcinoma pulmonar. En algunos casos, la infiltración linfomatosa afecta al parénquima pulmonar de forma difusa y el diagnóstico se realiza por una biopsia pulmonar a cielo abierto. Su incidencia es muy baja, y para el diagnóstico de linfoma pulmonar primario es necesario cumplir los criterios establecidos por Saltzstein2: afectación pulmonar uni- o bilateral, con o sin adenopatías mediastínicas o hiliares y sin evidencia de enfermedad extratorácica en los 3 meses siguientes del diagnóstico.
El pronóstico de los linfomas pulmonares de bajo grado es favorable. La progresión de la enfermedad es muy lenta12.
Se han descrito asociaciones del linfoma pulmonar con linfomas MALT en otras localizaciones, como glándulas salivares, estómago, globo ocular, aparato urinario, mama, hígado, timo y piel13. La recurrencia de sucesivos linfomas MALT todavía no ha sido establecida, quedando la puerta abierta para futuras investigaciones. La supervivencia a los 5 años en la serie de L´Hoste12 fue del 88%, superior a la supervivencia de los linfomas sistémicos, que a los 5 años se cifra en un 47%.
Como conclusión, diremos que la asociación del nódulo pulmonar con un pico monoclonal es considerada casi patognomónica del linfoma pulmonar primario11.
El tratamiento se basa en la quimioterapia, siendo la pauta con CHOP combinada con la inmunoterapia con anticuerpos anti CD20 (rituximab) la más difundida y con mayor tasa de respuestas14.
*Autor para correspondencia.
Correo electrónico:jesussmartinez@hotmail.com (J. Martínez Baños).
Recibido el 9 de mayo de 2010;
aceptado el 1 de julio de 2010