A diabetes gestacional (DG) está associada a inúmeras complicações para a mãe e feto. O índice de massa corporal (IMC) prévio à gravidez e o ganho de peso gestacional têm sido associados ao peso do recém-nascido.
PopulaçãoDuzentas e cinquenta e sete grávidas seguidas na consulta multidisciplinar de Nutrição e Obstetrícia no Centro Hospitalar do Alto Ave durante 2009/2010.
ObjetivoAvaliar a associação entre o IMC prévio da grávida e o ganho ponderal durante a gravidez com o peso do recém-nascido.
Tipo de estudoObservacional, longitudinal, retrospetivo.
MetodologiaForam recolhidos dados sociodemográficos e antropométricos da mãe e recém-nascido. Foi realizada regressão linear para prever o peso do recém-nascido. A análise estatística foi realizada com o SPSS versão 18®.
ResultadosAs categorias de IMC analisadas foram: peso normal (45%), excesso de peso (33%) e obesidade (22%). A média de ganho ponderal (kg) nos grupos foi de 10,7±4,2, 10,5±5,5 e 7,1±5,9, respetivamente. Das mulheres com excesso de peso e obesidade, 39,3 e 35,5% tiveram ganho ponderal superior às recomendações. A prevalência de macrossomia foi de 2%. O IMC prévio (p <0,001), ganho ponderal materno (p <0,001) e idade gestacional no parto (p <0,001) foram preditivos do peso à nascença. Mulheres com excesso de peso e obesidade prévia têm 1,4 e 3,5 vezes mais probabilidade de ter um bebé grande para a idade gestacional (GIG) em comparação com as mulheres com peso prévio normal. O ganho ponderal superior às recomendações do IOM duplica o risco de nascimento de bebés GIG, no entanto, sem significado estatístico.
ConclusãoO IMC prévio e o ganho ponderal são preditivos do peso à nascença, em mulheres com diabetes gestacional.
Gestational diabetes is associated with numerous complications for mother and fetus. Pre-pregnancy BMI and the gestational weight gain have been associated to newborn weight.
PopulationTwo hundred and fifty-seven pregnant women who attended the multidisciplinary clinics of Nutrition and Obstetrics at Centro Hospitalar do Alto Ave during 2009/2010.
ObjectiveEvaluate the association of Pre-pregnancy BMI and weight gain during pregnancy with the newborn weight.
StudyObservational, longitudinal, retrospective.
MethodologySociodemographic and anthropometric data of mothers and newborns was collected from clinical notes. Multiple linear regression was used to predict the newborn weight. Statistical analysis was done using SPSS 18®.
ResultsThe following categories of BMI were analyzed: normal weight (45%), overweight (33%) and obesity (22%). The average weight gain (kg) in each group was 10.7±4.2, 10.5±5.5 and 7.1±5.9, respectively. 39.3% of overweight and 35.5% of obese women had a weight gain above recommended levels. The prevalence of macrossomia was 2%. Pre-pregnancy BMI (p<0.001), weight gain (p<0.001) and gestational age on birth (p<0.001) are predictive of the weight at birth. Overweight and obese women are 1.4 and 3.5 times more likely to give birth to a newborn large for gestational age than normal weight women. Weight gain above IOM recommendation, doubles the risk of newborns large for gestational age, although with no statistical significance.
ConclusionPre-pregnancy BMI and weight gain during pregnancy are predictive of newborn weight in women with gestational diabetes.
A diabetes gestacional (DG) pode ser definida como qualquer grau de intolerância aos hidratos de carbono (HC) diagnosticado ou detetado pela primeira vez durante a gravidez, independentemente de ser necessário ou não recorrer a terapêutica com insulina1–3. Na primeira visita médica pré-natal todas as grávidas deverão ser submetidas a uma pesquisa de glicemia plasmática em jejum. Resultados compreendidos entre 92-126mg/dl são consistentes com o diagnóstico de DG. Caso o valor da glicemia em jejum seja inferior a 92mg/dl, a grávida deve ser reavaliada entre as 24-28 semanas de gestação com uma prova de tolerância oral à glicose com 75g de glicose3.
Existem alguns fatores de risco para o aparecimento da DG tais como história familiar de diabetes, obesidade, idade superior a 35 anos, antecedentes de diabetes gestacional ou macrossomia fetal1. A hiperglicemia durante a gravidez está associada ao aumento do risco de pré-eclâmpsia, aumento dos níveis de peptídeo C no cordão umbilical, parto prematuro, parto por cesariana e, mais tarde, ao desenvolvimento de diabetes mellitus tipo 2 (DM tipo 2) na mulher2,4,5.
A prevalência da DG não é igual em todas as populações, tal como a DM tipo 2 é mais prevalente em certos grupos étnicos como nativos americanos e latino-americanos6,7. Em Portugal, das parturientes que recorreram ao Sistema Nacional de Saúde no ano de 2007 e 2008, a prevalência de DG foi de 3,3% e em 2009 de 3,9%8. Este aumento da prevalência da DG poderá estar relacionado com uma melhoria dos cuidados de rastreio, mas também com o aumento da prevalência da obesidade (IMC ≥30kg/m2), que representa per si um fator de risco para o aparecimento da DG9,10. Estima-se que o risco de desenvolver DG é 2, 4 e 8 vezes maior em mulheres com excesso de peso, obesidade e obesidade mórbida, respetivamente, quando comparadas com mulheres normoponderais11,12. Assim, quanto maior o grau de obesidade materno maior o risco de desenvolver DG por resistência à insulina10,13. Prevê-se que na ausência de obesidade a prevalência de DG cairia cerca de 50% diminuindo também o risco de nascimento de bebés macrossómicos (peso à nascença igual ou superior a 4.000g), peso do recém-nascido acima do percentil 90, hipertensão materna, nascimentos prematuros (antes das 37 semanas de gestação) e parto por cesariana2,14,15.
O aumento de peso excessivo durante a gravidez tem igualmente consequências negativas para a futura mãe e respetivo feto. Um estudo recente realizado em Portugal mostra que o ganho ponderal excessivo na gravidez está associado ao risco de excesso de peso na infância16. O Institute Of Medicine (IOM) estabeleceu valores padrão de ganho ponderal durante a gravidez; para mulheres normoponderais (com IMC entre 18,5-24,9kg/m2) recomenda-se o ganho de 11,5-16kg, a mulheres com excesso de peso (com IMC entre 25,0-29,9kg/m2) são recomendados 7-11,5kg e para mulheres com obesidade (com IMC ≥30kg/m2) é recomendado o ganho de 5-9kg17. As mulheres que durante a gravidez ultrapassam as recomendações de ganho de peso têm maior risco de pré-eclâmpsia, parto por cesariana, macrossomia fetal, retenção de peso pós-parto, obesidade e risco aumentado de DM tipo 2 no futuro, em comparação com as mulheres que têm ganho de peso adequado17–20. Como tal, o IMC prévio e ganho de peso durante a gestação revelam-se indicadores antropométricos importantes utilizados durante a gravidez, não só porque são procedimentos de baixo custo, mas também porque refletem o estado nutricional materno antes e após a gravidez21,22.
Segundo Kim, Newton e Knopp o aumento da prevalência da DG deve implicar a sua prevenção, já que 50% das mulheres com história de DG desenvolvem DM tipo 2 entre 5-10 anos após o parto11.
Valores elevados de glicemia durante a gravidez aumentam a probabilidade de partos pré-termo23 e estimulam a secreção de insulina fetal, acelerando o crescimento o que pode originar macrossomia e posterior obesidade infantil24–26. O peso à nascença de 4.000g coloca o recém-nascido no percentil 90 às 40 semanas de gestação. Com o peso acima do percentil 90, o recém nascido é considerado grande para a idade gestacional (GIG)27–29. Estes bebés têm maior risco de asfixia fetal, distócia do ombro durante o parto, trauma, hipoglicemias e no futuro resistência à insulina, obesidade e diabetes20,25. A macrossomia, para além de ser prevalente em mulheres com DG, também está relacionada com a obesidade e com a idade materna superior a 35 anos27,30.
A terapêutica nutricional (TN) é recomendada para prevenir as inúmeras complicações que advêm da DG. Tem como objetivo um bom controlo glicémico na grávida (60-90mg/dl em jejum e 60-120mg/dl 1h após as refeições)3. A TN é individualizada e realizada em função do IMC prévio, evolução ponderal e nível de atividade física, de modo a fornecer a energia e os nutrientes necessários para um ganho de peso apropriado, proporcionar um adequado desenvolvimento fetal, bem como alcançar ou manter a normoglicemia, sem cetogénese10,31. A quantidade de HC é recomendada de acordo com o estado clínico da grávida e com os níveis de glicemia, devendo-se fornecer um mínimo de 175g de HC/dia para evitar a cetogénese32.
As recomendações da American Diabetes Association sugerem uma restrição calórica de cerca de 30-33% em mulheres obesas com DG, com a ingestão mínima de 1.800kcal/dia32,33. Segundo um estudo de Dornhorst et al. a restrição calórica de 20-25kcal kg–1 dia–1 em mulheres com obesidade a partir da 24.ª semana de gestação resulta em menos recém-nascidos GIG comparando com mulheres com obesidade tolerantes à glicose e sem restrição alimentar. No estudo, as mulheres com DG aumentaram metade do peso dos controlos a partir da 28.ª 34.
Deve-se dar preferência aos HC complexos, com baixo índice glicémico (IG) e fracionar a sua ingestão ao longo do dia, minimizando o seu consumo ao pequeno-almoço, para melhorar o controlo glicémico34,35. A cetose pode ser reduzida por estas medidas, atenuando a resposta da insulina, inibindo a lipólise e consequentemente a cetogénese34. Se através da TN não se alcançar a normoglicemia dentro de 1-2 semanas será necessário o uso de insulina. Uma alimentação baseada num baixo IG e prática regular de exercício físico de resistência diminui a necessidade de insulina sem comprometer a mãe ou o feto36,37.
Objetivo do estudoAvaliar a associação entre o IMC prévio e o ganho ponderal durante a gravidez com o peso do recém-nascido, assim como analisar as variáveis que conseguem prever o peso de recém-nascido.
Tipo de estudoObservacional, longitudinal e retrospetivo.
Material e métodosAmostraFoi estudada uma amostra de conveniência constituída por grávidas com DG que durante 2009 e 2010 foram seguidas na consulta multidisciplinar de Nutrição e Obstetrícia e realizaram o parto no Centro Hospitalar do Alto Ave. Os dados foram recolhidos pela análise retrospetiva de processos clínicos de 257 mulheres, com idade média de 32 anos (num intervalo de 19-44 anos). Apenas foram incluídas no estudo mulheres com diagnóstico positivo para a DG38. Foram excluídas mulheres com diabetes prévia, DM tipo 1 (n=4), DM tipo 2 (n=10), mulheres com gestação gemelar (n=5), mulheres com baixo peso (IMC ≤18,5kg/m2) (n=2) e mulheres cujo parto não foi realizado no CHAA (n=5).
Recolha de informaçãoForam recolhidos dados sociodemográficos da grávida, onde constava a idade e anos de escolaridade. O ganho ponderal no final da gravidez foi calculado pela diferença entre o peso materno na última consulta de nutrição/obstetrícia antes do parto (de 3 semanas antes do parto até à semana do parto) e o peso habitual relatado antes da gravidez. A grávida foi classificada de acordo com o estado nutricional inicial, como ganho de peso inferior às recomendações (GPI), de acordo com as recomendações (GPA) e superior às recomendações (GPS), como descrito pelo IOM17. O IMC prévio à gestação foi calculado pela fórmula de Quetelet e a classificação feita de acordo com os critérios da FAO/OMS39. Foram estudados os fatores de risco para o desenvolvimento de DG, história pessoal do peso, idade gestacional no diagnóstico, necessidade de insulina durante a gestação e hemoglobina glicada (HbA1c) no terceiro trimestre de gravidez. Relativamente ao recém-nascido foram recolhidos dados como o peso à nascença, sexo, tipo de parto e tempo de gestação. Com base no peso à nascença, os recém-nascidos foram classificados em Leve para a Idade Gestacional (LIG; peso < percentil 10), Adequado à Idade Gestacional (AIG; percentil10 < peso < percentil 90) e Grande para a Idade Gestacional (GIG; peso > percentil 90)28,29. A macrossomia foi definida pelo peso à nascença igual ou superior a 4.000g independentemente da idade gestacional.
Análise estatísticaFoi elaborada uma base de dados no programa SPSS®versão 18.0 para o Mac OSX. A análise descritiva consistiu no cálculo de frequências absolutas e relativas para variáveis categóricas e de médias e desvios-padrão para as variáveis contínuas (tabela 1). Efetuou-se um modelo de regressão linear, pelo método de recuo passo a passo, onde foram incluídas todas as variáveis que potencialmente previam o peso do recém-nascido: IMC prévio, ganho ponderal, idade da grávida, idade de diagnóstico, idade gestacional no parto, tipo de parto, sexo do bebé, necessidade de insulina, fatores de risco para o desenvolvimento da DG e HbA1c no 3° trimestre. Ao 12.° modelo de regressão encontrou-se equação de regressão linear com os coeficientes de correlação linear que estão apresentados na tabela 2. A regressão binária logística foi utilizada para encontrar a associação independente entre a classe de IMC, o ganho ponderal e o percentil do peso à nascença. Considerou-se como nível de significância crítico para rejeição da hipótese nula, um valor de p inferior a 0,05.
Análise da população
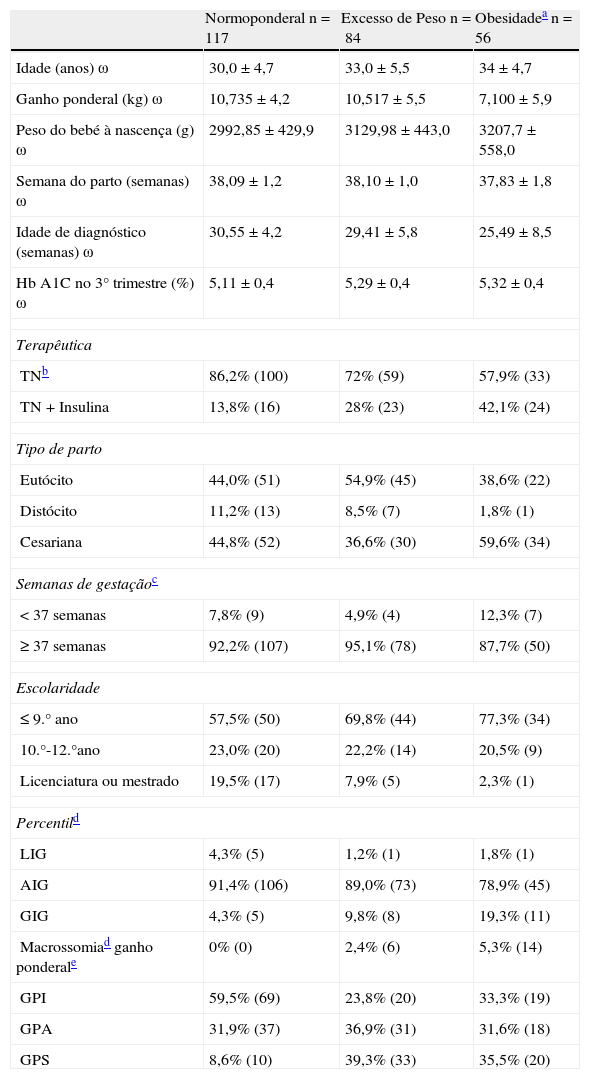
| Normoponderal n=117 | Excesso de Peso n=84 | Obesidadea n=56 | |
| Idade (anos) ω | 30,0±4,7 | 33,0±5,5 | 34±4,7 |
| Ganho ponderal (kg) ω | 10,735±4,2 | 10,517±5,5 | 7,100±5,9 |
| Peso do bebé à nascença (g) ω | 2992,85±429,9 | 3129,98±443,0 | 3207,7±558,0 |
| Semana do parto (semanas) ω | 38,09±1,2 | 38,10±1,0 | 37,83±1,8 |
| Idade de diagnóstico (semanas) ω | 30,55±4,2 | 29,41±5,8 | 25,49±8,5 |
| Hb A1C no 3° trimestre (%) ω | 5,11±0,4 | 5,29±0,4 | 5,32±0,4 |
| Terapêutica | |||
| TNb | 86,2% (100) | 72% (59) | 57,9% (33) |
| TN+Insulina | 13,8% (16) | 28% (23) | 42,1% (24) |
| Tipo de parto | |||
| Eutócito | 44,0% (51) | 54,9% (45) | 38,6% (22) |
| Distócito | 11,2% (13) | 8,5% (7) | 1,8% (1) |
| Cesariana | 44,8% (52) | 36,6% (30) | 59,6% (34) |
| Semanas de gestaçãoc | |||
| <37 semanas | 7,8% (9) | 4,9% (4) | 12,3% (7) |
| ≥37 semanas | 92,2% (107) | 95,1% (78) | 87,7% (50) |
| Escolaridade | |||
| ≤9.° ano | 57,5% (50) | 69,8% (44) | 77,3% (34) |
| 10.°-12.°ano | 23,0% (20) | 22,2% (14) | 20,5% (9) |
| Licenciatura ou mestrado | 19,5% (17) | 7,9% (5) | 2,3% (1) |
| Percentild | |||
| LIG | 4,3% (5) | 1,2% (1) | 1,8% (1) |
| AIG | 91,4% (106) | 89,0% (73) | 78,9% (45) |
| GIG | 4,3% (5) | 9,8% (8) | 19,3% (11) |
| Macrossomiad ganho ponderale | 0% (0) | 2,4% (6) | 5,3% (14) |
| GPI | 59,5% (69) | 23,8% (20) | 33,3% (19) |
| GPA | 31,9% (37) | 36,9% (31) | 31,6% (18) |
| GPS | 8,6% (10) | 39,3% (33) | 35,5% (20) |
ω: valores correspondem à média ± desvio padrão; GPI: ganho ponderal inferior às recomendações; GPA: ganho ponderal adequado às recomendações; GPS: ganho ponderal superior às recomendações – IOM.
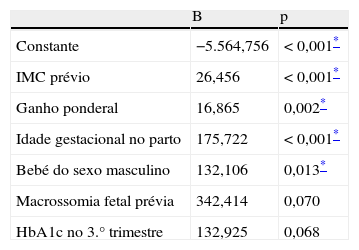
Modelo final de regressão linear multivariada
| B | p | |
| Constante | −5.564,756 | <0,001* |
| IMC prévio | 26,456 | <0,001* |
| Ganho ponderal | 16,865 | 0,002* |
| Idade gestacional no parto | 175,722 | <0,001* |
| Bebé do sexo masculino | 132,106 | 0,013* |
| Macrossomia fetal prévia | 342,414 | 0,070 |
| HbA1c no 3.° trimestre | 132,925 | 0,068 |
B=Coeficiente da regressão linear (aumento do peso à nascença [g];); R=0,623, p<0,001.
Na primeira abordagem nutricional após o diagnóstico de DG, foi prescrito, conforme as recomendações da Sociedade Portuguesa de Endocrinologia, Diabetes e Metabolismo (SPEDM) um plano alimentar personalizado de acordo com as necessidades energéticas40, estado clínico e nutricional das grávidas, mas tendencialmente não inferior a 1.800kcal/dia. A distribuição dos macronutrientes pelo valor energético total foi: 50-55% para os HC, 30% para as gorduras e 15-20% para as proteínas. Posteriormente foi realizada a distribuição das refeições ao longo do dia, em 3 refeições principais e 2-3 intermédias. Foi-lhes também aconselhada a prática de exercício físico após as refeições principais para controlar as glicemias pós-prandiais.
ResultadosNa análise foram incluídos dados de 257 grávidas, estratificados de acordo com o seu IMC prévio (tabela 1). Das grávidas, 117 eram normoponderais (45%), 84 tinham excesso de peso (33%) e 56 tinham obesidade (22%) antes de engravidar. Em média, as mulheres com obesidade tinham idade mais avançada (34±4,6) e um ganho ponderal menor (7,100±5,9) do que as grávidas normoponderais e com excesso de peso. Relativamente ao recém-nascido, as mulheres com obesidade tiveram, em média, os bebés mais pesados (3.207,7±558,0), 12,3% tiveram partos pré-termo e, mais de metade, 34 tiveram parto por cesariana (59,6%). Quando analisamos os níveis de HbA1c constatamos que este marcador é mais elevado nas mulheres com obesidade. Em relação à necessidade do uso de insulina durante a gravidez, 13,8% das mulheres com peso prévio normal, 28% com excesso de peso e 42,1% das mulheres com obesidade necessitaram do uso de insulina. Em relação ao percentil de peso à nascença, 4,3% das mulheres com peso prévio normal, 9,8% com excesso de peso e 19,3% com obesidade deram à luz bebés GIG.
A prevalência de macrossomia neste estudo foi de 2%. Todos os bebés macrossómicos provêm de mulheres com excesso de peso ou obesidade, pelo que nenhuma mulher com peso normal teve filhos com peso superior a 4.000g.
As normoponderais foram o grupo com maior percentagem de GPI e as mulheres com excesso de peso e obesidade foram os grupos que mais excederam as recomendações de ganho ponderal.
Em relação aos fatores de risco para desenvolvimento da DG, 112 grávidas tinham familiares do 1.° grau com diabetes (43,8%), 73 tinham idade superior a 35 anos (20,3%), 52 tinham outros familiares diabéticos (20,3%) e 35 tinham historial de DG prévia (13,7%). Atabela 2 mostra que o IMC prévio (p <0,001), ganho ponderal (p <0,002), idade gestacional no parto (p <0,001) e o sexo do bebé (p <0,013) são variáveis preditivas do peso à nascença. A história de macrossomia fetal prévia e a HbA1c no 3.° trimestre, embora demonstrem uma relação positiva, não apresentaram significado estatístico.
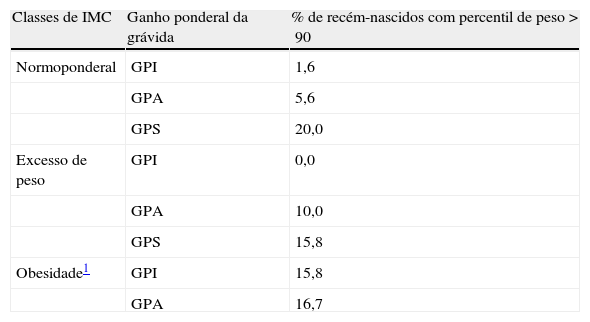
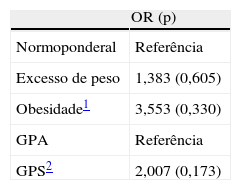
No grupo com peso prévio normal a prevalência de GIG foi baixa (tabela 3). Contudo, nas mulheres com GPS esta prevalência foi de 20%. No grupo da obesidade podemos constatar que independentemente do ganho ponderal a percentagem de GIG é superior a 15%, registando-se a percentagem máxima no grupo com GPS (26,3%). À medida que o IMC aumenta, o risco de recém-nascidos GIG também se eleva (tabela 4). Uma mulher com obesidade apresentou 3,5 mais probabilidade (odds) de ter um filho GIG do que uma mãe normoponderal. As mulheres com GPS apresentaram o dobro do risco de ter recém-nascidos GIG.
Frequência de nascimentos acima do percentil 90 de acordo com o IMC prévio e as recomendações do IOM
| Classes de IMC | Ganho ponderal da grávida | % de recém-nascidos com percentil de peso >90 |
| Normoponderal | GPI | 1,6 |
| GPA | 5,6 | |
| GPS | 20,0 | |
| Excesso de peso | GPI | 0,0 |
| GPA | 10,0 | |
| GPS | 15,8 | |
| Obesidade1 | GPI | 15,8 |
| GPA | 16,7 |
IMC (kg/m2). Normoponderal - 18,5-24,9; excesso de peso - 25-29,9; obesidade - ≥30.
GPI: ganho ponderal inferior às recomendações; GPA: ganho ponderal adequado às recomendações; GPS: ganho ponderal superior às recomendações - IOM.
Risco de nascimento acima do percentil 90
| OR (p) | |
| Normoponderal | Referência |
| Excesso de peso | 1,383 (0,605) |
| Obesidade1 | 3,553 (0,330) |
| GPA | Referência |
| GPS2 | 2,007 (0,173) |
IMC (kg/m2). Normoponderal - 18,5-24,9; excesso de peso - 25-29,9; obesidade - ≥30.
GPI: ganho ponderal inferior às recomendações; GPA: ganho ponderal adequado às recomendações; GPS: ganho ponderal superior às recomendações – IOM.
No estudo foi analisado o efeito do ganho ponderal sobre o peso do recém-nascido nas 3 classes de IMC mais prevalentes na população em causa.
A probabilidade (odds) de nascimento de bebés GIG foi cerca de 1,4 vezes superior nas mulheres com excesso de peso e 3,5 vezes nas mulheres com obesidade, em comparação com as normoponderais, independentemente do ganho ponderal materno. Assim, uma mulher com IMC prévio superior ao considerado normal apresentou risco aumentado de dar à luz um bebé GIG. O risco também parece elevar-se quando se considera o ganho ponderal independentemente do IMC prévio. Mulheres que tiveram GPS apresentaram 2 vezes mais probabilidade de dar à luz um bebé GIG. No presente estudo, apesar de se verificar uma associação positiva entre o IMC prévio, GPS e a possibilidade do nascimento de recém-nascidos GIG, os resultados não foram estatisticamente significativos. O número de variáveis analisadas requerem um tamanho amostral superior, para clarificar se os efeitos estão relacionados ou ocorreram aleatoriamente.
As análises multivariadas desenvolvidas neste estudo evidenciaram que maior IMC prévio (p <0,001), maior ganho ponderal (p=0,002), idade gestacional no parto superior (p <0,001) e o sexo masculino (p=0,013) são preditivos de peso superior do recém-nascido. O coeficiente da regressão linear (B) dá-nos a informação de quantos gramas aumenta o peso à nascença. Em comparação com outros estudos, Kac e Velásquez-Meléndez revelam que mulheres com ganho de peso gestacional excessivo apresentaram 5,83 vezes (IC 95%: 1,51-22,48) mais probabilidade de ter recém-nascido com macrossomia41. Hillier et al. concluíram que o GPS praticamente dobra o risco de macrossomia42, assim como aumenta o risco de desenvolvimento de cancro da mama no futuro43.
No presente estudo, 55% das grávidas tinha excesso de peso ou obesidade prévia. Segundo McIntyre et al. o IMC materno elevado, independente da glicemia, está fortemente relacionado com o aumento da frequência de complicações na gravidez, em especial relacionadas ao crescimento fetal excessivo e adiposidade44. Assim, os fetos expostos in útero a diabetes e obesidade materna têm um risco aumentado de desenvolver síndrome metabólica na infância45, tal como DM tipo 2 no futuro46.
Em média, ao nascer, um bebé do sexo masculino apresentou mais 132,1g do que um bebé do sexo feminino, o que vai de encontro ao estudo de Catalano, Drago e Amini, que descrevem um peso ao nascer por parte dos rapazes 176g superior ao das raparigas47.
Neste estudo 5,3% das grávidas com obesidade e 2,4% com excesso de peso tiveram bebés macrossómicos, o que representa 2% da população total. Estes valores são inferiores aos encontrados num estudo recente por Ouzounian et al. em que a prevalência de recém-nascidos macrossómicos foi de 7,4% em mulheres com peso prévio normal, 11,4% com excesso de peso e 19% no grupo de mulheres com obesidade48. É provável que a baixa prevalência de macrossomia encontrada se deva ao acompanhamento regular, com planos alimentares individualizados, em função do controlo glicémico e, se necessário, do recurso à insulina. Desta forma pode-se especular que, dado o sucesso do acompanhamento, estas mulheres não sofreram alterações metabólicas que afetassem o meio intrauterino de forma a impulsionar o crescimento fetal excessivo. Gillman et al. acompanharam crianças cujas mães tiveram DG na gravidez e fizeram parte do grupo de intervenção, embora a percentagem de recém-nascidos com macrossomia tivesse sido substancialmente inferior no grupo intervenção em relação ao grupo controlo (5,3 vs 21,9%), aos 4-5 anos, 33 e 27,6% das crianças apresentavam percentil de peso acima dos 8549. O simples facto de nascer de uma mãe com DG aumenta o risco de excesso de peso no futuro50. Segundo Catalano et al. os filhos de mulheres com DG, mesmo quando nasceram AIG, apresentaram aumento da gordura corporal em comparação com filhos de mulheres com tolerância normal à glicose. Este aumento da gordura corporal pode ser um fator de risco para a obesidade na infância e idade adulta51. Num estudo que acompanha o crescimento de crianças expostas e não expostas à DG no útero, Crume et al. verificaram um crescimento semelhante na infância nos 2 grupos, no entanto, constataram um aumento do IMC dos 10-13 anos nas crianças expostas à diabetes in utero. Põe como hipótese a predisposição genética e o facto de a diabetes alterar o metabolismo lipídico, resultando numa desregulação adipocitária e posteriormente a acumulação de ácidos gordos no feto52.
Neste estudo, o ganho ponderal nas grávidas com obesidade (7,100kg±5,9) foi menor do que nas grávidas com peso normal e excesso de peso (10,735kg±4,2 e 10,517±5,5), respetivamente. Estes valores vão de encontro ao referido no estudo Butte et al. em que ganho ponderal das mulheres com excesso de peso prévio foi relatado como sendo semelhante ao das mulheres com baixo peso e com peso normal, enquanto mulheres obesas tendem a ganhar menos peso53. No seu estudo, Gunderson et al. verificaram que as mulheres com excesso de peso prévio à gravidez tiveram um ganho de peso superior às mulheres com IMC anterior normal54. Numa recente revisão sobre o tema, Morisset et al. concluem que nenhum dos estudos com restrição de energia para controlar a glicemia e ganho de peso gestacional demonstraram um aumento significativo de corpos cetónicos ou resultados adversos na gravidez. Pelo contrário revelou-se que a restrição energética levou a menor ganho de peso gestacional, benéfico na melhoria do controlo glicémico22. Hillier et al. sugerem que o tratamento da DG diminui o risco de obesidade infantil, através de mecanismos de imprinting genéticos que ocorrem nas mulheres com diabetes na gravidez25.
Relativamente ao ganho ponderal, 39,3% das mulheres com excesso de peso e 35,5% das mulheres com obesidade excederam as recomendações do IOM. Como a DG é habitualmente diagnosticada no terceiro trimestre de gravidez, esta situação pode ter ocorrido por ganho ponderal excessivo no início da gravidez, o que também poderá ter contribuído para o aparecimento da DG. Num estudo recente de Morriset et al., cujo objetivo era detalhar o ganho de peso gestacional e relacioná-lo com o aparecimento de DG, estes identificaram o ganho ponderal durante o primeiro trimestre como um fator de risco para o aparecimento da DG55.
Na análise multivariada, a HbA1c no terceiro trimestre, mesmo dentro dos valores de referência, revelou uma relação positiva entre o seu aumento e o peso do recém-nascido. Embora a HbA1c seja um indicador útil do controlo metabólico nos últimos 3 meses, não reflete a complexidade do controle glicémico nem as variações e amplitudes de glicemia a curto prazo56. Na revisão recente de Katon et al. elevados níveis deste marcador no diagnóstico são associados ao risco de intolerância à glicose no pós-parto e DM tipo 2. Apesar de não ser um excelente indicador, após o diagnóstico, os valores de HbA1c podem ser úteis para identificar mulheres em risco de ter bebés GIG e macrossómicos57.
Neste estudo há maior prevalência de nascimentos pré-termo e cesariana nas mulheres com obesidade prévia, o que está de acordo com um estudo de Rowlands et al. e indica que a obesidade materna está associada com o risco de nascimentos pré-termo58 e cesarianas59.
O presente estudo apresenta algumas limitações, como o facto de ter havido pouco controlo sobre o mesmo (uma vez que é retrospetivo), o peso prévio à gravidez foi relatado e não medido/avaliado, a data do diagnóstico e do início da TN foi não foi igual em todas as grávidas e estas não realizaram a última consulta antes do parto com a mesma idade gestacional.
São vários os fatores que influenciam o risco da DG, contribuem para macrossomia fetal e nascimento de GIG, e que devem ser considerados na elaboração de estratégias nutricionais. Para prevenir o aparecimento da DG seria útil facultar orientação nutricional às mulheres em idade fértil de modo a diminuírem a ingestão de gordura saturada, aumentarem a ingestão de fibras, HC de baixo IG e apresentarem peso adequado no início da gravidez60. Para a grávida, seria importante um GPA para evitar o nascimento de bebés GIG. Através da monitorização do ganho ponderal na gravidez contribui-se não só para diminuir o risco de complicações para a mãe e feto, mas também para ajudar a evitar a retenção de peso pós-parto. Caso se verifique o diagnóstico da DG, as grávidas devem ser referenciadas para a consulta de nutrição, que deve acontecer no máximo uma semana após o diagnóstico para evitar a exposição da mãe e feto às hiperglicemias60. É essencial a prescrição de um plano alimentar individualizado e aconselhamento em função dos hábitos culturais, IMC prévio, ganho ponderal, atividade física e controlo metabólico. Assim, minimizam-se as complicações para grávida e para o feto e transmitem-se estratégias nutricionais a serem utilizadas no pós-parto, úteis para prevenir o desenvolvimento de doenças crónicas como a diabetes e obesidade no futuro.
Em conclusão, no presente estudo há evidência de uma relação positiva entre o IMC prévio à gravidez, GPS e nascimento de bebés GIG, ou seja, elevado IMC prévio e GPS aumentam o risco de nascimento de GIG, sendo preditivos de peso superior do recém-nascido. Serão necessários mais estudos que acompanhem mulheres em idade fértil e durante a gravidez para recolher a história alimentar e influência no processo da diabetes, assim como ensaios intensivos de estratégias alimentares capazes de assinalar recomendações nutricionais especificas em grávidas com DG.
Conflito de interessesOs autores declaram não haver conflito de interesses.