As alterações da função tiroideia são comuns nos doentes infetados pelo vírus da imunodeficiência humana (VIH). A prevalência de condições geralmente assintomáticas (como o hipotiroidismo subclínico) está aumentada e a doença de Graves pode ocorrer durante a reconstituição imune associada à terapêutica antirretrovírica combinada (TARC).
ObjetivoO objetivo deste estudo é avaliar a presença de doença tiroideia em doentes infetados pelo VIH‐1 sob TARC numa consulta cardiometabólica de endocrinologia associada ao VIH.
MétodosEstudo transversal de 377 doentes infetados pelo VIH‐1 sob TARC.
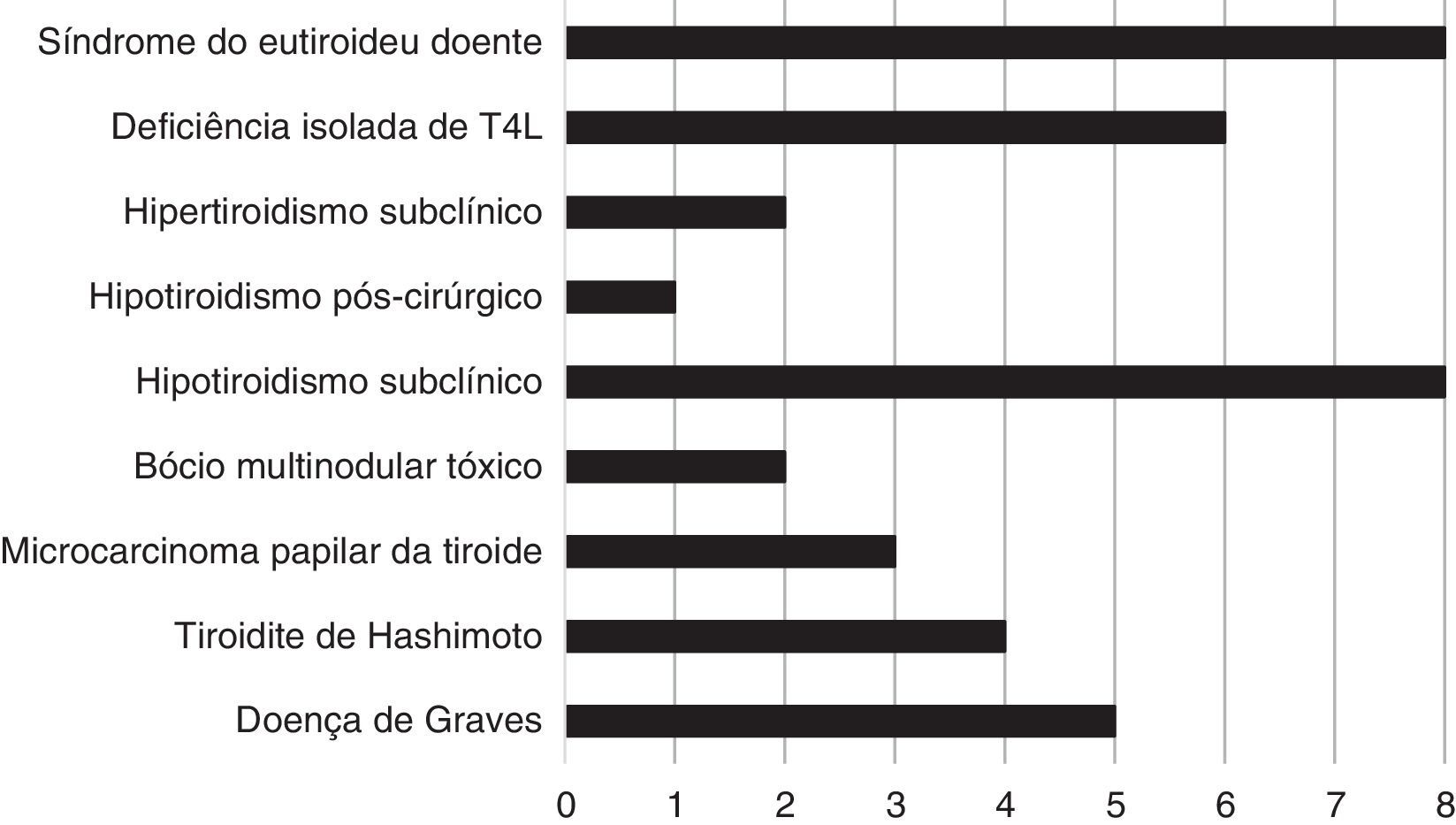
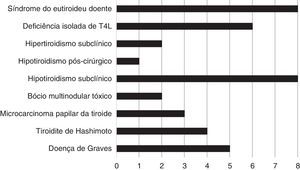
ResultadosTrezentos e trinta e oito doentes (89,66%) eram eutiroideus. Encontrámos alterações da glândula tiroideia em 10,34% (39/377): 1,33% (5/377) doença de Graves; 1,06% (4/377) tiroidite de Hashimoto; 0,80% (3/377) microcarcinoma papilar da tiroide; 0,53% (2/377) bócio multinodular tóxico; 2,12% (8/377) hipotiroidismo subclínico; 0,265% (1/377) hipotiroidismo pós‐cirúrgico; 0,53% (2/377) hipertiroidismo subclínico; 1,59% (6/377) deficiência isolada de T4L e 2,12% (8/377) síndrome do eutiroideu doente.
ConclusõesNesta população de doentes do ambulatório a prevalência de alterações da função tiroideia foi baixa quando comparada com outros estudos em doentes com VIH sob TARC (com prevalência de disfunção até 35%), aproximando‐se da prevalência estimada na população geral. As alterações mais frequentes foram o hipotiroidismo subclínico e a doença de Graves.
Changes in thyroid function are common in HIV‐infected patients. The prevalence of conditions usually asymptomatic (such as subclinical hypothyroidism) is increased and Graves’ disease may occur during immune reconstitution associated with combined antiretroviral therapy (cART).
AimThe aim of this study is to evaluate the presence of thyroid disease in HIV‐1 infected patients on cART in a cardiometabolic Endocrinology Out‐patient Clinic associated with HIV.
MethodsCross‐sectional study of 377 HIV‐1 infected patients on cART.
ResultsThree hundred and thirty‐eight patients (89.66%) were euthyroid. We found thyroid changes in 10.34% (39/377): 1.33% (5/377) Graves’ disease; 1.06% (4/377) Hashimoto's thyroiditis; 0.80% (3/377) papillary thyroid microcarcinoma; 0.53% (2/377) toxic multinodular goiter; 2.12% (8/377) subclinical hypothyroidism; 0.265% (1/377) postsurgical hypothyroidism; 0.53% (2/377) subclinical hyperthyroidism; 1.59% (6/377) low FT4 level and 2.12% (8/377) euthyroid sick syndrome.
ConclusionThe prevalence of thyroid function changes in this ambulatory population was low when compared with other studies in HIV‐patients on cART (dysfunction prevalence of up to 35%), approaching the estimated prevalence in general population. The most common abnormalities were subclinical hypothyroidism and Graves’ disease.
A introdução da terapêutica antirretrovírica combinada (TARC) em 1996 alterou o curso da infeção pelo vírus da imunodeficiência humana (VIH), tendo diminuído significativamente a morbilidade e mortalidade associadas1–4. Deste modo, os indivíduos com idade superior a 45 anos já representam mais de 45% das pessoas que vivem com infeção por VIH nos Estados Unidos da América5.
A utilização da TARC tem sido associada a vários efeitos secundários, incluindo alterações metabólicas como dislipidemia, resistência à insulina, lipodistrofia, aumento da pressão arterial, redução da densidade mineral óssea e disfunção dos eixos gonadal, suprarrenal e tiroideu2,6. Todavia, os mecanismos através dos quais a terapêutica causa tais alterações metabólicas e quais destas anomalias poderão resultar do efeito direto da infeção pelo VIH e das complicações associadas à TARC ainda não estão esclarecidos4,7.
Relativamente às alterações da função tiroideia, 1‐2% dos indivíduos infetados pelo VIH apresenta disfunção tiroideia clínica e cerca de 35% pode apresentar alterações subclínicas ou subtis da função tiroideia4,7–13. Vários autores descreveram um aumento do hipotiroidismo subclínico, uma situação geralmente assintomática e que pode não requerer tratamento7–13. Para além disso, tem‐se observado a ocorrência de doença de Graves como manifestação da síndrome inflamatória de reconstituição imune associada à TARC8,14. Nos doentes com síndrome de imunodeficiência adquirida (SIDA) é ainda muito comum a presença da síndrome do eutiroideu doente9,15.
Atualmente, os dados disponíveis são muito controversos e não existe um consenso sobre a necessidade de rastreio de alterações da função tiroideia em todos os doentes infetados pelo VIH sob TARC.
Este estudo tem como objetivo avaliar a presença de doença tiroideia em doentes infetados pelo VIH‐1 sob TARC numa consulta cardiometabólica de Endocrinologia associada ao VIH do Centro Hospitalar de São João.
MétodosSeleção dos participantesEstudo observacional transversal que incluiu 409 adultos caucasianos não institucionalizados infetados pelo VIH‐1 sob TARC que foram referenciados para a consulta externa de Endocrinologia do Centro Hospitalar de São João pelo especialista em doenças infeciosas por apresentarem alterações metabólicas e/ou lipodistrofia. Trinta e dois doentes não realizaram testes de função tiroideia, pelo que foram excluídos do estudo, perfazendo uma amostra final de 377 doentes. A amostra de sangue foi insuficiente para determinar a tiroxina livre (T4L) em 7 doentes, pelo que apenas 370 doentes tiveram a T4L doseada. O estudo foi aprovado pela Comissão de Ética do Centro Hospitalar de São João e todos os doentes forneceram o consentimento informado.
Avaliação clínicaPara cada doente foram recolhidos os dados sobre idade, género e história tabágica. O peso, estatura, índice de massa corporal (IMC) e perímetros cervical, da cintura, da anca e da coxa foram medidos de acordo com o protocolo descrito anteriormente16. O curso da doença foi definido pela duração da infeção por VIH desde o primeiro resultado positivo do teste VIH, o estádio da doença pelo Centro de Prevenção e Controlo de Doenças (CDC), a contagem das células CD4 e a carga vírica RNA‐VIH. Considerou‐se apenas o último esquema de tratamento antirretrovírico usado na data da avaliação e avaliou‐se o tipo de fármacos e a duração do tratamento desde o início da doença.
Avaliação laboratorialA contagem das células CD4 foi determinada por citometria de fluxo e a carga vírica RNA‐VIH por reação em cadeia da polimerase via transcriptase reversa, com um limite mínimo de deteção de 50 cópias/mL.
A determinação dos níveis séricos de hormona estimulante da tiroide (TSH), triiodotironina livre (T3L), T4L e anticorpos antitiroideus foi realizada pelo método de quimioluminescência (aparelho Architect Plus I2000 SR, Abbott). Os níveis séricos normais de TSH, T4L e T3L foram definidos de acordo com os valores de referência do laboratório de análises do Centro Hospitalar de São João, situando‐se entre 0,350‐4,940mUI/mL para a TSH, entre 0,70‐1,48ng/dL para a T4L e entre 1,71‐3,71pg/mL para a T3L. A negatividade dos anticorpos antitiroideus correspondeu a um nível de anticorpos antitiroglobulina (anti‐Tg) inferior a 0,60UI/mL (ou inferior a 4,11UI/mL, se o doseamento foi realizado após 16/03/2009), anticorpos antiperoxidase (antiTPO) inferior a 0,60UI/mL (ou inferior a 5,61UI/mL, se o doseamento foi realizado após 16/03/2009) e anticorpos antirrecetor da TSH (TRAbs) inferior a 1,8U/L.
A presença de doença tiroideia foi definida com base na alteração dos parâmetros laboratoriais, na história clínica e no uso de medicação tiroideia. O eutiroidismo foi definido por níveis de TSH e T4L normais (0,350‐4,940mUI/mL e 0,70‐1,48ng/dL, respetivamente). O hipotirodismo foi definido por um valor de TSH superior a 4,940mUI/mL e um valor de T4L normal ou inferior a 0,70ng/dL consoante se trate, respetivamente, de hipotiroidismo subclínico ou clínico. O hipertiroidismo foi definido por um valor de TSH inferior a 0,350mUI/mL e um valor de T4L normal ou superior a 1,48ng/dL consoante se trate, respetivamente, de hipertiroidismo subclínico ou clínico. A coexistência de hipertiroidismo e TRAbs positivos permitiu o diagnóstico de doença de Graves. A categoria «deficiência isolada de T4L» foi associada a um valor de T4L inferior a 0,70ng/dL, com níveis de TSH e T3L normais. A síndrome do eutiroideu doente foi associada a um valor de T3L inferior a 1,71pg/mL, com níveis de TSH normais e valor de T4L variável.
Análise estatísticaA descrição dos dados foi efetuada recorrendo ao software estatístico SPSS (versão 18). As variáveis contínuas foram descritas como médias e medianas com as respetivas medidas de dispersão desvio padrão e percentis 25 e 75. Quanto às variáveis categóricas foram descritas como proporções.
ResultadosAs características demográficas e clínicas dos doentes estão sumarizadas na tabela 1. A nossa amostra era constituída maioritariamente por indivíduos do sexo masculino (66,6%) e a mediana de idade foi de 44 anos. O IMC médio encontrava‐se acima do valor da normalidade (25,3kg/m2). A mediana da duração da infeção pelo VIH foi de 8 anos, tendo a maioria uma contagem de células CD4 igual ou superior a 200 células/mm3 (91,6%) e carga vírica inferior a 50 cópias/mL em 85,6% dos doentes.
Os doentes estavam sob TARC há cerca de 6,5 anos, sendo em 56,4% inibidores da protease, em 46,9% inibidores não‐nucleosídeos da transcriptase reversa e em 97,2% inibidores nucleosídeos da transcriptase reversa.
Dos 377 doentes incluídos no estudo, 89,66% (338/377) eram eutiroideus. Encontrámos alterações da glândula tiroideia em 39 doentes (10,34%): 1,33% (5/377) com doença de Graves; 1,06% (4/377) com tiroidite de Hashimoto; 0,80% (3/377) com microcarcinoma papilar da tiroide; 0,53% (2/377) com bócio multinodular tóxico; 2,12% (8/377) com hipotiroidismo subclínico; 0,265% (1/377) com hipotiroidismo pós‐cirúrgico; 0,53% (2/377) com hipertiroidismo subclínico; 1,59% (6/377) com deficiência isolada de T4L e 2,12% (8/377) com síndrome do eutiroideu doente. A prevalência das alterações tiroideias encontradas nesta população encontra‐se representada na figura 1.
DiscussãoNão encontrámos publicações sobre a prevalência de disfunção tiroideia em adultos da população geral portuguesa. Com o aumento da idade, a prevalência destas alterações tende a aumentar17.
As disfunções tiroideias nos doentes infetados pelo VIH têm sido descritas como prováveis efeitos adversos da TARC. No entanto, elas podem ocorrer na ausência de terapêutica antirretrovírica e resultar do envolvimento direto da glândula por infeções oportunistas (por Pneumocystis jiroveci, Cryptococcus neoformans ou citomegalovírus) ou neoplasias locais (sarcoma de Kaposi ou linfoma), de doença sistémica grave e de restrição calórica2,7,8,18,19. São vários os mecanismos protetores que contribuem para a resistência da tiroide à infeção: maior suprimento sanguíneo e drenagem linfática, grande quantidade de iodo (agente bactericida), envolvimento completo por cápsula fibrosa e separação das outras estruturas por fáscias19. Atualmente as infeções ou infiltrações tiroideias sintomáticas são pouco comuns, sendo extremamente raras desde a introdução da TARC e o uso generalizado de profilaxia primária de infeções oportunistas8,19.
A alteração mais frequente neste estudo foi o hipotiroidismo subclínico, presente em 2,12% dos doentes. A prevalência do hipotiroidismo subclínico na população geral está estimada em 4,3%20, mas na faixa etária entre os 40‐60 anos esta patologia pode atingir 1,9% dos homens e 7,6% das mulheres21. No nosso estudo, todos os indivíduos com hipotiroidismo subclínico eram do sexo masculino, o que reflete uma tendência invertida nos infetados pelo VIH, já descrita previamente por outros autores7,22. Contudo, é necessário considerar que a percentagem de doentes do sexo masculino na amostra era superior à do sexo feminino (66,6 e 33,4%, respetivamente). Os doentes com esta patologia tinham uma idade superior (mediana de 48,5 anos).
Antes do aparecimento da TARC, um estudo de Merenich realizado em 1990 encontrou uma prevalência de 8% de hipotirodismo subclínico em doentes assintomáticos com VIH18. Vários autores têm verificado um aumento da prevalência desta patologia desde a introdução da TARC (prevalência entre 3,5‐12,2%)4,7,9–13,15,23,24. Brockmeyer observou uma prevalência mais elevada (17,6%) numa pequena amostra de homens homossexuais infetados pelo VIH25. Outro estudo associou a interrupção da TARC com a normalização da função tiroideia, contudo, não realizaram uma análise multivariada para confirmar os resultados descritivos observados4. Por outro lado, o estudo de coorte de Nelson que envolveu 2.437 indivíduos infetados pelo VIH encontrou uma incidência de hipotiroidismo de 10,7 por 10.000 doentes‐ano e uma prevalência muito baixa (1,2%)22.
Dos doentes com hipotirodismo subclínico, cerca de 2‐5% por ano progridem para hipotirodismo clínico, sendo mais provável em doentes cujo valor sérico de TSH seja superior a 10mIU/L. Nestes indivíduos, o tratamento com levotiroxina poderá estar indicado, no sentido de evitar a progressão e diminuir as consequências do hipotiroidismo26. No nosso estudo, nenhum dos doentes com hipotiroidismo subclínico apresentava valor de TSH superior a 10mIU/L, pelo que o risco de progressão para hipotiroidismo clínico é baixo.
O hipotiroidismo clínico pode ocorrer tanto na população geral, onde afeta cerca de 0,3‐2% dos indivíduos nas populações sem deficiência de iodo17,20, como nos indivíduos infetados pelo VIH, com uma prevalência estimada entre 0‐2,6% de acordo com diferentes autores4,7,11–13,15,23. No entanto, na amostra estudada observámos 4 casos de tiroidite de Hashimoto. O aumento da concentração sérica dos antiTPO está presente em 90% dos doentes com tiroidite de Hashimoto27. Apesar da etiologia autoimune ser a causa mais frequente de hipotiroidismo na população geral, a tiroidite de Hashimoto não é comum durante a reconstituição imune associada à terapêutica antirretrovírica8,28.
Vários autores têm observado na análise multivariada que a utilização da estavudina, um inibidor nucleosídeo da transcriptase reversa, se associa à presença de hipotiroidismo4,7,11,22,29 e a níveis baixos de T4L23. Portanto, a terapêutica poderá afetar diretamente a produção e/ou metabolização das hormonas tiroideias, embora o mecanismo não seja conhecido4,7,8,11. Foi descrito que a TSH se correlacionava positivamente com a duração da TARC e que globalmente os níveis de T3L e T4L diminuiam significativamente em relação aos valores basais durante o seguimento dos doentes submetidos a TARC 4. O hipotiroidismo foi também associado à utilização de efavirenz, amprenavir, lopinavir, ritonavir e nevirapina7,29. Contudo, um estudo de larga escala realizado por Madge que incluiu 1.565 pacientes e outros 3 estudos de pequena dimensão não encontraram associação entre alterações tiroideias e TARC, nomeadamente a estavudina10,15,24,30. Nós não efetuámos análise por fármaco mas por grupo farmacológico. Observámos que todos os doentes que desenvolveram hipotiroidismo estavam a receber tratamento com um inibidor nucleosídeo da transcriptase reversa (como referido anteriormente, este tipo de fármaco estava incluído no esquema terapêutico da maioria dos doentes do estudo) (tabela 1).
Características demográficas, antropométricas e clínicas dos doentes
| Dados demográficos | |
|---|---|
| Género [n (%)] | |
| Masculino | 251 (66,6) |
| Feminino | 126 (33,4) |
| Idade (anos, mediana [percentis 25 e 75]) | 44 (37,0‐53,0) |
| História tabágica (n (%)) | |
| Nunca | 137 (39,0) |
| Fumador | 152 (43,3) |
| Ex‐fumador | 62 (17,7) |
| Dados antropométricos | |
| Peso (kg, média [DP]) | 69,1 (14,4) |
| Estatura (m, média [DP]) | 1,65 (0,09) |
| IMC† (kg/m2, média [DP]) | 25,3 (4,9) |
| Perímetro cervical (cm, média [DP]) | 37,0 (4,0) |
| Perímetro cintura (cm, média [DP]) | 91,7 (12,4) |
| Perímetro anca (cm, média [DP]) | 95,1 (8,9) |
| Perímetro coxa (cm, média [DP]) | 47,7 (6,5) |
| Infeção | |
| Duração da infeção VIH (anos, mediana [percentis 25 e 75]) | 8,0 (5,0‐11,0) |
| RNA VIH <50 cópias/mL | |
| Sim (n[%]) | 316 (85,6) |
| Não (n[%]) | 53 (14,4) |
| Contagem células CD4 (células/mm3) | |
| <200 (n [%]) | 31 (8,4) |
| ≥200 (n [%]) | 338 (91,6) |
| CDC (n [%]) | |
| A | 206 (56,0) |
| B | 5 (1,3) |
| C | 157 (42,7) |
| Duração da TARC (anos, mediana, percentis 25 e 75) | 6,5 (3,0‐9,75) |
| IP (n [%]) | 202 (56,4) |
| NNRTI (n [%]) | 168 (46,9) |
| NRTI (n [%]) | 348 (97,2) |
DP: desvio padrão; IMC: índice de massa corporal; RNA VIH: ácido ribonucleico vírus da imunodeficiência humana; CDC: Centro de Prevenção e Controlo de Doenças; TARC: terapêutica antirretrovírica combinada; IP: inibidor da protease; NNRTI: inibidor não‐nucleosídeo da transcriptase reversa; NRTI: inibidor nucleosídeo da transcriptase reversa.
Embora rara, a associação com o sistema imunológico foi descrita por alguns autores. Beltran observou que baixa contagem CD4 foi fator de risco para hipotiroidismo e Collazos encontrou uma correlação significativa entre os níveis de T4L e a contagem CD4 nos pacientes submetidos a TARC7,24. Na análise multivariada, Madeddu observou que a TSH, mas não a T4L e a T3L, correlacionava‐se positivamente com a duração da TARC e negativamente com a contagem de células CD4 naive4. Vários autores sugerem que esta associação entre a função tiroideia e a contagem CD4 seja mediada por citocinas pró‐inflamatórias (por exemplo, TNF‐alfa e IL‐2), que se encontram aumentadas nos doentes infetados pelo VIH, tanto antes como durante a terapêutica4,24,31. Assim, os doentes com a menor contagem de células CD4 antes do início do tratamento poderão ter maior risco de desenvolver hipotiroidismo subclínico durante a TARC, como parece ocorrer com as complicações lipodistróficas32. Nos doentes com hipotiroidismo subclínico, 2 doentes (25%) tinham contagem de células CD4 inferior a 200 células/mm3.
Carella descreveu a coinfeção pelo vírus da hepatite C (VHC) como fator de risco para o hipotirodismo; esta associação pode ser mediada por alterações autoimunes (justificadas pela presença de anticorpos antitiroideus em doentes com infeção pelo VHC) ou por efeitos adversos da terapêutica com interferão33. Outros autores não observaram esta associação4,7,10,11,15,34. O aumento do colesterol total durante a TARC foi considerado preditor de hipotiroidismo subclínico num estudo de Bongiovanni, que sugere que os doentes que desenvolvem hipercolesterolemia após o início da TARC são aqueles que têm maior risco de hipotiroidismo subclínico30. No nosso estudo não averiguámos a relação do hipotiroidismo com a coinfeção por VHC ou com o colesterol.
O hipertiroidismo subclínico ocorre em 0,4‐0,7% da população geral e até 1,3% nos doentes VIH13,15,22. A incidência em indivíduos infetados é cerca de 3,4 por 10.000 doentes‐ano22. Progride para hipertiroidismo clínico numa taxa de 1‐2% por ano nos indivíduos com níveis de TSH inferiores a 0,1mIU/L26. Na amostra apenas 2 doentes (0,53%) tinham esta alteração tiroideia e nenhum deles apresentava um valor tão baixo de TSH. O tratamento deve ser realizado se a disfunção estiver associada a doença de Graves ou a doença nodular da tiroide, em doentes com idade superior a 60 anos e nos que tiverem um elevado risco cardiovascular, osteopenia ou osteoporose ou sintomas sugestivos de hipertiroidismo26.
O hipertiroidismo clínico é encontrado numa percentagem inferior a 2% tanto na população geral17,20 como nos doentes infetados pelo VIH4,12,13. A doença de Graves, uma doença autoimune que resulta na produção de TRAbs27, é a principal causa de hipertiroidismo na população geral e nos indivíduos infetados pelo VIH8,17.
A síndrome inflamatória de reconstituição imune resulta da disfunção da restauração da imunocompetência nos primeiros 6 meses após a introdução da TARC35. A população de células CD4 tendem a aumentar de acordo com um padrão bifásico após a introdução da TARC. Numa primeira fase (primeiros 2‐3 meses de tratamento), há supressão da replicação do vírus e aumento das células T memória que são redistribuídas a partir de tecidos linfoides para o sangue periférico, o que leva a um rápido aumento da contagem de células CD436–39. Neste período pode ocorrer reativação de infeções oportunistas por Mycobacterium avium complex, Mycobacterium tuberculosis, Cryptococcus neoformans ou citomegalovírus, sendo as células CD4 memória específicas para os antigénios desses agentes35,37. Numa segunda fase, as células CD4 naive aumentam lentamente, devido à repopulação e à produção pelo timo36,37,39,40. A involução do timo tende a ocorrer com a idade, mas pode permanecer funcional em indivíduos infetados pelo VIH, o que sugere que a depleção de células T induzida pela infeção poderá levar à maturação de timócitos41.
A doença de Graves pode ocorrer como uma manifestação tardia da síndrome inflamatória de reconstituição imune, com uma prevalência de 3% na mulher e 0,2% no homem, sendo diagnosticada num período muito variável após a introdução da terapêutica, variando entre 8‐53 semanas consoante os diferentes autores8,14,35,37,42. Esta associação foi descrita pela primeira vez por Gilquin em 1998, mas atualmente os mecanismos responsáveis por esta associação ainda permanecem desconhecidos36. Observámos que 1,33% dos doentes estudados tinha doença de Graves, mas não avaliámos em que altura foi efetuado o diagnóstico.
A associação da doença de Graves à utilização da TARC foi bem demonstrada por Jubault, que observou que os anticorpos antiTPO e TRAbs surgiram após o aumento muito rápido de células CD4 derivado da TARC em doentes cujos anticorpos eram persistentemente negativos antes da terapêutica14. Além disso, Chen observou que os indivíduos com doença de Graves tinham uma contagem inicial de células CD4 significativamente mais baixa e um incremento da contagem com a TARC significativamente maior em relação ao grupo controlo37. Em alguns estudos, o hipertiroidismo associou‐se positivamente ao uso de inibidores não‐nucleosídeos da transcriptase reversa (nomeadamente o efavirenz), à raça negra e à utilização de drogas nos 6 meses anteriores ao diagnóstico22,34.
O bócio multinodular tóxico é a segunda principal causa de hipertiroidismo. Vanderpump descreveu uma prevalência de 1% em doentes seropositivos17; na nossa amostra a prevalência foi apenas de 0,53%. Um doente com bócio multinodular tinha sido submetido a tiroidectomia total por bócio multinodular tóxico.
Três doentes (0,80%) tinham sido submetidos a tiroidectomia total por microcarcinoma papilar da tiroide, de acordo com o diagnóstico anatomopatológico.
A deficiência isolada de T4L ocorre entre 1,3‐6,8% dos infetados pelo VIH4,7,24. Encontrámos uma prevalência de 1,59%. Esta identidade tem sido associada ao uso de didanosina, estavudina e ritonavir por alguns autores, mas não se conhece o significado clínico desta alteração4,23. Os indivíduos assintomáticos com diminuição isolada dos níveis de T4L têm um maior pico de TSH após a estimulação com hormona libertadora de tirotrofina (TRH), o que sugere que a regulação do eixo hipotálamo‐hipófise‐tiroide está intacta, tornando a insuficiência hipotalâmica ou hipofisária menos provável23.
A síndrome do eutiroideu doente pode afetar até 70% dos doentes em estado crítico, estando associado a um aumento da mortalidade43. A alta prevalência observada pode ser atribuída, em parte, ao excesso de testes de função tiroideia requisitados em doentes hospitalizados e à terapêutica com corticosteroides, heparina e outros fármacos não esteroides15. Calza e Madge observaram que 16‐17% dos doentes submetidos a TARC desenvolveu esta síndrome9,15. No nosso estudo, apenas 2,12% dos indivíduos tinha esta alteração, o que pode ser explicado pelo facto de os doentes incluídos serem do ambulatório. Esta síndrome sugere disfunção tiroideia, mas deve ser considerada como uma resposta endócrina fisiológica à doença grave (nomeadamente em casos avançados de infeção pelo VIH)8,43. Caracteriza‐se globalmente por redução da produção de T3 (por diminuição da 5′‐desiodisação da T4), elevação de T3 reversa, T4L variável e nível de TSH normal ou diminuído consoante a gravidade da doença8. Parece resultar da falta de estimulação pela TRH, uma vez que após administração de TRH ocorre aumento dos níveis de TSH e subsequentemente de T3L e T4L44. Durante a recuperação do evento agudo as hormonas tiroideias regressam progressivamente aos valores basais normais, mas a TSH pode aumentar temporariamente, simulando um hipotiroidismo43,44. Portanto, os testes de função tiroideia não devem ser requisitados nos doentes críticos, exceto se houver uma forte suspeita de disfunção tiroideia. Perante alterações destes testes no contexto de uma infeção descontrolada pelo VIH, o diagnóstico de síndrome do eutiroide doente deve ser sempre ponderado8,43.
As recomendações da Associação Americana de Tiroide aconselham o rastreio de disfunção tiroideia através do doseamento da TSH nos indivíduos com idade superior a 35 anos ou mais precocemente se houver risco acrescido ou sintomas sugestivos de disfunção tiroideia45. Além disso, o doseamento da T4L apenas é recomendado se houver alteração do valor de TSH ou se houver suspeita de hipotiroidismo central ou resistência à hormona tiroideia45.
A necessidade de realização de rastreio sistemático da função tiroideia em doentes assintomáticos infetados pelo VIH é uma questão controversa, pois não existe evidência científica suficiente que comprove o seu benefício. Se por um lado alguns autores recomendam o rastreio de alterações da função tiroideia em todos os doentes submetidos a TARC22,30, outros referem que o rastreio nesta população é desnecessário13. Hoffmann defende a análise da função tiroideia em doentes com sintomas sugestivos ou com sintomas sistémicos inespecíficos8. Wiener sugere o rastreio nos doentes do sexo masculino de raça negra ou consumidores de cocaína e heroína, devido à maior prevalência de disfunção tiroideia nesta população34. Beltran e Madeddu recomendam o rastreio nos doentes submetidos a TARC, sobretudo se tratados com estavudina, e nos que apresentem baixa contagem CD44,7. Contudo, um estudo recente em indivíduos recém‐diagnosticados com infecção por VIH demonstrou uma prevalência de disfunção tiroideia de 30% em indivíduos que ainda não estavam sob TARC, sugerindo a monitorização sistemática da função tiroideia antes de iniciar a terapêutica nos doentes infectados12.
O presente estudo apresenta várias limitações. É difícil comparar prevalências de doenças em indivíduos com diferente adesão e duração da TARC. Além disso, não podemos excluir o viés de seleção, uma vez que só foram analisados os resultados dos doentes que foram selecionados pelo especialista em doenças infeciosas e encaminhados para a consulta de endocrinologia por apresentarem alguma alteração metabólica e/ou lipodistrofia. A idade dos doentes da amostra era mais homogénea em relação a outros estudos e não houve comparação dos resultados com um grupo controlo não infetado pelo VIH. Como realizámos um estudo transversal, apenas pudemos estabelecer associações e não determinar causalidade ou fatores de risco associados à disfunção tiroideia. Com uma amostra de pequena dimensão, o poder de identificar associações estatisticamente significativas em alterações que ocorrem numa fração pequena de indivíduos é limitada. Assim sendo, consideramos que são necessários estudos de seguimento de larga escala que permitam a compreensão e associação das alterações endócrinas, nomeadamente disfunção tiroideia, com a introdução da TARC em doentes infetados pelo VIH.
ConclusãoNa nossa população de doentes infetados pelo VIH‐1 sob TARC, as alterações mais frequentes foram o hipotiroidismo subclínico e a doença de Graves, estando de acordo com o descrito na literatura. A prevalência global de alterações da função tiroideia foi baixa quando comparada com outros estudos, aproximando‐se da prevalência estimada na população geral. Consideramos que os doentes assintomáticos infetados pelo VIH‐1 submetidos a TARC não deverão ser alvo de rastreio sistemático da função tiroideia. Deverão realizá‐lo aqueles que apresentem sintomas sugestivos de alterações tiroideias, sobretudo se estiverem sob terapêutica com inibidores nucleosídeos da transcriptase reversa (nomeadamente estavudina). Contudo, são necessários estudos de seguimento de grande escala para uma melhor compreensão do efeito da TARC na função tiroideia e dos possíveis fatores de risco associados.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.