Avaliar a relação entre sobrecarga de ferro e idade de diagnóstico, grau de secreção de insulina e controlo glicémico numa coorte de doentes com diabetes mellitus tipo 1 (DMT1).
MétodosIncluíram‐se doentes caucasianos com DMT1 sem outras comorbilidades relevantes. A amostra foi caracterizada relativamente ao género, idade no momento do diagnóstico, idade atual, duração da doença, doseamento do peptídeo C, HbA1c, saturação da transferrina e ferritina. Foram pesquisadas correlações entre os diferentes parâmetros. Os doentes com alterações da cinética do ferro mantidas foram submetidos a estudo do gene HFE.
ResultadosIncluíram‐se 166 doentes. A média foi de 17,1±11,1anos para a idade no momento do diagnóstico, 30,8±12,7anos para a idade atual e 13,4±9,1anos para a duração da doença. O estudo laboratorial revelou um nível médio de peptídeo C de 0,16±0,33ng/mL, de HbA1c de 9,0±2,0%, de saturação da transferrina de 29,0±11,4% e de ferritina de 84,0±81,5ng/mL. O peptídeo C correlacionou‐se inversamente com a duração da doença e diretamente com os níveis de ferritina e a saturação de transferrina. A ferritina correlacionou‐se diretamente com a idade de diagnóstico e idade atual. Obteve‐se correlação inversa entre a HbA1c e a idade atual.
ConclusõesA sobrecarga de ferro associou‐se a maior preservação da secreção de insulina e a idades de diagnóstico mais avançadas, sem efeito deletério sobre o controlo metabólico. Atendendo a que a sobrecarga de ferro pode ser um fator precipitante tardio para a DMT1, o estudo da cinética do ferro em doentes com DMT1 poderá contribuir para estabelecer o diagnóstico precoce de hemocromatose e assim garantir a manutenção da qualidade de vida destes doentes.
To assess the relation between iron overload and age at diagnosis, insulin secretion and glycemic control on a cohort of patients with type 1 diabetes.
MethodsCaucasian patients with type 1 diabetes and no other significant comorbidities were included. They were characterized on what concerns to gender, age at diagnosis, current age, disease's duration, C‐peptide, A1C, transferrin saturation and ferritin. Correlations among different parameters were sought. Patients with maintained iron kinetics abnormalities underwent HFE testing.
ResultsWe included 166 patients. The average age at diagnosis was of 17.1±11.1 years, current age of 30.8±12.7 years and disease's duration of 13.4±9.1 years. The laboratory study revealed an average C‐peptide of 0.16±0.33ng/mL, A1C of 9.0±2.0%, transferrin saturation of 29.0±11.4% and ferritin of 84.0±81.5ng/mL. C‐peptide correlates inversely with disease's duration and directly with ferritin and transferrin saturation. Ferritin correlates directly with age at diagnosis and current age. An inverse correlation between A1C and current age was attained.
ConclusionsIron overload is related with greater maintenance of insulin secretion and older age at diagnosis, without harmful influence over glycemic control. Considering that iron overload may be an environmental trigger for late‐onset type 1 diabetes, iron kinetics evaluation in patients with type 1 diabetes might be helpful to settle an early diagnosis of hemochromatosis and therefore ensure preservation of quality of life in these patients.
A sobrecarga de ferro pode ser hereditária ou secundária. A hemocromatose hereditária engloba os seguintes subgrupos: tipo 1 (gene HFE), 2A (gene HJV), 2B (gene HAMP), 3 (gene TFR2) e 4 (gene SLC40A1). A sobrecarga de ferro secundária pode ser atribuível a doenças hepáticas crónicas, a anemias associadas a sobrecarga de ferro e a sobrecarga parentérica de ferro. Consideram‐se como síndromes multifatoriais a atransferrinemia congénita, aceruloplasminemia, sobrecarga de ferro neonatal e sobrecarga de ferro africana1–5.
A hemocromatose hereditária ligada ao gene HFE é a causa genética mais comum de sobrecarga de ferro. A prevalência estimada é de um caso por cada 220‐250 indivíduos de origem caucasiana. A hemocromatose hereditária com fenótipo característico associa‐se maioritariamente ao genótipo C282Y/C282Y, estando implicados com menor frequência os genótipos C282Y/H63D e C282Y/S65C1–3,6,7.
Considerando a população de origem caucasiana, a frequência alélica estimada das mutações C282Y, H63D e S65C é de, respetivamente, 6,2, 14 e 0,5%. Apesar de ser mais frequente, a mutação H63D é considerada um polimorfismo minor (tal como a mutação S65C), com penetrância muito reduzida. Assim, a homozigotia H63D e a heterozigotia composta C282Y/H63D e C282Y/S65C podem condicionar sobrecarga ligeira de ferro, sem doença clínica evidente na ausência de outros cofatores de risco (esteatose hepática não alcoólica, hepatopatia alcoólica, hepatite viral crónica, porfiria cutânea tardia, anemia com sobrecarga de ferro, obesidade)1–3,5,6,8.
Em Portugal, a frequência alélica das mutações C282Y e H63D é de, respetivamente, 5,8 e 19,4% no Norte, 4,6 e 20% no Centro, 3 e 15% em Lisboa e Vale do Tejo, 2,3 e 18,2% no Alentejo, 0,9 e 16,8% no Algarve, 2,1 e 17,6% nos Açores e 0,33 e 20,5% na Madeira8–10.
A hemocromatose hereditária, que tem uma penetrância estimada de 13,5% quando implicado o genótipo C282Y/C282Y, pode cursar com manifestações hepáticas, cardiovasculares, osteoarticulares, cutâneas e endocrinológicas. A mortalidade decorre de complicações como a insuficiência cardíaca, diabetes mellitus, cirrose hepática e carcinoma hepatocelular1,3,6,11.
A American Association for the Study of Liver Diseases (AASLD) defende a realização de rastreio em indivíduos com antecedentes familiares de hemocromatose, manifestações clínicas ou alterações bioquímicas e/ou imagiológicas sugestivas de sobrecarga de ferro. O estudo do gene HFE deverá ser efetuado em doentes que evidenciem saturação de transferrina igual ou superior a 45% e/ou ferritina elevada (caso a elevação da saturação de transferrina seja confirmada numa avaliação em jejum)1.
O doseamento da ferritina como marcador da reserva de ferro caracteriza‐se por sensibilidade elevada, com a vantagem de apresentar menor variabilidade biológica do que a saturação de transferrina. Contudo, a especificidade deste parâmetro analítico é comprometida pela frequência de resultados falsos positivos em doentes com antecedentes de etilismo, hepatite viral crónica, doença hepática não alcoólica, doença inflamatória crónica, infeção, neoplasia, diabetes mellitus e síndrome metabólica1–3,6,11.
O aumento do aporte de ferro, saturações de transferrina elevadas e a homozigotia para a mutação C282Y associam‐se a aumento de risco para a diabetes mellitus tipo 1 (DMT1)7,12,13.
Ellervik et al. demonstraram que em doentes com DMT1 de manifestação tardia (diagnóstico estabelecido após os 30 anos de idade) uma saturação de transferrina elevada, avaliada num momento variável após o diagnóstico de DMT1, constitui um fator preditivo de mortalidade independente do genótipo HFE. Concluíram ainda, por comparação com uma coorte de doentes com DMT1 em que o estudo da cinética do ferro foi realizado na primeira consulta com endocrinologista, que a avaliação precoce da saturação de transferrina se associa a um aumento da esperança de vida14.
De acordo com as recomendações da European Association for the Study of the Liver (EASL), o estudo do gene HFE deve ser ponderado em doentes com DMT1 (grau de recomendação 2C), mas não com diabetes mellitus tipo 2 (grau de recomendação 1B)6.
O objetivo deste trabalho foi avaliar a relação entre marcadores de sobrecarga de ferro e a idade de diagnóstico, grau de secreção de insulina e controlo glicémico numa população de doentes com DMT1.
Material e métodosO estudo realizado incluiu indivíduos caucasianos com DMT1 observados em consulta do nosso serviço no período compreendido entre 1 de julho de 2010 e 30 de setembro de 2011.
O diagnóstico de DMT1 foi considerado confirmado desde que os doentes que cumprissem os critérios de diagnóstico de diabetes mellitus apresentassem concomitantemente anticorpos específicos para a DMT1 positivos (anticorpos antiglutamato descarboxilase 65, antitirosina fosfatase e/ou anti‐ilhéus de Langerhans) e/ou um nível de peptídeo C inferior a 0,5ng/mL no momento do diagnóstico.
Considerou‐se como critério de exclusão a presença de outra entidade clínica que pudesse interferir com o estudo da cinética de ferro, nomeadamente etilismo, neoplasia, hepatopatia, insuficiência renal e/ou anemia (ferropriva, sideroblástica, hemolítica, aplásica ou talassemia).
Cada doente selecionado foi avaliado relativamente ao género, idade no momento do diagnóstico da DMT1, idade atual e duração da doença. Através da consulta do processo clínico, obteve‐se informação respeitante ao tipo de esquema de insulinoterapia, dose diária total de insulina e, no caso das mulheres, relativamente ao uso de métodos contracetivos e número de gestações de termo. O estudo laboratorial habitual englobou ainda o doseamento do peptídeo C, HbA1c, saturação da transferrina e ferritina. Os elementos da amostra com saturação de transferrina superior a 45% e/ou níveis elevados de ferritina (superiores a 200ng/mL nas mulheres e a 250ng/mL nos homens) foram contactados para repetir o estudo da cinética do ferro após cumprirem um período de jejum. Procedeu‐se à realização do estudo do gene HFE nos doentes em que os resultados laboratoriais anómalos persistiram.
A análise estatística dos dados foi efetuada com recurso ao SPSS 18.0. Foi considerado estatisticamente significativo um valor de p inferior a 0,05.
ResultadosForam incluídos 166 doentes caucasianos com DMT1, sendo que 50,6% da amostra era constituída por elementos do sexo masculino.
Cerca de 48,4% dos doentes (n=159) encontravam‐se sob esquema de insulinoterapia intensiva funcional (com contagem de hidratos de carbono), 27% sob insulinoterapia intensiva com múltiplas administrações (basal‐bólus) e 20,8% sob bomba perfusora de insulina. Um número reduzido de doentes (3,8%) encontrava‐se presentemente sob esquema terapêutico com insulina bifásica, por persistente incumprimento de esquemas de insulinoterapia intensiva previamente instituídos. A média da dose diária de insulina da população estudada foi de 0,77±0,25U/kg de peso.
Considerando as mulheres cuja consulta do registo clínico permitiu a obtenção de informação relativa ao uso de métodos contracetivos que possam influenciar a intensidade do fluxo da hemorragia de privação (n=69), verificou‐se que 36,2% usam um estroprogestativo (oral ou anel vaginal) e 1,4% um dispositivo intrauterino de levonorgestrel. Cerca de 69% das mulheres estudadas (n=71) nunca tiveram uma gestação de termo (18,3% – uma; 9,9% – 2 e 2,8% – 3 gestações de termo).
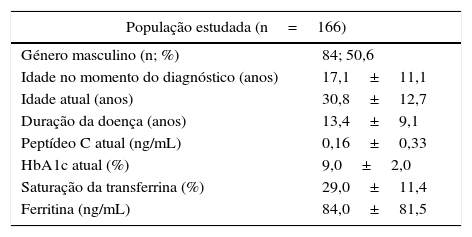
A população estudada apresentava uma média de idade no momento do diagnóstico de 17,1±11,1 anos e da idade atual de 30,8±12,7 anos. A duração média da doença foi de 13,4±9,1 anos, com um nível de peptídeo C atual de 0,16±0,33ng/mL e HbA1c atual de 9,0±2,0%. Relativamente ao estudo da cinética do ferro efetuado durante o período de inclusão, a amostra apresentava uma saturação da transferrina média de 29,0±11,4% e uma ferritina média de 84,0±81,5ng/mL (tabela 1).
Caracterização da população estudada
| População estudada (n=166) | |
|---|---|
| Género masculino (n; %) | 84; 50,6 |
| Idade no momento do diagnóstico (anos) | 17,1±11,1 |
| Idade atual (anos) | 30,8±12,7 |
| Duração da doença (anos) | 13,4±9,1 |
| Peptídeo C atual (ng/mL) | 0,16±0,33 |
| HbA1c atual (%) | 9,0±2,0 |
| Saturação da transferrina (%) | 29,0±11,4 |
| Ferritina (ng/mL) | 84,0±81,5 |
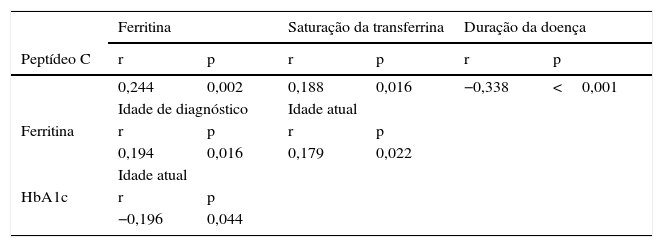
Os níveis de peptídeo C atuais correlacionaram‐se diretamente com os níveis de ferritina e com a saturação de transferrina e inversamente com a duração da doença.
Os níveis de ferritina correlacionaram‐se diretamente com a idade de diagnóstico da DMT1 e com a idade atual.
Verificou‐se a existência de uma correlação inversa entre o doseamento da HbA1c e a idade atual (tabela 2).
Correlações estatisticamente significativas encontradas
| Ferritina | Saturação da transferrina | Duração da doença | ||||
|---|---|---|---|---|---|---|
| Peptídeo C | r | p | r | p | r | p |
| 0,244 | 0,002 | 0,188 | 0,016 | −0,338 | <0,001 | |
| Idade de diagnóstico | Idade atual | |||||
| Ferritina | r | p | r | p | ||
| 0,194 | 0,016 | 0,179 | 0,022 | |||
| Idade atual | ||||||
| HbA1c | r | p | ||||
| −0,196 | 0,044 | |||||
r: correlação de Pearson.
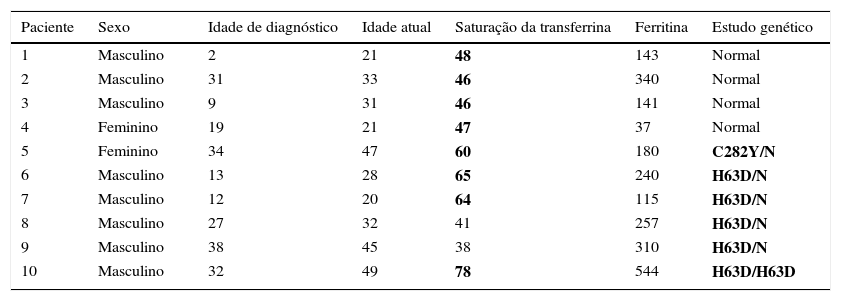
Vinte doentes (12%da amostra) apresentaram saturações de transferrina superiores a 45% e/ou níveis de ferritina elevados (superiores a 200 e 250ng/mL no caso de mulheres e homens, respetivamente), pelo que repetiram o estudo analítico após um período de jejum. Os 10 doentes (6%da amostra) que mantiveram as alterações da cinética do ferro realizaram estudo do gene HFE. Os dados relativos à caracterização deste subgrupo e os resultados do estudo genético estão representados na tabela 3.
Caracterização dos doentes com diabetes mellitus tipo 1 submetidos a estudo do gene HFE
| Paciente | Sexo | Idade de diagnóstico | Idade atual | Saturação da transferrina | Ferritina | Estudo genético |
|---|---|---|---|---|---|---|
| 1 | Masculino | 2 | 21 | 48 | 143 | Normal |
| 2 | Masculino | 31 | 33 | 46 | 340 | Normal |
| 3 | Masculino | 9 | 31 | 46 | 141 | Normal |
| 4 | Feminino | 19 | 21 | 47 | 37 | Normal |
| 5 | Feminino | 34 | 47 | 60 | 180 | C282Y/N |
| 6 | Masculino | 13 | 28 | 65 | 240 | H63D/N |
| 7 | Masculino | 12 | 20 | 64 | 115 | H63D/N |
| 8 | Masculino | 27 | 32 | 41 | 257 | H63D/N |
| 9 | Masculino | 38 | 45 | 38 | 310 | H63D/N |
| 10 | Masculino | 32 | 49 | 78 | 544 | H63D/H63D |
Negrito: resultados anómalos.
Considerando o subgrupo de doentes submetido a estudo genético, não foram detetados homozigotos C282Y ou heterozigotos compostos C282Y/H63D. Foi identificado um caso de homozigotia H63D, com potencial risco de desenvolver manifestações clínicas de sobrecarga de ferro (particularmente hepáticas) caso venha a apresentar concomitantemente outros cofatores de risco.
DiscussãoOs níveis de ferritina e a saturação de transferrina correlacionaram‐se diretamente com os níveis de peptídeo C. Verificou‐se igualmente a existência de uma correlação direta entre os níveis de ferritina e a idade de diagnóstico e a idade atual.
Depreende‐se dos resultados supramencionados que, em doentes com DMT1 e reservas de ferro mais significativas, as células β‐pancreáticas foram comparativamente preservadas e o diagnóstico de DMT1 ocorreu em idades mais avançadas. Estes dados reforçam a hipótese, previamente descrita, de que a exposição prolongada a «sobrecarga relativa» de ferro se constitua como um fator desencadeante tardio de DMT17. Alguns estudos sustentam um aumento de risco de DMT1 em indivíduos com maior aporte e reserva de ferro, mas são omissos ou inconclusivos relativamente à investigação do mecanismo fisiopatológico envolvido. Alguns autores sugerem a hipótese do ferro atuar como fator ambiental precipitante de fenómenos autoimunes de destruição das células β‐pancreáticas em indivíduos geneticamente suscetíveis. Outra hipótese avançada defende que a acumulação de ferro a nível pancreático pode induzir lesão direta das células β, com subsequente redução da secreção de insulina12,13.
Os resultados da nossa amostra indiciam que doentes com DMT1 e sobrecarga de ferro não apresentam (comparativamente) menor secreção de insulina (níveis de peptídeo C são reduzidos, mas detetáveis).
Consideramos que a correlação obtida entre a ferritina e a idade atual era previsível, atendendo aos dados já apresentados pelo estudo NHANES III.
O estudo NHANES III demonstrou que no sexo feminino os doseamentos de ferritina mantêm‐se estáveis até aos 40‐49 anos de idade, altura em que começam a aumentar progressivamente (atribuível ao efeito pós‐menopausa). No sexo masculino os níveis de ferritina aumentam significativamente a partir do momento em que o surto de crescimento pubertário termina, atingindo o valor máximo entre os 30‐39 anos e mantendo‐se estáveis até aos 70 anos, quando começam a decair lentamente. As saturações de transferrina mantêm‐se estáveis ao longo da vida15.
Observa‐se um declínio progressivo da função das células β‐pancreáticas em doentes com DMT1, pelo que era expectável a correlação inversa entre os níveis de peptídeo C e duração da doença que obtivemos na população estudada.
Constatou‐se a existência de uma correlação inversa entre o valor de HbA1c e a idade atual do doente, o que significa que doentes mais jovens apresentam níveis mais elevados de HbA1c.
Cerca de 15,1% dos doentes estudados tinham idade igual ou inferior a 18 anos. Os objetivos glicémicos devem ser individualizados em função do doente. A ADA recomenda que a HbA1c seja inferior a 7‐7,5% em jovens com idades entre os 13 e os 19 anos e inferior a 6,5‐7% em adultos sem complicações micro ou macrovasculares, sem hipoglicemias assintomáticas e com duração reduzida da doença e esperança de vida significativa16. O surto de crescimento pubertário associa‐se a aumento da insulinorresistência (fenómeno mediado pela somatotropina), pelo que a ausência de ajuste adequado das doses de insulina poderá condicionar uma deterioração do controlo glicémico. Estes fatores poderão contribuir para justificar a correlação encontrada, de que os doentes mais jovens apresentam comparativamente pior controlo metabólico.
Não se verificou correlação entre a HbA1c e os níveis de ferritina ou saturação de transferrina, pelo que se conclui que a sobrecarga de ferro (independentemente do mecanismo pelo qual possa desencadear a DMT1) não se associa a pior controlo glicémico.
À semelhança do que foi previamente descrito para a população geral, a mutação H63D foi mais frequente que a C282Y no subgrupo submetido a estudo genético.
A sobrecarga de ferro pode constituir‐se como um fator de risco para a DMT1. A avaliação das reservas de ferro em doentes com DMT1 terá a vantagem de, ao identificar os indivíduos com sobrecarga de ferro, permitir a instituição de medidas terapêuticas e de seguimento adequadas no sentido de evitar o aparecimento/agravamento de complicações associadas a morbimortalidade significativa (nomeadamente complicações hepáticas e cardiovasculares). O estudo da cinética do ferro em doentes com DMT1 justifica‐se, portanto, pelo potencial impacto benéfico sobre a qualidade de vida e sobrevida dos doentes.
A ausência de avaliação do aporte alimentar diário de ferro dos doentes poderá constituir uma limitação deste estudo. Por outro lado, as dimensões da amostra estudada e o fato de não dispormos do estudo da cinética do ferro no momento do diagnóstico da DMT1 limitam a interpretação e extrapolação dos resultados obtidos. Serão necessários mais estudos para melhor caracterizar os mecanismos subjacentes à associação entre a sobrecarga de ferro e a DMT1.
Responsabilidades éticasDireito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Proteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Conflito de interessesOs autores declaram não haver conflito de interesses.