A cirurgia bariátrica é um tratamento eficaz e duradouro da obesidade mórbida e várias das suas comorbilidades, incluindo a síndrome metabólica (SM). Das diferentes técnicas cirúrgicas descritas, o bypass gástrico é um procedimento cirúrgico bem validado, enquanto a gastrectomia vertical, quando utilizada isoladamente, é um procedimento mais recente, mas que tem vindo a mostrar resultados igualmente satisfatórios. O objetivo do presente estudo foi comparar os efeitos destes 2 procedimentos cirúrgicos quanto à evolução ponderal e resolução da SM.
MetodologiaFoi realizado um estudo prospetivo que incluiu doentes obesos com critérios de SM submetidos a gastrectomia vertical (n=48) ou bypass gástrico (n=121), que foram comparados quanto à evolução ponderal e resolução dos diferentes critérios de SM por período de seguimento até 24 meses.
ResultadosApós a cirurgia, o excesso de índice de massa corporal perdido (EIMCP) e a taxa de remissão da SM foram semelhantes nos 2 grupos, embora o índice de massa corporal (IMC) dos doentes submetidos a bypass gástrico fosse menor ao longo de todo o seguimento e a taxa de remissão de SM, aos 12 meses, tenha sido maior nos doentes submetidos a gastrectomia vertical. No pré‐operatório, os doentes submetidos a bypass gástrico apresentavam glicose em jejum e uso de terapêutica antidiabética significativamente superiores, em comparação com os doentes submetidos a gastrectomia vertical, diferenças que desapareceram após a cirurgia. O uso das diferentes classes de fármacos diminuiu significativamente após ambos os procedimentos, com exceção dos antidislipidémicos após gastrectomia vertical. Não houve diferenças significativas na taxa de complicações pós‐operatórias entre os 2 procedimentos.
ConclusãoA gastrectomia vertical e o bypass gástrico demonstraram ser igualmente eficazes e seguros na redução ponderal e remissão da SM em doentes obesos. No entanto, a melhoria do perfil glicémico pós‐bypass sugere a existência de um efeito antidiabético específico associado ao procedimento.
Bariatric surgery is an effective treatment for morbid obesity and several comorbidities, including Metabolic Syndrome (MS). Among the described techniques, gastric bypass is a well validated surgical procedure, while vertical gastrectomy as standalone procedure, is more recent but has already showed to provide equally satisfying results regarding weight loss and comorbidities improvement. Our aim was to compare the two procedures regarding weight loss and MS remission criteria.
MethodsThis prospective study included obese patients with MS submitted to vertical gastrectomy (n=48) or gastric bypass (n=121), which were compared regarding weight loss and MS criteria for 24 months after surgery.
ResultsThe percentage of excess body mass index lost and MS remission rate after the surgery were similar in both groups after 24 months. However, in the first year after surgery, patients submitted to gastric bypass presented a significantly lower body mass index (BMI) and higher percentage of excess BMI lost while patients submitted to vertical gastrectomy showed a higher MS remission rate. Noticeably, before surgery, fasting glucose and anti‐diabetic drug use were significantly higher in the gastric bypass group compared to the sleeve gastrectomy group, a difference that disappeared after the surgery. There were no statistically significant differences regarding major surgical complications between the groups.
ConclusionVertical gastrectomy and gastric bypass were equally effective and safe in terms of weight loss and MS remission in obese patients. The distinctive improvement in the glycemic profile after gastric bypass, suggests the possible existence of a specific anti‐diabetic effect associated with the procedure.
A Organização Mundial de Saúde (OMS) considera a obesidade a maior ameaça à saúde pública da atualidade1. Aproximadamente 400 milhões dos adultos são obesos e 1,6 biliões têm excesso de peso1. Em Portugal, nos inquéritos de saúde de âmbito nacional de realizados nos anos de 1995‐1996 e 1998‐1999, foi observada uma tendência crescente da prevalência de excesso de peso/obesidade na população adulta de ambos os sexos, de 50,2 para 54,0% nos homens e de 44,9 para 46,5% nas mulheres, respetivamente2.
A elevada prevalência da obesidade está associada ao aumento de várias comorbilidades, incluindo diabetes mellitus tipo 2 (DM2), dislipidemia, doença cardiovascular, hipertensão arterial e síndrome metabólica (SM)3,4.
A SM caracteriza‐se pela presença de obesidade visceral, disglicemia, dislipidemia e hipertensão arterial, estando associada ao aumento do risco de doenças cardiovasculares e de desenvolvimento de DM25. A prevalência da SM varia com a definição utilizada para a sua classificação e com a população estudada (sexo, idade, raça e etnia)5. Segundo o National Health and Nutrition Examination Survey de 1999‐2002, 39% dos adultos americanos apresentavam critérios de SM, pela classificação da International Diabetes Federation (IDF), e 34,5%, quando utilizados os critérios do National Cholesterol Education Program's Adult Treatment Panel III (ATPIII)6. Por sua vez, o estudo DECODE estimou as prevalências de SM na Europa em 9,5% para o sexo masculino e 8,9% para o sexo feminino7. Na população portuguesa, a prevalência de SM encontrada pelo estudo VALSIM foi de 27,5%8, enquanto o estudo PorMets encontrou uma prevalência da SM semelhante à observada nalguns países europeus e nos EUA, de 26,3% no sexo masculino e 28,4% no sexo feminino quando usados os critérios da ATPIII, mas superior à média europeia, sendo 36,9% no sexo masculino e 40,8% no sexo feminino, se utilizados os critérios da IDF9.
A etiopatogenia da SM é controversa. No entanto, a evidência sugere que os principais fatores responsáveis pela ocorrência dos seus componentes são a resistência à insulina e a obesidade visceral10,11, motivo pelo qual o tratamento da obesidade é considerado o primeiro objetivo terapêutico nestes doentes12,13.
Em doentes com obesidade grau 3 ou grau 2 com comorbilidades associadas, a cirurgia bariátrica demonstrou atingir resultados superiores aos obtidos com terapêutica médica, sendo o único tratamento que permite uma perda de peso sustentada que varia entre 50‐75% do excesso de peso corporal, consoante o tipo de técnica cirúrgica utilizada14, assim como, ser igualmente eficaz no tratamento e remissão clínica de várias patologias associadas, incluindo a DM2 e SM, motivos pelos quais é o tratamento recomendado pelo National Institutes of Health nos doentes com antecedentes de falência da terapêutica convencional15–18.
A cirurgia bariátrica pode ser classificada em restritiva ou mal absortiva, consoante o mecanismo de ação pelo qual é induzida a perda de peso19. As cirurgias puramente restritivas limitam a ingestão alimentar através da formação de uma pequena bolsa gástrica (gastroplastia, banda gástrica ajustável e gastrectomia vertical), enquanto os procedimentos puramente mal absortivos, como o bypass jejunoileal, atualmente abandonado devido ao desenvolvimento de efeitos secundários graves, limitam a absorção dos nutrientes20, tendo sido substituído por procedimentos do tipo misto, que combinam o efeito restritivo com a malabsorção de micronutrientes (bypass gástrico proximal em Y de Roux) e/ou macronutrientes (bypass gástrico distal e desvio biliopancreático). As intervenções bariátricas mais utilizadas atualmente são o bypass gástrico e a gastrectomia vertical19.
O bypass gástrico proximal consiste em criar uma pequena bolsa gástrica que não inclui o fundo do estômago (componente restritivo), uma anastomose gastrojejunal em Y de Roux, de forma a fazer bypass do estômago excluso, duodeno e intestino delgado proximal, e em criar um canal biliopancreático de 50cm e um canal alimentar de 150cm21. O bypass gástrico demonstrou ter efeitos metabólicos benéficos, especialmente na DM2, com a melhoria do controlo glicémico22,23 ou remissão clínica da doença até 85% dos casos22,24, frequentemente a preceder uma perda de peso substancial, sendo considerado um procedimento bariátrico muito equilibrado, pela elevada taxa de sucesso e pequena taxa de efeitos adversos e complicações22. A gastrectomia vertical é um procedimento decorrente de outro mais complexo, a derivação biliopancreático tipo duodenal switch, no qual se realiza uma ressecção da maior parte da grande curvatura gástrica, criando‐se um estômago tubular com menor capacidade e mais resistente às forças de distensão, como componente restritivo e uma derivação biliopancreática como componente mal absortivo25–27. Pelo risco cirúrgico, este procedimento é geralmente realizado em 2 tempos operatórios, no qual a gastrectomia vertical é realizada no primeiro tempo27. A gastrectomia vertical utilizada como procedimento bariátrico restritivo isoladamente é uma técnica mais recente, que se difundiu após se ter verificado que frequentemente permitia uma perda de peso suficiente para melhorar as comorbilidades dos doentes28,29. A gastrectomia vertical, ao retirar a maior parte da grande curvatura gástrica, é ainda responsável por depletar o estômago de células produtoras de grelina, uma hormona gastrointestinal que estimula o apetite e promove o aumento ponderal29,30. A perda de peso obtida após a gastrectomia vertical é superior à observada após colocação de banda gástrica ajustável31 e tem sido relatada como sendo semelhante à observada após o bypass gástrico30. Alguns estudos têm ainda demonstrado que a gastrectomia vertical está associada a uma elevada taxa de melhoria e remissão da DM2, bem como de outras comorbilidades32. Estudos anteriores de pequenas dimensões, e com um tempo de seguimento após as cirurgias de um ano, sugerem que a gastrectomia vertical e o bypass gástrico, são igualmente eficazes na perda de peso e remissão das comorbilidades relacionadas com a obesidade33–35.
O objetivo deste estudo foi avaliar e comparar os efeitos da gastrectomia vertical e do bypass gástrico com ansa biliopancreática longa, designado por bypass metabólico, na perda ponderal e na resolução dos critérios da SM, assim como a ocorrência de complicações médicas e cirúrgicas associadas, e necessidade de terapêutica farmacológica.
Material e métodosEste estudo incluiu todos os doentes que reuniam critérios de SM (n=48), do total dos doentes obesos submetidos a gastrectomia vertical (n=373) na Clínica Universitária de Cirurgia II do Hospital de Santa Maria, no período compreendido entre agosto de 2007 e agosto de 2011; e doentes com critérios de SM (n=121), do total de doentes obesos submetidos a bypass gástrico (n=696) no Serviço de Cirurgia do Centro Hospitalar Entre Douro e Vouga, entre julho de 2004 e fevereiro de 2010. Os doentes com SM submetidos ao bypass metabólico foram selecionados entre o total dos doentes com SM (n=172), de acordo com as características antropométricas no momento da cirurgia, de modo a poderem ser comparados com os doentes submetidos a gastrectomia vertical. O diagnóstico da SM baseou‐se nos critérios harmonizados, nomeadamente glicemia em jejum ≥100mg/dL, tensão arterial sistólica ≥130mmHg ou tensão arterial diastólica ≥85mmHg, triglicerídeos≥150mg/dL, colesterol high density lypoprotein (HDL)<40mg/dL no sexo masculino e<50mg/dL no sexo feminino ou terapêutica com hipoglicemiantes, anti‐hipertensores ou hipolipemiantes; com a particularidade de ter sido utilizado o índice de massa corporal (IMC) ≥30 como marcador indireto de obesidade visceral, em substituição da medição do perímetro abdominal, de acordo com as recomendações do National Institutes of Health, pela dificuldade em determinar o local de medição do perímetro da cintura nestes doentes36.
A gastrectomia vertical consistiu na elaboração de um tubo gástrico à custa da pequena curvatura gástrica, na qual após secção do grande epíploon, de forma a entrar na retrocavidade dos epíploones, o estômago foi entubado com uma sonda tipo Fouchet 32Fr introduzida até ao piloro e posicionada em justaposição à pequena curvatura gástrica; a gastrectomia foi realizada com início a 5cm do piloro, utilizando um agrafador linear cortante e articulável (Echelon™ Flex 60 Endopath® Stapler, Johnson and Johnson, Nova Jérsia, EUA) com carga Ethicon Gold (ETH‐ECR60D). A técnica de bypass gástrico com ansa biliopancreática longa, também designado por bypass metabólico, divergiu da técnica cirúrgica de bypass clássico apenas no comprimento da ansa biliopancreática, sendo elaborada com 200cm de comprimento no bypass metabólico, em comparação com 60‐70cm de comprimento utilizados na técnica do bypass clássico, tendo sido realizada como previamente descrita37. Todos os doentes propostos para bypass gástrico, com critérios de SM durante o período do estudo, foram submetidos à técnica cirúrgica de bypass metabólico. Ambos os procedimentos foram realizados por via laparoscópica.
Todos os doentes incluídos no estudo tinham um tempo de seguimento após a cirurgia de um mínimo de 6 meses e foram acompanhados por uma equipa multidisciplinar que integra as especialidades de cirurgia geral, endocrinologia, dietética ou nutrição e psicologia; tendo sido submetidos a avaliações clínica, antropométrica e analítica pré e pós‐operatórias. Em todos os doentes de ambos os grupos foi instituída suplementação polivitamínica profilática após a cirurgia. Foram igualmente registadas todas as complicações major e minor, cirúrgicas e médicas, do pós‐operatório.
Análise estatísticaForam determinados a média, o mínimo, o máximo e o desvio padrão para as variáveis contínuas. As variáveis nominais e ordinais são apresentadas em frequências absolutas ou percentuais. Para comparação das médias ao longo do tempo dentro dos grupos, foi utilizado o teste de Kruskal‐Wallis, seguido de um teste post hoc de Dunn. Para comparar os valores entre os diferentes grupos, foi utilizado o teste t de Student emparelhado. Na análise das variáveis nominais e ordinais, foi utilizado o teste do X2. O valor p<0,05 foi considerado estatisticamente significativo. Os dados foram analisados com recurso ao software Graphpad Prism 5.04 e o SPSS Statistics 21.
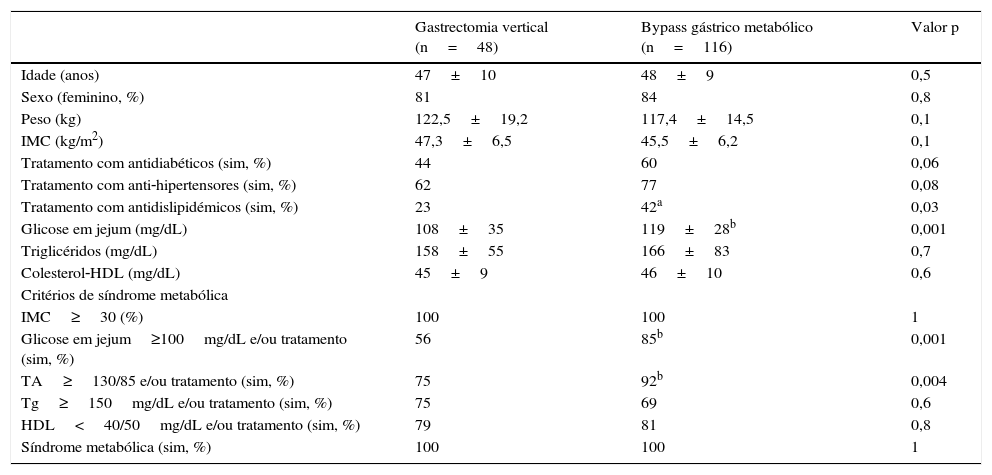
ResultadosÀ data da cirurgia, os 2 grupos de doentes eram semelhantes quanto à idade, sexo, peso, IMC, perfil lipídico e presença de critérios de SM, embora a glicemia em jejum e a percentagem de doentes com HTA e DM2 fossem significativamente maiores nos doentes submetidos a bypass gástrico (tabela 1).
Características antropométricas, clínicas e analíticas dos 2 grupos de doentes no pré‐operatório
| Gastrectomia vertical (n=48) | Bypass gástrico metabólico (n=116) | Valor p | |
|---|---|---|---|
| Idade (anos) | 47±10 | 48±9 | 0,5 |
| Sexo (feminino, %) | 81 | 84 | 0,8 |
| Peso (kg) | 122,5±19,2 | 117,4±14,5 | 0,1 |
| IMC (kg/m2) | 47,3±6,5 | 45,5±6,2 | 0,1 |
| Tratamento com antidiabéticos (sim, %) | 44 | 60 | 0,06 |
| Tratamento com anti‐hipertensores (sim, %) | 62 | 77 | 0,08 |
| Tratamento com antidislipidémicos (sim, %) | 23 | 42a | 0,03 |
| Glicose em jejum (mg/dL) | 108±35 | 119±28b | 0,001 |
| Triglicéridos (mg/dL) | 158±55 | 166±83 | 0,7 |
| Colesterol‐HDL (mg/dL) | 45±9 | 46±10 | 0,6 |
| Critérios de síndrome metabólica | |||
| IMC≥30 (%) | 100 | 100 | 1 |
| Glicose em jejum≥100mg/dL e/ou tratamento (sim, %) | 56 | 85b | 0,001 |
| TA≥130/85 e/ou tratamento (sim, %) | 75 | 92b | 0,004 |
| Tg≥150mg/dL e/ou tratamento (sim, %) | 75 | 69 | 0,6 |
| HDL<40/50mg/dL e/ou tratamento (sim, %) | 79 | 81 | 0,8 |
| Síndrome metabólica (sim, %) | 100 | 100 | 1 |
O grupo de doentes submetidos a gastrectomia vertical era constituído por 81% (n=39) de indivíduos do sexo feminino e 19% (n=9) do sexo masculino, com idade média de 47±10 anos e IMC médio de 47,3±6,5kg/m2. Destes, 44% (n=21) estavam sob terapêutica antidiabética, 62% (n=29) sob terapêutica anti‐hipertensiva e 23% (n=11) sob terapêutica antidislipidémica. O grupo de doentes submetidos a bypass gástrico era constituído por 84% (n=97) de indivíduos do sexo feminino e 16% (n=19) do sexo masculino, com idade média de 48±9 anos e IMC de 45,5±6,2kg/m2. Destes doentes, 60% (n=70) estava sob terapêutica antidiabética, 77% (n=88) sob terapêutica anti‐hipertensiva e 42% (n=47) sob terapêutica antidislipidémica (tabela 1).
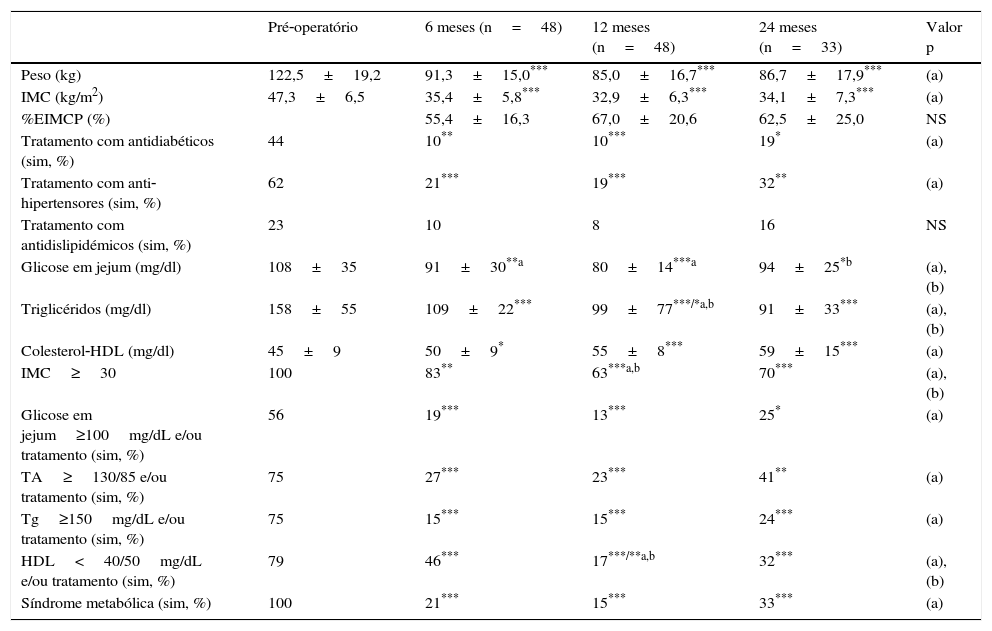
Após a gastrectomia vertical, observou‐se uma diminuição significativa do peso e IMC desde os 6 meses (91,3±15kg e 35,4±5,8kg/m2; p<0,001) até aos 24 meses de pós‐operatório (86,7±17,9kg e 34,1±7,3kg/m2), embora ocorresse um aumento não significativo entre os 12 meses (85,0±15,0kg e 32,9±6,3kg/m2) e os 24 meses de seguimento, pelo que a percentagem de excesso de IMC perdido (EIMCP) máxima foi de 67,0±20,6% aos 12 meses de seguimento, com uma diminuição não significativa aos 24 meses para 62,52±25,02%. Pelo contrário, a glicose em jejum diminuiu significativamente até aos 12 meses de seguimento (108±35 vs. 80±14mg/dl, p<0,01), sofrendo um aumento significativo aos 24 meses (94±25mg/dl, p<0,01). Por sua vez, a tensão arterial e os triglicéridos diminuíram, até aos 24 meses de seguimento, enquanto o colesterol‐HDL aumentou no mesmo período de tempo. A percentagem de doentes tratados com antidiabéticos e anti‐hipertensores diminuiu significativamente após a cirurgia, assim como com fármacos antidislipidémicos, embora sem significado estatístico. A percentagem de doentes com critérios de SM diminuiu significativamente após a cirurgia, atingindo o valor mínimo de 15% (p<0,01) aos 12 meses, seguida de um aumento não significativo para 33% aos 24 meses (tabela 2).
Características dos doentes submetidos a gastrectomia vertical ao longo do tempo
| Pré‐operatório | 6 meses (n=48) | 12 meses (n=48) | 24 meses (n=33) | Valor p | |
|---|---|---|---|---|---|
| Peso (kg) | 122,5±19,2 | 91,3±15,0*** | 85,0±16,7*** | 86,7±17,9*** | (a) |
| IMC (kg/m2) | 47,3±6,5 | 35,4±5,8*** | 32,9±6,3*** | 34,1±7,3*** | (a) |
| %EIMCP (%) | 55,4±16,3 | 67,0±20,6 | 62,5±25,0 | NS | |
| Tratamento com antidiabéticos (sim, %) | 44 | 10** | 10*** | 19* | (a) |
| Tratamento com anti‐hipertensores (sim, %) | 62 | 21*** | 19*** | 32** | (a) |
| Tratamento com antidislipidémicos (sim, %) | 23 | 10 | 8 | 16 | NS |
| Glicose em jejum (mg/dl) | 108±35 | 91±30**a | 80±14***a | 94±25*b | (a), (b) |
| Triglicéridos (mg/dl) | 158±55 | 109±22*** | 99±77***/*a,b | 91±33*** | (a), (b) |
| Colesterol‐HDL (mg/dl) | 45±9 | 50±9* | 55±8*** | 59±15*** | (a) |
| IMC≥30 | 100 | 83** | 63***a,b | 70*** | (a), (b) |
| Glicose em jejum≥100mg/dL e/ou tratamento (sim, %) | 56 | 19*** | 13*** | 25* | (a) |
| TA≥130/85 e/ou tratamento (sim, %) | 75 | 27*** | 23*** | 41** | (a) |
| Tg≥150mg/dL e/ou tratamento (sim, %) | 75 | 15*** | 15*** | 24*** | (a) |
| HDL<40/50mg/dL e/ou tratamento (sim, %) | 79 | 46*** | 17***/**a,b | 32*** | (a), (b) |
| Síndrome metabólica (sim, %) | 100 | 21*** | 15*** | 33*** | (a) |
* p<0,05; ** p<0,01; *** p<0,001; (a) vs. inicial; (b) vs. observação anterior. ANOVA com analise post‐hoc de Dunns.
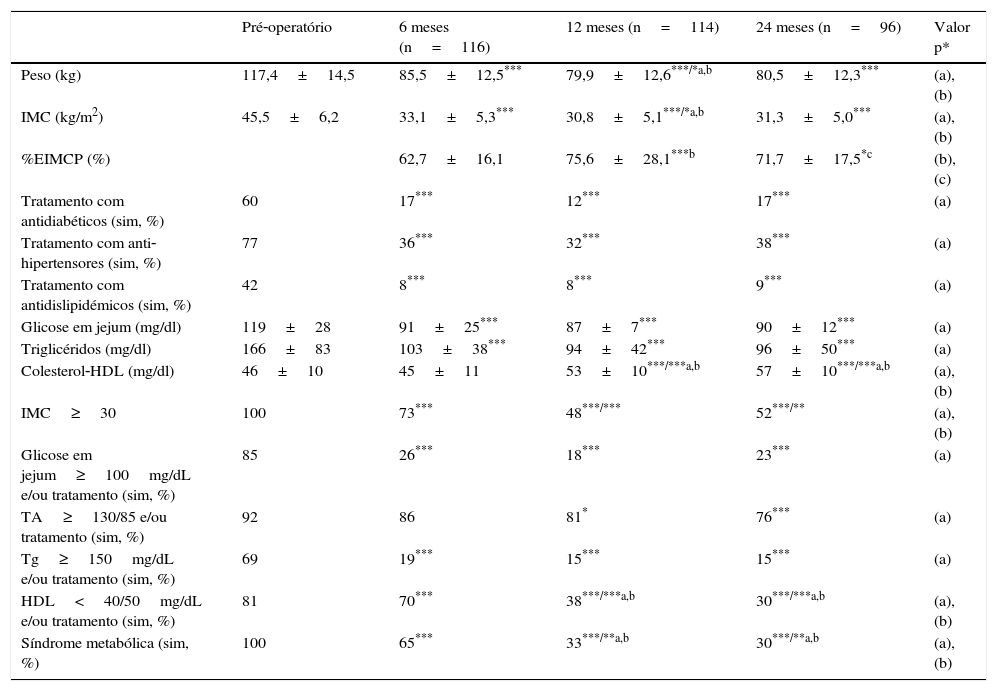
No grupo de doentes submetidos a bypass gástrico metabólico, o peso e o IMC diminuíram significativamente após a cirurgia, apresentando valores mínimos após 12 meses (79,9±12,6kg e 30,8±5,1kg/m2; p<0,05), tendo‐se verificado igualmente um aumento não significativo aos 24 meses de pós‐operatório (80,5±12,3kg e 31,3±5,0kg/m2). A percentagem de EIMCP foi máxima aos 12 meses de pós‐operatório 75,6±28,1% (p<0,001), diminuindo para 71,7±17,5% aos 24 meses (p=NS). A glicose em jejum, tensão arterial e triglicéridos diminuíram significativamente ao longo do tempo, enquanto o colesterol‐HDL aumentou significativamente ao longo dos 24 meses até ao valor máximo de 57±10mg/dl (p<0,001). A percentagem de doentes tratados com antidiabéticos, anti‐hipertensores e antidislipidémicos diminuiu significativamente ao longo dos 24 meses após a cirurgia, assim como a prevalência da SM diminuiu, passando de 100% no pré‐operatório para 30% (p<0,01) aos 24 meses (tabela 3).
Características clínicas e analíticas dos doentes submetidos a bypass gástrico metabólico
| Pré‐operatório | 6 meses (n=116) | 12 meses (n=114) | 24 meses (n=96) | Valor p* | |
|---|---|---|---|---|---|
| Peso (kg) | 117,4±14,5 | 85,5±12,5*** | 79,9±12,6***/*a,b | 80,5±12,3*** | (a), (b) |
| IMC (kg/m2) | 45,5±6,2 | 33,1±5,3*** | 30,8±5,1***/*a,b | 31,3±5,0*** | (a), (b) |
| %EIMCP (%) | 62,7±16,1 | 75,6±28,1***b | 71,7±17,5*c | (b), (c) | |
| Tratamento com antidiabéticos (sim, %) | 60 | 17*** | 12*** | 17*** | (a) |
| Tratamento com anti‐hipertensores (sim, %) | 77 | 36*** | 32*** | 38*** | (a) |
| Tratamento com antidislipidémicos (sim, %) | 42 | 8*** | 8*** | 9*** | (a) |
| Glicose em jejum (mg/dl) | 119±28 | 91±25*** | 87±7*** | 90±12*** | (a) |
| Triglicéridos (mg/dl) | 166±83 | 103±38*** | 94±42*** | 96±50*** | (a) |
| Colesterol‐HDL (mg/dl) | 46±10 | 45±11 | 53±10***/***a,b | 57±10***/***a,b | (a), (b) |
| IMC≥30 | 100 | 73*** | 48***/*** | 52***/** | (a), (b) |
| Glicose em jejum≥100mg/dL e/ou tratamento (sim, %) | 85 | 26*** | 18*** | 23*** | (a) |
| TA≥130/85 e/ou tratamento (sim, %) | 92 | 86 | 81* | 76*** | (a) |
| Tg≥150mg/dL e/ou tratamento (sim, %) | 69 | 19*** | 15*** | 15*** | (a) |
| HDL<40/50mg/dL e/ou tratamento (sim, %) | 81 | 70*** | 38***/***a,b | 30***/***a,b | (a), (b) |
| Síndrome metabólica (sim, %) | 100 | 65*** | 33***/**a,b | 30***/**a,b | (a), (b) |
* p<0,05; ** p<0,01; *** p<0,001; (a) vs. inicial; (b) vs. observação anterior; (c) vs. 6 Meses. ANOVA com analise post‐hoc de Dunns.
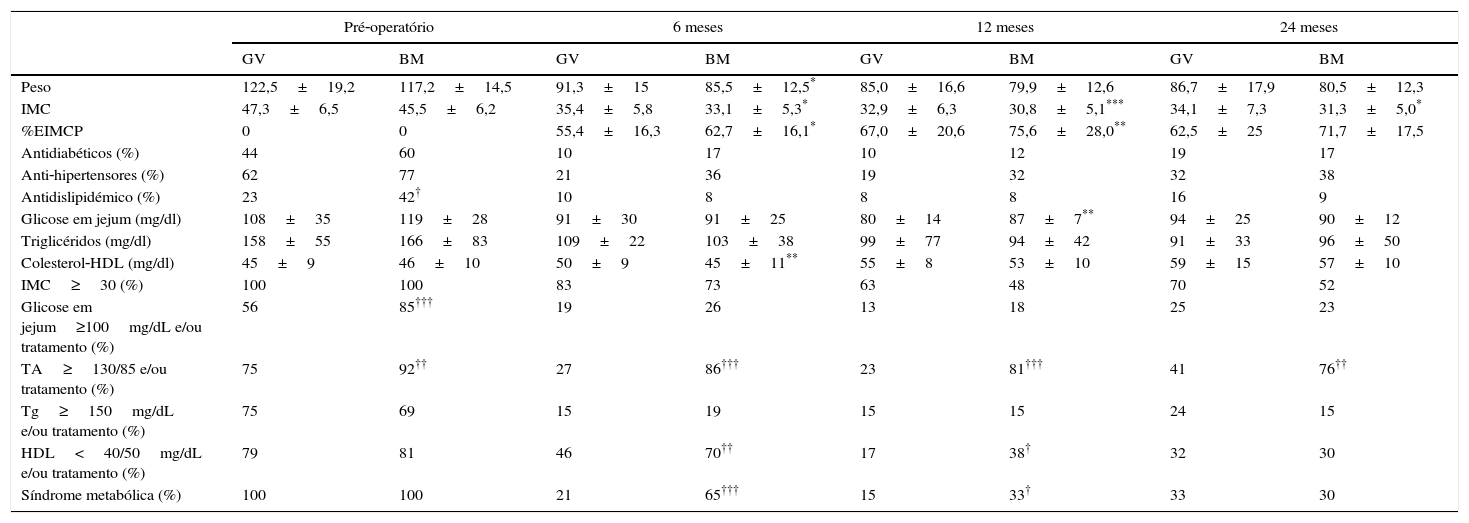
Quando comparados os 2 procedimentos cirúrgicos, verificou‐se que, embora os doentes submetidos a bypass gástrico apresentassem um IMC significativamente menor ao longo de todo o seguimento e a percentagem de doentes com SM fosse significativamente menor nos doentes submetidos a gastrectomia vertical ao fim do primeiro ano, aos 24 meses após a cirurgia, não havia diferenças na percentagem de EIMCP e percentagem de doentes com critérios de SM. No entanto, apesar dos doentes submetidos a bypass gástrico no pré‐operatório apresentarem glicose em jejum e uso de antidiabéticos significativamente maior do que os doentes submetidos a gastrectomia vertical, no pós‐operatório, deixaram de se observar diferenças estatisticamente significativas nestes parâmetros. Pelo contrário, a percentagem de doentes com tensão arterial elevada e/ou tratamento com anti‐hipertensores manteve‐se significativamente mais elevada nos doentes submetidos a bypass gástrico ao longo de todo seguimento. Por sua vez, a diminuição dos triglicerídeos e o aumento do colesterol‐HDL foi semelhante nos 2 grupos ao longo do seguimento (tabela 4).
Comparação entre os 2 grupos ao longo do seguimento
| Pré‐operatório | 6 meses | 12 meses | 24 meses | |||||
|---|---|---|---|---|---|---|---|---|
| GV | BM | GV | BM | GV | BM | GV | BM | |
| Peso | 122,5±19,2 | 117,2±14,5 | 91,3±15 | 85,5±12,5* | 85,0±16,6 | 79,9±12,6 | 86,7±17,9 | 80,5±12,3 |
| IMC | 47,3±6,5 | 45,5±6,2 | 35,4±5,8 | 33,1±5,3* | 32,9±6,3 | 30,8±5,1*** | 34,1±7,3 | 31,3±5,0* |
| %EIMCP | 0 | 0 | 55,4±16,3 | 62,7±16,1* | 67,0±20,6 | 75,6±28,0** | 62,5±25 | 71,7±17,5 |
| Antidiabéticos (%) | 44 | 60 | 10 | 17 | 10 | 12 | 19 | 17 |
| Anti‐hipertensores (%) | 62 | 77 | 21 | 36 | 19 | 32 | 32 | 38 |
| Antidislipidémico (%) | 23 | 42† | 10 | 8 | 8 | 8 | 16 | 9 |
| Glicose em jejum (mg/dl) | 108±35 | 119±28 | 91±30 | 91±25 | 80±14 | 87±7** | 94±25 | 90±12 |
| Triglicéridos (mg/dl) | 158±55 | 166±83 | 109±22 | 103±38 | 99±77 | 94±42 | 91±33 | 96±50 |
| Colesterol‐HDL (mg/dl) | 45±9 | 46±10 | 50±9 | 45±11** | 55±8 | 53±10 | 59±15 | 57±10 |
| IMC≥30 (%) | 100 | 100 | 83 | 73 | 63 | 48 | 70 | 52 |
| Glicose em jejum≥100mg/dL e/ou tratamento (%) | 56 | 85††† | 19 | 26 | 13 | 18 | 25 | 23 |
| TA≥130/85 e/ou tratamento (%) | 75 | 92†† | 27 | 86††† | 23 | 81††† | 41 | 76†† |
| Tg≥150mg/dL e/ou tratamento (%) | 75 | 69 | 15 | 19 | 15 | 15 | 24 | 15 |
| HDL<40/50mg/dL e/ou tratamento (%) | 79 | 81 | 46 | 70†† | 17 | 38† | 32 | 30 |
| Síndrome metabólica (%) | 100 | 100 | 21 | 65††† | 15 | 33† | 33 | 30 |
* p<0,05; ** p<0,01; *** p<0,001 (teste t Student); † p<0,05; ††p< 0,01; ††† p<0.001(teste qui‐quadrado).
No pós‐operatório dos doentes submetidos a gastrectomia vertical foram registadas as seguintes complicações major: fístulas (n=2; 4%), suboclusão (n=1; 2%), hemorragia digestiva alta (n=1; 2%), hematoma da parede abdominal (n=1; 2%) e hemorragia intraoperatória (n=1; 2%); enquanto as complicações minor registadas incluíram: anemia (n=14; 29%), défice de ferro (n=14; 29%), défice de vitamina B12 (n=9; 19%), défice de ácido fólico (n=26; 54%), vómitos (n=6; 13%), epigastralgias (n=5; 10%), refluxo gastroesofágico (n=4; 8%) e disfagia (n=2; 4%). No pós‐operatório dos doentes submetidos a bypass gástrico metabólico foram registadas as seguintes complicações major: perfuração esofágica (n=1; 1%), fístula da anastomose gastrojejunal (n=7; 6%), perfuração ileal (n=1; 1%), abcesso intra‐abdominal (n=2; 2%), leak da anastomose gastrojejunal (n=1; 1%) e estenose da anastomose gastrojejunal (n=1; 1%); e ainda as complicações minor: anemia (n=35; 30%), défice de ferro (n=18; 16%), défice de vitamina B12 (n=39; 34%) e défice de ácido fólico (n=9; 8%). Não houve diferenças estatisticamente significativas entre os 2 grupos quanto à ocorrência de complicações pós‐operatórias major, embora os doentes submetidos a gastrectomia vertical apresentassem maior prevalência de défice de ferro (p<0,001) e de ácido fólico (p<0,001) e os doentes submetidos a bypass gástrico metabólico apresentassem uma prevalência mais elevada de anemia e de défice de vitamina B12 (p<0,05). Os doentes submetidos gastrectomia vertical apresentaram complicações que não foram registadas nos doentes submetidos a bypass gástrico, nomeadamente vómitos, disfagia, refluxo gastroesofágico e epigastralgias.
DiscussãoA prevalência de obesidade e SM têm vindo a aumentar gradualmente, constituindo um problema substancial de saúde pública, uma vez que os doentes com SM têm o dobro do risco de desenvolver doença cardiovascular nos 5‐10 anos seguintes e um risco 5 vezes maior de desenvolver DM22,9,38–40. A redução ponderal e o tratamento da obesidade visceral demonstraram ter efeitos benéficos na remissão da SM e prevenção ou melhoria das suas complicações tardias12,13. Em doentes com IMC superior a 35kg/m2 com comorbilidades associadas, tais como a DM2 e SM, o recurso à cirurgia bariátrica, demonstrou permitir uma redução ponderal sustentada e com resultados superiores aos geralmente obtidos com terapêutica médica, variando entre 50‐75% a percentagem do excesso de peso corporal perdido consoante o tipo de técnica cirúrgica utilizada14, e ainda permitir a remissão clínica da SM ou melhoria dos parâmetros metabólicos associados15–18.
O objetivo deste estudo foi avaliar e comparar os efeitos de 2 técnicas de cirurgia bariátrica – a gastrectomia vertical e o bypass gástrico metabólico – na perda de peso e na resolução dos critérios da SM, assim como a ocorrência de complicações médicas e cirúrgicas associadas a estes procedimentos.
Após a cirurgia, ambos os grupos apresentaram uma diminuição significativa do IMC e aumento do EIMCP, que foi máxima aos 12 meses de seguimento, embora os doentes submetidos a bypass gástrico metabólico apresentassem valores de IMC significativamente menores ao longo de todo o seguimento e uma percentagem de EIMCP significativamente maior durante o primeiro ano de pós‐operatório. Esta redução ponderal esteve associada a uma remissão significativa de todos os critérios de diagnóstico de SM, com uma taxa de remissão aos 2 anos de pós‐operatório semelhante entre os 2 grupos, embora com perfis de evolução distintos, uma vez que a gastrectomia vertical se associou a uma taxa de remissão da SM superior nos primeiros 6 meses, enquanto após o bypass gástrico a SM apresentou uma taxa de remissão inicialmente mais lenta mas progressiva ao longo de todo o seguimento. Ambos os grupos de doentes tiveram uma diminuição significativa na necessidade de tratamento farmacológico com antidiabéticos e anti‐hipertensores, com exceção do uso de antidislipidémicos que não se alterou significativamente nos doentes submetidos a gastrectomia vertical. Embora tenha sido observada uma melhoria de todos os parâmetros associados ao SM durante o primeiro ano após as cirurgias, observou‐se uma deterioração não significativa no segundo ano para ambos os procedimentos, pelo que se torna importante reavaliar a repercussão destas intervenções também a longo prazo.
No pré‐operatório, a percentagem de doentes com glicose em jejum ≥100mg/dl e/ou tratamento com antidiabéticos nos doentes submetidos a bypass gástrico era significativamente maior do que nos doentes submetidos a gastrectomia vertical, no entanto, no pós‐operatório os 2 grupos deixaram de apresentar diferenças estatisticamente significativas, o que sugere a possível existência de um mecanismo hipoglicemiante específico associado à técnica de bypass gástrico utilizada no presente estudo, tal como já sugerido em observações anteriores22,23,37,41–43. Pelo contrário, a diferença observada na percentagem de doentes com tensão arterial elevada e/ou tratamento com anti‐hipertensores que era mais elevada nos doentes submetidos a bypass gástrico no pré‐operatório, manteve‐se ao longo do seguimento.
Verificou‐se que apesar das 2 técnicas cirúrgicas terem complexidades distintas, não houve diferenças estatisticamente significativas relativamente as complicações major, tal como já tinha sido demonstrado em estudos comparativos prévios30,33,34.
A principal limitação deste estudo foi ter sido realizado com doentes provenientes de 2 centros de tratamento da obesidade e acompanhados por equipas de profissionais distintos, o que torna a comparação dos resultados entre as 2 técnicas menos consistente, especialmente no que concerne à prática de terapêuticas farmacológicas. Apesar da limitação referida, este estudo permitiu demonstrar que a gastrectomia vertical, inicialmente considerada uma técnica puramente restritiva, permite uma redução ponderal e taxa de remissão da SM semelhante à obtida com o bypass gástrico, uma cirurgia do tipo misto. Estes resultados corroboram que a gastrectomia vertical não deve ser considerada apenas uma técnica restritiva, mas também uma cirurgia metabólica, uma vez que envolve também mecanismos hormonais complexos ao remover o fundo gástrico e alterar os níveis plasmáticos de grelina, que poderão ajudar a explicar a perda ponderal e melhoria das co‐morbilidades metabólicas30, tal como advogado por várias sociedades científicas, tais como a American Society for Metabolic and Bariatric Surgery, The International Federation for the Surgery of Obesity and Metabolic Disorders28 e a Sociedade Portuguesa de Cirurgia da Obesidade e Doenças Metabólicas.
ConclusãoO presente estudo demonstrou que em doentes obesos, a redução ponderal com recurso à cirurgia bariátrica permite induzir a remissão dos critérios da SM. Quando comparadas as técnicas cirúrgicas, gastrectomia vertical e bypass gástrico, demonstraram ser igualmente seguras e eficazes na redução do excesso ponderal e na remissão dos critérios de SM aos 24 meses de seguimento, com melhoria do controle glicémico, tensão arterial e perfil lipídico, bem como na descontinuação da terapêutica farmacológica para estas comorbilidades. Os efeitos observados na melhoria do controle glucídico após o bypass gástrico sugerem a possível existência de um mecanismo hipoglicemiante específico associado a esta técnica cirúrgica.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem à Dra. Fátima Carepa, do Hospital de Santa Maria, e à Dra. Marta Guimarães, do Hospital de São Sebastião, pelo apoio na pesquisa bibliográfica e recolha de dados, assim como a todos os membros das Consultas Multidisciplinares de Tratamento Cirúrgico da Obesidade dos Hospitais de Santa Maria e São Sebastião que foram responsáveis pela avaliação e seguimento clínico dos doentes do presente estudo.