A arginina vasopressina é uma hormona fundamental na manutenção do equilíbrio hídrico e do tónus vascular. No entanto, o doseamento laboratorial é difícil e impossibilita o seu uso por rotina na prática clínica. A arginina vasopressina tem origem num peptídeo precursor juntamente com a copeptina, que é produzida numa razão equimolar e é mais estável em circulação e fácil de dosear. A quantidade de copeptina libertada é um marcador da produção de arginina vasopressina. Recentemente, foi demonstrado que o doseamento de copeptina pode ser útil em vários contextos clínicos, como no diagnóstico diferencial de diabetes insípida. Acresce que a copeptina tem sido proposta como um marcador de prognóstico em doentes com doenças agudas.
Arginine vasopressin is a key hormone in maintaining fluid balance and vascular tone. Nevertheless, laboratory measurement is difficult and precludes its routine use in clinical practice. Arginine vasopressin derives from a larger precursor peptide along with copeptin, which is released in an equimolar ratio and is more stable in circulation and easy to determine. Copeptin was found to be a surrogate marker for arginine vasopressin release. Recently, copeptin measurement has been shown to be useful in various clinical contexts, such as the differential diagnosis of diabetes insipidus. Also, it has been proposed as a prognostic marker in patients with acute illnesses.
Introdução
A arginina vasopressina (AVP), também conhecida por hormona antidiurética (HAD), é sintetizada pelos neurónios magnocelulares do hipotálamo e segregada para a circulação sanguínea pela hipófise posterior. O estado de hiperosmolaridade é o principal estímulo para a secreção de AVP, mas a diminuição de volume sanguíneo também induz a sua produção1.
Após a sua libertação para a corrente sanguínea, a AVP atua a nível periférico através da ligação a três receptores: V1a, V1b e V2. Os receptores V1a são responsáveis pelos efeitos vasoconstritores. Os receptores V1b estão presentes na hipófise anterior e ilhéus pancreá--ticos, sendo responsáveis pelos seus efeitos endócrinos. A ativação dos receptores V2 a nível dos ductos coletores renais é responsável pelos efeitos antidiuréticos1.
Além das ações osmóticas, hemodinâmicas e endócrinas, também têm sido descritos efeitos adicionais da AVP no sistema nervoso central, na regulação da temperatura corporal e na contractilidade muscular cardíaca2,3.
Fisiopatologia
A patogenia de várias doenças está relacionada com distúrbios primários ou secundários do sistema AVP.
A diabetes insípida (DI) central caracteriza-se pela diminuição ou ausência de secreção de AVP com consequente diminuição da capacidade de concentração renal de urina, causando poliúria e polidipsia. A diminuição ou ausência de secreção de AVP pode resultar de um ou mais defeitos a nível dos receptores osmóticos hipotalâmicos, núcleos supraóptico ou paraventricular ou trato supraopticohipofi--sário4. A DI nefrogénica caracteriza-se pela diminuição da capacidade de concentração de urina devido a resistência dos nefrónios distais à ação da AVP5. A síndrome de secreção inapropriada de HAD caracteriza-se pela produção de AVP na ausência de estímulos hemodinâmicos ou osmóticos. O excesso de secreção de AVP pode ter origem na neuro--hipófise ou num local ectópico, como em casos de neoplasia1.
O envolvimento secundário da AVP na patogenia de outras doenças tem sido descrito para patologias como insuficiência cardíaca crónica, insuficiência hepática crónica e doenças críticas agudas6,7.
Tendo em conta o contributo da AVP na fisiopatologia de várias doenças agudas e crónicas, seria importante o doseamento dos seus níveis plasmáticos para o diagnóstico de distúrbios do sistema de regulação osmótica e para a monitorização do tratamento de doentes com patologia cardiovascular. No entanto, a fiabilidade dos métodos laboratoriais para a determinação das concentrações de AVP não é a ideal8-10 (Tabela 1).
Copeptina
Caracterização, processamento e função fisiológica
A AVP tem origem num peptídeo precursor de 164 aminoácidos designado preprovasopressina, que é formada por um peptídeo de sinalização, AVP, neurofisina II e copeptina11 (Figura 1). A copeptina foi isolada e descrita pela primeira vez por Holwerda em 197212. Trata-se de um peptídeo glicosilado, formado por 39 aminoácidos com um segmento central rico em leucina, que constitui porção C-terminal da preprovasopressina11.
Figura 1. Representação esquemática do peptídeo precursor preprovasopressina. Os números indicam aminoácidos da proteína humana. AVP: arginina vasopressina. Adaptado de Morgenthaler .
A preprovasopressina é sintetizada nos núcleos magnocelulares do hipotálamo e sujeita a uma cascata de reações enzimáticas para dar origem a peptídeos bioativos. Após clivagem do peptídeo de sinalização, forma-se a provasopressina, que é armazenada em grânulos neurosecretores e posteriormente clivada em peptídeos durante o transporte axonal dos núcleos hipotalâmicos para a neurohipófise. Este processamento decorre em duas etapas: a primeira clivagem liberta a AVP e a segunda separa a neurofisina II da copeptina13.
A função fisiológica precisa da copeptina ainda permanece desconhecida. Recentemente, foi sugerido que desempenha um papel importante na correção da conformação estrutural da provasopressina como pré-requisito para uma maturação proteolítica eficiente14. Pensa-se que a copeptina interatua com o sistema calnexina-calreticulina, que monitoriza o processamento proteico, diminuindo a formação de peptídeos inativos e aumentando a formação de hormonas ativas15,16. Desta forma, a ausência de co--peptina e a consequente ineficácia no processamento proteico poderá contribuir para a patogénese da DI central14.
Doseamento laboratorial
A copeptina é produzida juntamente com a AVP em concentrações equimolares. Tal como a concentração de peptídeo C ref lete a secreção de insulina, também a quantidade de copeptina libertada reflete a produção de AVP1.
A neurofisina II apresenta uma estrutura complexa que envolve sete ligações dissulfídicas intramoleculares e tem tendência para se ligar à AVP, não sendo o doseamento alternativo ideal para refletir a secreção de AVP. A copeptina não apresenta essas limitações e o seu doseamento laboratorial tem vantagens em relação ao da AVP (Tabela 2).
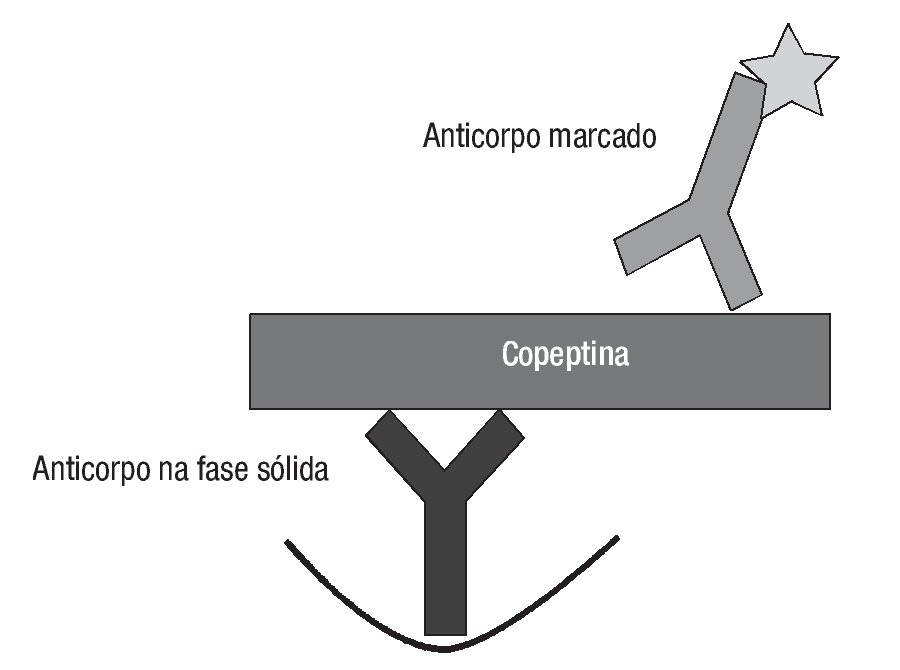
A determinação laboratorial da copeptina, recentemente descrita, consiste num doseamento imunoluminométrico tipo sanduíche no qual são utilizados dois anticorpos policlonais dirigidos à sequência de aminoácidos 132-164 na região C-terminal do peptídeo precursor preprovasopressina17 (Figura 2).
Figura 2. Doseamento da copeptina por imunoensaio tipo sanduíche. Um anticorpo policlonal (na figura anticorpo em baixo) dirigido à sequência de aminoácidos 132-147 da preprovasopressina está ligado à fase sólida; um segundo anticorpo policlonal (na figura anticorpo em cima) dirigido à sequência de aminoácidos 149-164 da preprovasopressina é marcado (estrela) para ser detetado por quimioluminescência. Adaptado de Morgenthaler .
Em 359 indivíduos saudáveis (153 homens e 206 mulheres), a concentração plasmática mediana de copeptina foi de 4,2 pmol/L (variação: 1,0-13,8 pmol/L; intervalo de confiança a 95%: 4,0-4,4 pmol/L).
Dos indivíduos avaliados, 2,5% apresentaram valores de copeptina abaixo do limiar de deteção analítica de 1,7 pmol/L. Ao contrário de outros biomarcadores, não se verificaram diferenças significativas nas concentrações plasmáticas de copeptina em diferentes grupos etários. Embora tenha sido descrita uma diferença significativa na concentração mediana de copeptina entre homens e mulheres (5,2 vs 3,7 pmol/L, p < 0,0001), a variação foi comparável nos dois subgrupos17.
Tal como a AVP, os níveis de copeptina em indivíduos saudáveis são regulados num determinado intervalo mas podem variar de acordo com determinados estados fisiológicos. Em jejum e após exercício físico a concentração de copeptina aumenta para valores normais altos e após sobrecarga oral de água diminui rapidamente para valores normais baixos17.
Copeptina na prática clínica
A AVP desempenha um papel f isiológico importante nos sistemas de regulação osmótica e cardiovascular. No entanto, o seu doseamento tem sido reservado para contextos endócrinos específicos e não tem sido implementado na prática clínica do dia a dia. A copeptina pode ser considerada um bom marcador de libertação de AVP: os dois peptídeos apresentam uma boa correlação, são libertados estequiometricamente e o doseamento laboratorial de copeptina não apresenta as limitações técnicas assinaladas para a AVP. A utilidade prática da copeptina tem sido demonstrada em vários contextos clínicos.
Síndrome polidipsia-poliúria
A síndrome polidipsia-poliúria compreende três entidades principais: DI central, DI nefrogénica e polidipsia primária. Em termos conceptuais, o diagnóstico diferencial deveria ser facilmente exequível através do teste de restrição hídrica padrão, incluindo a determinação da osmolaridade urinária após um período de desidratação seguido da administração de desmopressina (também designado por «teste indireto»). No entanto, a interpretação dos resultados na prática pode ser difícil, dado que a presença de diurese crónica pode causar alterações do gradiente de concentração medular renal e consequente diminuição da expressão dos canais aquaporina-2 no túbulo proximal e ducto coletor18.
Doentes com formas leves de DI central representam um desafio diagnóstico particular, porque a maioria mantém uma capacidade considerável de produzir HAD perante desidratação grave. Da mesma forma, doentes com DI nefrogénica adquirida podem apresentar uma resistência apenas parcial à ação da HAD, resultando numa variação significativa na capacidade de concentrar urina.
Pelos motivos enunciados, foi inicialmente recomendada a determinação da HAD plasmática antes e após o teste de restrição hídrica para permitir uma classificação mais fidedigna em relação à obtida apenas com a osmolaridade urinária19. No entanto, até à data, o doseamento laboratorial de HAD não se afirmou como teste diagnóstico de referência, devido principalmente a limitações metodológicas.
Recentemente, a utilidade da copeptina no diagnóstico diferencial de doentes com síndrome polidipsia-poliúria foi avaliada e comparada com o teste de restrição hídrica clássico20. Cinquenta doentes com síndrome polidipsia-poliúria realizaram o teste de restrição hídrica com determinação dos valores plasmáticos de HAD e copeptina. O diagnóstico de referência foi baseado na informação clínica e na resposta ao tratamento. O teste de restrição hídrica indireto permitiu um diagnóstico correto em 70% dos doentes. O teste direto diagnosticou corretamente 46% dos casos com o doseamento de HAD e 72% dos casos com o doseamento de copeptina. Um único doseamento basal de copeptina permitiu a identificação de doentes com DI nefrogénica (valores superiores a 20 pmol/L) e com DI central completa (valores inferiores a 2,6 pmol/L). O diagnóstico diferencial entre polidipsia primária e DI central parcial foi menos linear. Nesse contexto, apesar de ter havido melhores resultados com um único doseamento de copeptina no final do teste em compara--ção com a osmolaridade urinária, o indicador com melhor precisão diagnóstica foi a razão D copeptina [08h-16h] / concentração sérica de sódio [16h] (sensibilidade de 86% e especificidade de 100%). Estes dados apontam o doseamento de copeptina como uma ferramenta promissora em doentes com síndrome polidipsia-poliúria, melhorando significativamente a precisão diagnóstica do teste de restrição hídrica direto.
Distúrbios eletrolíticos
As alterações do equilíbrio do sódio são comuns em pacientes hospitalizados estando relacionadas principalmente com alterações da homeostase da água. A hiponatremia é o distúrbio hidroelectrolítico mais frequente, apresentando uma prevalência de 15 a 30%. A hipernatremia é menos frequente, ocorrendo em cerca de 1 a 3% dos casos21. Ambos os distúrbios estão associados a morbilidade e mortalidade substanciais22,23.
A determinação da causa da hiponatremia baseada em sinais clínicos e avaliação laboratorial de rotina tem uma sensibilidade e especificidade inferior a 50%. Estima-se que o diagnóstico etiológico correto com base nos algoritmos de rotina seja feito apenas em 10% dos doentes, com a consequente possibilidade de consequências clínicas significativas nos casos de tratamento inadequado24,25.
A HAD é a hormona mais importante envolvida na regulação do volume e equilíbrio osmótico. A determinação da concentração plasmática da copeptina tem sido sugerida para o diagnóstico diferencial de hiponatremia, de forma a tornar a abordagem diagnóstica menos complexa e a implementar atempadamente a estratégia terapêutica mais adequada.
Num estudo recentemente publicado foi avaliada a utilidade da copeptina no diagnóstico diferencial de distúrbios do equilíbrio do sódio em doentes internados com infeções do trato respiratório inferior, pneumonias adquiridas na comunidade e acidentes vasculares cerebrais agudos26. Os autores concluíram que nesta população os níveis de copeptina foram semelhantes para as várias etiologias de alterações leves do balanço de sódio e que a sua determinação acrescentou escassa informação ao algoritmo diagnóstico tradicional. O estímulo não osmótico associado ao stress da doença aguda foi apontado como o principal fator de confusão ao sobrepor-se ao estímulo osmótico.
No entanto, outro estudo recente demonstrou a utilidade da copeptina no diagnóstico diferencial de doentes com hiponatremia hiposmolar isolada 27. Numa amostra de 106 doentes com hiponatremia, os autores concluíram que a combinação de um valor de copeptina inferior a 3 pmol/L com uma osmolaridade urinária inferior a 200 mOsm/Kg permitiu o diagnóstico correto de polidipsia primária em 100% de casos suspeitos. No entanto, apresentou utilidade limitada no diagnóstico diferencial entre a síndrome de secreção inapropriada de HAD e estados de depleção de sódio. Nesse contexto, a razão copeptina / sódio urinário foi um índice mais útil, inclusivamente superior aos critérios de referência. Uma razão copeptina / sódio urinário inferior a 30 pmol/mmol foi superior na identificação correta da síndrome de secreção inapropriada de HAD em comparação com os parâmetros padrão (sódio urinário, valor sérico de uratos e excreção fraccional de sódio).
Doenças agudas
A AVP é uma das principais hormonas envolvidas na fisiopatologia da doença aguda. A determinação da copeptina tem sido proposta como marcador prognóstico de doenças agudas, como sépsis, infeções respiratórias, doença cardíaca e doença vascular cerebral28.
Num estudo efetuado com 101 doentes internados numa unidade de cuidados intensivos, os valores de copeptina aumentaram significativamente de acordo com a gravidade da sépsis29. A concentração mediana de copeptina foi de 4,1 pmol/L em controlos saudáveis mas significativamente superior em doentes com sépsis (50,0 pmol/L), sépsis grave (73,6 pmol/L) e choque séptico (171,5 pmol/L). O doseamento de copeptina parece ter valor prognóstico, dado que, no momento da admissão, a sua concentração mediana foi significativamente superior no grupo de não sobreviventes (171,5 pmol/L) em comparação com o grupo de sobreviventes (86,8 pmol/L). Comparativamente com o sistema de pontuação APACHE II, o sistema de classificação clínica de referência em doentes em estado crítico, o doseamento de copeptina forneceu informação prognóstica semelhante.
Os níveis circulantes de copeptina estão correlacionados com a gravidade clínica de infeções respiratórias, sobretudo em doentes com pneumonia. Num estudo efetuado com 545 doentes internados por infeções do trato respiratório inferior, a concentração mediana de copeptina foi significativamente superior em comparação com controlos (25,3 pmol/L vs 5,0 pmol/L, p < 0,001)30. Foram observados valores mais elevados em doentes com pneumonia adquirida na comunidade (30,5 pmol/L) e aumento dos níveis de copeptina de acordo com a gravidade da pneumonia. À admissão, a concentração mediana de copeptina foi superior nos doentes não sobreviventes do que nos sobreviventes (70,0 pmol/L vs 24,3 pmol/L, p < 0,001). Os resultados de outro estudo sugeriram o doseamento de copeptina como bom marcador de prognóstico a curto e a longo prazo em doentes internados por exacerbações agudas de doença pulmonar obstrutiva crónica31.
Níveis elevados de AVP têm sido associados a pior prognóstico em doentes com insuficiência cardíaca crónica. Em dois estudos recentes, 268 e 137 doentes com insuficiência cardíaca crónica e concentrações elevadas de copeptina apresentaram pior prognóstico do que doentes com concentrações baixas32,33. Além disso, a combinação do doseamento de copeptina com o de peptídeo natriurético auricular melhorou a informação prognóstica. O doseamento de copeptina em 980 doentes após enfarte agudo do miocárdio mostrou ser um fator predictor independente de mortalidade ou insuficiência cardíaca34.
Tem sido descrito aumento dos níveis de AVP em doentes com doença vascular cerebral aguda. Num estudo efetuado com 362 doentes internados por acidente vascular cerebral isquémico, a utilidade do doseamento de copeptina foi superior à de outros parâmetros laboratoriais (glicemia, proteína C reativa ou contagem de leucócitos) ou clínicos (pressão arterial, temperatura). Além disso, melhorou a informação prognóstica do sistema de pontuação clínica NIHSS (National Institute of Health Stroke Scale)35.
Diabetes mellitus e resistência à insulina
Nos últimos anos, tem sido sugerido um papel do sistema AVP na homeostase da glicose, resistência à insulina e desenvolvimento de diabetes mellitus. A AVP parece modelar a glicogenólise hepática através dos receptores V1a e a secreção de insulina e glucagon através dos receptores V1b36. Doentes diabéticos com mau controlo metabólico apresentam níveis plasmáticos elevados de AVP e a infusão de AVP em indivíduos saudáveis causa aumento dos níveis de glicose2. A resistência à ação da AVP a nível dos receptores V1a hepáticos parece causar aumento dos níveis de AVP que, por sua vez, estimula os receptores V1b e contribui para a resistência à insulina e desenvolvimento de diabetes mellitus. Num estudo prospetivo com 4742 doentes, verificou-se que níveis elevados de copeptina predizem um risco aumentado de diabetes mellitus independentemente de outros fatores de risco, nomeadamente glicose plasmática em jejum e insulina em jejum37. Noutro estudo, foi avaliada a utilidade da copeptina como marcador de resistência à insulina e síndrome metabólica38, tendo-se verificado correlações estatisticamente significativas entre os níveis plasmáticos de copeptina e índice de massa corporal, glicose plasmática em jejum, insulina em jejum, índices de resistência à insulina, triglicerídeos e colesterol HDL (high density lipoprotein).
Conclusões
Os mecanismos patogénicos de várias doenças envolvem distúrbios primários ou secundários do sistema AVP. No entanto, a determinação dos níveis de AVP na prática clínica apresenta limitações metodológicas consideráveis. O doseamento laboratorial de copeptina permite de forma fiável avaliar a concentração plasmática de AVP e tem-se mostrado útil em vários contextos clínicos, quer no diagnóstico diferencial de distúrbios do equilíbrio osmótico e eletrolítico, quer como marcador prognóstico de várias doenças agudas e crónicas.