O efeito dos fármacos inibidores da aromatase (IA) na estatura de jovens do sexo masculino com baixa estatura idiopática (BEI) tem vindo a ser estudado desde que foi evidenciado o papel dos estrogénios na paragem do crescimento linear. Os ensaios clínicos aleatorizados, duplamente cegos, de caso‐controlo com letrozol indicam impacto positivo na previsão de estatura final em jovens do sexo masculino com BEI, com ou sem atraso constitucional do crescimento e puberdade. Por persistirem aspetos de segurança a requerer melhor estudo, a sua utilização terapêutica continua a ser off‐label.
ObjetivosTendo em vista a implementação de um ensaio clínico sobre a terapêutica com IA em jovens do sexo masculino com BEI procedeu‐se a uma revisão sistemática da literatura, na qual se fundamenta a proposta de protocolo apresentada.
MétodosPesquisa na base de dados eletrónica Medline de revisões sistemáticas, ensaios clínicos aleatorizados controlados e referências bibliográficas dos artigos selecionados, publicados entre janeiro de 2001 e dezembro de 2012.
ConclusõesA terapêutica com um IA de terceira geração (letrozol) poderá ser considerada em jovens do sexo masculino com BEI, altura inferior a pelo menos −2,0 SDS para a idade ou previsão de altura final pelo menos 2,0 SDS abaixo da estatura média parental, desde que já tenha sido iniciada a puberdade e a idade óssea seja inferior a 14 anos. Os principais aspetos de segurança ainda sob discussão na literatura referem‐se a potenciais efeitos a nível ósseo. A utilização de medicamentos off‐label deve obedecer a critérios estritos de prescrição e seguimento das crianças, de forma a minimizar os riscos e obter resultados fiáveis e comparáveis. Apresenta‐se proposta de sistematização de monitorização clínica, imagiológica e laboratorial, bem como critérios de término ou suspensão da mesma.
The effect of aromatase inhibitors in the height of male adolescents with idiopatic short stature has been studied since the role of estrogen in the finishing of the linear growth has been clarified. Randomized controlled double blind clinical trials comparing letrozol with placebo indicate a positive impact on the predicted adult height of male adolescents with idiopatic short stature, either with or without constitutional growth and puberty delay. As there still remain some security aspects requiring better enlightment, their therapeutic use is off‐label.
ObjectivesRegarding the development of a clinical trial on the prescription of aromatase inhibitors in male adolescents with idiopathic short stature, a systematic literature review has been performed, which supports the current protocol proposal.
MethodsResearch on the electronic database Medline for sistematic reviews, randomized controlled double blind clinical trials and references from the selected articles, published between January 2001 and December 2012.
ConclusionsPrescription of a third generation aromatase inhibitor (letrozol) may be considered in male pubertal adolescents with idiopathic short stature with height below −2.0 SDS for their age or predicted adult height 2.0 SDS lower than midparental height, and bone age under 14 years. Potential effects on bone health are the main safety issues under discussion on the published papers. Off‐label therapy should comply to strict prescription and follow‐up criteria, in order to reduce the risks and to obtain valuable and comparable outcomes. A proposal for the clinical, imaging and laboratory follow up of patients under aromatase inhibition is presented, as well as criteria for ending or suspending the treatment.
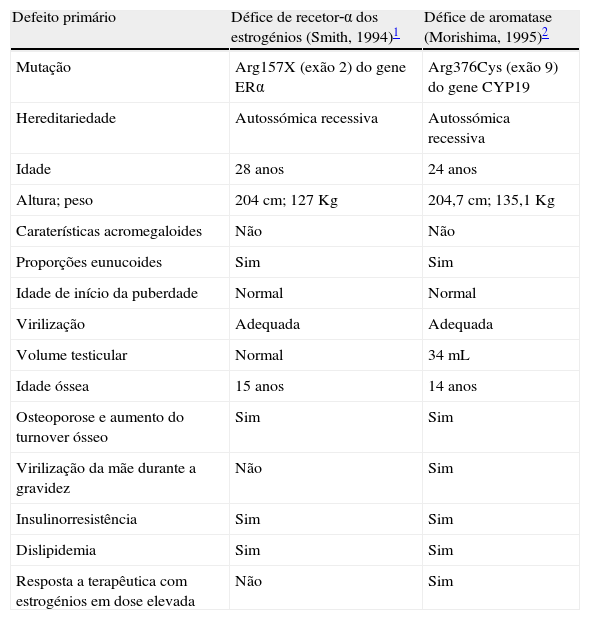
O grau de maturação da placa de crescimento epifisária é o fator determinante do potencial de crescimento de uma criança. O papel crítico dos estrogénios na maturação e encerramento da cartilagem de crescimento foi elucidado a partir dos anos 90, com o estudo de 2 casos de elevada estatura em jovens adultos do sexo masculino, um deles com mutação no gene do recetor de estrogénios1, outro com mutação no gene da aromatase2, tendo em comum a ausência de sinalização estrogénica eficaz. Na tabela 1 encontram‐se sistematizadas as caraterísticas clínico‐laboratoriais destes 2 casos paradigmáticos.
Caraterísticas dos 2 casos que contribuíram para elucidar o efeito dos estrogénios na maturação da cartilagem de crescimento
| Defeito primário | Défice de recetor‐α dos estrogénios (Smith, 1994)1 | Défice de aromatase (Morishima, 1995)2 |
| Mutação | Arg157X (exão 2) do gene ERα | Arg376Cys (exão 9) do gene CYP19 |
| Hereditariedade | Autossómica recessiva | Autossómica recessiva |
| Idade | 28 anos | 24 anos |
| Altura; peso | 204cm; 127Kg | 204,7cm; 135,1Kg |
| Caraterísticas acromegaloides | Não | Não |
| Proporções eunucoides | Sim | Sim |
| Idade de início da puberdade | Normal | Normal |
| Virilização | Adequada | Adequada |
| Volume testicular | Normal | 34mL |
| Idade óssea | 15 anos | 14 anos |
| Osteoporose e aumento do turnover ósseo | Sim | Sim |
| Virilização da mãe durante a gravidez | Não | Sim |
| Insulinorresistência | Sim | Sim |
| Dislipidemia | Sim | Sim |
| Resposta a terapêutica com estrogénios em dose elevada | Não | Sim |
Fonte: adaptado de Geffner et al.5
A aromatase é uma enzima do grupo do citocromo P450 que catalisa a aromatização dos androgénios em estrogénios, nomeadamente a conversão da testosterona em estradiol e da androstenediona em estrona. Localiza‐se no retículo endoplasmático de células produtoras de estrogénios de vários órgãos e tecidos: ovário, mama, cérebro, músculo, fígado, tecido adiposo, testículo e osso, entre outros.
Os fármacos inibidores da atividade da aromatase, inibidores da aromatase (IA), são comercializados primordialmente para a terapêutica da neoplasia da mama com recetores de estrogénios positivos. Todavia, desde que foi clarificado o papel dos estrogénios na paragem do crescimento linear, o seu efeito na estatura de jovens do sexo masculino com baixa estatura idiopática (BEI) tem vindo a ser estudado, tendo o primeiro trabalho sido publicado há 12 anos3. Desde então têm sido reportados vários resultados de eficácia e segurança, que contribuem para o progressivo esclarecimento de algumas incertezas quanto à possibilidade de aplicação terapêutica dos IA neste contexto clínico. No entanto, por ainda persistirem aspetos de segurança a requerer melhor estudo, a sua utilização terapêutica continua a ser off‐label.
A baixa estatura idiopática define‐se auxologicamente por estatura inferior a 2 desvios‐padrão em relação à média correspondente para a idade, sexo e grupo populacional, após exclusão de doença sistémica, endócrina, nutricional ou anomalias cromossómicas4. Por definição, aplica‐se a crianças com normal peso e comprimento ao nascer e sem défice de hormona do crescimento. O conceito de BEI descreve um grupo heterogéneo de crianças sem causa identificada para a baixa estatura e inclui os subgrupos das crianças com baixa estatura familiar e das que têm baixa estatura no contexto de atraso constitucional do crescimento e puberdade (ACCP). Estima‐se que 60‐80% das crianças com estatura abaixo de −2,0 SDS cumpram os critérios de BEI.
Tendo em vista o desenho e futura implementação de um ensaio clínico para avaliar os efeitos da terapêutica com IA em jovens do sexo masculino com BEI, procedeu‐se a uma revisão sistemática da literatura, na qual se fundamenta a proposta de protocolo que se apresenta.
MétodosFoi realizada uma pesquisa de revisões sistemáticas com ou sem metanálises e ensaios clínicos aleatorizados e controlados, utilizando a base de dados eletrónica Medline, e referências bibliográficas dos artigos selecionados, publicados entre janeiro de 2001 e dezembro de 2012, nas línguas portuguesa, inglesa, espanhola e francesa, utilizando as palavras‐chave (termos MeSH): aromatase inhibitors, growth e body height. Foram selecionados os artigos com enfoque principal na terapêutica com IA em jovens do sexo masculino com BEI. Foram descartadas as publicações não relacionadas, publicações sob a forma de resumo sem acesso integral e estudos de caso. Não foram incluídos dados relativos às restantes áreas de potencial aplicação dos IA em endocrinologia pediátrica, nomeadamente, entidades com hiperestrogenismo, hiperandrogenismo e ginecomastia pubertária.
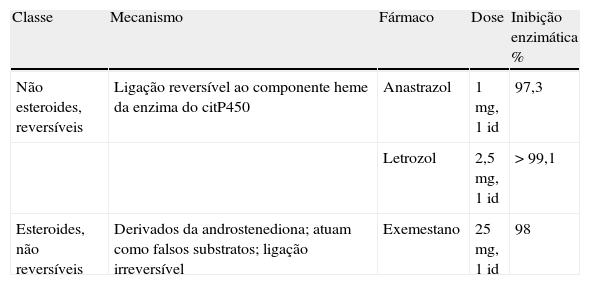
Fármacos inibidores da atividade da aromataseAtualmente são utilizados os IA de terceira geração, mais específicos, com maior eficácia de bloqueio enzimático obtida com menores doses de fármaco, menos efeitos secundários e maior duração de ação face aos IA de gerações anteriores5. Na tabela 2 apresentam‐se os IA de terceira geração, de acordo com a sua classificação.
Fármacos inibidores da atividade da aromatase
| Classe | Mecanismo | Fármaco | Dose | Inibição enzimática % |
| Não esteroides, reversíveis | Ligação reversível ao componente heme da enzima do citP450 | Anastrazol | 1mg, 1id | 97,3 |
| Letrozol | 2,5mg, 1id | >99,1 | ||
| Esteroides, não reversíveis | Derivados da androstenediona; atuam como falsos substratos; ligação irreversível | Exemestano | 25mg, 1id | 98 |
Fonte: adaptado de Geffner et al.5.
Sugere‐se o letrozol em primeira linha atendendo a que foi o fármaco incluído nos ensaios clínicos aleatorizados e controlados disponíveis na literatura3,6,7.
O letrozol tem absorção rápida e completa, não sendo afetada pela alimentação, pelo que pode ser tomado com ou sem refeições. A metabolização é hepática (CYP3A4 e 2A6) em metabolito carbinol inativo. A excreção é renal (90%), sob a forma de metabolito inativo (75%), outros metabolitos (9%) e fármaco não metabolizado (6%). A semivida plasmática é de 2 dias e atingem‐se níveis estáveis após 2‐6 semanas de administração diária de 2,5mg, não se verificando efeito de acumulação8. Os dados apresentados referem‐se a estudos em adultos, não tendo sido estudadas as diferenças de farmacocinética entre a população adulta e pediátrica.
Nos estudos em crianças não foram reportados efeitos adversos, nomeadamente no que se refere a manifestações de hiperandrogenismo.
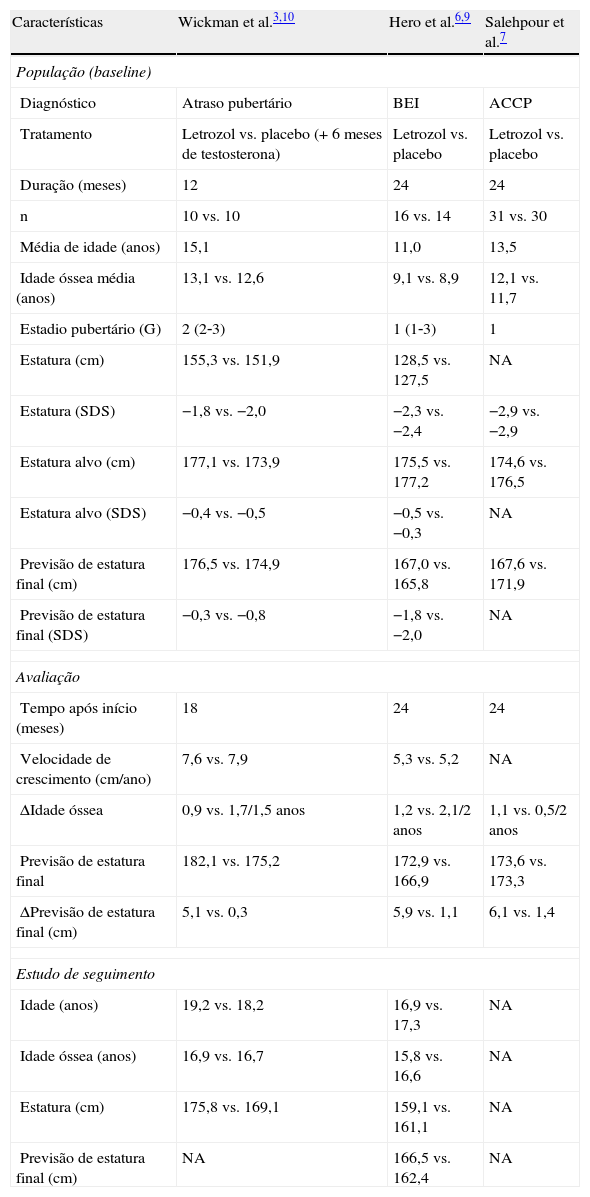
EvidênciaEficáciaOs resultados dos 3 ensaios clínicos aleatorizados, duplamente cegos, de caso‐controlo contra placebo utilizando o letrozol indicam impacto positivo na previsão de estatura final em casos de BEI6, 2 dos quais com grupos de casos com ACCP3,7. Os dados mais relevantes de cada estudo encontram‐se resumidos na tabela 3.
Resumo dos resultados dos 3 ensaios clínicos com letrozol
| Características | Wickman et al.3,10 | Hero et al.6,9 | Salehpour et al.7 |
| População (baseline) | |||
| Diagnóstico | Atraso pubertário | BEI | ACCP |
| Tratamento | Letrozol vs. placebo (+6 meses de testosterona) | Letrozol vs. placebo | Letrozol vs. placebo |
| Duração (meses) | 12 | 24 | 24 |
| n | 10 vs. 10 | 16 vs. 14 | 31 vs. 30 |
| Média de idade (anos) | 15,1 | 11,0 | 13,5 |
| Idade óssea média (anos) | 13,1 vs. 12,6 | 9,1 vs. 8,9 | 12,1 vs. 11,7 |
| Estadio pubertário (G) | 2 (2‐3) | 1 (1‐3) | 1 |
| Estatura (cm) | 155,3 vs. 151,9 | 128,5 vs. 127,5 | NA |
| Estatura (SDS) | −1,8 vs. −2,0 | −2,3 vs. −2,4 | −2,9 vs. −2,9 |
| Estatura alvo (cm) | 177,1 vs. 173,9 | 175,5 vs. 177,2 | 174,6 vs. 176,5 |
| Estatura alvo (SDS) | −0,4 vs. −0,5 | −0,5 vs. −0,3 | NA |
| Previsão de estatura final (cm) | 176,5 vs. 174,9 | 167,0 vs. 165,8 | 167,6 vs. 171,9 |
| Previsão de estatura final (SDS) | −0,3 vs. −0,8 | −1,8 vs. −2,0 | NA |
| Avaliação | |||
| Tempo após início (meses) | 18 | 24 | 24 |
| Velocidade de crescimento (cm/ano) | 7,6 vs. 7,9 | 5,3 vs. 5,2 | NA |
| ΔIdade óssea | 0,9 vs. 1,7/1,5 anos | 1,2 vs. 2,1/2 anos | 1,1 vs. 0,5/2 anos |
| Previsão de estatura final | 182,1 vs. 175,2 | 172,9 vs. 166,9 | 173,6 vs. 173,3 |
| ΔPrevisão de estatura final (cm) | 5,1 vs. 0,3 | 5,9 vs. 1,1 | 6,1 vs. 1,4 |
| Estudo de seguimento | |||
| Idade (anos) | 19,2 vs. 18,2 | 16,9 vs. 17,3 | NA |
| Idade óssea (anos) | 16,9 vs. 16,7 | 15,8 vs. 16,6 | NA |
| Estatura (cm) | 175,8 vs. 169,1 | 159,1 vs. 161,1 | NA |
| Previsão de estatura final (cm) | NA | 166,5 vs. 162,4 | NA |
ACCP: atraso constitucional do crescimento e puberdade; BEI: baixa estatura idiopática; NA: não avaliado; SDS: standard deviation score; vs: versus.
Fonte: adaptado de Wit et al.12.
O ensaio clínico em adolescentes do sexo masculino com BEI sem outra especificação (n=31, idade média de 11 anos, 87% pré‐púberes), teve duração de 24 meses6. O grupo com letrozol apresentou desaceleração da maturação óssea, com velocidade de crescimento sobreponível à do grupo placebo (5,3 vs. 5,2cm/ano), mas com incremento da previsão de estatura final em 5,9 vs. 1,1cm (p<0,0001)6. Nos resultados de seguimento 6 anos após o estudo inicial não havia diferença estatisticamente significativa na previsão de altura final entre os grupos com letrozol ou placebo9. Este ensaio clínico incluiu predominantemente jovens pré‐púberes, o que poderá ter contribuído para uma menor expressividade dos resultados após 6 anos, em comparação com o estudo de seguimento do grupo em que foram incluídos predominantemente rapazes púberes10. Aquando da realização deste ensaio clínico não tinham sido reportados anteriormente achados vertebrais em crianças pré‐púberes tratadas com IA. Não foram publicados até à data resultados de seguimento de altura final.
Não sendo o subgrupo com ACCP a aplicação visada nesta revisão, referem‐se os estudos que incluíram jovens com esta entidade porque documentam também o efeito dos IA no aumento do potencial de crescimento na BEI. O estudo pioneiro publicado em 2001 incluiu jovens do sexo masculino com ACCP (n=23, idade média de 15 anos) em 2 grupos submetidos a terapêutica com testosterona durante 6 meses, associada a 12 meses de letrozol ou placebo3. O grupo com letrozol apresentou desaceleração da maturação óssea, com velocidade de crescimento semelhante ao grupo placebo. A variação da previsão de estatura final oscilou entre −3,5cm (sendo negativa apenas num caso) e+8,8cm, com incremento médio de 5,1 vs. 0,3cm no grupo placebo (p<0,05). Além dos 2 grupos aleatorizados, 10 doentes integraram um grupo sem intervenção terapêutica, 7 dos quais foram avaliados aos 18 meses de estudo, tendo a previsão de estatura final aumentado 2cm. No estudo de seguimento até idade média de 19,2 anos, o grupo com letrozol teve estatura em média 6,7cm superior à do grupo placebo, 1,3cm abaixo da altura alvo, enquanto o grupo placebo teve estatura em média 4,8cm abaixo da altura alvo10.
O estudo mais recente envolvendo jovens do sexo masculino com ACCP7, com braço letrozol vs. placebo (n=61, idade média de 13,5 anos) documentou aumento da previsão de estatura final em 6,1 vs. 1,4cm (p<0,01). Foi também reportada diminuição da diferença entre a previsão de estatura final e a estatura alvo, de −7,0cm para −0,9cm, pré e pós‐tratamento, respetivamente. Contudo, o grupo tratado com letrozol teve aumento da velocidade de crescimento (variação de SDS da velocidade de crescimento +0,5 vs. 0), e avanço de idade óssea (IO) superior ao do grupo placebo (1,1 vs. 0,5 anos), resultados a requerer esclarecimento em estudos subsequentes. Os autores propõem como explicação a supressão incompleta da atividade da aromatase na população em estudo7. Este estudo incluiu apenas rapazes pré‐púberes, mas é omisso quanto a achados vertebrais.
As principais limitações dos estudos de referência são o pequeno número de doentes envolvidos e a indisponibilidade de resultados de altura final. A amplitude do intervalo de IO determinada nos estudos de seguimento9,10, entre 15,8‐18,0 anos, poderá ter‐se traduzido em consideráveis variações na altura final. Por outro lado, a heterogeneidade de desenho dos ensaios clínicos dificulta a comparação direta de resultados, nomeadamente atendendo a que um dos grupos recebeu também terapêutica com testosterona.
As mais recentes revisões sistemáticas concluem haver evidência da eficácia dos IA para desacelerar a progressão da IO e aumentar a previsão da estatura final na idade adulta em jovens do sexo masculino com BEI e ACCP11,12.
A terapêutica com IA na BEI, com ou sem ACCP, tem nível de evidência IB12, na medida em que estão disponíveis dados de pelo menos um estudo adequadamente aleatorizado e controlado, havendo moderada evidência para apoiar o seu uso. Na prática, a sua utilização off‐label nas referidas indicações é considerada provavelmente eficaz, havendo, no entanto, aspetos de segurança a requerer precaução na sua utilização.
SegurançaOs principais aspetos de segurança ainda sob discussão na literatura publicada referem‐se a potenciais efeitos a nível ósseo.
A densidade mineral óssea foi avaliada em 4 estudos aleatorizados e controlados com IA. Durante o tratamento com letrozol por 1‐2 anos em rapazes com BEI6,13 e ACCP3,7, a densidade mineral óssea da coluna lombar e colo do fémur aumentou de forma semelhante à do grupo placebo.
Nos jovens sob placebo houve aumento dos marcadores de remodelação óssea, relacionando‐se positivamente com a velocidade de crescimento13. Por outro lado, nos jovens medicados com letrozol os doseamentos do pró‐peptídeo N‐terminal do colagénio I (s‐PINP) e da fosfatase alcalina mantiveram‐se sobreponíveis aos níveis pré‐tratamento. Este dado sugere uma baixa taxa de remodelação óssea, possivelmente relacionada com inibição da reabsorção óssea mediada por androgénios, cujos efeitos na resistência do osso ainda não são evidentes5,12.
Foi reportada deformidade vertebral em cunha ligeira e assintomática em rapazes com BEI no início da puberdade, não havendo diferenças significativas entre o grupo placebo e o grupo tratado com o fármaco9. Todavia, a inexistência de estudos prévios ao início da terapêutica dificulta a valorização desse achado. O grupo responsável pelo estudo propõe que alguns rapazes com BEI possam ter um defeito do metabolismo ósseo que comprometa o crescimento e resistência ósseos, resultando em deformidade vertebral em cunha9. O grupo de Mauras avaliou a morfologia vertebral de jovens incluídos alguns anos antes num estudo com terapêutica com anastrazol e hormona de crescimento, contra placebo, observando também achados vertebrais assintomáticos – ligeiro estreitamento do espaço intervertebral e irregularidades da placa terminal11. São necessários estudos subsequentes acerca do impacto da inibição da aromatase na arquitetura óssea e morfologia vertebral.
Quanto aos efeitos dos IA no eixo hipotálamo‐hipófise‐gónada, importa ter em conta que na fase inicial da puberdade os estrogéneos são os principais responsáveis pelo retrocontrolo negativo na secreção de gonadotropinas, pelo que o bloqueio com letrozol faz aumentar os níveis circulantes de hormona luteinizante (LH) e hormona folículo‐estimulante (FSH) a intensidade dos pulsos noturnos de LH e a resposta de LH induzida por pela hormona libertadora de gonadotropinas (GnRH), sendo o resultado final o aumento da produção de testosterona testicular. O aumento da testosterona sérica pode potenciar a progressão dos sinais físicos de puberdade6. Ainda não é claro se a terapêutica com IA influencia o tempo de início e ritmo de progressão da puberdade. À exceção de eventual policitemia, a monitorizar12, não se encontram na literatura relatos de efeitos adversos de hiperandrogenismo. Os potenciais efeitos no comportamento não foram sistematicamente estudados. O letrozol induz supressão da atividade da aromatase ligeiramente superior à induzida pelo anastrazol, pelo que se verificam níveis de testosterona plasmáticos mais elevados em jovens tratados com letrozol3,6,14.
Quanto aos efeitos metabólicos, foi reportada diminuição do colesterol‐HDL, mantendo‐se no intervalo de níveis normais15. Os níveis de testosterona estão em relação direta com a hemoglobina plasmática e em relação inversa com o colesterol‐HDL.
A terapêutica com IA não teve efeito no índice de massa corporal15.
Parece haver um efeito inibitório dos IA sobre a estimulação pubertária do eixo hormona do crescimento‐fator de crescimento semelhante à insulina I (IGF I), o que é a favor do conceito de que são os estrogénios que induzem esta ativação13. No entanto, a velocidade de crescimento em rapazes púberes sob terapêutica com letrozol é semelhante à do grupo de placebo e superior à dos rapazes pré‐púberes, o que sugere que na presença de níveis pré‐púberes de IGF I e estradiol os androgénios tenham a capacidade de estimular o aumento pubertário da velocidade de crescimento16. Refira‐se que o efeito de diminuição de valores de IGF I não foi identificado no estudo aleatorizado controlado mais recente envolvendo adolescentes do sexo masculino com ACCP7. A menor ativação do eixo hormona do crescimento‐IGF I é sugerida como mecanismo para a diminuição da insulinorresistência da puberdade identificada num grupo sob terapêutica com letrozol17. No entanto, tal não foi encontrado em outros estudos, tendo o ambiente hormonal sob terapêutica com IA um efeito predominantemente neutro sobre a sensibilidade à insulina15.
Não se verificaram alterações da função cognitiva de acordo com o estudo que avaliou este potencial efeito secundário com base nos efeitos documentados de alteração da memória verbal em mulheres sob terapêutica com IA para a neoplasia da mama18. Quanto aos eventuais efeitos na espermatogénese, não se encontraram diferenças em relação aos controlos19.
IndicaçõesA terapêutica com IA pode ser considerada em jovens do sexo masculino com altura inferior a pelo menos −2,0 SDS para a idade e sexo que cumprem critérios de BEI e/ou que têm previsão de altura final pelo menos 2,0 SDS abaixo da estatura média parental, desde que cumpram 3 critérios de inclusão: (1) puberdade iniciada, isto é, volume testicular superior ou igual a 4mL; (2) IO inferior a 14 anos; (3) ausência de contraindicações.
Atendendo ao seu mecanismo de atuação, é razoável admitir que obtenham maior benefício os jovens que já tenham iniciado a puberdade11, o que é também sugerido pelos melhores resultados no estudo de seguimento do grupo em que foram incluídos predominantemente rapazes púberes3, em oposição aos do estudo que incluiu predominantemente rapazes impúberes6.
É necessário que haja suficiente imaturidade óssea para permitir incrementar o potencial de crescimento, pelo que se propõe IO abaixo de 14 anos, de acordo com o critério de inclusão de um dos estudos de referência6.
Saliente‐se que o doseamento de testosterona sérica basal não foi utilizado nos estudos citados como critério de decisão terapêutica.
ContraindicaçõesEm relação direta com o mecanismo de atuação, está contraindicada a utilização dos IA no sexo feminino6,11 e em crianças pré‐púberes11. Também a frequência de achados vertebrais reforça a contraindicação ao seu uso na fase pré‐pubertária. São ainda contraindicações a presença de doença primária ou secundária conhecida com envolvimento ósseo12 e a presença de alterações relevantes na avaliação clínica, laboratorial e imagiológica inicial, merecendo decisão caso a caso.
PrescriçãoSalvaguardado o contexto de aplicação, recomenda‐se a prescrição de letrozol na dose de 2,5mg, uma toma diária por via oral. Sugere‐se a toma ao pequeno‐almoço para facilitar a adesão à terapêutica. À data da revisão, o fármaco encontra‐se comercializado sob a forma de comprimidos revestidos por película, em embalagens de 30 comprimidos.
Quanto à terapêutica coadjuvante com suplementação de vitamina D e cálcio sugerida por alguns autores20, propomos que seja ponderada de acordo respetivamente com o doseamento basal de vitamina D e a avaliação do aporte regular de cálcio na dieta.
MonitorizaçãoDo ponto de vista clínico, devem ser avaliados em todas as consultas os dados de anamnese relativos a eventuais sintomas relacionados com hiperandrogenismo ou musculoesqueléticos, devendo o exame objetivo incluir a avaliação da altura, peso e estádio pubertário. Propõe‐se consultas mensais nos primeiros 3 meses de terapêutica, passando posteriormente a trimestrais.
Antes do início da terapêutica sugere‐se a realização de radiografia da coluna incluindo projeção lateral, para análise da morfologia vertebral, e densitometria óssea da coluna lombar e fémur. Propõe‐se a reavaliação semestral da idade óssea, anual da radiografia da coluna e bianual da densitometria óssea (ou pelo menos uma reavaliação aquando do final da terapêutica).
A avaliação laboratorial deve incluir parâmetros hormonais com interesse no contexto (LH, FSH, testosterona, estradiol e IGF I), metabolismo fosfocálcico (cálcio total e ionizado, fósforo, magnésio, vitamina D) e remodelação óssea (fosfatase alcalina e desoxipiridinolina, D‐pyr), perfil lipídico (colesterol total, colesterol‐HDL, colesterol‐LDL e triglicéridos), glicemia e insulinemia, hemograma, função hepática (proteínas totais, albumina, PT e aPTT) e enzimas hepáticas (AST, ALT e GGT), função renal (ureia e creatinina) e análise sumária de urina. Na ausência de alterações laboratoriais, sugere‐se reavaliação trimestral no 1.° ano e posteriormente semestral. A monitorização de valores alterados deverá ser individualizada caso a caso.
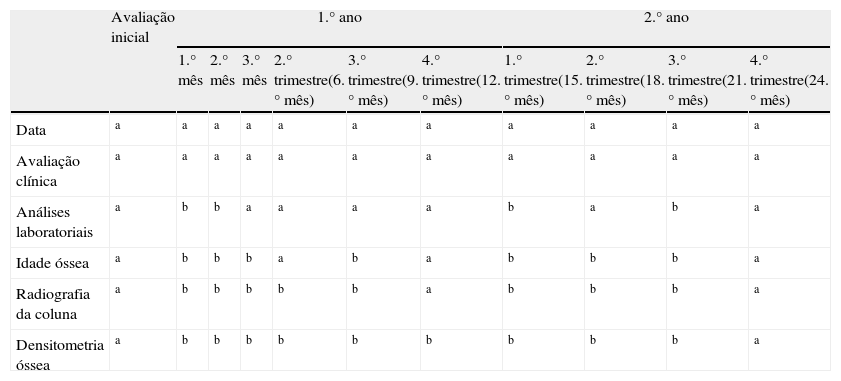
Na tabela 4 encontra‐se sistematizada uma proposta de ficha de seguimento com a calendarização da monitorização clínica, imagiológica e laboratorial da terapêutica com IA.
Ficha de monitorização da terapêutica com IA
| Avaliação inicial | 1.° ano | 2.° ano | |||||||||
| 1.° mês | 2.° mês | 3.° mês | 2.° trimestre(6.° mês) | 3.° trimestre(9.° mês) | 4.° trimestre(12.° mês) | 1.° trimestre(15.° mês) | 2.° trimestre(18.° mês) | 3.° trimestre(21.° mês) | 4.° trimestre(24.° mês) | ||
| Data | a | a | a | a | a | a | a | a | a | a | a |
| Avaliação clínica | a | a | a | a | a | a | a | a | a | a | a |
| Análises laboratoriais | a | b | b | a | a | a | a | b | a | b | a |
| Idade óssea | a | b | b | b | a | b | a | b | b | b | a |
| Radiografia da coluna | a | b | b | b | b | b | a | b | b | b | a |
| Densitometria óssea | a | b | b | b | b | b | b | b | b | b | a |
a Dados a avaliar na consulta correspondente; b dados que não necessitam ser avaliados na consulta correspondente.
São necessários pelo menos 2‐3 anos de tratamento diário para se verificarem efeitos positivos na previsão de estatura final11.
Propõem‐se como critérios de paragem da terapêutica: IO superior a 14 anos e/ou o avanço de IO superior ao avanço de idade cronológica (IC), Δ IO/IC superior a 1.
A terapêutica deverá ser interrompida antecipadamente perante inexistência de resposta, traduzida por ausência de desaceleração da idade óssea, ou se ocorrerem efeitos secundários relevantes, implicando decisão caso a caso.
É esperada subida dos níveis de testosterona, em função direta do mecanismo de atuação dos IA. Com base nos estudos citados, não é possível fundamentar um valor limiar de testosterona a partir do qual seja aconselhável suspender o tratamento, diminuir a dose ou substituir o letrozol por anastrazol, que tem menor efeito sobre os níveis de testosterona. No entanto, estas atitudes devem ser ponderadas caso se verifiquem consequências da elevação da testosterona, nomeadamente policitemia, descida acentuada do colesterol‐HDL, acne grave e/ou alterações comportamentais.
Contexto de aplicaçãoO protocolo proposto deverá ser aplicado preferencialmente para a prescrição off‐label no contexto de ensaio clínico, a desenhar e implementar a nível institucional. A sua aplicação deverá ser condicionada face às normas éticas válidas para qualquer ensaio clínico. Deverá ser disponibilizada aos pais a informação oral e escrita necessária ao indispensável consentimento informado.
Conflito de interesesOs autores declaram não haver conflito de interesses.