A osteoporose é a doença metabólica do osso mais frequente, afetando sobretudo mulheres pós‐menopausa e homens idosos.
ObjetivoResponder a 12 questões referentes ao diagnóstico e tratamento da osteoporose.
MétodosPesquisa bibliográfica na base de dados Medline. Revistas às referências bibliográficas dos artigos selecionados e pesquisadas para inclusão as de maior relevo.
Conclusões1 ‐ O que é? Caracteriza‐se por diminuição da massa óssea e deterioração da microarquitectura, com aumento da fragilidade óssea e do risco de fraturas. 2 ‐ Qual é a clínica? Clinicamente silenciosa até à ocorrência de fraturas. 3 ‐ Quais os fatores de risco? O principal fator é uma densidade mineral óssea baixa (avaliada por absorciometria radiológica de energia dupla [DXA]), mas outros contribuem para o risco total de fratura. 4 ‐ Quais as causas secundárias? Doenças metabólicas, endocrinológicas, gastrointestinais, do tecido conjuntivo ou fármacos. São mais comuns em mulheres pré‐menopausa e homens. 5 ‐ Quem rastrear? Devem ser avaliados quanto à presença de fatores de risco todos os indivíduos com mais de 50 anos. 6 ‐ Como rastrear? Identificar fatores de risco clínicos que impliquem realização de DXA. 7 ‐ Com que periodicidade repetir DXA? Varia com o resultado do teste prévio e probabilidade de perda óssea. 8 ‐ Como avaliar? Avaliar todos os doentes clínica e laboratorialmente para excluir causas secundárias e selecionar o tratamento mais adequado. Alguns podem necessitar de exames específicos. 9 ‐ Quem tratar? O tratamento está indicado conforme o risco de fratura (calculado através da ferramenta FRAX®). 10 ‐ Como tratar? Estão indicadas medidas de prevenção primária, a iniciar na infância. Diversos fármacos têm demonstrado eficácia, sendo abordadas as indicações para cada um. 11 ‐ Quanto tempo tratar? Permanece incerta a duração ótima, sugerindo‐se o conceito de “drug holiday”. 12 ‐ Como monitorizar? Realizar DXA 1‐2 anos após o inicio do tratamento. Biomarcadores ósseos, apesar de promissores, ainda não estão recomendados.
Osteoporosis is the most common metabolic bone disease, affecting mainly postmenopausal women and older men.
AimAnswer to 12 key questions regarding osteoporosis diagnosis and treatment.
MethodsLiterature search in Medline database. References of the selected articles were revised and the most relevant articles were also included.
Conclusions1 ‐ What is osteoporosis? It is characterized by low bone mass and deterioration of microarchitecture, with increased bone fragility and risk of fractures. 2 ‐ What are the clinical manifestations? It is clinically silent until fracture occurs. 3 ‐ What are the risk factors? The main factor is low bone mineral density (assessed by dual energy X‐ray absorptiometry ‐ DXA), but others contribute to the overall risk of fracture. 4 ‐ What are the secondary causes? Metabolic, endocrine, gastrointestinal, connective tissue diseases or drugs. They are more common in premenopausal women and men. 5 ‐ Who should be screened? All individuals over 50 years should be evaluated for the presence of clinical risk factors. 6 ‐ How to screen? By identification of risk factors that suggest performing DXA. 7 ‐ How frequently should DXA be repeated? It varies with the result of the previous test and the probability of bone loss. 8 ‐ How to evaluate osteoporotic patients? Evaluate all patients clinically and perform exams to exclude secondary causes and select the most appropriate pharmacological treatment. Some may require specific tests. 9 ‐ Who should be treated? The treatment is indicated according to the risk of fracture (calculated by FRAX® tool). 10 ‐ How to treat? Primary prevention measures are recommended since childhood. Several drugs have demonstrated efficacy, being addressed the indications to each of them. 11 ‐ How long to treat? The optimal duration remains uncertain, being suggested the concept of “drug holiday”. 12 ‐ How to monitor? Perform DXA 1 to 2 years after starting treatment. Bone biomarkers, although promising, are not recommended.
A osteoporose (OP) – uma doença caracterizada por diminuição da massa óssea e deterioração da microarquitectura do tecido ósseo, aumento da fragilidade óssea e risco aumentado de fraturas – é a doença metabólica do osso mais frequente, constituindo um problema de saúde global1. Em 2000, o NIH definiu conceptualmente OP como doença esquelética caracterizada por compromisso da resistência óssea, predispondo para um maior risco de fratura2. Sendo uma doença que afeta sobretudo mulheres pós‐menopausa e homens idosos, e tendo em conta o envelhecimento da população, espera‐se que o número de doentes com OP venha a aumentar nos próximos anos. Neste artigo, procura‐se rever de uma forma sucinta os principais aspetos relativos ao diagnóstico e tratamento da OP, respondendo, para isso, a 12 questões fundamentais na prática clínica.
MétodosPara a realização desta revisão bibliográfica, foi efetuada pesquisa na base de dados de literatura internacional Medline de artigos publicados em inglês e português, sob o termo Mesh «osteoporose». Os artigos foram selecionados inicialmente pela leitura do título e resumo. Dos artigos selecionados para inclusão, foram ainda revistas manualmente as referências bibliográficas e também incluídas as de maior relevância. Foram também utilizadas as principais recomendações europeias e americanas sobre OP. As normas de orientação clínica publicadas pela Direção Geral de Saúde foram igualmente consultadas, sendo referenciadas ao longo do artigo. Assim, na realização desta revisão, foram incluídas 40 publicações em inglês e 3 publicações em português.
O que é a osteoporose?O esqueleto está em constante renovação ao longo da vida. Durante a infância e a adolescência ocorrem alterações no tamanho, forma e composição dos ossos, seguido de um período de consolidação até se atingir o pico de massa óssea, geralmente por volta da 3a década de vida. Após isto, torna‐se dominante o processo de remodelação óssea, no qual há reabsorção de osso antigo e deposição de osso novo. Este processo é mediado por osteoblastos e por osteoclastos e regulado por várias hormonas sistémicas, assim como por reguladores locais (o RANKL – receptor activator of nuclear factor kappa‐B ligand – e a osteoprotegerina). Os osteoblastos e células estromais por ação de hormonas sistémicas, fatores de crescimento e citocinas produzem o RANKL que, ao ligar‐se ao seu recetor, promove a osteoclastogenese e estimula a reabsorção óssea. Por outro lado, os osteoblastos e células estromais produzem osteoprotegerina, a qual, sendo um recetor armadilha, impede a ligação do RANKL ao seu recetor, impedindo a formação, ativação e sobrevivência dos osteoclastos e favorecendo a formação óssea. O predomínio de um destes reguladores em relação ao outro determina qual o processo predominante – formação ou reabsorção3.
Além dos osteoclastos e osteoblastos, um terceiro tipo de célula está envolvido neste processo de remodelação óssea – osteócitos, os quais são osteoblastos com diferenciação final. De facto, o seu papel permaneceu desconhecido durante muito tempo e foi possivelmente subestimado4. Atualmente sabe‐se que são importantes coordenadores do processo de remodelação óssea. Estão localizados em lacunas na matriz óssea e apresentam extensões citoplasmáticas, que permitem a comunicação entre si e com células da superfície óssea (osteoblastos e osteoclastos) – sistema lacuno‐canalicular. Formam uma rede de células com capacidade de detetar pressões mecânicas e emitir sinais específicos (modulando a expressão e secreção de várias moléculas como insulin‐like growth factor [IGF] – I e II, osteocalcina, esclerostina, c‐fos, prostaglandinas, prostanoides e óxido nítrico) para as células na superfície óssea. Além disso, os osteócitos parecem ser igualmente importantes durante a sua apoptose. No osso podem ocorrer microfissuras, que criam interrupções do sistema lacuno‐canalicular. Verifica‐se um aumento da expressão de moléculas pró‐apoptóticas nos osteócitos nas imediações das microfissuras, comparativamente com os osteócitos afastados. O osteócito em apoptose pode emitir uma mensagem sinalizadora, transmitida pelo sistema lacuno‐canalicular, para as células da superfície óssea e células progenitoras, estimulando o ciclo de reabsorção/formação ósseas. Pensa‐se que as zonas formadas por osso «antigo», altamente mineralizadas, sejam mais sujeitas a microfissuras e que, desta forma, o processo de remodelação desencadeado pelos osteócitos possibilite o desaparecimento das microfissuras que enfraquecem o osso e a substituição por osso novo com propriedades mais favoráveis. A apoptose dos osteócitos em torno de microfissuras funciona como um sinalizador para os osteoclastos, promovendo o início da reabsorção óssea. Uma explicação alternativa baseia‐se na possibilidade de osteócitos vivos atuarem como inibidores da reabsorção pelos osteoclastos através da expressão de osteoprotegerina e outros inibidores dos osteoclastos. Pode ocorrer ainda ativação direta do processo de remodelação, resultante da expressão do RANKL pelos osteócitos. Os osteócitos desempenham ainda um papel major na homeostasia do fosfato, importante para a mineralização óssea, pela secreção de fatores como o fibroblast growth factor (FGF) 234.
No adulto, a existência de diminuição da densidade mineral óssea (DMO) e fragilidade esquelética pode ser resultante de um baixo pico de massa óssea, de uma perda óssea excessiva ou ambos3. Ocorre perda óssea excessiva quando há um desequilíbrio entre a reabsorção e a formação ósseas, o que se verifica sobretudo em associação com a menopausa e o envelhecimento5. Nos 3‐5 anos que precedem o último cataménio, a taxa de remodelação óssea acelera, uma vez que as alterações hormonais estimulam a produção de RANKL, voltando a desacelerar 3‐5 anos depois. Com esta taxa acelerada, o equilíbrio ósseo é perturbado e, em média, ocorre uma perda óssea de cerca de 1% por ano3. No caso da perda óssea associada ao envelhecimento, embora envolva o mesmo desequilíbrio a nível das unidades de remodelação óssea, o processo iniciador não é tão claro. Tem início por volta da 6a década de vida e processa‐se a uma taxa mais lenta (cerca de 0,5% por ano)3.
Qual é a clínica da osteoporose?A OP é uma doença silenciosa até ser complicada pela ocorrência de fraturas, as quais ocorrem quando o osso enfraquecido é sobrecarregado por traumatismos de baixo impacto, como quedas da própria altura (fraturas de fragilidade nos ossos longos) ou durante certas atividades da vida diária sem queda ou lesão específica, como no caso de fraturas de compressão vertebral3,5. Neste último caso, uma perda significativa de estatura (história de perda de estatura superior a 4cm nas mulheres ou superior a 6cm nos homens; perda prospetiva de 2cm nas mulheres ou 3cm nos homens), o desenvolvimento progressivo de cifose, ou de dor aguda sugestiva de fratura compressiva, deve levar a uma avaliação imagiológica da coluna vertebral3,6. As fraturas osteoporóticas podem ocorrer em qualquer local do esqueleto, mas mais frequentemente atingem as vértebras, o fémur proximal e o antebraço distal5. As fraturas do úmero proximal também podem ser englobadas neste grupo, dado que a probabilidade de um doente com OP ter uma fratura a este nível é 7 vezes superior quando comparado com indivíduos sem OP7. Quando avaliado por género, verifica‐se que no sexo feminino as fraturas a nível do antebraço distal são as mais frequentes (24% antebraço, 21% anca, 16% vértebras, 10% úmero, 29% outras), enquanto no sexo masculino as fraturas vertebrais são o tipo mais frequente (16% vértebras, 14% anca, 10% antebraço, 5% úmero, 55% outras)8.
O risco de desenvolver uma fratura osteoporótica ao longo da vida varia entre 30‐40%, sendo muito próximo do risco de desenvolver doença coronária9. Em alguns casos, pode haver recuperação completa mas, na maioria das vezes, a recuperação é lenta e incompleta, deixando sequelas como dor crónica e deformidade, que condicionam limitação funcional e incapacidade3,5. As fraturas da anca são aquelas que causam maior morbilidade e mortalidade. Cerca de 50% dos doentes que deambulavam não são capazes de o fazer um ano após a fratura3,9,10. Em homens e mulheres idosos, a taxa de mortalidade global está aumentada cerca de 5‐8 vezes durante os primeiros 3 meses após fratura da anca, persistindo o risco de mortalidade mais precoce associado à fratura aumentado por 5‐10 anos, embora tendendo a diminuir gradualmente com o tempo11,12.
As fraturas vertebrais são o tipo mais frequente e a sua ocorrência indica sempre um alto risco para futuras fraturas3,13. Como tal, os doentes com fraturas vertebrais frequentemente apresentam fraturas recorrentes, aumentando a incapacidade à medida que aumenta o número de fraturas11. Além das complicações já referidas para as fraturas osteoporóticas em geral, a ocorrência de múltiplas fraturas vertebrais torácicas pode resultar em doença pulmonar restritiva, assim como múltiplas fraturas lombares podem alterar a anatomia abdominal, levando a obstipação, dor abdominal e saciedade precoce5. Também se associam a aumento da mortalidade, a qual aumenta com o tempo após o diagnóstico de fratura3,12. No caso das fraturas do punho, embora associadas também a dor e perda da função durante a fase aguda, podendo interferir igualmente em atividades diárias específicas, geralmente a recuperação é completa5,11.
Quais são os fatores de risco?Densidade mineral óssea baixaPor definição, a OP é uma doença esquelética caracterizada por um compromisso da resistência óssea, a qual reflete a integração de 2 propriedades: a densidade e a qualidade ósseas. Atualmente, ainda não existem métodos clínicos disponíveis para avaliar a qualidade óssea, pelo que a medição da DMO constitui a técnica primária para o diagnóstico de OP pré‐fratura, para a monitorização do tratamento e para a previsão quanto ao risco de futuras fraturas3,11. No entanto, a ocorrência de uma fratura de fragilidade é suficiente para fazer um diagnóstico clinico de OP, independentemente do valor da DMO3.
Atualmente existem disponíveis várias técnicas para determinar a DMO, sendo a absorciometria radiológica de energia dupla (DXA) considerada a técnica padrão5,11. A DXA utiliza uma quantidade de radiação muito inferior à utilizada numa radiografia convencional e é bastante versátil, permitindo avaliar vários locais esqueléticos. No entanto, são usados para o diagnóstico e classificação os valores da coluna lombar e do fémur proximal (DXA central), uma vez que estes são locais onde há uma maior proporção de osso trabecular e onde, consequentemente, a perda óssea é mais rápida13. Os resultados são apresentados em valores absolutos (em g/cm2) e através de 2 pontuações (scores), que representam desvios‐padrão (DP) em relação a um valor médio de DMO: T‐score, que compara a DMO individual com o valor médio de indivíduos jovens normais; Z‐score, que compara a DMO individual com a DMO esperada para a idade e para o sexo6.
Com base no T‐score, um grupo de peritos da OMS estabeleceu uma definição operacional de OP (tabela 1). Estes critérios definidos com base no T‐score aplicam‐se a mulheres pós‐menopausa e homens com ≥50 anos. No caso das mulheres pré‐menopausa e homens com <50 anos, a International Society for Clinical Densitometry recomenda a utilização do Z‐score (considerando DMO inferior à esperada para a idade e género quando inferior a –2,0DP)6. Por cada DP que diminui na DMO ajustada para a idade e género, o risco total de fratura aumenta em cerca de 1,5‐3 vezes11. A DMO da anca é aquela que melhor prevê o risco de fratura da anca, mas uma DMO diminuída em qualquer ponto do esqueleto prediz fratura potencial não só naquele sítio como em qualquer outro local3. No entanto, a utilização da DXA apresenta algumas limitações: a presença de osteomalacia pode subestimar a matriz óssea total devido a uma diminuição na mineralização óssea; por outro lado, a presença de osteófitos da osteoartrose ou osteoartrite, situações comuns nos idosos, contribuem para a densidade medida, mas não necessariamente para a resistência esquelética, interferindo assim nos resultados obtidos11.
Definição operacional segundo a OMS
| T‐score | Classificação |
| ≥–1DP | Normal |
| –2,5DP a –1DP | Baixa densidade mineral óssea |
| ≤–2,5DP | Osteoporose |
| ≤–2,5DP+fratura de fragilidade | Osteoporose grave |
Adaptado de National Osteoporosis Foundation5.
Embora a DXA seja considerada a técnica padrão para o diagnóstico de OP, a maioria dos indivíduos em que ocorre uma fratura de fragilidade apresentam valores de DMO acima do limiar de OP (DMO baixa ou normal), implicando a existência de outros fatores interferentes no risco de fratura9,14,15. Várias outras características esqueléticas, como a geometria óssea, microarquitectura, mineralização, remodelling e microdano ósseo, influenciam a resistência óssea e são, no global, designados por qualidade óssea. No entanto, a avaliação clínica da qualidade óssea não está tão facilmente acessível quanto a avaliação da DMO. No caso da microarquitectura óssea e remodelling, podem ser avaliadas por biópsia óssea, através de histomorfometria e tomografia microcomputorizada. No entanto, para tal é necessária a realização de biópsia da crista ilíaca, que é um procedimento invasivo e de acessibilidade limitada, sendo atualmente usado primariamente como método de investigação. Como alternativa, várias modalidades imagiológicas têm demonstrado ser capazes de medir a geometria, microarquitetura e resistência ósseas (tomografia computorizada quantitativa, tomografia computorizada quantitativa periférica de alta resolução, ressonância magnética de alta resolução). No entanto, comparativamente com a DXA, estas técnicas têm custo elevado e acesso limitado, além de exporem os indivíduos a maiores quantidades de radiação ionizante15.
Numa tentativa de incorporar na prática clínica uma tecnologia não‐invasiva e de fácil acesso, que permitisse melhorar a predição do risco de fratura, foi desenvolvido o trabecular bone score (TBS), que é um índice de textura derivado da imagem de DXA da coluna lombar e que avalia variações nos níveis de cinzento (pixels) da imagem a duas dimensões (2D), fornecendo assim um índice indireto da microarquitetura trabecular. Deste modo, uma estrutura trabecular densa produzirá uma imagem 2D com grande número de variações de pequena amplitude no valor‐pixel, associando‐se a um valor TBS alto, enquanto a projeção 2D de uma arquitetura óssea deteriorada produz uma imagem com um baixo número de variações de valor‐pixel de grande amplitude, associando‐se a um baixo TBS. Os resultados deste índice (expresso sem unidade) são fornecidos para cada vértebra e também para a coluna lombar total (L1‐L4), podendo as vértebras anormais (fraturadas ou com osteoartrite) ser excluídas da análise, à semelhança do que é feito com a medição da DMO15.
Apesar de não ser uma medida direta da microarquitetura trabecular, o TBS poderá melhorar a predição do risco de fratura atendendo às correlações encontradas em estudos ex‐vivo com medidas de microarquitetura trabecular (densidade de conectividade, número de trabéculas e separação entre trabéculas). Estudos em mulheres pós‐menopausa e homens idosos têm demonstrado, consistentemente, que um baixo TBS se associa a um aumento do número de fraturas prevalentes e incidentes. De um modo geral, a diminuição de um DP no TBS confere um aumento de 20‐50% no risco de fratura vertebral, anca e fratura de fragilidade total em mulheres pós‐menopausa e confere um aumento de 30‐40% no risco de fratura da anca e fraturas osteoporóticas major em homens idosos15. Em alguns dos estudos, esta associação entre TBS e risco de fratura foi independente da DMO determinada por DXA central e de fatores de risco clínicos, suportando o uso do TBS para avaliar o risco de fratura vertebral, anca e osteoporótica major em mulheres pós‐menopausa e para avaliar o risco de fratura da anca e fratura osteoporótica major em homens com mais de 50 anos6,15. O seu uso em mulheres pré‐menopausa ou homens com menos de 50 anos não pode para já ser recomendado por falta de estudos publicados15.
Atendendo à influência dos tecidos moles abdominais sobre a região de interesse para avaliação do TBS, este não deve ser determinado em indivíduos com índice de massa corporal inferior a 15kg/m2 ou superior a 37kg/m215.
Começa a ser também possível avaliar o processo de remodelação óssea através do doseamento de biomarcadores (BMO) séricos, que são resultantes do metabolismo ósseo2. Constituem uma forma dinâmica de avaliação da atividade esquelética e incluem: fosfatase alcalina óssea e osteocalcina (índices de formação óssea); piridinolinas e deoxipiridinolinas urinárias, e telopeptídeo do colagénio tipo I séricos e urinários (índices de reabsorção óssea)2,16,17. Refletem mudanças na remodelação óssea que ocorrem num intervalo de tempo relativamente curto (vários dias a meses), antes que seja possível detetar alterações na DMO2. No entanto, embora avaliem o equilíbrio entre a formação e a reabsorção óssea e estejam geralmente inversamente relacionados com a DMO, as correlações não são suficientemente fortes, sendo influenciadas por vários fatores: biológicos não modificáveis (idade, sexo, etnia, fratura em cicatrização, função hepática e renal e outras doenças associadas); factores relacionados com alimentação, exercício, ritmo circadiano e variações sazonais; e factores inerentes à própria técnica16,17. Assim, tendo em conta a alta variabilidade, a baixa capacidade preditiva para o doente individual e a falta de limiares para a tomada de decisões clínicas, por enquanto não está recomendada a sua utilização na prática clínica3,11.
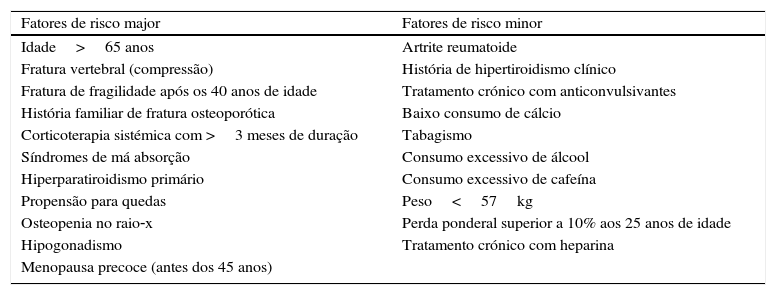
Fatores de risco clínicoEmbora a determinação da DMO seja a técnica padrão para identificar os indivíduos com OP, como já referido não é suficiente para a determinação do risco total de fratura3. Além dos aspetos da DMO e da qualidade óssea, fatores de risco clínicos aumentam o risco de fratura15. De facto, um grande número de outros fatores de risco clínicos tem sido identificado através de estudos epidemiológicos, os quais podem ser reconhecidos durante a avaliação clínica, facilitando a identificação dos indivíduos em risco (tabela 2)11,12,18. Estes fatores de risco podem influenciar diretamente a DMO ou aumentar o risco de fratura de forma independente. Os fatores que interferem com a DMO são na sua maioria genéticos, no entanto, fatores relacionados com o estilo de vida não devem ser subestimados. Inatividade física e dieta com um aporte insuficiente de cálcio, fósforo e vitamina D comprometem a formação e mineralização ósseas, assim como aumentam a reabsorção óssea. Em indivíduos com um consumo inadequado destes nutrientes, a massa óssea e a força diminuem, aumentado o risco de fratura, assim como diminui a massa e força musculares, comprometendo a função neuromuscular e o equilíbrio, levando a um aumento do risco de quedas19. Estão particularmente em risco para défice de cálcio indivíduos com síndromes de má absorção intestinal, sob corticosteroides ou anticonvulsivantes, com diminuição da secreção ácida gástrica (pós‐bypass gástrico, anemia perniciosa, uso de inibidores da bomba de protões) e doença renal crónica. Os indivíduos alectuados/diminuição da mobilidade, com síndromes de má absorção intestinal e sob corticosteroides ou anticonvulsivantes estão em maior risco para défice de vitamina D3. Outros fatores parecem influenciar o risco de fratura de forma independente do valor da DMO. Por exemplo, a idade é um fator de risco independente da DMO, uma vez que para um mesmo valor de T‐score o risco de fratura é muito superior num individuo mais idoso11,16. Além disso, fatores relacionados com a predisposição para quedas e o próprio mecanismo da queda também influenciam o risco de fratura2,18. Assim, a identificação dos indivíduos em risco através da determinação de fatores clínicos é crucial numa estratégia “procura de casos”, permitindo uma melhor avaliação do risco de fratura e uma utilização mais adequada da DXA9,11.
Fatores de risco clínicos
| Fatores de risco major | Fatores de risco minor |
| Idade>65 anos | Artrite reumatoide |
| Fratura vertebral (compressão) | História de hipertiroidismo clínico |
| Fratura de fragilidade após os 40 anos de idade | Tratamento crónico com anticonvulsivantes |
| História familiar de fratura osteoporótica | Baixo consumo de cálcio |
| Corticoterapia sistémica com >3 meses de duração | Tabagismo |
| Síndromes de má absorção | Consumo excessivo de álcool |
| Hiperparatiroidismo primário | Consumo excessivo de cafeína |
| Propensão para quedas | Peso<57kg |
| Osteopenia no raio‐x | Perda ponderal superior a 10% aos 25 anos de idade |
| Hipogonadismo | Tratamento crónico com heparina |
| Menopausa precoce (antes dos 45 anos) |
Adaptado de Kanis18.
Além da perda de massa óssea associada à menopausa ou ao envelhecimento (OP primária tipo I e tipo II), esta pode ocorrer devido a uma variedade de doenças crónicas ou medicações que afetam negativamente o metabolismo ósseo (OP secundária)13,20. As causas mais comuns (tabela 3) parecem variar de acordo com as características demográficas. No sexo masculino, em 30‐60% dos casos de OP há uma causa secundária identificável, sendo as mais comuns o hipogonadismo, os glicocorticoides e o alcoolismo. Nas mulheres na perimenopausa, 50% dos casos estão associados a causas secundárias, sendo as mais comuns o hipogonadismo, a tireotoxicose e os anticonvulsivantes. No caso das mulheres pós‐menopausa, a prevalência das causas secundárias é muito menor2. Como pode haver sobreposição entre formas primárias e secundárias, a sua presença deve ser sempre considerada, particularmente porque muitas das causas secundárias têm tratamentos específicos21.
Causas secundárias de OP
| Endócrinas ou metabólicas | Acromeglia, diabetes mellitus, deficiência de GH, hipercortisolismo, hiperparatiroidismo, hipertiroidismo, hipogonadismo, hipofosfatemia, porfiria, gravidez |
| Nutricionais ou gastrointestinais | Alcoolismo, anorexia nervosa, deficiência de cálcio e de vit. D, doença hepática crónica, síndromes de má absorção (incluindo doença celíaca, doença Crohn, resseção gástrica ou bypass), nutrição parentérica total |
| Fármacos | Glicocorticoides, inibidor da bomba de protões, anticoagulantes (heparina, varfarina), anticonvulsivantes, antiepilépticos, acetato medroxiprogesterona, inibidores selectivos da recaptação da serotonina, agonistas do GnRH, glitazonas, hormonas tiroideias em doses suprafisiológicas, excesso de vit. A, inibidores da aromatase, terapêutica de privação de androgénios, imunossupressores, quimioterapia, lítio |
| Distúrbios do metabolismo do colagénio | S. Ehlers‐Danlos, homocistinúria devido a deficiência de cistationina, S. Marfan, osteogenese imperfecta |
| Outros | SIDA/VIH, espondilite anquilosante, DPCO, doença Gaucher, hemofilia, hipercalciúria, imobilização, depressão major, mieloma e algumas neoplasias, transplante de órgãos, insuficiência renal crónica, acidose tubular renal, artrite reumatoide, mastocitose sistémica, talassemia |
Adaptado de AACE Osteoporosis Task Force3.
Embora a perda óssea seja assintomática, a OP pode ser diagnosticada e tratada antes de ocorrer uma fratura. Durante esta fase assintomática, o diagnóstico baseia‐se na determinação da DMO. No entanto, só deve ser considerada a sua realização quando se considera que esta possa auxiliar na tomada de decisão quanto à necessidade de iniciar tratamento farmacológico2. Deste modo, todas as mulheres e homens com mais de 50 anos devem ser avaliados clinicamente para determinar a presença de fatores de risco para OP, de modo a decidir quanto à necessidade de avaliar a DMO por DXA3,5.
Como rastrear?Os indivíduos com um ou mais fatores de risco clínicos deverão ser submetidos a uma determinação da DMO com DXA3,11. Segundo a NOF, a realização de DXA está indicada em mulheres com idade ≥65 anos e homens com idade ≥70 anos. Nas mulheres pós‐menopausa com menos de 65 anos, mulheres perimenopausa e homens entre os 50‐69 anos, a realização de DXA está indicada quando estão presentes fatores de risco para fratura (um fator de risco major ou 2 fatores de risco minor). Está ainda indicada a sua realização para rastreio em adultos com doença/sob terapêutica associadas a baixa massa ou perda óssea (tabela 4)5,22. Estas são também as recomendações apontadas pela Direção Geral da Saúde22. A realização de DXA está também indicada em adultos com fratura de fragilidade. Nestes casos, uma vez que já há um diagnóstico clínico de OP, a determinação do valor da DMO destina‐se sobretudo à obtenção de um valor basal para posterior monitorização3,5.
Indicações para realização de DXA (segundo NOF)
| Mulheres com ≥65 anos e homens com ≥70 anos, independentemente da presença/ausência de fatores de risco clínicos |
| Mulheres pós‐menopausa com <65 anos, mulheres perimenopausa e homens entre os 50‐69 anos que tenham fatores de risco para fratura |
| Adultos com doença/sob terapêutica associada a baixa massa ou perda óssea |
| Adultos com fratura após os 50 anos |
Adaptado de National Osteoporosis Foundation5.
Após uma primeira avaliação dentro da normalidade, a frequência da reavaliação da DMO depende dos resultados do teste inicial e da probabilidade de perda óssea clinicamente significativa3. Se o T‐score na primeira avaliação for muito acima do limite inferior do normal, a DXA pode ser repetida em 5‐10 anos, uma vez que a probabilidade de transição para valores compatíveis com OP é baixa3,23. Se o T‐score estiver no limite inferior do normal, a DXA deverá ser repetida em 3‐5 anos3. No entanto, este intervalo pode ser encurtado se estiverem presentes fatores de risco que o justifiquem.
Segundo a norma de orientação clínica da Direção Geral de Saúde, os indivíduos com mais de 65 anos que apresentem uma DXA com resultado normal não necessitam de repetir o exame. No caso de a primeira DXA ter sido realizada em mulheres perimenopausa e ter um valor normal, esta só deverá ser repetida após os 65 anos. Se a primeira avaliação por DXA tiver revelado osteopenia, o exame só deverá ser repetido 5 anos depois22. Além disso, tendo em conta que o intervalo de tempo estimado até desenvolver OP vai encurtando com o aumento da idade, o intervalo de reavaliações também poderá ser encurtado à medida que a idade avança, particularmente mulheres com mais de 85 anos23. Nos casos em que o T‐score está próximo do limiar de intervenção, a DXA deverá ser repetida em 1‐2 anos3. Após cada reavaliação, o intervalo de tempo até nova DXA deve ser ajustado tendo em conta o novo resultado obtido24.
Como avaliar os doentes com osteoporose?Uma vez estabelecido o diagnóstico de OP e antes de iniciar qualquer tipo de tratamento, deverá ser realizada uma avaliação médica abrangente em todos os doentes, independentemente da presença/ausência de fraturas prévias. Esta avaliação tem por objetivo excluir doenças que mimetizem a OP (osteomalacia, mielomatose), identificar situações que causam/contribuem para a perda óssea, avaliar a gravidade, selecionar o tipo de tratamento mais adequado, obter valores basais para monitorizar a resposta ao tratamento e determinar o prognóstico (risco de futuras fraturas)18.
Esta avaliação tem por base a realização de uma história clínica e exame físico aprofundados, com particular destaque para potenciais fármacos e sinais de doenças subjacentes. A investigação subsequente terá por base os achados obtidos. A probabilidade de se identificar uma causa secundária é maior entre as mulheres pré‐menopausa e em homens, mas uma avaliação para exclusão de situações simples, comuns e potencialmente tratáveis, está indicada em todos os doentes25. A avaliação inicial deve incluir realização de hemograma completo, velocidade de sedimentação ou proteína C‐reativa, creatinina sérica, perfil hepático com GGT, cálcio sérico (total corrigido para albumina ou ionizado), fosfatase alcalina, glicose, 25‐hidroxivitamina D e função tiroideia, permitindo detetar mais de 90% dos distúrbios secundários que, de outra forma, seriam assintomáticos3,21,25,26. Além desta avaliação inicial, deverá ser considerada em cada caso a avaliação dos níveis de fósforo sérico, paratormona e excreção de cálcio em urina de 24 horas. Exames mais específicos podem estar indicados se estiverem presentes achados clínicos sugestivos (tabela 5)3,21,25,26. Caso os resultados sejam normais, mas a gravidade da OP seja incomum para a idade e sexo, podem igualmente estar indicados exames complementares adicionais, inclusive biópsia óssea3,21,25,26.
Avaliação laboratorial de rotina/exclusão de causas secundárias nos doentes com osteoporose
| 1 ‐ História clínica (avaliação detalhada de fármacos)+exame físico | ||
| 2 ‐ Avaliação basal em todos os doentes | Hemograma completo, velocidade de sedimentação ou proteína C reativa, creatinina sérica, perfil hepático, fosfatase alcalina, cálcio sérico (total corrigido para albumina ou ionizado), glicose, função tiroideia, 25‐hidroxivitamina D | |
| 3 ‐ Considerar | Excreção urinária de cálcio (urina 24); paratormona, fósforo | |
| 4 ‐ Se suspeita de: | ‐ S. Cushing: cortisol livre urinário, prova de frenação noturna com dexametasona | |
| ‐ Hemocromatose: ferro, ferritina, transferrina, saturação de transferrina | ||
| ‐ Doença celíaca: anticorpos antiendomísio, antitransglutaminase, antigliadina | ||
| ‐ Mieloma múltiplo: eletroforese proteínas séricas e/ou urinárias; cadeias leves | ||
| ‐ Mastocitose: triptase sérica, N‐metilhistamina urinária | ||
| Mulher pré‐menopausa: | Homens: | |
| • LH, FSH, estrogénio | • LH, FSH, testosterona total e livre, SHBG | |
| • Exclusão de doenças reumatológicas (ex: LES) | • PSA | |
| • Anorexia nervosa | ||
| 5 ‐ Biópsia óssea | ||
A decisão de iniciar tratamento farmacológico tem por base o risco de fratura. Tendo em conta a grande prevalência de indivíduos com baixa DMO (osteopenia) em relação aos indivíduos com OP, a maioria das fraturas ocorre no primeiro grupo devido ao maior número de indivíduos em risco. Deste modo, as decisões terapêuticas devem incorporar outros fatores clínicos que contribuem para o risco de fratura, para além do valor da DMO27–29. Nenhum fator de risco isoladamente é suficiente para prever o risco total de fratura. Como tal, têm sido criadas ferramentas que procuram integrar vários fatores e, assim, calcular o risco total de fratura para um individuo em particular3. O Fracture Risk Assessment Tool (FRAX®), desenvolvida pela OMS em 2008, é uma ferramenta que permite calcular a probabilidade de fratura do fémur ou de fratura osteoporótica major (anca, vertebra, úmero, punho) em 10 anos, com base em: idade, sexo, índice de massa corporal, fratura prévia, história familiar de fratura da anca, tabagismo, consumo de álcool, medicação com corticosteroides, artrite reumatoide e outras causas secundárias de OP. A DMO do colo do fémur pode ser incluída para aumentar a previsão do risco de fratura. Uma vez que a probabilidade de fratura difere de forma marcada em diferentes regiões do mundo, a ferramenta FRAX® é calibrada para diferentes países, estando validada e disponível para utilização em Portugal9,11,14,29. No entanto, esta ferramenta apresenta algumas limitações como: não considerar o efeito dose‐resposta de alguns fatores de risco (n.° de fraturas prévias, tabaco, álcool, corticosteroides); usar apenas o T‐score do colo do fémur (nos indivíduos com baixa DMO a nível vertebral e DMO relativamente normal a nível da anca, pode subestimar o risco de fratura); não incluir outros fatores de risco para fratura, como fatores de risco de quedas; e não considerar os doentes que já efetuaram terapêutica antiosteoporótica5,11,16.
Com base na informação inicial obtida a partir dos fatores de risco clínicos, podem ser identificados 3 grupos de doentes. Em alguns casos, são identificados indivíduos de alto risco clínico para os quais está automaticamente indicado iniciar tratamento, independentemente do valor da DMO (por exemplo, indivíduos com fratura de fragilidade prévia). No extremo oposto estão os indivíduos de baixo risco, para os quais não está sequer recomendada a realização de DXA. Entre estes 2 grupos, estão indivíduos de risco intermédio, para os quais é fundamental a realização de DXA e posterior integração dos vários fatores, calculando o risco de fratura através da ferramenta FRAX®11.
Atualmente, não existe evidência que suporte o uso do TBS como uma medida isolada que permita determinar a necessidade de tratamento, uma vez que, embora valores baixos de TBS se associem a um aumento do risco de fratura, ainda não foi definido um limiar que identifique os indivíduos de alto risco que possam beneficiar de tratamento. No entanto, dado que o TBS permite predizer o risco de fratura de forma independente da DMO e dos fatores de risco clínicos utilizados no FRAX®, poderá ser usado em associação ao FRAX® de modo a ajustar o risco de fratura calculado. Desde abril de 2014 que está disponível uma nova versão do FRAX® onde, após calcular a probabilidade de fratura incluindo a DMO, é possível selecionar a opção de ajustar para o TBS15.
Em suma, o tratamento farmacológico está indicado em doentes com fraturas da anca/vertebrais prévias; doentes com T‐score <–2,5DP a nível do colo do fémur ou vertebral, após exclusão de causas secundárias; e doentes com T‐score ‐2,5 a ‐1DP a nível do colo do fémur ou vertebral, com uma probabilidade de fratura da anca a 10 anos ≥3%, ou probabilidade de fratura osteoporótica major a 10 anos ≥20% (determinado através do FRAX®)3,5.
Como tratar?Medidas geraisA prevenção da OP deve iniciar‐se ainda na idade pediátrica13. De facto, a massa óssea alcançada precocemente na vida é talvez o mais importante determinante da saúde esquelética. Embora fatores genéticos (70‐80%) e fatores hormonais exerçam uma influência significativa no pico de massa óssea, os fatores ambientais (alimentação e exercício físico) também desempenham um papel essencial, sendo passiveis de ser modificados, de forma a otimizar o desenvolvimento esquelético/maximizar o pico de massa óssea, prevenir a perda óssea associada à idade/causas secundárias e preservar a integridade estrutural do esqueleto2,3,13.
Estas medidas de prevenção primária relacionadas com a alimentação, exercício físico, consumo de álcool e tabaco devem ser implementadas e promovidas precocemente na vida de um indivíduo, de forma a permitir um pico máximo de massa óssea, e adequadas às necessidades de cada faixa etária (tabela 6)30,31.
Medidas de prevenção primária
| Aporte adequado de cálcio |
|---|
| Crianças e adolescentes |
| DDR* (mg/dia): <6M ‐ 200; 7‐12M–260; 1‐3A–700; 4‐8A–1000; 9‐13A–1300; 14‐18A 1300 |
| Uso de suplementos em crianças saudáveis: sem efeito na DMO da anca ou coluna lombar e apenas pequeno efeito no membro superior (pouco provável que se traduza em reduções significativas do risco de fratura na infância ou mais tarde a vida) → não está recomendado o seu uso por rotina |
| Mulheres pré‐menopausa |
| DDR* (mg/dia): 19‐30A–1000; 31‐50A ‐ 1000 |
| Uso de suplementos: evidência insuficiente para recomendar o seu uso |
| Mulheres pós‐menopausa |
| DDR* (mg/dia): 51‐70A–1200; >70A ‐ 1200 |
| Uso de suplementos: indicados se não for possível aporte suficiente pela dieta (limitados a 500‐600mg/dia) |
| Homens |
| DDR* (mg/dia): 19‐30A–1000; 31‐50A–1000; 51‐70A–1000; >70A ‐ 1200 |
| Uso de suplementos: indicados se não for possível aporte suficiente pela dieta (limitados a 500‐600mg/dia) |
| Aporte adequado de vitamina D |
| Crianças e adolescentes |
| DDR* (UI/dia): <6M ‐ 400; 7‐12M–400; 1‐3A–600; 4‐8A–600; 9‐13A–600; 14‐18A–600 |
| Uso de suplementos: pode permitir melhorias clinicamente úteis na DMO em crianças com défice de vitamina D se as pequenas melhorias verificadas na DMO se mantiverem com a suplementação contínua |
| Mulheres pré‐menopausa |
| DDR* (UI/dia): 19‐30A–600; 31‐50A ‐ 600 |
| Uso de suplementos: evidência insuficiente para recomendar o seu uso |
| Mulheres pós‐menopausa |
| DDR* (UI/dia): 51‐70A–600; >70A ‐ 800 |
| Uso de suplementos: indicados se deficiência ou risco de níveis baixos de vitamina D (1.000‐2.000UI/dia) |
| Homens |
| DDR*(UI/dia): 19‐30A–600; 31‐50A–600; 51‐70A–600; >70A ‐ 800 |
| Uso de suplementos: evidência insuficiente para recomendar o seu uso |
| Outras medidas alimentares |
| Dieta equilibrada |
| Fruta e vegetais: efeitos benéficos por induzir alcalose ligeira; fonte de vitamina K, vitamina C, antioxidantes e fitoestrogénios) – evidência limitada a estudos observacionais |
| Consumo excessivo de sal (influenciando a excreção de cálcio) e bebidas gaseificadas (por redução do aporte de leite em alternativa ou por efeito independente no risco de fraturas |
| Exercício físico |
| Crianças e adolescentes |
| Atividades de carga são eficazes em melhorar a massa óssea, particularmente em crianças na pré‐puberdade, e será mais eficaz e naquelas com aporte mais alto de cálcio |
| Mulheres pré‐menopausa |
| Podem ser recomendados exercícios de impacto, embora efeitos modestos |
| Mulheres pós‐menopausa |
| Diferentes tipos de exercício têm efeitos benéficos em diferentes locais anatómicos. Programadas multimodais parecem ter efeito superior em aumentar ligeiramente a DMO e reduzir o risco de quedas e fraturas |
| Homens |
| Treino de resistência (isolado ou combinado com treino de carga de alto impacto) é eficaz em preservar ou atrasar o declínio da DMO |
| Nota: frequência, intensidade e duração ótimas – ainda não definidas |
| Consumo moderado de álcool |
| Uma bebida/dia – mulheres; 2 bebidas/dia – homens |
| Evicção tabágica |
*DDR: dose diária recomendada, de acordo com Institute of Medicine; M: meses; A: anos.
Um consumo adequado de cálcio é necessário para a aquisição do pico de massa óssea e a manutenção subsequente da saúde óssea5. No entanto, em média, o consumo dos adultos é cerca de metade do recomendado. Além disso, as necessidades de cálcio aumentam com a idade4. Assim, está recomendado um consumo de 1.200mg/dia para as mulheres pós‐menopausa3,5,11,31. Os doentes com consumo insuficiente devem alterar os seus hábitos alimentares (os produtos lácteos são uma fonte rica em cálcio, por exemplo, em 250mL de leite estão presentes cerca de 300mg de cálcio; alguns produtos hortofrutícolas, como a couve galega ou a couve lombarda, são excelentes fornecedores de cálcio) ou receber suplementos de cálcio (carbonato de cálcio; citrato de cálcio)3. Suplementação com doses superiores a 1.200‐1.500mg/dia tem benefício potencial limitado e pode aumentar o risco de desenvolver nefrolitíase ou doenças cardiovasculares5. A maioria dos adultos saudáveis apresenta também níveis séricos de 25‐hidroxivitamina D inferiores ao desejável, estando particularmente em risco de deficiência os doentes com mobilidade limitada, com reduzida exposição solar, com má absorção intestinal, insuficiência renal crónica, sob corticosteroides ou anticonvulsivantes3. Os níveis sanguíneos de 25‐hidroxivitamina D são o melhor indicador das reservas. O Institute of Medicine recomenda um aporte de 400‐600UI/dia, enquanto outras entidades apontam valores mais altos (800‐1.000UI/dia) para adultos com 50 ou mais anos3,4,10,31. Além dos efeitos esqueléticos, a vitamina D tem efeitos benéficos sobre a força muscular e equilíbrio e, consequentemente, sobre o risco de quedas3.
É igualmente importante um consumo adequado de proteínas (0,8g/kg/dia), uma vez que são necessárias para um funcionamento saudável do sistema musculoesquelético e, no caso da ocorrência de uma fratura, ajudam a diminuir o risco de complicações (úlceras de decúbito, anemia, infeções)3,13.
Os doentes devem ser aconselhados a restringir o consumo de bebidas alcoólicas (<3 bebidas/dia), uma vez que o álcool predispõe a deficiência de cálcio e vitamina D, além de aumentar o risco de quedas3,12. Devem restringir o consumo de bebidas com cafeína para menos de 1‐2 por dia, por diminuírem a absorção intestinal de cálcio e aumentarem a sua excreção urinária3,5. O consumo de tabaco também está associado a um aumento do risco de fratura, pelo que deve ser promovida a cessação tabágica3.
O exercício é outro elemento fundamental. Embora os benefícios máximos decorram da prática de exercício antes da menopausa, quando influencia o pico de massa óssea, a realização de exercícios aeróbicos, de carga, ou de resistência em mulheres pós‐menopausa permite prevenir em cerca de 2% a perda de DMO. Além disso, permite melhorar o equilíbrio e os mecanismos de resposta neuromuscular, a velocidade de movimentos e reflexos, diminuindo o risco de quedas3,13. Por último, um regime de tratamento efetivo deve incluir ainda um programa de prevenção de quedas3,5.
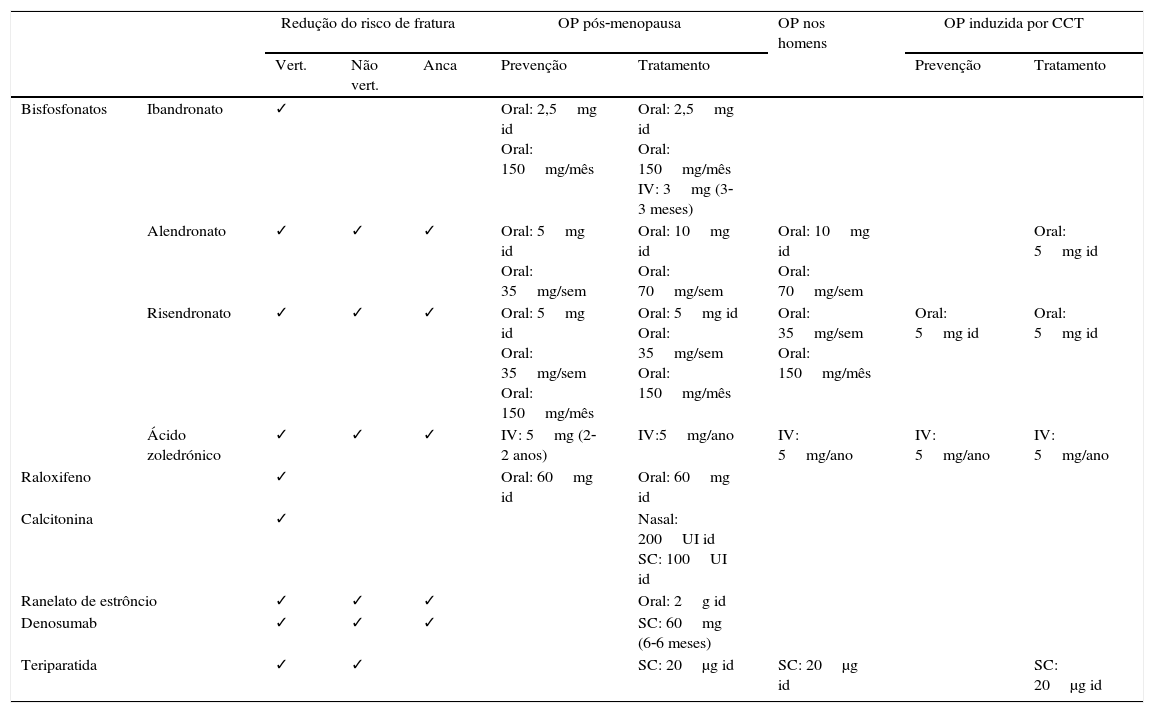
Tratamento farmacológicoAtualmente existem várias classes de fármacos disponíveis para o tratamento da OP (tabela 7). A escolha do tratamento deve ser individualizada, tendo em conta a eficácia, segurança, custo e conveniência para cada doente em particular27.
Tratamento farmacológico
| Redução do risco de fratura | OP pós‐menopausa | OP nos homens | OP induzida por CCT | ||||||
| Vert. | Não vert. | Anca | Prevenção | Tratamento | Prevenção | Tratamento | |||
| Bisfosfonatos | Ibandronato | ✓ | Oral: 2,5mg id Oral: 150mg/mês | Oral: 2,5mg id Oral: 150mg/mês IV: 3mg (3‐3 meses) | |||||
| Alendronato | ✓ | ✓ | ✓ | Oral: 5mg id Oral: 35mg/sem | Oral: 10mg id Oral: 70mg/sem | Oral: 10mg id Oral: 70mg/sem | Oral: 5mg id | ||
| Risendronato | ✓ | ✓ | ✓ | Oral: 5mg id Oral: 35mg/sem Oral: 150mg/mês | Oral: 5mg id Oral: 35mg/sem Oral: 150mg/mês | Oral: 35mg/sem Oral: 150mg/mês | Oral: 5mg id | Oral: 5mg id | |
| Ácido zoledrónico | ✓ | ✓ | ✓ | IV: 5mg (2‐2 anos) | IV:5mg/ano | IV: 5mg/ano | IV: 5mg/ano | IV: 5mg/ano | |
| Raloxifeno | ✓ | Oral: 60mg id | Oral: 60mg id | ||||||
| Calcitonina | ✓ | Nasal: 200UI id SC: 100UI id | |||||||
| Ranelato de estrôncio | ✓ | ✓ | ✓ | Oral: 2g id | |||||
| Denosumab | ✓ | ✓ | ✓ | SC: 60mg (6‐6 meses) | |||||
| Teriparatida | ✓ | ✓ | SC: 20μg id | SC: 20μg id | SC: 20μg id | ||||
Adaptado de AACE Osteoporosis Task Force3.
Os bisfosfonatos (BF) são considerados tratamento de 1a linha27. São fármacos que se ligam aos cristais de hidroxiapatite, pelo que têm uma afinidade muito alta pelo osso. O ácido zolendrónico é aquele que apresenta maior afinidade, seguido de alendronato > ibandronato > risedronato. Os BF que têm maior afinidade ligam‐se com avidez à superfície óssea, mas difundem‐se lentamente pelo osso; aqueles com menor afinidade distribuem‐se mais amplamente pelo osso, mas têm menor tempo de residência quando o tratamento é suspenso32,33. Os BF atuam inibindo a enzima farnesil‐pirofosfato sintase presente nos osteoclastos, levando a redução da sua atividade reabsortiva33. Após o início do tratamento com BF orais, a supressão da reabsorção óssea ocorre em cerca de 3 meses, sendo mais rápida após a administração endovenosa32. No entanto, no momento da sua prescrição é necessário ter em conta algumas condicionantes. Quando administrados por via oral, podem causar irritação do esófago. Como tal, recomenda‐se a sua ingestão com um copo cheio de água após jejum prolongado (geralmente ao acordar), devendo o doente permanecer de pé pelo menos 30‐60 minutos após engolir o comprimido e sem ingerir mais alimentos (para permitir uma adequada absorção, uma vez que apenas 1% é absorvido)32,33. Como tal, doentes com qualquer alteração que atrase o esvaziamento esofágico, ou doentes incapazes de se manterem em pé ou sentados por pelo menos 30 minutos, não devem fazer tratamento com BF orais27,33. Quando os doentes desenvolvem efeitos laterais gastrointestinais, o tratamento deverá ser alterado para BF endovenosos ou outra classe de fármacos em vez de trocar por outro BF oral, uma vez que o doente provavelmente irá experimentar os mesmos sintomas27. No caso dos BF endovenosos, cerca de 1/3 dos doentes apresentam uma reação de fase aguda após a primeira toma (febre, mialgias, linfopenia), mas que raramente recorre com a administração repetida33. A administração endovenosa rápida pode também causar toxicidade renal, estando o uso de BF endovenosos contraindicado em doentes com depuração da creatinina <30‐35mL/min32,33. Estão também contraindicados nos doentes com hipocalcemia11. Outras questões que têm vindo a ser levantadas dizem respeito a potenciais efeitos secundários a longo prazo, o que poderá suscitar algum receio na prescrição destes fármacos em doentes mais jovens, que podem necessitar de tratamento por vários anos27. Desde a aprovação e utilização generalizada dos BF que tem vindo a ser levantada a possibilidade de efeitos laterais raros, mas graves, como osteonecrose da mandíbula, fibrilação auricular, fraturas atípicas e carcinoma do esófago, mas sem uma relação de causalidade bem definida. Os resultados de vários estudos têm sido controversos, requerendo mais investigação. De momento, a relação risco‐beneficio permanece favorável à utilização de BF para prevenção de fraturas11,13,33,34.
Outro grupo de fármacos em que está demonstrada eficácia na redução de perda óssea em todos os locais esqueléticos são os usados na terapia hormonal de substituição. No entanto, esta classe associa‐se a riscos significativos (enfarte do miocárdio, acidente vascular cerebral, trombose venosa profunda, tromboembolismo pulmonar e cancro da mama), pelo que atualmente a única recomendação para a sua utilização é o tratamento de sintomas vasomotores associados há menopausa, durante o menor intervalo de tempo e na menor dose eficaz5. Assim, apenas as mulheres com sintomas vasomotores e com OP, em que os benefícios ultrapassem os riscos relativamente a outras opções terapêuticas, poderá ser considerada a sua utilização27. Não deve ser considerada para prevenção/tratamento de OP isoladamente5,11.
O raloxifeno é o único modulador seletivo dos recetores de estradiol aprovado para uso no tratamento de OP. É um fármaco que atua ligando‐se aos recetores do estradiol e, consoante os tecidos, tem uma ação agonista ou antagonista: no osso tem efeito estrogénico reduzindo a reabsorção (reduz o risco de fraturas vertebrais; sem evidência de redução do risco de fraturas não vertebrais ou da anca); noutros órgãos, como mama e útero, tem efeitos antiestrogénicos reduzindo o risco de neoplasia13. Outra ação benéfica consiste na redução dos níveis de colesterol total e LDL. No entanto, está associado a risco aumentado de eventos tromboembólicos (2‐3 vezes) e pode associar‐se a um agravamento dos sintomas vasomotores da menopausa10,13,27,32. Deste modo, pode ser considerado tratamento de 1a linha em mulheres jovens com grande risco de fraturas vertebrais em relação às da anca, ou como terapia de 2a linha em mulheres com OP pós‐menopausa que não toleram os tratamentos de 1a linha27.
O ranelato de estrôncio (RE) é um fármaco administrado por via oral (saquetas 2g/dia), aprovado para o tratamento da OP em vários países. Parece atuar por um mecanismo duplo, estimulando a formação e reduzindo a reabsorção óssea32. Tem o espectro de eficácia documentado mais alargado (tabela 8)11. A diminuição da taxa de fratura é semelhante em magnitude à dos BF. O RE não está recomendado em doentes com insuficiência renal grave (depuração creatinina <30mL/min). Os efeitos adversos são geralmente ligeiros e transitórios. Numa meta‐análise de ensaios clínicos, foi demonstrado um risco acrescido de tromboembolismo venoso (TEV)35. Não está estabelecida uma relação causal entre o RE e TEV. Contudo, o RE está contraindicado em doentes com história de tromboflebite. Num Safety Report publicado pela European Medical Agency (EMA) em 2012, apresentando uma análise conjunta de 7.572 doentes, foi sugerido um aumento de risco de enfarte de miocárdio, tendo levado a EMA a modificar as indicações da utilização do RE, estando restrito o seu uso em doentes com OP grave para os quais não seja possível outro tratamento médico, que não apresentem história de doença cardíaca isquémica, doença arterial periférica, doença cerebrovascular ou HTA não controlada36,37. A exclusão dos doentes com estas condições da análise praticamente mitiga o risco de enfarte. Também os dados de farmacovigilância não têm sugerido excesso de eventos cardíacos e estudos observacionais subsequentes não demonstraram qualquer aumento no risco38. Um desses estudos englobou 112.445 sob tratamento para OP e verificou que o uso corrente ou passado de RE em mulheres com OP pós‐menopausa, não se associou a aumento do risco de um primeiro enfarte do miocárdio, hospitalização por enfarte ou morte cardiovascular comparativamente com doentes nunca tratados39. Assim, o RE é um tratamento efetivo para a OP em doentes com OP grave, podendo ser útil em doentes sem as contraindicações indicadas e mantendo vigilância de sintomatologia do foro cardiovascular38.
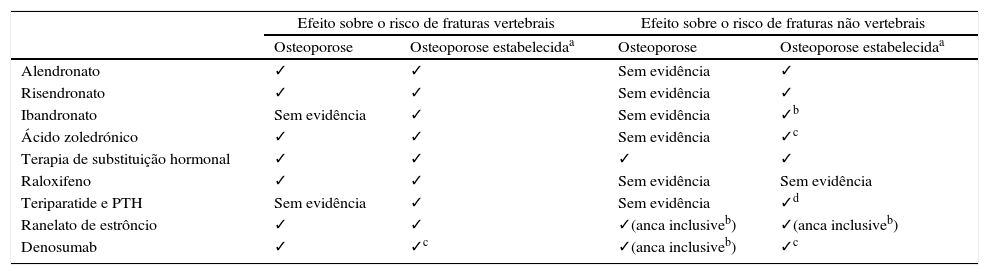
Eficácia antifratura dos fármacos mais frequentemente utilizados no tratamento da osteoporose em mulheres pós‐menopausa
| Efeito sobre o risco de fraturas vertebrais | Efeito sobre o risco de fraturas não vertebrais | |||
| Osteoporose | Osteoporose estabelecidaa | Osteoporose | Osteoporose estabelecidaa | |
| Alendronato | ✓ | ✓ | Sem evidência | ✓ |
| Risendronato | ✓ | ✓ | Sem evidência | ✓ |
| Ibandronato | Sem evidência | ✓ | Sem evidência | ✓b |
| Ácido zoledrónico | ✓ | ✓ | Sem evidência | ✓c |
| Terapia de substituição hormonal | ✓ | ✓ | ✓ | ✓ |
| Raloxifeno | ✓ | ✓ | Sem evidência | Sem evidência |
| Teriparatide e PTH | Sem evidência | ✓ | Sem evidência | ✓d |
| Ranelato de estrôncio | ✓ | ✓ | ✓(anca inclusiveb) | ✓(anca inclusiveb) |
| Denosumab | ✓ | ✓c | ✓(anca inclusiveb) | ✓c |
A calcitonina é uma hormona polipeptídica que inibe a reabsorção óssea, mas em menor extensão que os outros fármacos antirreabsortivos. Era administrada diariamente por via nasal ou subcutânea como tratamento de 2a linha em mulheres com OP e em menopausa há mais de 5 anos, que não podiam utilizar outras terapêuticas mais potentes13. No entanto, recentemente, a FDA e a EMA pronunciaram‐se contra a sua utilização, pelo risco plausível de neoplasias40,41.
O denosumab é um anticorpo monoclonal humano que atua ligando‐se com grande afinidade ao RANKL, impedindo a sua interação com o seu recetor presente na superfície dos osteoclastos e seus precursores, inibindo a atividade osteoclástica32. Está indicado no tratamento de OP em mulheres com alto risco de fratura, ou nos casos em que tenha havido intolerância ou falência do tratamento anterior3. Um aspeto atrativo, em termos de adesão terapêutica, passa pelo facto de ser administrado por via subcutânea a cada 6 meses. Ao contrário da maioria dos agentes antirreabsortivos, pode ser considerado em mulheres com insuficiência renal. Devido à possibilidade de infeções graves com o seu uso, devem ser pesados os benefícios e os riscos em mulheres a fazer tratamentos imunossupressores27.
Os análogos da paratormona (PTH) – teriparatide e PTH 1‐84 – são os únicos agentes anabolizantes aprovados. Quando administrados em baixas doses e de forma intermitente, têm efeitos predominantemente anabolizantes nos osteoblastos32. O seu uso está reservado para o tratamento de doentes de alto risco, incluindo os com T‐score <‐3,0 com uma fratura vertebral prévia, assim como para o tratamento de doentes com intolerância ou falência do tratamento anterior3,27. A segurança e eficácia a longo prazo não foram avaliadas além dos 2 anos, de modo que a sua utilização está recomendada apenas durante este período de tempo. O uso sequencial de BF após terminar tratamento com análogos da PTH parece manter o ganho obtido na DMO27,32. Estão contraindicados em doentes com hipercalcemia, outras doenças do metabolismo ósseo além da OP, doença renal grave, doenças malignas esqueléticas e radioterapia prévia ao esqueleto27.
De um modo geral, a utilização de 2 ou mais agentes antirreabsortivos em simultâneo não está recomendada, uma vez que não existe evidência de uma redução superior no risco de fratura3. Também tem sido proposta a combinação de agentes antirreabsortivos e teriparatide, mas os resultados dos estudos não tem sido consistentes e, por outro lado, associa‐se a um aumento do custo e de potenciais efeitos laterais3,27. Como já referido, o tratamento sequencial de teriparatide com BF em doentes de muito alto risco parece ser benéfico, de forma a manter ou potenciar os efeitos benéficos do tratamento anabolizante3,11.
Quanto tempo tratar?A duração ótima do tratamento com BF permanece incerta, particularmente porque estes fármacos se acumulam no osso, criando um reservatório a partir do qual podem ser libertados durante meses ou anos após a suspensão do tratamento9,33. Embora os riscos do tratamento pareçam ser pequenos, para doentes com baixo risco de fratura a razão risco‐benefício pode ser negativa, tendo em conta as potenciais consequências que a supressão a longo prazo do metabolismo ósseo possa acarretar33. Tem sido proposto o conceito de “drug holiday” em doentes sob tratamento com BF, com base na evidência de um efeito protetor sustentado sobre o ciclo de remodelação óssea e o risco de fratura em doentes que receberam tratamento com BF por 5 ou mais anos27,32. Assim, a duração do tratamento e da pausa deve ser individualizada, tendo em consideração o risco de fratura e a afinidade/ligação do BF utilizado (tabela 9)10,33. Com o RE há um ganho de massa óssea ao longo de 10 anos de tratamento, com concomitante redução progressiva da taxa de fraturas42.
Sugestão da duração do tratamento e do período de pausa
| Risco de fratura | Duração do tratamento | Duração da pausa |
| Baixo | Tratamento raramente indicado | ‐ |
| Ligeiro | 5 anos | Suspender BF até uma ↓ significativa da DMO ou ocorrer uma fratura |
| Moderado | 5‐10 anos | Suspender BF durante 2‐3 anos (ou menos se ↓ significativa da DMO ou ocorrer uma fratura) |
| Alto | 10 anos | Suspender BF durante 1‐2 anos (ou menos se ↓ significativa da DMO ou ocorrer uma fratura); considerar medicação alternativa durante a pausa dos BF |
Adaptado de Watts e Diab33.
Quando são administrados BF, os osteoclastos param abruptamente de reabsorver osso, mas os osteoblastos continuam a preencher as lacunas já existentes. Nos meses seguintes, enquanto estas lacunas são preenchidas, o volume de osso aumenta e torna‐se gradualmente mais denso. Como a reabsorção está inibida, o osso antigo não é reabsorvido e não são formadas novas lacunas para desencadear a deposição óssea (as taxas de reabsorção e de formação óssea são ambas muito baixas). No entanto, a matriz do osso existente torna‐se mais compacta. A DMO aumenta rapidamente durante os primeiros 6 meses, enquanto as lacunas de reabsorção são preenchidas, e mais gradualmente ao longo dos 3 anos seguintes, enquanto o osso é mineralizado. Após estes 3 anos, a DMO do fémur alcança um planalto43. Assim, a realização de DXA seriadas é fundamental na avaliação da resposta ao tratamento. Tendo em conta estes períodos de resposta ao tratamento com os BF e que as variações reais na DMO são pequenas, comparativamente à variabilidade inerente do próprio teste (erro de precisão), os intervalos em que devem ser realizadas as DXA de monitorização são definidos de modo a que a variação esperada esteja além da variabilidade do teste. A interpretação dos resultados seriados de DXA depende do pressuposto de que as mudanças mais pequenas na DMO estão além da margem de erro do teste3. Assim, deve ser realizada uma DXA em 1‐2 anos após início do tratamento e, depois, a cada 2 anos3,5. No caso de indivíduos com situações associadas a perda óssea rápida, por exemplo, doentes sob corticoterapia, pode ser apropriado testar mais frequentemente10. Se se verificar estabilidade do valor de DMO, é sinal de uma resposta adequada ao tratamento e, como tal, o intervalo entre avaliações pode ser aumentado. Por outro lado, se houver uma diminuição da DMO ou uma fratura de fragilidade apesar do tratamento, torna‐se necessário avaliar a adesão ao tratamento, possíveis causas secundárias e considerar a possibilidade de falência terapêutica, com necessidade de mudar para outro grupo farmacológico3.
Os BMO parecem ter a sua maior utilidade clínica na monitorização do tratamento16. Sabe‐se que há uma diminuição dos níveis dos BMO de reabsorção em 4‐6 semanas após início do tratamento antirreabsortivo, refletindo a inibição da atividade osteoclástica, seguido de um declínio tardio (2‐3 meses) dos marcadores de formação; finalmente, ambos os BMO alcançam um planalto. No caso do tratamento com agentes anabolisantes, ocorre o fenómeno oposto16,17. No entanto, apesar destas alterações estarem bem documentadas, os objetivos a alcançar para cada tipo de tratamento e os benefícios em termos de redução de fraturas ainda não estão estabelecidos26. Assim, por enquanto, não se recomenda o seu doseamento por rotina11.
ConclusãoA OP é uma doença silenciosa até ser complicada por fraturas, acarretando consequências significativas a nível individual e social. Um alto nível de suspeição é necessário para o seu diagnóstico precoce, sendo por isso fundamental a implementação de medidas preventivas para evitar o seu desenvolvimento, que devem ser iniciadas ainda durante a fase de crescimento e desenvolvimento ósseos. Mesmo fatores durante o desenvolvimento intrauterino podem vir a interferir no risco futuro de OP e de fraturas. Nos últimos anos têm sido feitos avanços significativos, não só nos meios de diagnóstico e identificação dos indivíduos em risco, com o desenvolvimento de ferramentas de cálculo do risco de fratura, mas também em termos fisiopatológicos, como o reconhecimento de um papel central dos osteócitos na iniciação e regulação do processo de remodelação e identificação de elementos moleculares que controlam este processo, criando a possibilidade de novos alvos terapêuticos, como a esclerostina, a conexina 43 e podoplanina. Os fármacos disponíveis atualmente são eficazes, mas alguns estão limitados por efeitos laterais, comorbilidades ou adesão a longo prazo ao tratamento. Novos fármacos que combinem eficácia e tolerabilidade, alargando o leque de possibilidades terapêuticas, são esperados.
Conflito de interessesOs autores declaram não haver conflito de interesses.