(1) Avaliar as diferenças nas concentrações e na dinâmica, dos marcadores bioquímicos da inflamação, entre dentes com histórico de doença periodontal e dentes saudáveis, quando submetidos a forças. (2) Verificar de que forma essa dinâmica é afetada pela condição periodontal.
Material e métodosA população selecionada foi dividida em dois grupos, baseados no histórico de doença periodontal:
Grupo I (grupo experimental, com histórico de periodontite);
Grupo II (grupo de controlo, pacientes saudáveis a nível periodontal).
Foram selecionados 76 dentes, de 22 pacientes. Os dentes teste receberam uma força mesial através da aplicação de um separador elástico; os dentes controlo não foram submetidos a força. Todos os pacientes aceitaram o protocolo e assinaram o consentimento informado.
O fluido crevicular gengival foi recolhido no ponto mesio-vestibular antes da colocação dos separadores (T1), imediatamente a seguir (T2), uma hora depois (T3) e uma semana mais tarde (T4). A sua quantificação foi realizada com recurso ao Periotron® 8000 e os níveis de IL-1β, e o os níveis de fator de necrose tumoral-α (FNT-α) foram determinados com recurso aos teste ELISA.
Analise estatísticaTeste ANOVA entre grupos e o teste t-student intra-grupo.
ResultadosAs concentrações de IL-1β apresentaram diferenças entre T1 e T4 nos grupos teste, com ou sem histórico de doença periodontal (p ≤ 0,05). Para o FNT-α não foram registadas diferenças entre as quatro avaliações (p > 0,05) em nenhum dos grupos. No entanto, os níveis desta citoquina foram mais elevados em pacientes saudáveis.
ConclusãoO uso de separadores cria alterações nos níveis de IL-1β em ambos os grupos teste, mas não nos níveis de FNT-α.
(1) Assess the differences in the concentrations and dynamics of biochemical markers of inflammation between patients with a history of periodontal disease and healthy patients undergoing forces. (2) Study whether these dynamics are affected by the current periodontal status of the patients.
Material and methodsThe patients were divided in two groups, based in their periodontal history:
Group I (Experimental, with historical of periodontal disease);
Group II (Control, with no history of periodontal disease).
76 teeth from 22 patients were selected. Test teeth received a mesial force, through the application of an elastic separator; control teeth were not subjected to force. All patients accepted the protocol and signed the informed consent.
The gingival crevicular fluid was collected from mesio-buccal before the placement of the separators (T1), immediately afterwards (T2), 1 hour later (T3) and a week later (T4). Its quantification was accomplished with Periotron® 8000 and the IL-1β and TNF-α levels were determined through ELISA tests.
Statistical analysisANOVA test between groups and the paired t-student intra-group.
ResultsIL-1β concentrations presented differences from T1 to T4 in test groups with or without history of periodontal disease (p≤0.05).
For the FNT-α no differences were founded between the four evaluations (p>0.05) in all groups, although the concentration levels of this cytokine was higher in healthy patients.
ConclusionThe use of separators creates alterations in IL-1β levels in both test groups, but not in TNF-α levels.
A periodontite é uma doença inflamatória crónica causada pelas bactérias presentes no biofilme subgengival1,2. Estas bactérias atuam indiretamente, provocando uma resposta inflamatória e autoimune, por parte do hospedeiro, modulando o processo destrutivo. Esta resposta por parte do hospedeiro liberta mediadores catabólicos ativos que causam a destruição do tecido conjuntivo e do osso3,4.
As metaloproteinases da matriz são os mediadores mais relevantes na destruição do tecido conjuntivo, e a interleuquina-1β (IL-1β), prostaglandina E2 (PGE2) e o fator de necrose tumoral α (FNT-α) na reabsorção óssea. A associação entre estes mediadores e a periodontite tem sido demonstrada uma vez que altas concentrações destes mediadores têm sido associadas a períodos de destruição ativa do periodonto. Por outro lado, as concentrações destes marcadores retornam à sua normalidade, após tratamento periodontal com subsequente resolução da inflamação gengival5.
O tratamento ortodôntico baseia-se no movimento controlado dos dentes, pela aplicação de forças mecânicas e ocorre através do desenvolvimento de áreas de pressão e tensão no ligamento periodontal, resultando em áreas de aposição e de reabsorção óssea. Este mecanismo inflamatório «controlado», também designado como inflamação assética, está também ele dependente da libertação de mediadores bioquímicos específicos associados à inflamação crónica e à estimulação osteoclástica, como por exemplo a IL-1β e o FNT-α6–16.
Estudos in vitro demonstram que durante o movimento do dente existe um aumento acentuado nas concentrações de IL-1β e de FNT-α3. Também in vivo, alguns autores detetaram mudanças significativas na composição bioquímica do fluido crevicular gengival (FCG) (4), considerando estas citoquinas como fatores-chave para o movimento do dente16.
O aumento do tratamento ortodôntico em adultos, despoletou uma controvérsia sobre se pacientes com histórico de periodontite poderiam ter respostas bioquímicas diferentes às forças a que seriam sujeitos. Os objetivos deste trabalho foram:
- (1)
Avaliar as diferenças nas concentrações e na dinâmica, dos marcadores bioquímicos da inflamação, entre dentes com histórico de doença periodontal e dentes saudáveis, quando submetidos a forças.
- (2)
Verificar de que forma essa dinâmica é afetada pela condição periodontal.
Os pacientes foram selecionados entre aqueles que procuravam tratamento ortodôntico em duas clínicas privadas (Porto, Portugal), entrando para o estudo se os seguintes critérios fossem totalmente preenchidos:
- •
Ser adulto (≥ 20 anos);
- •
Ter pelo menos dois quadrantes completos (até ao primeiro molar inclusive);
- •
Estar disposto a participar no estudo e a cumprir com todas as consultas agendadas. Isto foi confirmado pelo consentimento escrito assinado pelos pacientes, após terem sido informados sobre todos os pormenores do estudo;
- •
Ser não fumador. Pacientes fumadores ou ex-fumadores foram excluídos;
- •
Ser saudável. Pacientes com patologias sistémicas, grávidas ou a tomar medicação anti-inflamatória foram igualmente excluídos;
- •
Ser saudável a nível periodontal. Pacientes com doença periodontal ativa ou em fase de tratamento periodontal ativo, também foram excluídos.
Esta investigação é um estudo clínico prospetivo, onde a população selecionada foi dividida em dois grupos, baseados no histórico de doença periodontal:
Grupo I (grupo experimental) – pacientes com histórico de periodontite que, uma vez tratados, estão dispostos a submeterem-se a tratamento ortodôntico.
Grupo II (grupo de controlo) – pacientes saudáveis a nível periodontal que também se submeteriam a tratamento ortodôntico.
Em cada grupo de pacientes, os últimos molares erupcionados num quadrante (primeiro ou segundo molar) foram selecionados para receber forças através da aplicação de um separador elástico aplicado na sua superfície mesial (dentes teste). Os últimos molares erupcionados do quadrante oposto serviram de controlo negativo (nenhuma força foi aplicada).
Em ambos os grupos, os dentes foram examinados do ponto de vista periodontal, antes da aplicação da força (T1) e uma semana depois desta (T4). Este exame periodontal incluiu: determinação da presença de placa, de hemorragia após sondagem, da profundidade de sondagem e da recessão gengival, e ainda a recolha e quantificação do volume de FCG e a determinação das concentrações de IL-1β e FNT-α.
Em T2 (imediatamente após a aplicação da força) e T3 (uma hora depois) apenas foi efetuada a recolha, a quantificação do volume de FCG e a determinação das concentrações de IL-1β e FNT-α, somente para os dentes de teste.
Metodologia bioquímicaA recolha e quantificação do volume de FCG foi efetuada em todos os dentes selecionados para exame. Nos dentes de teste, este procedimento foi efetuado antes da colocação dos separadores (T1), imediatamente após (T2), uma hora depois (T3) e uma semana mais tarde (T4). Nos dentes de controlo apenas T1 e T4.
O procedimento de recolha das amostras de FCG foi efetuado recorrendo ao uso de tiras de papel (Periopapers proflow coro, Amigyville, NY, EUA), inseridas na face mesio-vestibular do sulco dos dentes selecionados, sendo que todas as amostras subsequentes foram retiradas sempre da mesma localização.
As tiras de papel foram mantidas no sulco durante um tempo pré-estabelecido findo o qual as tiras foram colocados no Periotron® 8000 (Periotron Ide-interstate, NY, EUA), para quantificação do volume de FCG17. Uma vez terminada a quantificação as amostras foram imediatamente colocadas em tubos individualizados, que continham um filtro micro-poroso (Micro-spin Eppendorf Lida. Manufacturing Corp., NY, EUA) e congeladas até ao momento da análise bioquímica. Estas análises foram efetuadas usando os testes comerciais específicos Elisa Cytoscreen (Biosource International, CA, EUA) para cada citoquina (IL-1β e FNT-α) utilizando o «double-antibody method».
Todas as amostras foram processadas duplicadamente de forma a reduzir os erros metodológicos.
Análise estatísticaAs comparações foram feitas entre dois grupos e, dentro de cada, ao longo do tempo e expresso em médias (± desvio padrão).
Para as comparações inter-grupos, as variações nas quantidades e concentrações bioquímicas foram avaliadas recorrendo aos testes ANOVA. As comparações entre T1 e T4 foram igualmente efetuadas utilizando os testes unpaired t-student e o HSD Tukey. As comparações intra-grupo foram efetuadas através do teste paired t-student.
As variáveis clínicas categóricas foram analisadas através dos testes McNemar e Fisher's.
A análise estatística foi levada a cabo com o recurso ao SPSS 14.0, utilizando um intervalo de confiança de 95% (p ≤ 0,05).
ResultadosForam selecionados 26 pacientes, no entanto apenas 22 preenchiam os critérios de inclusão. A amostra selecionada apresentou uma média de idade de 30 ± 8,1 anos. Contudo, o Grupo II possuía uma média de idade inferior ao Grupo I (p < 0,05).
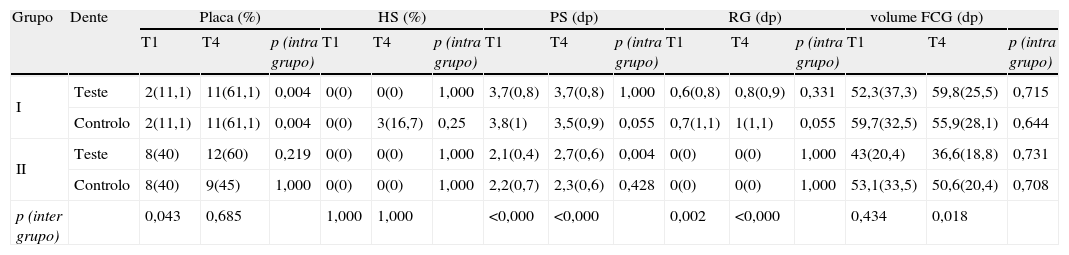
Os resultados clínicos (T1 e T4) estão demonstrados na tabela 1.
Resultados das variáveis clínicas: Placa, Hemorragia após sondagem (HS), Profundidade de sondagem (PS), Recessão gengival (RG) e volume de FCG.
| Grupo | Dente | Placa (%) | HS (%) | PS (dp) | RG (dp) | volume FCG (dp) | ||||||||||
| T1 | T4 | p (intra grupo) | T1 | T4 | p (intra grupo) | T1 | T4 | p (intra grupo) | T1 | T4 | p (intra grupo) | T1 | T4 | p (intra grupo) | ||
| I | Teste | 2(11,1) | 11(61,1) | 0,004 | 0(0) | 0(0) | 1,000 | 3,7(0,8) | 3,7(0,8) | 1,000 | 0,6(0,8) | 0,8(0,9) | 0,331 | 52,3(37,3) | 59,8(25,5) | 0,715 |
| Controlo | 2(11,1) | 11(61,1) | 0,004 | 0(0) | 3(16,7) | 0,25 | 3,8(1) | 3,5(0,9) | 0,055 | 0,7(1,1) | 1(1,1) | 0,055 | 59,7(32,5) | 55,9(28,1) | 0,644 | |
| II | Teste | 8(40) | 12(60) | 0,219 | 0(0) | 0(0) | 1,000 | 2,1(0,4) | 2,7(0,6) | 0,004 | 0(0) | 0(0) | 1,000 | 43(20,4) | 36,6(18,8) | 0,731 |
| Controlo | 8(40) | 9(45) | 1,000 | 0(0) | 0(0) | 1,000 | 2,2(0,7) | 2,3(0,6) | 0,428 | 0(0) | 0(0) | 1,000 | 53,1(33,5) | 50,6(20,4) | 0,708 | |
| p (inter grupo) | 0,043 | 0,685 | 1,000 | 1,000 | <0,000 | <0,000 | 0,002 | <0,000 | 0,434 | 0,018 | ||||||
Em T1, fazia-se notar a presença de mais placa no Grupo II comparativamente com o Grupo I (p < 0,05). Entre T1 e T4, denotou-se um aumento de placa apenas no Grupo I.
Ainda em T1 não se verificou hemorragia após sondagem em nenhum dos locais examinados. Já em T4, 16,7% dos locais de controlo do Grupo I sangravam após a sondagem (p > 0,05).
As profundidades de sondagem foram significativamente mais elevadas no Grupo I do que no Grupo II (p < 0,05) em T1 e T4. No entanto, mudanças na profundidade de sondagem entre T1 e T4 foram estatisticamente significativas apenas no Grupo II, que apresentou maior profundidade de sondagem nos locais de teste, em T4.
A recessão gengival foi significativamente maior no Grupo I do que no Grupo II (p < 0,05) em T1 e T4. Contudo, as alterações entre T1 e T4 não foram estatisticamente relevantes para nenhum dos grupos.
O volume de FCG mostrou-se consistentemente similar ao longo do tempo em ambos os grupos (p > 0,05). Comparando as diferenças entre os grupos, não se verificou qualquer diferença em T1, T2, e T3. Apenas na última avaliação (T4), os dentes teste no Grupo I mostraram um volume de FCG significativamente mais elevado do que dentes teste do Grupo II.
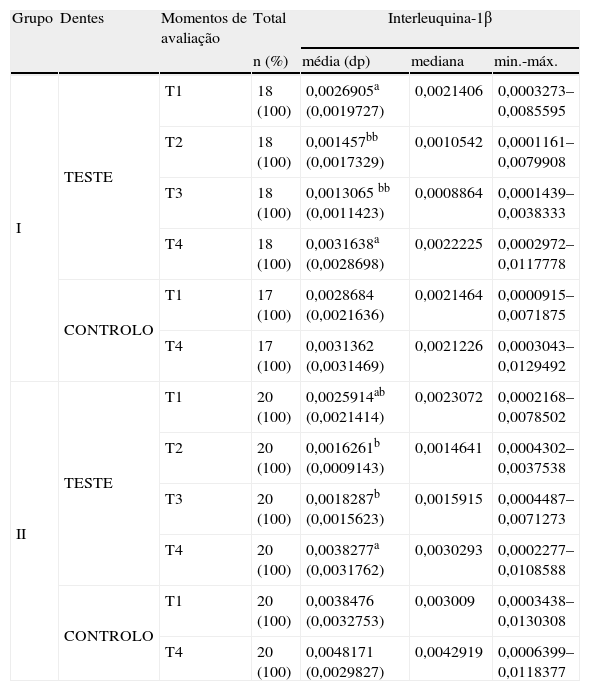
As alterações nos níveis de Interleuquina-1β encontram-se descritas na tabela 2.
Diferenças intra e inter-grupos nos níveis de Interleuquina-1β ao longo do tempo.
| Grupo | Dentes | Momentos de avaliação | Total | Interleuquina-1β | ||
| n (%) | média (dp) | mediana | min.-máx. | |||
| I | TESTE | T1 | 18 (100) | 0,0026905a (0,0019727) | 0,0021406 | 0,0003273–0,0085595 |
| T2 | 18 (100) | 0,001457bb (0,0017329) | 0,0010542 | 0,0001161–0,0079908 | ||
| T3 | 18 (100) | 0,0013065 bb (0,0011423) | 0,0008864 | 0,0001439–0,0038333 | ||
| T4 | 18 (100) | 0,0031638a (0,0028698) | 0,0022225 | 0,0002972–0,0117778 | ||
| CONTROLO | T1 | 17 (100) | 0,0028684 (0,0021636) | 0,0021464 | 0,0000915–0,0071875 | |
| T4 | 17 (100) | 0,0031362 (0,0031469) | 0,0021226 | 0,0003043–0,0129492 | ||
| II | TESTE | T1 | 20 (100) | 0,0025914ab (0,0021414) | 0,0023072 | 0,0002168–0,0078502 |
| T2 | 20 (100) | 0,0016261b (0,0009143) | 0,0014641 | 0,0004302–0,0037538 | ||
| T3 | 20 (100) | 0,0018287b (0,0015623) | 0,0015915 | 0,0004487–0,0071273 | ||
| T4 | 20 (100) | 0,0038277a (0,0031762) | 0,0030293 | 0,0002277–0,0108588 | ||
| CONTROLO | T1 | 20 (100) | 0,0038476 (0,0032753) | 0,003009 | 0,0003438–0,0130308 | |
| T4 | 20 (100) | 0,0048171 (0,0029827) | 0,0042919 | 0,0006399–0,0118377 | ||
| Momentos de avaliação | Grupo | TESTE/CONTROLO | Interleuquina-1β | |||
| n (%) | média (dp) | mediana | min.-máx. | |||
| T1 | I | TESTE | 17 (100) | 0,0026905 (0,0019727) | 0,0021406 | 0,0003273–0,0085595 |
| CONTROLO | 17 (100) | 0,0028684 (0,0021636) | 0,0021464 | 0,0000915–0,0071875 | ||
| II | TESTE | 20 (100) | 0,0025914 (0,0021414) | 0,0023072 | 0,0002168–,0078502 | |
| CONTROLO | 20 (100) | 0,0038476 (0,0032753) | 0,003009 | 0,0003438–0,0130308 | ||
| T2 | I | TESTE | 17 (100) | 0,001457 (0,0017329) | 0,0010542 | 0,0001161–0,0079908 |
| CONTROLO | – | – | – | – | ||
| II | TESTE | 20 (100) | 0,0016261 (0,0009143) | 0,0014641 | 0,0004302–0,0037538 | |
| CONTROLO | – | – | – | – | ||
| T3 | I | TESTE | 17 (100) | 0,0013065 (0,0011423) | 0,0008864 | 0,0001439–0,0038333 |
| CONTROLO | – | – | – | – | ||
| II | TESTE | 20 (100) | 0,0018287 (0,0015623) | 0,0015915 | 0,0004487–0,0071273 | |
| CONTROLO | – | – | – | – | ||
| T4 | I | TESTE | 17 (100) | 0,0031638 (0,0028698) | 0,0022225 | 0,0002972–0,0117778 |
| CONTROLO | 17 (100) | 0,0031362 (0,0031469) | 0,0021226 | 0,0003043–0,0129492 | ||
| II | TESTE | 20 (100) | 0,0038277 (0,0031762) | 0,0030293 | 0,0002277–0,0108588 | |
| CONTROLO | 20 (100) | 0,0048171 (0,0029827) | 0,0042919 | 0,0006399–0,0118377 | ||
a,b – letras diferentes significam grupos homogéneos com diferenças estatisticamente significativas.
Os dentes teste do Grupo I apresentaram uma concentração de IL-1β significativamente mais elevada (p = 0,032) entre T1 e T2 e entre T1 e T3; bem como entre T2 e T4 e entre T3 e T4. Nos dentes controlo, não existiram diferenças significativas ao longo do estudo (p = 0,821).
Dentro do Grupo II, todos os dentes teste, apresentaram elevadas concentrações de IL-1β (p = 0,002) entre T2 e T4 e entre T3 e T4. Ao longo do estudo não se verificaram alterações significativas nas concentrações desta citoquina nos dentes controlo (p = 0,239).
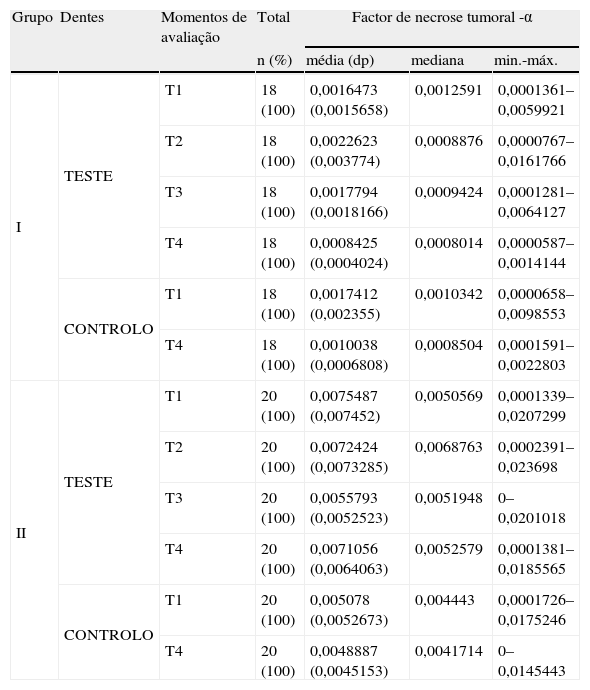
As alterações nos níveis de Fator de Necrose Tumoral-α encontram-se descritas na tabela 3.
Diferenças intra e inter-grupos nos níveis de Factor de necrose tumoral -α ao longo do tempo.
| Grupo | Dentes | Momentos de avaliação | Total | Factor de necrose tumoral -α | ||
| n (%) | média (dp) | mediana | min.-máx. | |||
| I | TESTE | T1 | 18 (100) | 0,0016473 (0,0015658) | 0,0012591 | 0,0001361–0,0059921 |
| T2 | 18 (100) | 0,0022623 (0,003774) | 0,0008876 | 0,0000767–0,0161766 | ||
| T3 | 18 (100) | 0,0017794 (0,0018166) | 0,0009424 | 0,0001281–0,0064127 | ||
| T4 | 18 (100) | 0,0008425 (0,0004024) | 0,0008014 | 0,0000587–0,0014144 | ||
| CONTROLO | T1 | 18 (100) | 0,0017412 (0,002355) | 0,0010342 | 0,0000658–0,0098553 | |
| T4 | 18 (100) | 0,0010038 (0,0006808) | 0,0008504 | 0,0001591–0,0022803 | ||
| II | TESTE | T1 | 20 (100) | 0,0075487 (0,007452) | 0,0050569 | 0,0001339–0,0207299 |
| T2 | 20 (100) | 0,0072424 (0,0073285) | 0,0068763 | 0,0002391–0,023698 | ||
| T3 | 20 (100) | 0,0055793 (0,0052523) | 0,0051948 | 0–0,0201018 | ||
| T4 | 20 (100) | 0,0071056 (0,0064063) | 0,0052579 | 0,0001381–0,0185565 | ||
| CONTROLO | T1 | 20 (100) | 0,005078 (0,0052673) | 0,004443 | 0,0001726–0,0175246 | |
| T4 | 20 (100) | 0,0048887 (0,0045153) | 0,0041714 | 0–0,0145443 | ||
| Momentos de avaliação | G | TESTE/CONTROLO | Factor de necrose tumoral -α | |||
| n (%) | média (dp) | mediana | min.-máx. | |||
| T1 | I | TESTE | 17 (100) | 0,0016473 b (0,0015658) | 0,0012591 | 0,0001361 - 0,0059921 |
| CONTROLO | 17 (100) | 0,0017412 ab (0,002355) | 0,0010342 | 0,0000658 - 0,0098553 | ||
| II | TESTE | 20 (100) | 0,0075487 a (0,007452) | 0,0050569 | 0,0001339 - 0,0207299 | |
| CONTROLO | 20 (100) | 0,005078 ab (0,0052673) | 0,004443 | 0,0001726 - 0,0175246 | ||
| T2 | I | TESTE | 17 (100) | 0,0022623b (0,003774) | 0,0008876 | 0,0000767 - 0,0161766 |
| CONTROLO | – | – | – | – | ||
| II | TESTE | 20 (100) | 0,0072424ª (0,0073285) | 0,0068763 | 0,0002391 - 0,023698 | |
| CONTROLO | – | – | – | – | ||
| T3 | I | TESTE | 17 (100) | 0,0017794b (0,0018166) | 0,0009424 | 0,0001281 - 0,0064127 |
| CONTROLO | – | – | – | – | ||
| II | TESTE | 20 (100) | 0,0055793ª (0,0052523) | 0,0051948 | 0 - 0,0201018 | |
| CONTROLO | – | – | – | – | ||
| T4 | I | TESTE | 17 (100) | 0,0008425 b (0,0004024) | 0,0008014 | 0,0000587 - 0,0014144 |
| CONTROLO | 17 (100) | 0,0010038 b (0,0006808) | 0,0008504 | 0,0001591 - 0,0022803 | ||
| II | TESTE | 20 (100) | 0,0071056 a (0,0064063) | 0,0052579 | 0,0001381 - 0,0185565 | |
| CONTROLO | 20 (100) | 0,0048887 a (0,0045153) | 0,0041714 | 0 - 0,0145443 | ||
a,b – letras diferentes significam grupos homogéneos com diferenças estatisticamente significativas.
Este marcador não registou alterações significativas ao longo do estudo, em ambos os grupos (p = 0,361). De igual forma, os seus níveis não se mostraram significativamente diferentes ao longo do tempo (p > 0,5). No entanto, verificaram-se diferenças estatisticamente significativas nos níveis de FNT-α entre os dentes teste do Grupo I e os dentes teste do Grupo II no inicio (T1) (p = 0,002), emT2 (p = 0,012) e em T3 (p = 0,006).
Em T4, as diferenças entre o Grupo I e o Grupo II (p < 0,000) foram significativas e o Grupo II mostrou-se consistentemente menor em termos dos níveis de FNT- α.
DiscussãoA associação entre periodontite e placa subgengival está bem fundamentada na literatura18,19. Similarmente, a presença de níveis elevados de citoquinas encontrados no FCG tem sido fortemente associados ao processo destrutivo na periodontite20,21, voltando este níveis à normalidade quando o tratamento periodontal é levado a cabo5. Por outro lado, as alterações nas concentrações de citoquinas a nível FCG têm sido igualmente associadas ao movimento ortodôntico. In vitro, a presença destas citoquinas têm sido associada à remodelação óssea8. In vivo, as alterações detetadas nestes marcadores bioquímicos no FCG durante o movimento ortodôntico6,22 levou a que alguns autores sugerissem que estas citoquinas têm um papel preponderante no movimento dos dentes6,15.
Uematsu et al. (1996) verificou que várias citoquinas, como a IL-1β e o FNT-α, mantêm os seus valores iguais em dentes não sujeitos a pressões mecânicas, enquanto que, nos dentes expostos a forças, estes níveis aumentam gradualmente15. Outros autores confirmaram estas descobertas, referindo a presença de níveis consideráveis de IL-1β no FCG durante o movimento do dente22–25. Esta citoquina tendencialmente aumenta passado uma hora da aplicação da força16,22,23, atingindo o seu valor mais elevado às 24h16,22,23 e mantendo-se elevado até ao quarto dia14, após o qual os valores tendem a diminuir aproximando-se dos iniciais no final de uma semana14,22.
O volume de FCG foi semelhante dentro do mesmo grupo nos quatro momentos de avaliação, embora em pacientes com histórico de periodontite, na última avaliação (T4), o volume apresentou-se bastante mais elevado quando comparado os dentes teste do Grupo I (pacientes saudáveis).
Neste estudo avaliamos os níveis de IL-1β e FNT-α no FCG. Com o objetivo de eliminar a presença destes mediadores bioquímicos devido à inflamação provocada por placa bacteriana, os pacientes de ambos os grupos foram motivados e instruídos para uma correta higiene oral. No entanto, o Grupo I demonstrou níveis inferiores de placa, quando comparado com o Grupo II, devendo-se este facto, provavelmente, a um maior conhecimento acerca da patologia periodontal e dos métodos de higiene oral decorrente de consultas de tratamento de suporte periodontal anteriores ao início do estudo.
Apesar destas alterações na presença de placa, os níveis de IL-1β no FCG não demonstraram diferenças estatisticamente significativas entre os grupos, independentemente de se tratar de dentes teste e de dentes controlo. Contrariamente, os níveis de FNT-α no FCG foram significativamente inferiores em pacientes do Grupo I quando comparados com o Grupo II, nos dentes teste e nos dentes de controlo negativo. Estas diferenças entre grupos podem ser explicadas pelo excelente controlo de placa e condições de saúde periodontal presentes nos pacientes do Grupo I.
Este estudo demonstrou a tendência para um aumento dos níveis de citoquinas no FCG, em dentes sujeitos a forças mecânicas. O pequeno tamanho da amostra e variabilidade inerente dos níveis de citoquinas no FCG, nem sempre demonstrou um aumento claro e consistente dos níveis de IL-1β e FNT-α após a aplicação de força. Contrariamente, as concentrações dos 2 mediadores foram bastante estáveis, demonstrando uma curva plana linear, nos dentes onde não foram aplicados separadores (dentes controlo), para ambos os grupos de pacientes. Estes resultados estão de acordo com os resultados de outros estudos que demonstraram que o movimento leva ao aumento nas concentrações dessas citoquinas6,15,22. Neste estudo, os dentes submetidos a forças (dentes de teste) apresentaram um aumento constante de IL-1β de T1 e T2 para T3. Depois denotou-se um declínio de T3 para T4, onde atingiram valores muito semelhantes aos iniciais. Esta tendência também foi verificada previamente por outros autores, os quais também comprovaram que o pico mais elevado ocorre 24h após a aplicação da força16,22,23. Contudo, o nosso estudo apenas avalia as alterações decorridas entre 1h e uma semana após a aplicação de força, pelo que não foi possível confirmar este pico às 24h. Estes resultados indicam que a aplicação dos separadores ortodônticos leva a uma reação inflamatória, aumentando os níveis de IL-1β em pacientes tratados de periodontite, assim como em pacientes saudáveis.
Contrariamente ao que era afirmado por Dudic et al. (2006)23, os nossos resultados sugerem que a irritação mecânica não provém da colocação dos separadores, uma vez que a avaliação efetuada em T2, na maioria dos casos, apresentou níveis de IL-1β mais baixos do que os iniciais. Este facto foi igualmente suportado por outro autores16,25.
Basaran et al. (2006) verificaram que a distalização e o nivelamento de dentes aumentam significativamente os níveis de IL-1β e FNT- α no FCG (p>0,05)6. Este estudo também demonstra que o FNT-α pode surgir durante movimentos muito pequenos, o que se encontra de acordo com outros estudos22,24,25, mas não foi notada qualquer alteração significativa ao longo do período experimental.
Verificamos que a aplicação de separadores ortodônticos em pacientes saudáveis ou tratados de doença periodontal não conduz a alterações significativas nos parâmetros clínicos periodontais desde de que sejam mantidos baixos níveis de placa bacteriana. No entanto, a aplicação de força conduz a uma resposta local caracterizada pelo aumento dos níveis de IL-1 no fluido crevicular gengival.
São necessários mais estudos para determinar o papel das citoquinas no tratamento ortodôntico.
ConclusãoConcluindo, podemos sugerir que a força aplicada usando separadores elásticos não conduz a qualquer inflamação periodontal ou à alteração em qualquer outro parâmetro periodontal detetável clinicamente. No entanto, os elásticos provocaram alterações significativas nos níveis de IL- β em ambos os grupos de pacientes, independentemente do seu histórico periodontal.
Responsabilidades éticasProteção de pessoas e animais. Os autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dados. Os autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escrito. Os autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Dra. Itziar Gonzalez e Dra. Ana O’Connor do Laboratório de Microbiologia da Facultad de Odontología de la Universidad Complutense de Madrid pela execução das analises imunológicas.
Dr. Álvaro Azevedo e Prof. Conceição Manso pela execução da análise estatística.
A todos os voluntários que colaborar que participaram neste estudo.