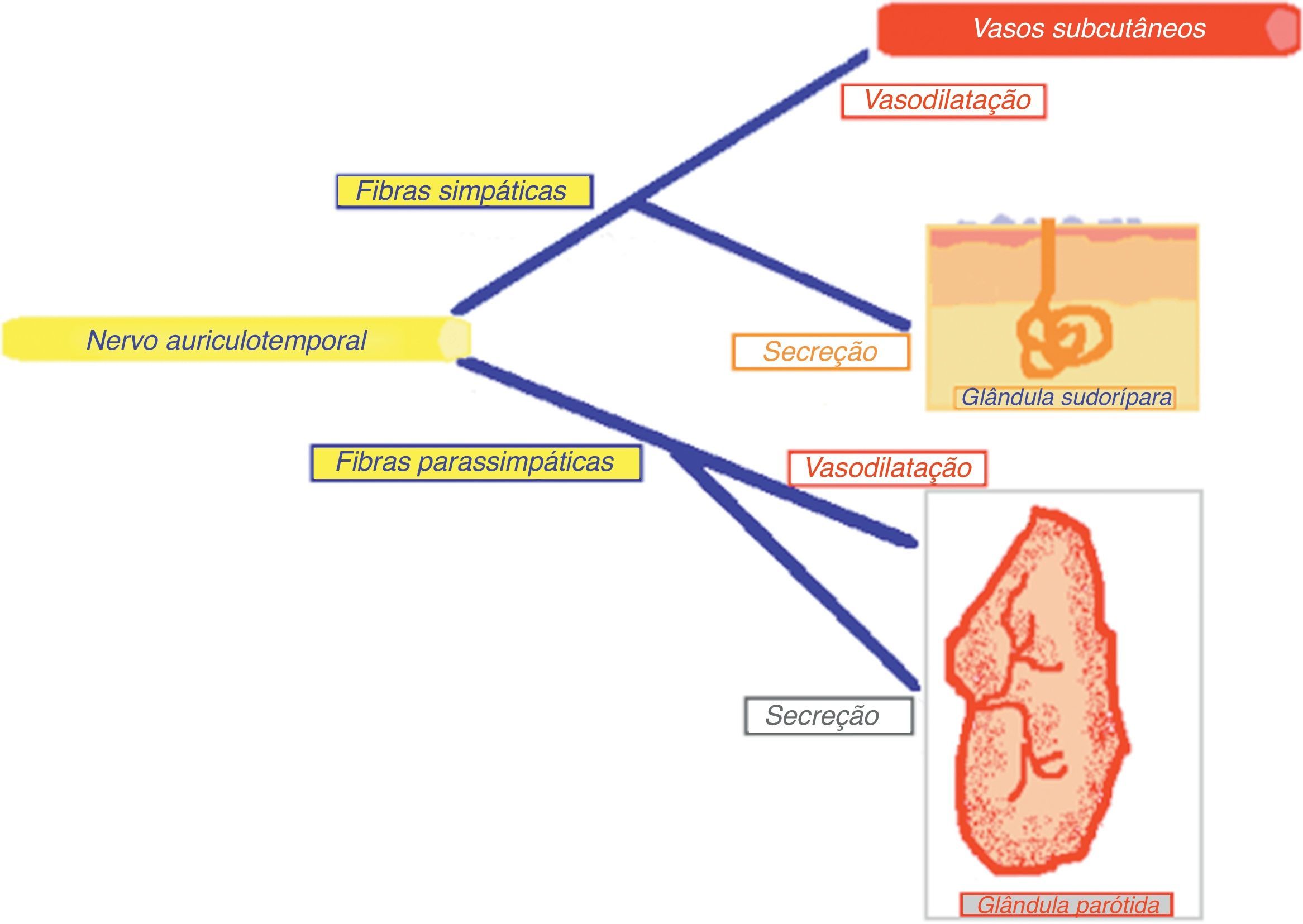
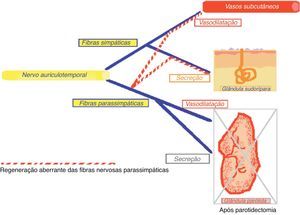
O Síndrome de Frey resulta de uma lesão irritativa ou mecânica das fibras vegetativas do nervo auriculotemporal. Esta lesão provoca uma regeneração aberrante das fibras parassimpáticas pós-ganglionares para os recetores das glândulas sudoríparas e vasos sanguíneos, provocando aumento da sensibilidade, eritema cutâneo e sudação durante a mastigação de alimentos.
MétodosEste trabalho foi realizado com base numa pesquisa bibliográfica realizada na base de dados PubMed, utilizando a combinação de palavras (mesh terms): «Frey's syndrome» or «Auriculotemporal syndrome» or «Gustatory sweating».
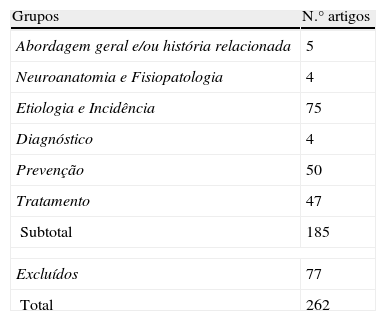
ResultadosNo total foram encontrados 262 artigos que foram publicados no período compreendido entre 1974-2012. Após a leitura dos resumos de cada artigo estes foram selecionados e categorizados a fim de facilitar a análise dos mesmos e excluir os menos relevantes para o estudo. Esta categorização permitiu atingir os objetivos deste trabalho que consistem em apresentar os aspetos principais relativos à Síndrome de Frey, nomeadamente a sua neuroanatomia, fisiopatologia, incidência, etiologia, diagnóstico, prevenção e tratamento.
Conclusão Dos doentes submetidos a parotidectomia, apenas uma pequena percentagem apresenta queixas espontâneas sugestivas deste síndrome. Deste modo, o uso rotineiro de procedimentos preventivos deve ser considerado e devidamente ponderado, uma vez que poderão mascarar possíveis recidivas tumorais a longo prazo. Por outro lado, a primeira opção de tratamento continua a ser a injeção de toxina botulínica tipo A.
Frey's syndrome is caused by a mechanical irritative lesion of the vegetative fibers from the auriculotemporal nerve. This lesion causes an abnormal regeneration of the post-ganglionic parasympathetic fibers to the receptors sweat gland and blood vessels, causing increases sensitivity, skin erythema and sudation during meals.
MethodsA literature search was performed in PubMed, using a combination of words (Mesh terms), such as «Frey's syndrome» or «syndrome Auriculotemporal» or «gustatory sweating».
Results262 articles, published between 1974 and 2012, were found. Papers were selected and categorized into several groups after reading their abstracts, to facilitate their analysis and exclude the less relevant to the study. This selection led to the achievement of the objectives of this paper, presenting the most relevant aspects of Frey's syndrome, including neuroanatomy, physiopathology, incidence, etiology, diagnosis, prevention and treatment.
ConclusionAmong the patients who had parotidectomies only a few mentioned spontaneously symptoms suggestive of Frey's syndrome. Therefore the routine use of preventive procedures must be previously and thoroughly considered since it may mask tumoral relapse in the long term. When treatment is needed, the first choice is, still, the injection of botulinum toxin type A.
Segundo estudos publicados, a primeira referência a sinais e sintomas sugestivos do Síndrome de Frey foi feita, em 1740, por Kastremsky, que descreveu o caso de um doente que apresentava uma sudação particular quando comia alimentos salgados. Seguiram-se outros relatos de casos semelhantes, como o descrito por Duphenix, em 1757, cit in Nicolai (1985)1, respeitante a um indivíduo ferido com um projétil de arma de fogo na região mandibular. No entanto, segundo o estudo de Dulguerov (1999)2, este caso teve como complicação uma fístula salivar e não o Síndrome de Frey. Deste modo, esse feito deve ser atribuído a Baillarger (1853) cit in O’Neill et al. (2008)3, que interpretou esta síndrome como sendo ocasionada pela obstrução do canal de Stenon, na sequência de uma parotidite não drenada.
A primeira descrição deste síndrome atribuindo-a à lesão do nervo auriculotemporal foi sugerida em 1923, pela Dra. Lucja Frey, uma neurologista polaca3–5. Descreveu-o como uma neuropatia vegetativa pós-ganglionar provocada pela lesão mecânica ou irritativa das fibras vegetativas (parassimpáticas e simpáticas) do nervo auriculotemporal no seu trajeto medial infra-temporal e/ou parotídeo.
Clinicamente manifesta-se por sudorese, eritema e calor no território da pele inervado pelo nervo auriculotemporal, não só com a mastigação dos alimentos, mas também com a visão, odor e imaginação dos mesmos, o que desencadeia o arco reflexo salivar3–6.
MétodosEste trabalho foi elaborado com base numa pesquisa bibliográfica realizada na base de dados primária Pubmed, utilizando a combinação das palavras (Mesh terms): «Frey's syndrome» ou «Auriculotemporal syndrome» ou «Gustatory sweating». A pesquisa bibliográfica foi reduzida ao selecionar apenas os artigos que apresentavam o resumo disponível na língua portuguesa, inglesa, francesa e espanhola. Foram incluídos apenas os trabalhos que se enquadravam em artigos científicos, artigos de revisão, meta-análises e casos clínicos. O intervalo temporal abrangeu o período compreendido entre 1974-2012, tendo sido identificados 262 artigos (tabela 1).
Na segunda fase do processo de seleção de artigos e com base na leitura dos seus resumos, estes foram grosseiramente categorizados em vários grupos de modo a facilitar a sua análise. Os grupos foram os seguintes: 1) Abordagem geral do tema e/ou história relacionada; 2) Neuroanatomia e Fisiopatologia; 3) Etiologia e Incidência; 4) Diagnóstico; 5) Prevenção; 6) Tratamento; 7) Excluídos. Neste último grupo estão os artigos excluídos do estudo, ou seja, aqueles que não possuíam qualquer informação que os permitisse integrar num dos grupos anteriores. Foram ainda excluídos os artigos que apenas referiam esta síndrome como tendo algum ponto em comum com um outro tema principal, sem acrescentar qualquer informação adicional. Deste modo, foram revistos 185 artigos, cuja distribuição se encontra apresentada na tabela 1.
Com vista a completar a informação sobre as bases neuroanatómicas desta síndrome, foi ainda consultado um atlas de anatomia da cabeça e pescoço.
NeuroanatomiaO nervo auriculotemporal tem origem no tronco posterior da terceira raiz do nervo trigémio (V). No seu percurso inicial dirige-se posteriormente, dando vários ramos para a articulação temporo-mandibular, passando por cima da artéria maxilar. Em seguida, contorna o bordo posterior do côndilo mandibular, penetrando depois na região parotídea. Atravessa o extremo superior da glândula parótida, mantendo uma estreita relação com os vasos temporais superficiais e ascende anteriormente ao canal auditivo externo, dividindo-se depois em numerosas ramificações na região temporal7–9.
Este nervo é composto tanto por fibras sensitivas como vegetativas. As fibras sensitivas (proprioceptivas e nociceptivas) vão inervar a articulação temporomandibular, o ouvido médio, o canal auditivo externo e o pavilhão auricular. Por sua vez, as fibras vegetativas transportam inervação simpática e parassimpática para a articulação temporomandibular, pele e anexos da região temporal, região pterigóideia e pavilhão auricular; fibras parassimpáticas para a glândula parótida e fibras simpáticas para as artérias meníngea média, timpânica anterior e temporal superficial7,8.
De uma forma simplista, a inervação simpática da glândula parótida vai provocar a vasoconstrição e secreção escassa de saliva espessa, enquanto a inervação parassimpática leva à vasodilatação e à secreção de saliva abundante e fluída.
Na salivação normal o arco reflexo é desencadeado ao visualizar o alimento, iniciando-se a nível das fibras pré-ganglionares aferentes que caminham em direção ao núcleo do trato solitário, que mantém comunicação com o núcleo salivatório superior e inferior. Estas fibras acompanham o nervo glossofaríngeo (ix), abandonando-o depois para se integrarem no nervo timpânico que atravessa a caixa do tímpano na sua parede interna, formando o plexo timpânico (nervo de Jacobson) ao longo do promontório. Segue, em seguida, através do nervo petroso menor até ao gânglio ótico, constituindo a principal aferência parassimpática deste gânglio. Aqui, estas fibras pré-sinápticas transmitem os estímulos para as fibras parassimpáticas pós-ganglionares que acompanham os ramos colaterais da terceira raiz do trigémio, sobretudo pelo nervo auriculotemporal até à glândula parótida3,8.
A inervação simpática da glândula segue pelas fibras simpáticas pré-ganglionares que têm origem a nível do núcleo intermédio lateral da substância cinzenta da coluna lateral a nível de D2, D3 e, por vezes, D4. Estas fibras seguem pela raiz anterior para o nervo espinhal da medula espinhal torácica e entram no tronco simpático por meio dos ramos comunicantes brancos. Uma vez no tronco simpático, ascendem e fazem sinapse com as fibras pós-ganglionares no gânglio cervical superior na base do crânio. Estas fibras vão acompanhar a artéria carótida externa e suas divisões, incluindo aquelas que irrigam a glândula parótida3,8.
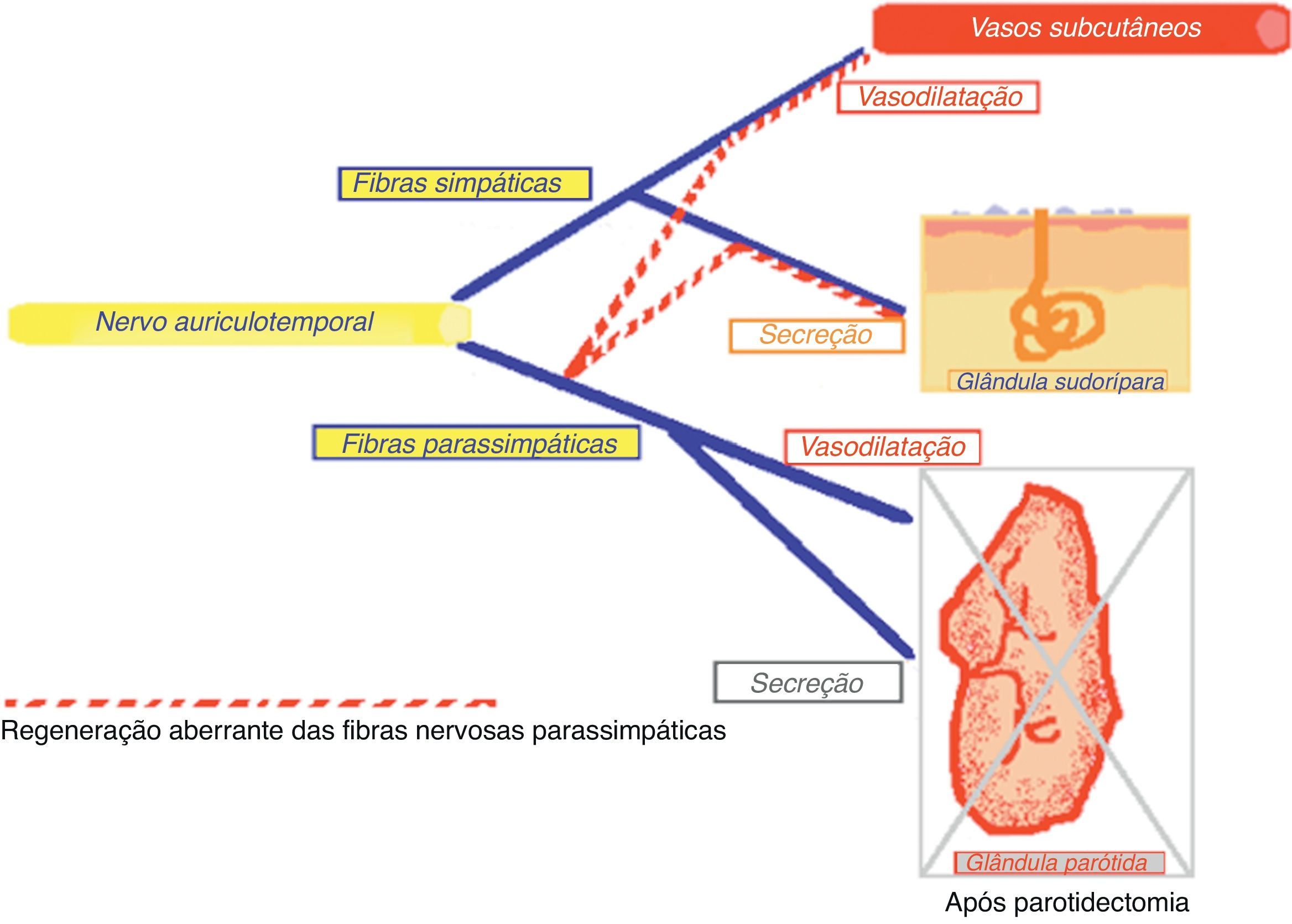
FisiopatologiaA teoria fisiopatológica mais aceite que explica o fenómeno do Síndrome de Frey, pela primeira vez proposta por Ford e Woodhall em 1958, cit in Rustemeyer et al. (2008)10, baseia-se no conceito de que quando o nervo auriculotemporal é lesado ocorre uma regeneração inadequada das fibras parassimpáticas pós-ganglionares do nervo auriculotemporal para os recetores das glândulas sudoríparas e vasos sanguíneos da pele. Assim, perante o estímulo que desencadeia o arco reflexo, em vez de ocorrer uma resposta natural de secreção salivar de origem parotídea, ocorre, por intermédio das terminações simpáticas da pele, a vasodilatação da circulação arterial subcutânea e estimulação das glândulas sudoríparas ocorrendo a sudação11,12 (figs. 1 e 2).
Uma outra hipótese de explicação baseia-se na teoria desenvolvida por Cannon, a teoria da desenervação autónoma7. Segundo esta, ao seccionar as fibras secretomotoras ocorre um fenómeno de hipersensibilidade das terminações sinápticas da glândula à noradrenalina e acetilcolina. Esta teoria explica a sintomatologia precoce, antes da regeneração nervosa ocorrer.
IncidênciaA maioria dos estudos referentes ao Síndrome de Frey apontam a parotidectomia como a sua causa principal, daí que a incidência declarada do síndrome seja na maioria das vezes respeitante à incidência do Síndrome de Frey após parotidectomia10,13. Dos 185 artigos analisados, 103 referiam a parotidectomia como causa do Síndrome de Frey. Todavia, a incidência correta do Síndrome de Frey continua a ser difícil de determinar e comparar, uma vez que os resultados vão variando dependendo do tipo de estudo em questão, dos critérios de diagnóstico adotados, da técnica cirúrgica utilizada e do follow-up que se aplica aos doentes em estudo. Por exemplo, Laskawi (1998)14, no seu estudo, de 296 doentes submetidos a parotidectomia cerca de 45% apresentavam o Síndrome de Frey como complicação. Por sua vez, Guntinas-Lichius (2006)15 obteve uma percentagem de 4% de 610 doentes estudados. No trabalho de De Ru (2006)16, de 45 doentes submetidos a parotidectomia somente 4 apresentavam sintomatologia, sendo que 2 tratavam-se de recidivas e os outros 2 de tumores malignos.
O início dos sintomas após parotidectomia também é variável, podendo ser após 2 meses, como o estudo de Rustemeyer (2007)10, ou 22 meses, como o estudo de Langdon (1984)17. Contudo, o início da sintomatologia pode ocorrer anos após o evento desencadeador18,19.
A incidência, dependendo do critério de diagnóstico (clínica/teste de Minor), no estudo prospetivo de Lindner et al. (1997)20 variou entre 43 e 96%, 12 meses após a intervenção cirúrgica, contrapondo com o estudo retrospetivo de Farrel e Kalnins (1991)21, que variou entre 14,3 e 42,8%, 18 meses após cirurgia. Isto realça o facto de que, numa grande percentagem de casos, os doentes, apesar de terem sintomas sugestivos de Síndrome de Frey como sequela da cirurgia, estes não interferem nas suas atividades de vida diária, sendo que apenas 10-15% dos doentes se queixam espontaneamente dos sintomas, ao passo que se questionados diretamente sobre eles, 30-40% respondem positivo6.
EtiologiaNa tabela 2 estão representadas as várias possíveis causas do Síndrome de Frey, assim como o número de artigos encontrados com referência às mesmas.
Etiologia da Síndrome de Frey e número de artigos respetivos
| Etiologia | N.° de artigos |
| Parotidectomia | 1036,10,13–113 |
| Ferimentos da região parotídea | 2114,115 |
| Fractura do côndilo mandibular | 3116-118 |
| Simpaticectomia toracoscópica | 4119-122 |
| Dissecção ganglionar cervical | 4123-126 |
| Submandibulectomia | 614,126–130 |
| Incisão pré-auricular de abordagem à articulação temporo-mandibular | 2131,132 |
| Infeção herpética | 1133 |
| Tumor de Pancoast | 1134 |
| Meningioma do ângulo pôntico-cerebeloso | 1135 |
| Retalho livre sobre a região parotídea | 1136 |
| Endarterectomia carotídea | 1137 |
| Osteotomia mandibular tipo Obwegeser | 1138 |
| Diabetes Mellitus | 6139–144 |
| Idade pediátrica | 12145-156 |
| Trauma/parto distócito | 9146,147,150,151,156 |
| Idiopático | 4145,146,148,149,152–155 |
| Tiroidectomia | 1157 |
| Idiopático | 6158-163 |
Tal como já foi referido anteriormente, a parotidectomia superficial ou total constitui a causa mais vezes relacionada com o Síndrome de Frey, tendo sido reconhecida esta ligação inicialmente por Bassoe, em 19323. Ainda relacionados com a glândula parótida, os abcessos parotídeos e parotidites, assim como os traumatismos dessa região, também foram apontados como possíveis causas114,115,133.
O nervo auriculotemporal, na região parotídea, descreve uma curva horizontal em contacto direto com o periósteo do bordo posterior do cólo do côndilo8. Esta estreita relação do nervo com a cápsula articular da articulação temporomandibular predispõe a que qualquer grau de mobilização do cólo do côndilo no decurso de uma intervenção cirúrgica ou traumatismo possa comprometer as fibras vegetativas do mesmo116–118,131,132.
As dissecções cervicais radicais e as submaxilectomias podem causar Síndrome de Frey, não por lesão do nervo auriculotemporal, mas por lesão do nervo lingual14,123–130. A inervação parassimpática da glândula submandibular segue um trajeto diferente. O arco reflexo inicia-se no núcleo salivatório superior e as fibras pré-ganglionares seguem pelo nervo intermédio do nervo facial, depois pela corda do tímpano, abandonando-a em seguida para se integrarem nas fibras no nervo lingual, acabando por fazer sinapse no gânglio submandibular. A partir daqui as fibras pós-ganglionares vão levar a inervação parassimpática à glândula submandibular e estimular a secreção de saliva8.
Este síndrome, embora em poucos casos, foi descrito em doentes com idade pediátrica, estando, na maioria das vezes, associado a traumatismos obstétricos em partos distócitos com o uso de fórceps146,147,150,151,156. Nestes casos é importante fazer o diagnóstico diferencial com alergias alimentares145–156.
Este síndrome também foi descrito em casos de neuropatia diabética139–144 e tumores do sistema nervoso central135.
Por outro lado, foram vários os casos clínicos apresentados em que não se chegou a uma conclusão concreta sobre a sua etiologia158–163. Contudo, foi apontada a inflamação primária do nervo ou secundária a processos inflamatórios adjacentes (por exemplo, otites externas de repetição) como possível causa161–163.
DiagnósticoO diagnóstico é sobretudo clínico, confirmado pelo clássico, rápido, simples e barato teste de Minor, proposto por este autor, em 1927.
Este teste consiste em pintar a região pré-auricular, retromandibular, temporal e cervical com uma solução iodada. Após a solução iodada secar, polvilha-se toda a área com uma fina camada de pó de amido. Em seguida dá-se ao doente um estímulo oral como sumo de limão. O aparecimento de áreas puntiformes, de coloração violácea, informa que as glândulas se encontram ativas no local. Estas áreas são depois marcadas, fotografadas e medidas através de uma escala estandardizada86,101,110.
Existem outros métodos mais sofisticados como uma versão do teste de Minor em que se utiliza uma película de papel que tem previamente a solução iodada incorporada (ISPH – iodine-sublimated paper histogram)164. Este mesmo autor apresenta uma outra técnica que consiste em colocar uma folha de papel absorvente sobre a área afetada e usar a diferença do peso antes e depois do estímulo oral para medir a quantidade de sudação164.
Outros métodos foram sugeridos em que se utiliza um biosensor enzimático capaz de detetar L-Lactato na pele intacta após o estímulo, sem necessidade de nenhum reagente químico165,166. A aplicação da termografia foi apresentada como um teste não invasivo, fácil, capaz de analisar qualitativamente a resposta capilar cutânea no Síndrome de Frey167.
As alternativas apresentadas ao teste de Minor, embora mais complexas na sua execução e de necessitarem de material específico, são adequadas a doentes alérgicos ao iodo.
PrevençãoA prevenção do Síndrome de Frey relacionada com a parotidectomia assenta em 2 conceitos principais. O primeiro consiste em minimizar o mais possível a ferida do leito parotídeo, sendo que a parotidectomia superficial está associada a uma menor incidência que parotidectomia total32,40,47,48. O estudo de Leverstein (1997)38 obteve uma incidência de Síndrome de Frey após parotidectomias superficiais parciais de 6,9% (9 em 131 doentes estudados) e 13,1% (8 em 61 doentes) após parotidectomias totais. Por sua vez, no seu estudo de 2004, Papadogeorgakis apresentou uma percentagem de 4,8% após parotidectomias superficiais29 e de 4% no seu estudo de 201139. O segundo conceito, desenvolvido por Kohnblunt et al. (1977)13, baseia-se na teoria de que a interposição de uma barreira entre o leito parotídeo e a pele que o recobre impede a regeneração aberrante das fibras parassimpáticas27.
Num trabalho levado a cabo por Singleton e Cassisi (1980)36 considerou-se a possibilidade de que a espessura do retalho de pele pudesse influenciar a incidência do Síndrome de Frey. Apesar de compararem apenas retalhos de pele fina e extremamente fina, concluíram que a incidência do síndrome em retalhos de pele mais grossa, levantados com uma tesoura de dissecção, era menor em comparação com retalhos de pele mais fina, levantados ao nível dos folículos pilosos usando um bisturi elétrico.
As barreiras de interposição podem ser autólogas e não autólogas. Relativamente às primeiras, e de uma forma muito simplista, estas podem ser selecionadas mediante o tamanho do defeito facial decorrente da parotidectomia. Se este for inferior a 3cm, o sistema musculoaponevrótico superficial (SMAS) e platisma é o preferido. Para defeitos faciais superiores a 3cm, o SMAS platisma associado ao retalho rotacional do músculo esternocleidomastoideo (ECM) pode ser utilizado assim como o retalho rotacional de fáscia temporoparietal (FTP) isolado ou associado ao SMAS-platisma ou retalho rotacional ECM46,47,72,82.
O retalho de SMAS-platisma, pela primeira vez descrito por Allison e Rappaport (1993)60, é o retalho descrito com mais artigos publicados. Consiste na dissecção e sutura do mesmo à glândula remanescente, ao músculo ECM, ao pericôndrio do canal auditivo externo e, eventualmente, à apófise mastoideia85. A variante deste retalho proposto por Höning (2005)75 consiste num SMAS híbrido em que uma malha de Vicryl® é englobada no SMAS dobrado, tornando-o assim mais robusto e impossibilitando de forma mais eficaz a regeneração aberrante das fibras nervosas.
Dada a estreita relação do SMAS com a cápsula da glândula parótida, este retalho é contraindicado em casos em que o tumor invade a cápsula da glândula50,54,63. Este retalho tem o inconveniente de se poder lesar o nervo grande auricular alterando a sensibilidade facial. O benefício estético de correção do defeito facial é alcançado, assim como a prevenção da síndrome, como vários trabalhos corroboram41,43,44,52,55,56,58,68,72,76,83,84.
O retalho rotacional da FTP, inicialmente descrito por Zaoli (1989), é de fácil acesso, ao estender a incisão da parotidectomia ao couro cabeludo temporal. Trata-se de um retalho muito bem vascularizado, robusto, ideal em caso de parotidectomias totais. Uma vez que é completamente separado do leito parotídeo não tem partes suscetíveis que possam ser lesionadas durante a parotidectomia, nem compromete as margens de segurança na exérese do tumor, ao contrário do que acontece com os outros retalhos61,98. No estudo de Ahmed e Kohle (1999)67 este retalho reduziu a incidência subjetiva do Síndrome de Frey para 8% e a incidência objetiva para 17% num total de 24 doentes, para além de obter um bom resultado estético. Cestelein et al. (2002)72 associando o retalho FTP ao SMAS reduziu a incidência do Síndrome de Frey para 4%. No entanto, este tipo de retalho requer um tempo acrescido de cerca de 45 minutos no tempo operatório, acarretando ainda o risco de lesar o ramo frontal do nervo facial, provocar alopecia e levar à atrofia do músculo temporal.
O retalho rotacional do ECM pode ser colhido sem necessidade de estender a incisão, logo não há cicatriz adicional e não há risco de alopecia comparando com retalho anterior. Os resultados obtidos com este retalho são controversos. O benefício estético pretendido é conseguido, mas existe uma possibilidade de atrofia muscular suficiente que permita a passagem das fibras através dos fascículos musculares em direção à pele, não tendo assim nenhum efeito na prevenção do Síndrome de Frey. Alguns trabalhos publicados não apontaram para nenhum benefício deste retalho na prevenção desta síndrome10,35,46,51,53,71. Em contrapartida, outros obtiveram bons resultados, atribuindo o facto ao terem utilizado uma variante de retalho que cobria completamente o leito parotídeo56,65,74,77.
Outras alternativas como barreiras autólogas foram apresentadas por outros autores. Biglioli (2007)42 aplicou um retalho livre paraescapular após remoção da epiderme que interpôs entre o leito parotídeo e a pele, tendo obtido bons resultados estéticos e preventivos relativamente ao Síndrome de Frey. Hegazy et al. (2011)49 sugeriram um retalho com um pedículo posterior de fáscia de glândula parotídea como barreira de interposição e Yoo et al. (2011)78 apenas um enxerto de pele com gordura subcutânea ainda aderente.
No que diz respeito às barreiras de interposição não autólogas, Dulguerov et al. (1999)164 orientaram um estudo em que comparavam a eficácia da polyglactin 920 (Vicryl®) + Polydioxanone (Ethisorb®), dura liofilizada (Lyodura®), politetrafluoroetileno expandido (e-PTFE®) e matriz dérmica acelular (Alloderm®). Concluíram que, de uma forma geral, quanto menos reabsorvido for o material utilizado, maior será a sua eficácia, tendo obtido os melhores resultados com o e-PTFE®. Este não é reabsorvido, apresenta uma boa biocompatibilidade e uma diminuta reação tecidular. Neste estudo a incidência subjetiva diminuiu para 3% e a incidência objetiva para 10%. O risco de fístula salivar inerente a este tipo de material deve-se a que estimula a secreção salivar, embora a ausência de exteriorização, durante uma média de 2 anos de follow-up, encoraje o seu uso62.
Melhores resultados e com menores efeitos secundários foram conseguidos com a utilização de matriz dérmica acelular45,59,64,70,73,80,81. No estudo de Ye et al. (2008)80 apenas 2% dos doentes apresentaram queixas subjetivas de Síndrome de Frey quando utilizaram este método, ao passo que no grupo em que se realizou a parotidectomia superficial sem qualquer barreira de interposição 67% dos doentes apresentaram queixas. Singh et al. (2001)79 sugeriram uma barreira de celulose regenerada oxidada, tipo Surgicel®, sem referência a complicações.
Segundo o trabalho de Bonanno et al. (2000)69 os sintomas debilitantes do Síndrome de Frey podem ser evitados com um planeamento cirúrgico rigoroso. Assumindo que a história e patologia do doente não contraindique a utilização do retalho SMAS-platisma este deve ser considerado como opção standard na prevenção desta síndrome após parotidectomias. Caso este retalho não esteja disponível, o retalho rotacional de fáscia temporoparietal fornece uma boa alternativa.
Em conclusão, no que diz respeito à prevenção deste síndrome, as barreiras de interposição autóloga têm a vantagem em relação às não autólogas de apresentarem um menor risco de infeção e rejeição, assim como de formação de fístulas salivares. Todavia, apresentam uma maior morbilidade local, cirurgicamente são mais difíceis de executar e mais morosas, para além de que a sua disponibilidade é limitada. Uma grande desvantagem das barreiras autólogas, mas que também se podem atribuir às não autólogas, diz respeito ao facto de poderem mascarar eventuais recidivas tumorais, sendo esta a preocupação mais importante a ter em conta.
TratamentoO tratamento do Síndrome de Frey apenas se justifica nos casos em que interfira nas atividades de vida diária do doente ou lhe cause tal embaraço social que este deseje tratamento. Curiosamente, somente uma pequena percentagem de doentes se queixam espontaneamente de sudação ou eritema após as refeições e, na maioria dos casos, os doentes ficam satisfeitos com a explicação do fenómeno. Kornblut (1977)13 analisou 70 doentes e destes, 23 apresentavam queixas subjetivas e nenhum tinha queixas incapacitantes.
Os tratamentos disponíveis podem ser cirúrgicos ou medicamentosos6,107.
Os tratamentos cirúrgicos mais vezes utilizados consistem na reelevação da pele e interposição de barreiras de vários tecidos tal como retalhos de fáscia temporoparietal ou de matriz dérmica acelular, entre o leito parotídeo e a pele87,98,168. Outra alternativa cirúrgica consiste na reelevação do retalho de pele e excisão da pele envolvida, seguidas de um enxerto de pele. Estas 2 técnicas têm a desvantagem de criar uma cicatriz adicional e arriscar lesar o nervo facial.
A técnica cirúrgica proposta por Gardner e McCubbin (1956)92 consiste na secção do nervo glossofaríngeo, tendo sido abandonada devido à morbilidade inerente.
A neurectomia timpânica parece ser dos métodos invasivos o que tem melhores resultados e menos complicações, contudo, os seus efeitos são temporários88. Consiste em seccionar o plexo timpânico, mais especificamente o nervo de Jacobson a nível do promontório no ouvido médio6,169.
Uma alternativa recente, proposta por Toretta et al. (2011)170, consiste na injeção de lipoaspirado, colhido previamente da parede abdominal, sob as áreas de pele envolvidas, evidenciadas pelo teste de Minor. Esta técnica é exequível com anestesia local, bem tolerada e segura, nomeadamente no que diz respeito ao risco de lesar o nervo facial. O benefício estético desejado, assim como a prevenção do Síndrome de Frey, é alcançado após vários tratamentos. No entanto, tratando-se de um procedimento recente e com o risco inerente de absorção da gordura, são necessários estudos futuros para confirmar a sua eficácia.
O tratamento farmacológico com agentes anticolinérgicos, como oxibutinina141, a escopolamina113,114 e o glicopirrolato89,143,171,172 têm uma eficácia muito variável, necessitando de ajustes de dosagem frequente6,88,91,173,174. A visão turva, boca seca e retenção urinária são os efeitos secundários mais frequentes, estando ainda contraindicados em doentes com glaucoma.
Os antitranspirantes tópicos, como o cloreto de alumínio, atuam diretamente sobre as glândulas sudoríparas, levando à sua atrofia progressiva e obstrução mecânica dos ductos glandulares. Inicialmente, devem ser aplicados diariamente e depois as aplicações necessárias vão diminuindo90,175.
A radioterapia, de facto, diminui a incidência do Síndrome de Frey mas não é indicação isolada para radioterapia pós-operatória devido aos seus efeitos secundários. No estudo de Casler e Conley (1991)56 somente 14% dos 14 doentes que receberam radioterapia apresentaram sudação, enquanto 51% dos 93 doentes que não receberam radioterapia tinham essas queixas.
Desde que foi proposto por Drobik e Laskawi (1995)176 que o tratamento do Síndrome de Frey com injeções intradérmicas de toxina botulínica tipo A tem sido a primeira opção terapêutica101–104,106,111,112,119,177–180. A neurotoxina entra no citoplasma das células nervosas e inibe irreversivelmente a libertação pré-sináptica de acetilcolina na junção neuromuscular.
O seu efeito é temporário devido à regeneração nervosa, mas as recorrências serão progressivamente mais espaçadas e de menor intensidade com a repetição dos tratamentos6,97,105,110,181,182.
O início de ação ocorre logo após 2 dias da aplicação e tem uma duração variável de 7-9 meses, segundo o estudo de Laccourreye et al. (1999)181, até 11-27 meses, de acordo com o de Laskawi et al. (1998)93, tendo outros estudos obtido resultados similares86,92–97,99,110,130,183.
O procedimento é simples e passível de ser realizado com anestesia local com o mínimo desconforto. É seguro, tendo apenas pequenos efeitos secundários e transitórios como reações locais agudas - dor, eritema, equimoses, hipostesia e reação alérgicas181,184,185. A possibilidade de difusão às terminações nervosas faciais resultando em parésias e hipostesias faciais temporárias são evitáveis se se mantiver a injeção da toxina nos tecidos subcutâneos86,94,96,97,183,184.
Resumidamente, antes de se proceder à administração da toxina, a área afetada é evidenciada pelo teste de Minor e divididas as zonas positivas em quadrados de 1cm2. Em seguida é aplicada anestesia local com lidocaína (15min antes) ou creme EMLA (durante 45min). Procede-se então à administração com uma agulha subcutânea 0,1ml numa concentração de 2,5U/0,1 ml de toxina botulínica em cada 1cm2 de área97,130,186. Arad-Cohen e Blizer (2000)100 sugeriram repetir o tratamento 2 a 4 semanas após em áreas persistentemente positivas. Luna-Ortiz K et al. (2007)179 conseguiram no seu estudo uma resposta de 79% ao utilizar uma concentração de 1,41MU/cm2 nas áreas atingidas.
Relativamente aos casos resistentes ainda não existem estudos suficientes que confirmem a segurança da toxina botulínica tipo A em doses mais elevadas, embora o estudo de Guntinas-Lichius et al. (2002)187 aponte para melhores resultados comparativamente às doses usuais. Cantarella et al. (2010)108 propôs o serotipo B da toxina botulínica como uma possível alternativa à do tipo A.
Conclusões- •
O síndrome de Frey deve-se a uma lesão mecânica ou irritativa das fibras vegetativas do nervo auriculotemporal no seu trajeto infratemporal e/ou parotídeo;
- •
Clinicamente, manifesta-se por aumento da sensibilidade + eritema + sudação durante a mastigação dos alimentos nas áreas de pele inervadas pelo nervo auriculotemporal;
- •
A causa mais vezes relacionada com Síndrome de Frey é a parotidectomia;
- •
A incidência do Síndrome de Frey difere substancialmente se o diagnóstico for apenas clínico ou recorrendo ao teste de Minor;
- •
Os métodos mais eficazes de prevenir o Síndrome de Frey consistem em minimizar a ferida do leito parotídeo (Parotidectomia superficial) e na interposição de uma barreira entre o leito parotídeo e a pele que o recobre;
- •
As barreiras de interposição podem ser autólogas (SMAS-platisma, retalho rotacional de fáscia temportoparietal e retalho rotacional do esternocleidomastoideo) e não autólogas (Polyglactin + Polydioxanone, Dura liofilizada, Politetrafluoroetileno expandido e matriz dérmica acelular);
- •
Para defeitos faciais pós-parotidectomia <3m o SMAS-platisma é o mais indicado, enquanto para defeitos faciais >3cm se podem utilizar o SMAS-platisma associado ao retalho rotacional de ECM ou o retalho rotacional de fáscia temporoparietal isolado ou associado à alternativa anterior;
- •
A interposição de barreiras pode mascarar possíveis recidivas e dificultar o seu diagnóstico precoce;
- •
Das barreiras não autólogas, as que têm melhores resultados são o e-PTFE e a matriz dérmica acelular;
- •
O tratamento pode ser cirúrgico ou farmacológico, sendo que a injeção de toxina botulínica tipo A continua a ser a primeira opção terapêutica.
Os autores declaram não haver conflito de interesses.