Os citostáticos são genotóxicos e não completamente seletivos para as células neoplásicas, podendo afetar o genoma das células normais. Está comprovada a sua genotoxicidade em modelos experimentais e doentes tratados com quimioterapia. Os profissionais de saúde responsáveis pela sua preparação e administração apresentam risco de sofrer efeitos adversos para a saúde, tendo sido comprovado por diversos estudos haver contaminação generalizada do ambiente e de superfícies de trabalho. Os procedimentos de segurança e equipamentos de proteção individual têm sido insuficientes para evitar a absorção, evidenciada por quantidades mensuráveis de citostáticos na urina, e o aumento de indicadores biológicos de genotoxicidade. São revistos os efeitos para a saúde decorrentes desta exposição.
Anticancer drugs share DNA-damaging properties affecting not only target-cells, but also non tumour cells. Its genotoxicity has been demonstrated in experimental models and in cancer patients treated with chemotherapy. Health care personnel involved in the preparation and administration of these agents are at risk for adverse health effects, since environmental sampling studies demonstrated widespread contamination of work surfaces and utensils. Adherence to safety guidelines and proper use of personal protective equipment are insufficient to prevent significant absorption, evidenced by the presence of detectable amounts of drugs in urine samples and increased frequency of genotoxicity biomarkers. The evidence regarding adverse health effects on workers occupationally exposed to anticancer agents is reviewed.
Os fármacos antineoplásicos são cada vez mais utilizados quer na terapêutica de doenças malignas quer com intuitos profiláticos (terapêutica adjuvante) e num espetro crescente de patologia benigna (doenças autoimunes, doenças inflamatórias crónicas do foro gastroenterológico ou reumatológico, entre outras). Têm em comum o facto de poderem lesar o genoma celular (efeito genotóxico). Idealmente, deveriam afetar apenas as células neoplásicas; os fármacos disponíveis, no entanto, embora afetem preferencialmente as células malignas, são relativamente inespecíficos, afetando simultaneamente o genoma das células normais e condicionando assim efeitos adversos para a saúde quer dos doentes tratados quer dos profissionais de saúde a eles expostos.
A genotoxicidade dos citostáticos tem sido evidenciada por estudos in vitro em diversos tipos de células. Yamada (2000)1, por exemplo, demonstrou a existência de aberrações cromossómicas e de mutações induzidas pela exposição a 5 citostáticos numa linha celular linfoide. Boos2 estudou os efeitos dos inibidores da topoisomerase ii sobre células linfoides de ratinho e verificou que estes induziram um aumento da frequência de micronúcleos e do grau de lesão do ADN medido pelo comet assay. Aydemir3 avaliou os efeitos genotóxicos da gemcitabina in vitro sobre linfócitos humanos utilizando o teste de aberrações cromossómicas e o teste de troca de cromátides irmãs (Sister Chromatid Exchange - SCE), tendo verificado que induz um aumento significativo de ambos em todas as concentrações testadas. Num estudo mais recente, demonstrou-se que o etoposido partilha com o metabolito do benzeno hidroquinona a capacidade de originar endorreduplicação cromossómica (amplificação do ADN sem a divisão celular correspondente), mecanismo que pode levar a hiperploidia4.
A genotoxicidade dos citostáticos tem sido também demonstrada in vivo em modelos de ratinho, nomeadamente sobre as células hematopoiéticas da medula óssea (aumento da frequência de aberrações cromossómicas e de micronúcleos)5,6 e sobre as células espermáticas (aneuploidia e aberrações cromossómicas estruturais, detetadas por hibridização in situ)7.
Existem ainda estudos evidenciando a genotoxicidade dos citostáticos em doentes com cancro tratados com estes agentes, traduzida num aumento da frequência de micronúcleos8–11 e no aumento do grau de lesão do ADN medido pelo comet assay12.
Em profissionais expostos a citostáticos, várias publicações referem uma frequência aumentada de diversos indicadores biológicos de genotoxicidade como sejam aberrações cromossómicas13–18, troca de cromátides irmãs15,17,19–21, micronúcleos19,22,23, lesão do ADN detetada por comet assay24–28 e mutações29,30, geralmente avaliadas em linfócitos do sangue periférico.
Exposição ocupacional a citostáticosPara além dos doentes com cancro, expostos a efeitos genotóxicos sobre as células normais por inerência da terapêutica da sua patologia, determinados grupos profissionais estão expostos, pelas exigências da sua atividade de trabalho, a estes fármacos. Destacam-se os profissionais de enfermagem, responsáveis pela administração da terapêutica citostática, e os profissionais das farmácias hospitalares, responsáveis pela sua preparação.
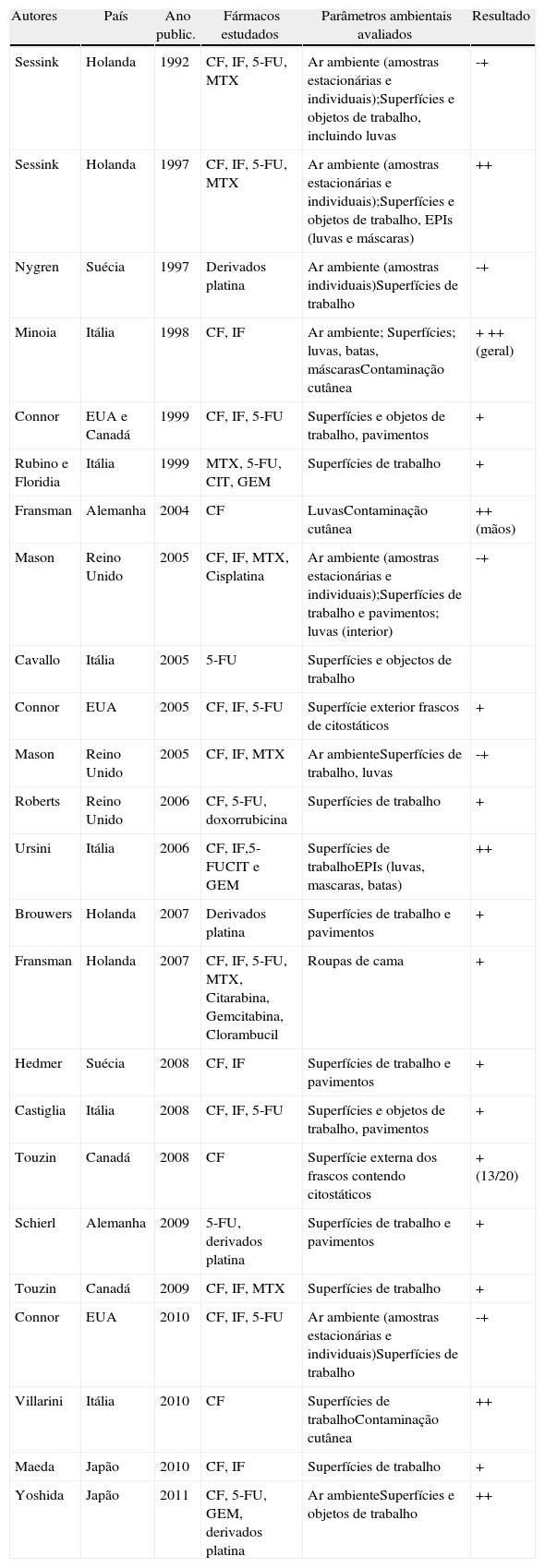
A exposição profissional parece ocorrer preferencialmente por via cutânea, resultante da manipulação direta dos fármacos ou contacto com superfícies e equipamentos contaminados31,32. Diversos estudos confirmam que existe contaminação generalizada das superfícies de trabalho, paredes, pavimentos, roupas de vestir e de cama de doentes tratados e recipientes que contêm ou contiveram secreções e excreções destes em todas as situações de trabalho, quer ao nível da preparação pelos técnicos de farmácia quer ao nível da administração pelos profissionais de enfermagem (quadro 1). Os doentes tratados eliminam quantidades importantes de citostáticos através das secreções e excreções após a terapêutica e constituem assim uma possível fonte adicional de contaminação31. Fransman32, por exemplo, demonstrou existirem quantidades significativas de citostáticos nas roupas de cama de doentes tratados, justificando a recomendação de que estas sejam transportadas em separado e sujeitas a pré-lavagem antes de serem misturadas com as restantes roupas33.
Estudos da contaminação do ar ambiente e de superficies/equipamentos de trabalho
| Autores | País | Ano public. | Fármacos estudados | Parâmetros ambientais avaliados | Resultado |
| Sessink | Holanda | 1992 | CF, IF, 5-FU, MTX | Ar ambiente (amostras estacionárias e individuais);Superfícies e objetos de trabalho, incluindo luvas | -+ |
| Sessink | Holanda | 1997 | CF, IF, 5-FU, MTX | Ar ambiente (amostras estacionárias e individuais);Superfícies e objetos de trabalho, EPIs (luvas e máscaras) | ++ |
| Nygren | Suécia | 1997 | Derivados platina | Ar ambiente (amostras individuais)Superfícies de trabalho | -+ |
| Minoia | Itália | 1998 | CF, IF | Ar ambiente; Superfícies; luvas, batas, máscarasContaminação cutânea | + ++ (geral) |
| Connor | EUA e Canadá | 1999 | CF, IF, 5-FU | Superfícies e objetos de trabalho, pavimentos | + |
| Rubino e Floridia | Itália | 1999 | MTX, 5-FU, CIT, GEM | Superfícies de trabalho | + |
| Fransman | Alemanha | 2004 | CF | LuvasContaminação cutânea | ++ (mãos) |
| Mason | Reino Unido | 2005 | CF, IF, MTX, Cisplatina | Ar ambiente (amostras estacionárias e individuais);Superfícies de trabalho e pavimentos; luvas (interior) | -+ |
| Cavallo | Itália | 2005 | 5-FU | Superfícies e objectos de trabalho | |
| Connor | EUA | 2005 | CF, IF, 5-FU | Superfície exterior frascos de citostáticos | + |
| Mason | Reino Unido | 2005 | CF, IF, MTX | Ar ambienteSuperfícies de trabalho, luvas | -+ |
| Roberts | Reino Unido | 2006 | CF, 5-FU, doxorrubicina | Superfícies de trabalho | + |
| Ursini | Itália | 2006 | CF, IF,5-FUCIT e GEM | Superfícies de trabalhoEPIs (luvas, mascaras, batas) | ++ |
| Brouwers | Holanda | 2007 | Derivados platina | Superfícies de trabalho e pavimentos | + |
| Fransman | Holanda | 2007 | CF, IF, 5-FU, MTX, Citarabina, Gemcitabina, Clorambucil | Roupas de cama | + |
| Hedmer | Suécia | 2008 | CF, IF | Superfícies de trabalho e pavimentos | + |
| Castiglia | Itália | 2008 | CF, IF, 5-FU | Superfícies e objetos de trabalho, pavimentos | + |
| Touzin | Canadá | 2008 | CF | Superfície externa dos frascos contendo citostáticos | + (13/20) |
| Schierl | Alemanha | 2009 | 5-FU, derivados platina | Superfícies de trabalho e pavimentos | + |
| Touzin | Canadá | 2009 | CF, IF, MTX | Superfícies de trabalho | + |
| Connor | EUA | 2010 | CF, IF, 5-FU | Ar ambiente (amostras estacionárias e individuais)Superfícies de trabalho | -+ |
| Villarini | Itália | 2010 | CF | Superfícies de trabalhoContaminação cutânea | ++ |
| Maeda | Japão | 2010 | CF, IF | Superfícies de trabalho | + |
| Yoshida | Japão | 2011 | CF, 5-FU, GEM, derivados platina | Ar ambienteSuperfícies e objetos de trabalho | ++ |
CF: ciclofosfamida; IF: ifosfamida; 5-FU: 5-fluoruracilo; MTX: metotrexato; CIT: Citosina arabinosido; GEM: Gemcitabina.
Apesar da utilização, atualmente quase generalizada, de câmaras de fluxo laminar vertical, demonstrou-se que existe contaminação das superfícies exteriores da câmara e de zonas relativamente distantes, resultante quer da dispersão aérea do agente quer de transferência por mãos e objetos contaminados34. Foi detetada contaminação de paredes, pavimentos, bancadas e dos mais diversos equipamentos e objetos de trabalho. Cavallo35, por exemplo, detetou contaminação no exterior das bombas infusoras, nos braços das cadeiras usadas para administrar os citostáticos e nas tampas dos contentores de resíduos. Brouwers et al.36, num estudo conduzido em 7 farmácias hospitalares holandesas, detetaram contaminação em 94% das amostras provenientes de diversas superfícies, nomeadamente no exterior das câmaras de fluxo laminar, pavimentos, trincos das portas, manípulos dos sistemas de transferência de citostáticos e prateleiras das zonas de armazenamento.
A introdução das atuais ampolas seladas representou uma melhoria substancial em relação ao uso das antigas, que tinham de ser quebradas para extração do conteúdo. No entanto, a superfície externa destas ampolas está frequentemente contaminada, contribuindo para a exposição cutânea a estes agentes37,38. Touzin38, por exemplo, detetou contaminação externa com ciclofosfamida em 13 de 20 ampolas analisadas. Algumas soluções de citostáticos podem permear as seringas, passando diretamente para as mãos do trabalhador39. Foi detetada ainda contaminação da superfície exterior das embalagens contendo citostáticos, antes da abertura, sugerindo que é necessária a proteção mesmo durante o desembalamento39.
A maior parte dos estudos descrevem níveis mais elevados de contaminação nas zonas de preparação em relação às de administração40,41, mas a frequência de amostras positivas é frequentemente semelhante41. Nas zonas de administração, alguns estudos sugerem diferenças entre o ambulatório (hospital de dia) e o internamento (enfermaria), associando-se este último a maiores níveis de contaminação42.
Por outro lado, existem dados que indiciam que diversas das medidas de prevenção utilizadas têm eficácia limitada. A eficiência das câmaras de fluxo laminar vertical tem sido contestada, particularmente para a ciclofosfamida, que pode vaporizar à temperatura ambiente, originando partículas inferiores aos poros dos filtros HEPA (High Efficency Particulate Air)31. De modo mais significativo ainda, todas as luvas têm revelado em trabalhos experimentais serem permeáveis aos citostáticos. Nos anos 80, Connor43 estudou a permeabilidade de luvas de látex e de PVC à carmustina e verificou que todas apresentavam permeação aos 90 minutos, sugerindo que a proteção oferecida é insuficiente. Os mesmos resultados obtiveram Laidlaw44, que estudou a permeabilidade de luvas de látex e PVC a 20 agentes citostáticos, tendo demonstrado haver permeação a todos eles, com uma intensidade dependente da espessura das luvas. Colligan45 estudou, também em condições experimentais, a permeabilidade dos mesmos 2 tipos de luvas à ciclofosfamida e verificou que os primeiros sinais de permeação ocorreram aos 10 minutos no caso das luvas de látex e aos 20 minutos no caso das luvas de PVC. Num estudo mais recente, foi testada a permeabilidade de 13 tipos diferentes de luvas (incluindo látex, PVC, nitrilo e neopreno) a diversos citostáticos, tendo sido demonstrado que, após uma hora, todos os materiais apresentavam permeação, baixa mas significativa, a pelo menos um dos citostáticos testados46. Esta permeabilidade das luvas aos citostáticos é evidenciada também pelos estudos em trabalhadores de saúde que demonstraram existirem níveis significativos de citostáticos na superfície interior das luvas, em contacto direto com a pele25,32,47–50. Também o interior das máscaras e batas utilizadas pode apresentar níveis detetáveis destes agentes, contribuindo para a exposição cutânea dos trabalhadores25,48,49.
Os produtos de limpeza utilizados nem sempre são eficazes na neutralização de citostáticos de uso comum, como sejam a ciclofosfamida e o 5-fluoruracilo51.
A atestar que esta contaminação generalizada das superfícies e equipamentos de trabalho resulta em contaminação cutânea dos profissionais expostos, estão os diversos estudos em que foi demonstrada a presença de citostáticos em diversas regiões corporais, sobretudo ao nível das mãos28,32,49. Estes achados demonstram que, efetivamente, os procedimentos de segurança e os equipamentos de proteção individual são insuficientes para prevenir a exposição cutânea, com consequente risco de absorção por esta via.
Apesar de parecer, pelos dados disponíveis, de menor importância, a via inalatória poderá desempenhar um papel adicional nalguns casos. Alguns citostáticos, como a ciclofosfamida, podem vaporizar à temperatura ambiente31. Determinados tipos de manipulação (transferência de formulações líquidas com seringa sob pressão, utilização de preparados sólidos sob a forma de pó ou esmagamento de comprimidos) podem gerar a formação de aerossóis ou poeiras suscetíveis de serem inalados31. Nalguns estudos efetuados com bombas de amostragem individual, foi detetada a presença de citostáticos no ar ambiente, embora este achado não seja tão frequente nem tão generalizado como a contaminação de superfícies48,49,52.
Para além da exposição crónica a baixas doses, a exposição acidental a elevadas quantidades de citostáticos pode constituir uma fonte não negligenciável de dose interna. Assim, um estudo recente de Kopjar17 revelou que uma percentagem significativa dos trabalhadores referia episódios de exposição aguda relacionada com quebra/rotura de ampolas e sacos de citostáticos (43%), derrame do seu conteúdo (39%) ou picadas com cortantes contaminados (13%).
Esta exposição, predominantemente a nível cutâneo e de forma secundária por via inalatória, associa-se a absorção significativa destes agentes. Tal é evidenciado por diversos estudos utilizando biomarcadores de exposição e que demonstram consistentemente a presença de citostáticos ou dos seus metabolitos na urina25,28,35,41,47,49,52–60. Havendo absorção e dose interna, haverá potencialmente risco de efeitos adversos para a saúde.
Efeitos adversos para a saúdeOs doentes tratados com citotóxicos desenvolvem frequentemente efeitos tóxicos agudos (mucosite, alopécia, diarreia, citopénias); a exposição ocupacional, no entanto, não tem sido associada a este tipo de efeitos, exceto no contexto de acidentes envolvendo quantidades elevadas de fármaco31.
Alguns estudos parecem indiciar que, em condições particulares, alguns profissionais expostos poderão apresentar uma prevalência aumentada de alguns sintomas atribuíveis a toxicidade aguda dos citostáticos. No início dos anos 90, um estudo realizado nos EUA61 refere, num grupo de enfermeiras expostas a citostáticos, uma prevalência superior de diversos sintomas (gastrointestinais, neurológicos, alérgicos, sistémicos) relacionada com uma possível toxicidade aguda dos citostáticos, estando o número de sintomas associado à intensidade de exposição cutânea (avaliada pelo número de doses manipulada e pela utilização ou não de luvas durante a manipulação). Mais recentemente, um estudo realizado por Krstev62 na Sérvia analisou 186 enfermeiras expostas a fármacos antineoplásicos por comparação com um grupo controlo de 77 enfermeiras não expostas. Foi constatada, no grupo exposto, uma frequência significativamente maior de sintomas como alopécia (OR = 7,14), rash cutâneo (OR = 4,7) e sensação de lipotímia (OR = 4,78), com uma regressão significativa nos fins de semana (OR = 4,78). Num estudo semelhante oriundo da Polónia, Walusiak63 refere, em 104 profissionais expostos e 103 controlos não expostos, uma prevalência aumentada de alopécia no grupo exposto (50,6% versus 10,7%).
Na interpretação destes resultados, deve ter-se em consideração que estes 3 estudos podem traduzir realidades particulares não generalizáveis à maior parte dos ambientes de trabalho atuais. Por exemplo, o estudo de Valanis61 incluíu profissionais expostas nos anos 70 e início dos anos 80, antes da implementação generalizada das medidas preventivas atualmente em vigor na maior parte dos locais de trabalho dos EUA, que ocorreu em meados dos anos 80. Os profissionais incluídos no estudo sérvio de Krstev62, por seu lado, não estavam em grande parte abrangidos por estas medidas, referindo os autores que apenas 38% utilizava câmaras de fluxo laminar para a preparação dos citostáticos, 57% máscaras (embora 82% referissem usar luvas) e que na maior parte dos locais de trabalho não existiam procedimentos escritos nem contentores específicos para material contaminado. O estudo polaco de Walusiak63 não refere dados suficientes para se aferirem as condições da atividade de trabalho. Numa meta-análise recente64, em que foram analisados todos os estudos publicados até 2004, foi considerado não existirem dados suficientes para calcular o risco de efeitos agudos em profissionais expostos a citostáticos.
Tendo em conta a genotoxicidade comum a todos os fármacos antineoplásicos, os efeitos a longo prazo que maior investigação têm merecido prendem-se com o aumento da incidência de determinados tipos de cancro e com os possíveis efeitos sobre a reprodução e o desenvolvimento.
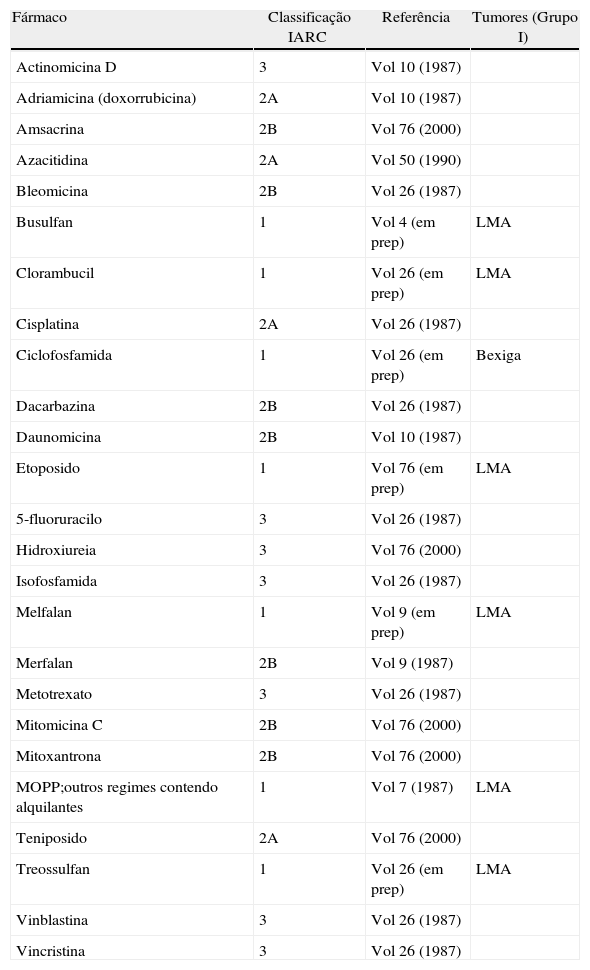
CarcinogenicidadeDe acordo com a IARC (International Agency for Research on Cancer), 7 fármacos citotóxicos possuem evidência suficiente para serem considerados carcinogénicos para o Homem (quadro 2), com base no risco de cancro de doentes tratados. Esta evidência inclui as associações entre terapêutica com agentes alquilantes ou inibidores da topoisomerase II e leucemia mieloide aguda e entre terapêutica com ciclofosfamida e neoplasia da bexiga. Com base nestas associações, Sessink54 publicou nos anos 90, um trabalho extremamente interessante visando calcular o risco teórico de cancro em profissionais expostos a ciclofosfamida, o agente antineoplásico sobre o qual existem mais dados disponíveis na literatura. Teve em conta os dados de modelos animais, o risco de tumores secundários em doentes tratados com ciclofosfamida e os valores disponíveis de marcadores biológicos de exposição (ciclofosfamida urinária) em profissionais de saúde expostos. Por extrapolação, estimou um risco aumentado, semelhante para a leucemia e para o carcinoma da bexiga, de 1,4 a 10 casos/milhão/ano.
Fármacos antineoplásicos classificados pela IARC quanto à sua carcinogenicidade (vols 1-100, revisto agosto/2010)
| Fármaco | Classificação IARC | Referência | Tumores (Grupo I) |
| Actinomicina D | 3 | Vol 10 (1987) | |
| Adriamicina (doxorrubicina) | 2A | Vol 10 (1987) | |
| Amsacrina | 2B | Vol 76 (2000) | |
| Azacitidina | 2A | Vol 50 (1990) | |
| Bleomicina | 2B | Vol 26 (1987) | |
| Busulfan | 1 | Vol 4 (em prep) | LMA |
| Clorambucil | 1 | Vol 26 (em prep) | LMA |
| Cisplatina | 2A | Vol 26 (1987) | |
| Ciclofosfamida | 1 | Vol 26 (em prep) | Bexiga |
| Dacarbazina | 2B | Vol 26 (1987) | |
| Daunomicina | 2B | Vol 10 (1987) | |
| Etoposido | 1 | Vol 76 (em prep) | LMA |
| 5-fluoruracilo | 3 | Vol 26 (1987) | |
| Hidroxiureia | 3 | Vol 76 (2000) | |
| Isofosfamida | 3 | Vol 26 (1987) | |
| Melfalan | 1 | Vol 9 (em prep) | LMA |
| Merfalan | 2B | Vol 9 (1987) | |
| Metotrexato | 3 | Vol 26 (1987) | |
| Mitomicina C | 2B | Vol 76 (2000) | |
| Mitoxantrona | 2B | Vol 76 (2000) | |
| MOPP;outros regimes contendo alquilantes | 1 | Vol 7 (1987) | LMA |
| Teniposido | 2A | Vol 76 (2000) | |
| Treossulfan | 1 | Vol 26 (em prep) | LMA |
| Vinblastina | 3 | Vol 26 (1987) | |
| Vincristina | 3 | Vol 26 (1987) |
Grupo 1: carcinogénico para o homem; Grupo 2A: provavelmente carcinogénico para o homem; Grupo 2B: possivelmente carcinogénico para o homem; Grupo 3: não classificável quanto à sua carcinogenicidade para o homem; Grupo 4: provavelmemente não carcinogénico para o homem; LMA: leucemia mieloide aguda; MOPP: Mostarda nitrogenada + Oncovina + Procarbazina + Prednisona
Diversos agentes alquilantes isolados (bussulfan, melfalan, clorambucil, treossulfan) ou em associação como o MOPP (Mostarda nitrogenada + Oncovina + Procarbazina + Prednisona) e outros esquemas similares, bem como o inibidor da topoisomerase II etoposido, estão classificados pela IARC no grupo I pela sua associação com leucemia mieloide aguda. O aumento da incidência de síndrome mielodisplásica (SMD) e de leucemia mieloide aguda (LMA) após terapêutica antineoplásica está descrito desde os anos 7065 e foi confirmada por estudos posteriores66,67. As síndromes mielodisplásicas e leucémias pós-terapêutica representam 10-15% do total de casos e estão descritas após terapêutica com agentes alquilantes e com inibidores da topoisomerase II68. Esta terapêutica associa-se a um risco de SMD e LMA 100 vezes superior ao da população geral68. Globalmente, a LMA pós-terapêutica responde pior ao tratamento do que a LMA de novo e apresenta pior prognóstico. Em termos clínicos e citogenéticos, estão descritos 2 tipos de LMA pós-terapêutica68,69: a) a LMA associada aos alquilantes, caracterizada por um período de latência médio de 5-7 anos, por ter um SMD antecedente e por apresentar deleção completa ou parcial do cromossoma 5 e/ou do cromossoma 7 e cujo risco está relacionado com a dose cumulativa de terapêutica alquilante; b) a LMA associada aos inibidores da topoisomerase II, caracterizada por um período de latência médio de 2 anos, por ausência de um SMD antecedente e por apresentar translocações equilibradas do braço longo do cromossoma 11 envolvendo o gene MLL (Mixed Lineage Leukemia), localizado em 11q23, cujo risco é independente da dose cumulativa de terapêutica.
No que diz respeito a um possível aumento da incidência destas síndromas hematológicas em profissionais de saúde expostos a citostáticos, existem alguns dados publicados que são sugestivos duma associação, embora se esteja longe de uma relação comprovada. Nos anos 90, Skov70 publicou um trabalho em que foram estudadas enfermeiras de unidades de oncologia (275) versus outras enfermeiras (765), tendo sido detetado um aumento significativo do risco de leucemia mieloide nas primeiras (RR = 10,65), embora apenas à custa de 2 casos (1 LMA e 1 LMC). Estudos posteriores mais alargados, de base populacional, descrevem um aumento da mortalidade por leucemia mieloide em profissionais de saúde71–74, mas em nenhum deles foi avaliada especificamente a exposição a citostáticos. A exposição dos profissionais de saúde a outros agentes possivelmente leucemogénicos (radiações ionizantes, formaldeído, gases anestésicos, óxido de etileno) torna impossível estabelecer relações etiológicas com base nestes estudos. De acordo com estas limitações dos dados publicados, Dranitsaris64 considera na sua meta-análise que não existem dados suficientes para calcular um risco de cancro de causa ocupacional em trabalhadores expostos a citostáticos.
Neoplasia da bexigaOutra associação bem estabelecida é a da terapêutica com ciclofosfamida e risco de neoplasia da bexiga. A ciclofosfamida é um agente alquilante com elevada toxicidade para o epitélio vesical, originando quer efeitos agudos (cistite hemorrágica) quer aumento a longo prazo do risco de neoplasia da bexiga. A prevalência de neoplasia da bexiga em doentes tratados com ciclofosfamida atinge os 10% aos 11-16 anos e a maior parte dos tumores são carcinomas de células de transição, embora estejam descritos tipos histológicos mais raros75. Não existe, no entanto, do nosso conhecimento, nenhuma publicação com incidência aumentada desta neoplasia em profissionais expostos a citostáticos.
Outras neoplasiasFoi sugerido também aumento do risco de outros tipos de cancro para além dos referidos, que seriam à partida os expectáveis com base nos efeitos descritos em doentes tratados com citostáticos. No final dos anos 90, um estudo de caso-controlo76, embora de pequenas dimensões (59 casos e 118 controlos), sugere um aumento do risco de cancro da mama em enfermeiras de oncologia (OR = 1,65). Mais recentemente, Ratner et al.77 et al. descrevem, num estudo de coorte de maior dimensão (56.213 enfermeiras), um aumento da incidência de neoplasia da mama (RR = 1,83 para IC = 95%) e, no subgrupo das profissionais com maior exposição, de cancro do reto (RR = 1,87 para IC = 95%).
Efeitos sobre a reprodução e desenvolvimentoOs agentes antineoplásicos são simultaneamente citotóxicos e genotóxicos para as células germinais. Os possíveis efeitos incidem, por um lado, sobre a capacidade reprodutiva (redução da fertilidade ou mesmo esterilidade, transitórias ou definitivas, aumento do risco de anomalias genéticas da linha germinal, com possível impacto a longo prazo sobre a descendência) e, por outro, sobre o desenvolvimento, imediato ou a longo prazo, de fetos ou embriões diretamente expostos.
Efeitos sobre a capacidade reprodutivaA toxicidade dos citostáticos para as células germinais, tanto masculinas como femininas, é confirmada por diversos modelos animais7,78–80. Relativamente às células germinais masculinas, os agentes alquilantes são mutagénicos para todos os estádios de maturação, embora não pareçam ocasionar aneuploidia ou translocações cromossómicas transmissíveis78. Os derivados da platina podem induzir aberrações cromossómicas, também transitórias e sem repercussão sobre a descendência80. Os alcaloides da vinca interferem com o fuso mitótico e originam elevadas taxas de aneuploidia, que ao nível da linha germinal masculina se parecem traduzir em citotoxicidade para os espermatócitos primários80. Os inibidores da topoisomerase ii são potentes indutores de anomalias cromossómicas, tendo sido demonstrado, num modelo de ratinho7, que o etoposido não só induz aberrações cromossómicas nas células germinais masculinas, como estas células podem transmitir as lesões à descendência, resultando num esperma com níveis persistentemente elevados de anomalias cromossómicas, tanto numéricas como estruturais, muitos anos após ter cessado a exposição ao agente. Também Palo81 demonstrou, para o antimetabolito citosina-arabinosido, a indução de aberrações cromossómicas das células germinais masculinas, algumas das quais transmitidas às células maduras. Relativamente às células germinais femininas, os agentes alquilantes têm sido associados, em modelos animais, a aborto espontâneo80, enquanto que os derivados da platina podem induzir mutações letais, conduzindo a morte embrionária precoce80. A exposição de células germinais femininas a alcaloides da vinca tem sido associada, também em modelos animais, a malformações fetais resultantes da fecundação de óvulos aneuploides80.
Efeitos adversos sobre a reprodução estão bem descritos em doentes tratados. No homem estão descritas esterilidade (geralmente transitória) e anomalias genéticas dos espermatozoides, embora tal não pareça traduzir-se em efeitos adversos sobre as futuras gravidezes82. Os agentes alquilantes, em particular, são extremamente citotóxicos para as células germinais masculinas, causando depleção ou aplasia do epitélio germinal dos testículos com a consequente oligospermia ou azoospermia, que apresentam baixa taxa de recuperação a longo prazo80. Na mulher, a terapêutica com citostáticos associa-se, com alguma frequência (dependendo do esquema terapêutico e da idade e função ovárica da mulher) a insuficiência ovárica e menopausa prematura82. Os alquilantes são também aqui particularmente tóxicos, provocando fibrose ovárica com depleção de folículos e oocitos, acompanhados de taxa elevada de infertilidade80. Muitas mulheres, no entanto, recuperam a fertilidade e, ao contrário do sugerido pelos estudos animais, estas gravidezes não apresentam aumento da frequência de aborto nem de malformações congénitas quando comparadas com as da população em geral82.
Efeitos sobre o desenvolvimentoApós administração materna, a maior parte dos agentes citostáticos atingem o embrião/feto em concentrações significativas, uma vez que a placenta não representa uma barreira eficaz contra estes agentes80. A exposição in utero a citostáticos tem efeitos imediatos comprovados sobre o desenvolvimento embrionário e fetal, que vão depender, em parte, da idade gestacionária. A exposição muito precoce, logo após a conceção, quando o embrião apresenta uma relativa resistência aos efeitos teratogénicos dos citostáticos, traduz-se habitualmente em morte embrionária e aborto espontâneo80. Da exposição durante o período de organogénese, que decorre durante o primeiro trimestre, é expectável que possam surgir malformações fetais. Os efeitos teratogénicos do metotrexato, por exemplo, são relativamente bem conhecidos: a exposição pré-natal a este agente, durante fases críticas da embriogénese (o período mais crítico parece ocorrer entre as 6 e as 8 semanas), causa uma síndrome característica com múltiplas malformações83. Também para a ciclofosfamida foi descrita, como consequência da exposição materna durante o primeiro trimestre, uma síndrome característica de malformações congénitas84. Globalmente, a terapêuticos citostáticos durante o 1.° trimestre da gravidez associa-se a malformações major em 10-20% dos fetos, atingindo de forma semelhante todos os órgãos e sistemas83–86. O risco de anomalias após quimioterapia administrada durante o 2.° e o 3.° trimestres é provavelmente baixo, embora tenham sido descritos casos de atraso de crescimento e mielossupressão fetal como consequência de terapêutica no 3.° trimestre87.
Mais difíceis de avaliar são as repercussões a longo prazo da exposição in utero a citostáticos. Foram estudados os efeitos sobre a função intelectual e neurológica, uma vez que o sistema nervoso se continua a desenvolver após o 1.° trimestre e é sensível às agressões durante todo o período de gestação – estas poderão não ter tradução em termos de defeitos anatómicos, mas resultar num deficiente desenvolvimento a longo prazo80. Estão publicados 2 estudos avaliando o desenvolvimento neurocognitivo a longo prazo em crianças expostas a citostáticos in utero e, em ambos, não foram detetatadas diferenças relativamente a valores de controlo comparáveis80.
Outro aspeto consiste na possibilidade de efeitos relacionados com mutações não letais, sem tradução imediata, que poderiam resultar num futuro aumento do risco de cancro. Esta possibilidade é levantada pelos resultados de alguns estudos experimentais em animais, demonstrando, por exemplo, que a exposição in utero de células germinais hematopoiéticas ao etoposido em baixas doses é suficiente para provocar aumento das quebras do ADN e induzir translocações específicas, envolvendo o gene MLL88. Estas alterações genéticas são semelhantes às descritas nas LMA do adulto que surgem após terapêutica com este tipo de citostáticos, tendo sido sugerido que a exposição materna a estes agentes aumentaria o risco de um tipo particular de leucemia que surge nos primeiros 12 meses de vida (Leucemia Aguda Infantil) e que apresenta como anomalia genética característica precisamente a presença de rearranjos do gene MLL. No Homem está demonstrada a presença, em descendentes de mães tratadas com citostáticos durante a gravidez, de anomalias cromossómicas estáveis, como, por exemplo, a translocação recíproca equilibrada entre os cromossomas 5 e 20 associada ao metotrexato86. Num estudo envolvendo 217 mães tratadas com quimioterapia durante a gravidez89 foram detetados 2 recém-nascidos portadores de anomalias cromossómicas estáveis sugerindo que este fenómeno, embora relativamente raro, pode ocorrer.
Estes dados dizem respeito à exposição a doses elevadas de citostáticos, no contexto da terapêutica de doenças neoplásicas. A questão sobre se a exposição crónica a baixos níveis destes agentes, no contexto profissional, se pode também repercutir de forma adversa sobre a reprodução ou sobre o desenvolvimento embrio-fetal é um assunto ainda em aberto. Os efeitos mais investigados e sobre os quais existem dados mais consistentes são o aborto espontâneo e as malformações congénitas.
Relativamente ao risco de aborto espontâneo, nos anos 80, Selevan90 publicou um primeiro estudo caso-controlo conduzido em enfermeiras de 17 hospitais finlandeses, tendo detetado uma associação significativa entre exposição a citostáticos e perda fetal (OR = 2,30). Por outro lado, na mesma altura, em outro estudo semelhante, conduzido por Hemminki91, e que incluiu 217 casos e 571 controlos, não se verificou associação significativa entre exposição a citostáticos e risco de aborto espontâneo (OR = 0,8). Já nos anos 90, Stucker92 publica um terceiro estudo de caso-controlo, realizado em 4 hospitais franceses, no qual é evidenciado, em profissionais expostas a citostáticos, um aumento do risco de aborto espontâneo (OR = 2,0); Skov70, pelo contrário, num estudo também caso-controlo (incluindo 1.282 enfermeiras de oncologia e 2.572 outras enfermeiras) não verificou associação entre exposição a citostáticos e aborto (OR = 0,76). Valanis93 publicou também um estudo caso-controlo transversal, incluindo 2.976 enfermeiras e técnicas de farmácia, referindo existir associação significativa entre exposição a citostáticos durante a gravidez e risco de aborto espontâneo (OR = 1,5). Na meta-análise de Dranitsaris64, que inclui todos os estudos referidos, conclui-se haver uma associação de fraca intensidade entre exposição a citostáticos e aborto (RR = 1,64).
Existem diversos estudos referindo um aumento da frequência de malformações congénitas em profissionais expostas a agentes citostáticos. Hemminki91 refere, num estudo caso-controlo (46 casos versus 128 controlos), um risco aumentado de malformações congénitas (OR = 4,7). Também nos anos 80, McDonald94 refere, num grupo de 152 grávidas com história de manipulação de citostáticos durante a gravidez, 8 anomalias congénitas versus 4,05 esperadas (p = 0,05). Mais recentemente, em outro estudo de caso-controlo95 que envolveu 851 gravidezes, 100 das quais associadas a fenda palatina, e 751 com recém-nascidos saudáveis, foi assinalada uma relação entre exposição ocupacional a agentes antineoplásicos e fenda palatina (OR = 5,0). Também Walusiak63 refere um aumento de malformações congénitas em profissionais expostas a citostáticos durante a gravidez (4/84 gravidezes versus 1/169 gravidezes) e, posteriormente, Ratner et al.77 descrevem um aumento da frequência de malformações congénitas do olho (OR = 3,46 para IC = 95%). Em sentido contrário, Skov70, num estudo caso-controlo com 1.282 enfermeiras expostas a citostáticos e 2.572 enfermeiras controlo, não detetou aumento da frequência de malformações congénitas nas expostas (OR = 1,02). Numa perspetiva geral, assinale-se a meta-análise já citada64, incluindo todos os trabalhos publicados entre 1966 e 2004, que não revelou associação significativa entre exposição a citostáticos e malformações congénitas (OR = 1,46).
Outros efeitos estudados na área da reprodução incluem a gravidez ectópica, com a qual não foi detetada associação96, a disfunção menstrual, com a qual foi referida uma associação positiva com OR = 3,497 e a redução da fertilidade feminina, igualmente com associação positiva, OR = 1,598. Do nosso conhecimento, não existem estudos publicados avaliando possíveis efeitos tardios sobre os descendentes de mães com exposição ocupacional a citostáticos durante a gravidez, nomeadamente sobre o desenvolvimento neurocognitivo e o risco de cancro. O facto de estes efeitos não terem sido cabalmente comprovados no caso da exposição terapêutica, com doses elevadas durante curtos períodos de tempo, não significa necessariamente que não existam efeitos da exposição profissional, com doses baixas mas ocorrendo durante períodos muito mais prolongados. Como dado indireto, uma revisão de Savitz99 incidindo sobre diversos estudos epidemiológicos que procuraram correlacionar a profissão materna e paterna com a incidência de cancro nos descendentes, concluiu existir evidência de uma associação forte entre a ocupação materna como técnica de farmácia e a incidência de leucemia (OR = 3,2).
Outros efeitos crónicos sobre a saúdeExistem alguns dados, embora escassos e geralmente em estudos de pequena dimensão, sobre outros efeitos crónicos para a saúde da exposição ocupacional a citostáticos. Os mais documentados são os que ocorrem sobre o sistema imunitário. Nos anos 80, Jochimsen100 comparou alguns parâmetros hematológicos de enfermeiras com exposição a citostáticos em situação basal e após um teste de estimulação com prednisolona, com o objetivo de averiguar se existiam anomalias fenotípicas subclínicas semelhantes às descritas em doentes submetidas a quimioterapia adjuvante para a neoplasia da mama, não tendo verificado diferenças significativas. Mais recentemente, Spatari101 descreve, num pequeno número de trabalhadores expostos a antineoplásicos (n = 17) um aumento significativo dos níveis circulantes de IL-15 e sugere que estes poderiam corresponder a um aumento da expressão endógena como resposta defensiva antitumoral. Num outro estudo recente102 foi efetuada imunofenotipagem dos linfócitos e estudada a função dos neutrófilos do sangue periférico em 306 enfermeiras expostas a antineoplásicos. Os autores descrevem algumas diferenças significativas em relação ao grupo controlo, nomeadamente, um aumento da proporção de linfócitos B e uma diminuição da frequência de linfócitos T helper ativados CD25+ (o marcador CD 25 corresponde à cadeia α do recetor de alta afinidade para a interleucina 2, indutível com a ativação destas células) e ainda um aumento da resposta oxidativa dos neutrófilos quando estimulados, sugerindo um priming prévio induzido pela exposição crónica a citostáticos. Nenhum estudo demonstra, no entanto, que estas anomalias fenotípicas do sistema imunitário tenham algum tipo de impacto no seu normal funcionamento. Ainda no que respeita ao sistema imunitário, estão bem documentados, embora sejam raros, casos esporádicos de reações alérgicas a alguns tipos de citostáticos. Estão descritos casos de asma ocupacional relacionada com a mitoxantrona103 e os derivados da platina104 e um caso de rinossinusite atribuída ao etoposido105.
O facto de as antraciclinas se associarem, em doentes tratados, a efeitos cutâneos, tanto por ação sistémica como por contacto direto, levou a que fossem estudados os efeitos cutâneos da exposição ocupacional. Demonstrou-se que a doxorrubicina permeia regularmente as luvas e, quando incubada com uma cultura celular de queratinocitos, é diretamente tóxica para estas células, induzindo apoptose por um mecanismo p53-independente106.
Alguns citostáticos, nomeadamente os derivados da platina, são nefrotóxicos em doentes submetidos a quimioterapia. Nos anos 90, Sessink107 analisou parâmetros laboratoriais de lesão renal precoce (doseamento urinária da Retinol Binding Protein e da albumina) em profissionais expostos a citostáticos e não encontrou diferenças em relação a um grupo controlo não exposto.
Em 1983, Sotaniemi108 descreve 3 casos de lesão hepática grave com fibrose em enfermeiras, que atribuiu à exposição a citostáticos, mas nenhum estudo posterior veio confirmar ou infirmar estes achados.
Observações finaisA contaminação do ambiente de trabalho com agentes antineoplásicos é um fator de risco inerente à atividade de muitos profissionais de farmácia e enfermagem. É indiscutível que esta contaminação permeia todos os equipamentos de proteção individual utilizados e se traduz na absorção, maior ou menor, destes agentes e em efeitos genotóxicos, demonstrados sobretudo ao nível do sangue periférico. Em termos globais e na maior parte dos países, é indiscutível que se registaram melhorias substanciais como resultados da adoção das atuais normas de segurança. A título de exemplo, encontram-se resumidas na quadro 3 as principais recomendações do NIOSH109(National Institute for Occupational Safety and Health) nos EUA.
Principais medidas de controlo do risco propostas pela NIOSH nas atividades de preparação e administração de Citostáticos116
| PREPARAÇÃO | |
| Receção e armazenamento | Uso de EPI* adequados (luvas, touca, óculos e bata) ao desembalar fármacosRotulagem adequadaArmazenamento em local com aspiração e separado dos restantes fármacosExistência de procedimentos escritos de emergência para o caso de derrame acidental |
| Preparação propriamente dita | Manipulação em salas próprias, com acesso restrito, e em câmaras de fluxo laminar verticalSala de preparação com aspiração adequada e pressão positivaUso de EPI adequados (luvas duplas, touca, óculos, bata e máscara) durante todos os procedimentos relacionados com a preparaçãoMudança de luvas de 30-30 minutosApós a preparação limpeza do exterior da mistura para administração e enchimento do respetivo sistema com líquido sem fármacoExistência de procedimentos de emergência escritos para o caso de derrame acidental |
| ADMINISTRAÇÃO |
| Uso de EPI adequados durante manipulação das misturas (luvas, touca, óculos, bata e máscara); estes devem ser imediatamente removidos e colocados em contentores adequados quando termina a manipulaçãoConexão direta da mistura e, após terminar a administração, remoção de todo o sistema em bloco e colocação em contentor adequadoExistência de procedimentos de emergência escritos para o caso de derrame acidental |
| PROCEDIMENTOS COMUNS | |
| Limpeza | Existência de procedimentos de limpeza periódicos com produtos adequados de todas as superfícies e equipamentos potencialmente contaminadosRotulagem e tratamento separado de todas as roupas potencialmente contaminadasRegisto e monitorização dos procedimentos de limpeza |
| Eliminação de material contaminado | Em recipientes próprios, fechados, e eliminados de forma separada dos restantes resíduos |
*EPIs: equipamentos de proteção individual.
No início desta década, Fransman110 analisou conjuntamente os resultados de 3 estudos transversais de avaliação da exposição (1997, 2000 e 2002) e referiu uma redução substancial da contaminação de luvas e superfícies de trabalho, não só em termos da quantidade de citostáticos presentes mas também em termos da extensão global das zonas contaminadas. Esta redução da contaminação ambiental foi acompanhada por uma diminuição da percentagem de profissionais de enfermagem expostos com ciclofosfamida detetável na urina, tanto ao nível do hospital de dia (6,6 para 1,7%) como do internamento (12,4 para 2,9%). Também Sottani111 estudou a evolução da contaminação de superfícies e da percentagem de profissionais com biomarcadores de exposição na urina em 5 farmácias italianas no período entre 1990 e 2010. Registou redução dos níveis de contaminação de superfícies e da frequência de biomarcadores de exposição positivos (30% dos profissionais nos anos 90 versus 2% na década 2000-2010. Turci112 refere também que, ao longo de um período de vigilância de 5 anos, foi verificada em 7 hospitais do Norte de Itália uma redução progressiva quer da contaminação de superfícies quer da percentagem de biomarcadores de exposição na urina positivos – de cerca de 30% na década de 90 para 2% após 2000.
Com base nestes dados e na análise da literatura, parece evidente que atualmente, nas condições de exposição verificadas na maior parte dos países de origem das publicações, o risco de efeitos agudos para a saúde é praticamente inexistente fora do contexto da exposição acidental a doses elevadas de citostáticos. Tal não invalida que, em determinados locais de trabalho, com maiores níveis de contaminação e menor nível de proteção dos trabalhadores, relacionado por exemplo, com ausência de procedimentos de segurança ou uso insuficiente ou inadequado de equipamentos de proteção individual, não possa existir sintomatologia aguda associada a estes agentes. Exemplos de trabalho recentes que fogem à tendência referida para uma redução progressiva nos níveis de exposição são os de Rekhadevi113, proveniente da Índia, e o de Krstev62, proveniente da Sérvia, em que a baixa percentagem de cumprimento de diversas regras de proteção se associou a uma elevada prevalência de sintomas sugestivos de toxicidade aguda dos citostáticos, como alopécia e rash cutâneo.
Já em termos de efeitos crónicos, nomeadamente, aumento do risco de determinados cancros e repercussão sobre a reprodução e o desenvolvimento, estamos longe de poder efetuar qualquer afirmação com segurança. Consoante é bem evidenciado pela meta-análise de Dranitasaris64, os dados publicados são insuficientes para retirar qualquer conclusão. Do conhecimento que se tem sobre mecanismos de genotoxicidade ressalta, no entanto, que as melhorias verificadas na maior parte dos locais de trabalho não serão provavelmente suficientes enquanto continuarem a existir trabalhadores com biomarcadores positivos. Para a maior parte dos citostáticos é postulado existir, para os efeitos genotóxicos, uma curva dose-resposta linear, sem efeito limiar de dose discernível (efeitos de tipo estocástico)114. Embora este modelo tenha sofrido ultimamente alguma contestação e, indiscutivelmente, alguns citostáticos não apresentem uma curva dose-resposta linear mas sim exponencial, sugerindo que possa existir um limiar de dose, para a maior parte das respostas genotóxicas, este limiar não parece existir115. Sendo portanto impossível, com base no conhecimento científico atual, determinar um nível de exposição abaixo do qual se possa assegurar a inexistência de efeitos adversos, deve tentar-se que a contaminação ambiental seja tão baixa quanto possível (As Low as Reasonably Achievable – ALARA)116.
Outro fator importante a considerar é o local onde cada estudo é efetuado, com as suas características específicas. Os resultados obtidos num determinado contexto ocupacional não podem ser usados para avaliar o risco noutro contexto ocupacional diferente, com uma população exposta de características também diferentes. São exemplos os trabalhos já referidos de Rekhadevi113 e Krstev62 e um estudo recente conduzido no Japão117 revelando que os profissionais de enfermagem, numa percentagem substancial de casos, não trabalhavam abrangidos pelas medidas de proteção atualmente recomendadas, referindo nomeadamente desconhecimento de recomendações específicas (47% casos), manipulação de citostáticos fora de câmaras de fluxo laminar (42% casos), não utilização de qualquer equipamento de proteção individual (10% casos), manipulação inadequada de frascos e ampolas contendo antineoplásicos (25% casos) e ausência de precauções especiais no contacto com excreções e secreções de doentes tratados (92% casos). Uma percentagem significativa destes profissionais (44%) referia ainda pelo menos um acidente de trabalho com exposição a citostáticos. Tais achados justificam que cada situação de trabalho concreta tenha de ser alvo de estudo, para avaliar de forma correta o risco dos profissionais que nela estão inseridos.