Diversos estudios han encontrado un aumento de los parámetros de estrés oxidativo en pacientes con esquizofrenia. Los objetivos de este estudio han sido identificar potenciales biomarcadores de estrés oxidativo en pacientes con esquizofrenia estables, durante los primeros 10 años de enfermedad, y determinar si se asocian con dimensiones clínicas específicas.
Material y métodosSe evaluaron 73 pacientes clínicamente estables y 73 controles sanos pareados por edad y sexo. Se recogieron datos sociodemográficos, clínicos y parámetros biológicos. Los biomarcadores sanguíneos incluyeron homocisteína, porcentaje de hemólisis, subproductos de peroxidación lipídica y, como biomarcador antioxidante, actividad de la catalasa en eritrocitos.
ResultadosLos análisis comparativos tras controlar por tabaquismo y síndrome metabólico evidenciaron un aumento significativo en la actividad de la catalasa en pacientes. Asimismo, niveles inferiores de peroxidación lipídica se asociaron de manera significativa con la sintomatología negativa.
ConclusionesComo conclusión, los mecanismos compensatorios antioxidantes podrían estar aumentados en pacientes con esquizofrenia estables durante las fases iniciales. Además, podría existir una relación inversa entre el estrés oxidativo y la dimensión negativa.
Several studies have described increased oxidative stress parameters in patients with schizophrenia. The objectives of the current study were to identify potential oxidative stress biomarkers in stable patients during first 10 years of schizophrenia and determine if they are associated with specific clinical dimensions.
Material and methodsSeventy-three clinically stable outpatients with schizophrenia and 73 sex and age-matched healthy controls were recruited. Sociodemographic, clinical and biological data were collected at enrollment. Blood biomarkers included homocysteine, the percentage of hemolysis, lipid peroxidation subproducts, and as an antioxidant biomarker, catalase activity in erythrocytes.
ResultsComparative analyses after controlling for smoking and metabolic syndrome evidenced a significant increase in catalase activity in patients. Also, lower lipid peroxidation levels showed an association with negative symptoms.
ConclusionsIn conclusion, compensatory antioxidant mechanisms might be increased in stable patients with schizophrenia at early stages. Furthermore, there may be an inverse relationship between oxidative stress and negative dimension.
La esquizofrenia (SZ) es un trastorno mental grave y crónico caracterizado por una sintomatología heterogénea y un curso deteriorante a largo plazo. Los criterios diagnósticos se basan en la fenomenología descriptiva de síntomas y el curso clínico debido a la falta de biomarcadores fiables y específicos1. Sin embargo, en las últimas décadas, se han descrito en esta población varios parámetros biológicos como biomarcadores inflamatorios, metabólicos y de neuroimagen con el objetivo de avanzar hacia una psiquiatría personalizada y de precisión2–6.
En la actualidad, se ha reformulado el concepto clásico de SZ7, y algunos autores sugieren que esta enfermedad tendría un impacto multisistémico desde las etapas iniciales8. De hecho, los estudios sobre biomarcadores sanguíneos han mostrado evidencia de anormalidades en las funciones metabólica y de respuesta inmune en individuos con SZ9–11. Además, el desequilibrio oxidativo estaría involucrado en la fisiopatología de este trastorno y algunos autores indican un posible vínculo entre el estrés oxidativo y un mayor riesgo de anomalías metabólicas en estos pacientes12.
Varios estudios han documentado cambios en los parámetros oxidativos (productos de peroxidación lipídica [LPO], óxido nítrico) y enzimas antioxidantes (catalasa, superóxido dismutasa, glutatión peroxidasa), aunque estos resultados no son consistentes, ya que se han descrito tanto aumentos como disminuciones en la concentración de estos parámetros en los pacientes13–16. Estudios más ambiciosos han intentado determinar una relación entre los biomarcadores periféricos y la gravedad de las diferentes dimensiones clínicas. García-Álvarez et al. publicaron recientemente una revisión de este tema17. En cuanto a la inflamación, varias citocinas y la proteína C reactiva se han asociado con síntomas positivos, negativos y cognitivos en varios estudios18–21. Sin embargo, la mayoría de los estudios no identifican una asociación significativa entre los biomarcadores de estrés oxidativo y la gravedad clínica en pacientes con SZ o con un primer episodio psicótico22–25.
Una de las razones probables de estos resultados inconsistentes es la heterogeneidad de la SZ y la dificultad para una categorización precisa. Otro obstáculo subyacente al estudio de los marcadores periféricos es que las diferentes etapas de la enfermedad pueden estar asociadas con biomarcadores distintos, y podrían fluctuar dependiendo de si los pacientes se encuentran en el primer episodio, en una recaída aguda o en una fase estable. Además, no en todos los estudios se han considerado factores de confusión como el tabaquismo, la obesidad u otras alteraciones metabólicas26.
Por lo tanto, el principal objetivo del presente estudio ha sido identificar si los niveles periféricos de los parámetros de estrés oxidativo difieren entre pacientes ambulatorios estabilizados en los primeros 10 años de evolución de la SZ y sus controles sanos (CS) pareados. El segundo objetivo ha consistido en explorar si los biomarcadores de estrés oxidativo se asocian con las diferentes dimensiones clínicas de la SZ.
Material y métodosEstudio multicéntrico, longitudinal, de un año de seguimiento de pacientes con SZ y CS, cuyo objetivo fue determinar biomarcadores diferenciales de la dimensión negativa. En este manuscrito, solo hemos empleado los datos procedentes de la evaluación basal. Este estudio fue aprobado por el comité de ética local, «Comité Ético de Investigación Clínica Regional del Principado de Asturias (Ref. 25/2014)».
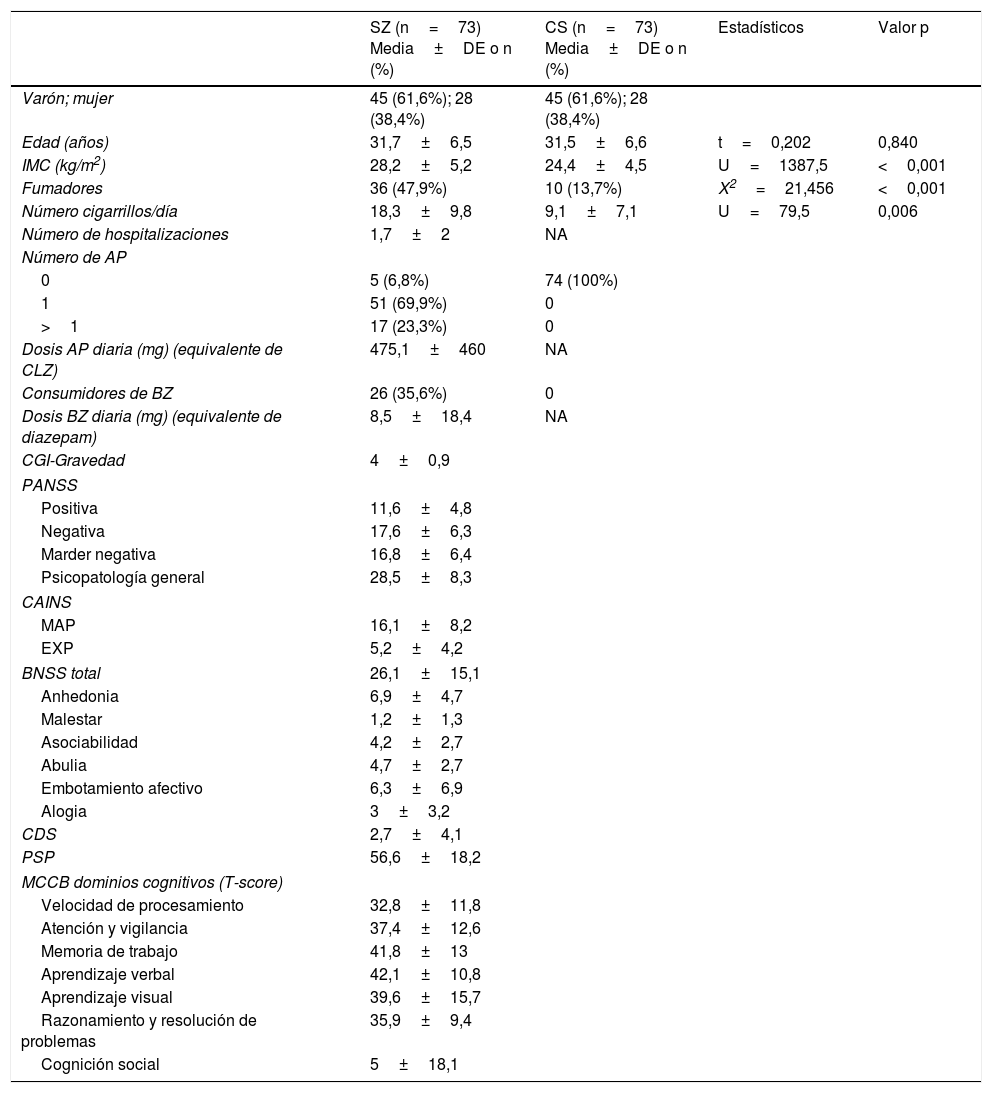
ParticipantesSetenta y tres pacientes ambulatorios con SZ y 73 CS pareados por edad y sexo, procedentes de Asturias (España) participaron en este estudio. Las características de la muestra aparecen recogidas en la tabla 1. Todos los pacientes estaban en los 10 primeros años de enfermedad, con edades comprendidas entre los 18 y 45 años, y se encontraban en tratamiento de mantenimiento estable durante al menos 3 meses previos a su inclusión en el estudio. El diagnóstico de SZ fue realizado por un psiquiatra y se confirmó mediante la entrevista clínica SCID (según los criterios del DSM-5). Los criterios de exclusión para ambos grupos fueron: (1) comorbilidades somáticas, tanto agudas (infección aguda, fiebre, procesos alérgicos o inflamatorios) como crónicas (cáncer, enfermedades autoinmunes, infecciones crónicas), que pudiesen interferir con los parámetros inflamatorios; (2) tratamiento con inmunosupresores o vacunas durante los 6 meses anteriores a la inclusión; y (3) tratamiento con medicaciones antiinflamatorias 2 días antes de la extracción de sangre. Los criterios de exclusión para CS también incluían historia de trastorno mental. Un 94,5% de los pacientes y de los controles eran de raza caucásica, mientras que 4 pacientes y 4 CS no lo eran. Todos los participantes recibieron información sobre los propósitos y protocolo del estudio, y firmaron el consentimiento informado antes de realizar los procedimientos del estudio.
Características clínicas y demográficas de pacientes con esquizofrenia y controles sanos
| SZ (n=73) Media±DE o n (%) | CS (n=73) Media±DE o n (%) | Estadísticos | Valor p | ||
|---|---|---|---|---|---|
| Varón; mujer | 45 (61,6%); 28 (38,4%) | 45 (61,6%); 28 (38,4%) | |||
| Edad (años) | 31,7±6,5 | 31,5±6,6 | t=0,202 | 0,840 | |
| IMC (kg/m2) | 28,2±5,2 | 24,4±4,5 | U=1387,5 | <0,001 | |
| Fumadores | 36 (47,9%) | 10 (13,7%) | X2=21,456 | <0,001 | |
| Número cigarrillos/día | 18,3±9,8 | 9,1±7,1 | U=79,5 | 0,006 | |
| Número de hospitalizaciones | 1,7±2 | NA | |||
| Número de AP | |||||
| 0 | 5 (6,8%) | 74 (100%) | |||
| 1 | 51 (69,9%) | 0 | |||
| >1 | 17 (23,3%) | 0 | |||
| Dosis AP diaria (mg) (equivalente de CLZ) | 475,1±460 | NA | |||
| Consumidores de BZ | 26 (35,6%) | 0 | |||
| Dosis BZ diaria (mg) (equivalente de diazepam) | 8,5±18,4 | NA | |||
| CGI-Gravedad | 4±0,9 | ||||
| PANSS | |||||
| Positiva | 11,6±4,8 | ||||
| Negativa | 17,6±6,3 | ||||
| Marder negativa | 16,8±6,4 | ||||
| Psicopatología general | 28,5±8,3 | ||||
| CAINS | |||||
| MAP | 16,1±8,2 | ||||
| EXP | 5,2±4,2 | ||||
| BNSS total | 26,1±15,1 | ||||
| Anhedonia | 6,9±4,7 | ||||
| Malestar | 1,2±1,3 | ||||
| Asociabilidad | 4,2±2,7 | ||||
| Abulia | 4,7±2,7 | ||||
| Embotamiento afectivo | 6,3±6,9 | ||||
| Alogia | 3±3,2 | ||||
| CDS | 2,7±4,1 | ||||
| PSP | 56,6±18,2 | ||||
| MCCB dominios cognitivos (T-score) | |||||
| Velocidad de procesamiento | 32,8±11,8 | ||||
| Atención y vigilancia | 37,4±12,6 | ||||
| Memoria de trabajo | 41,8±13 | ||||
| Aprendizaje verbal | 42,1±10,8 | ||||
| Aprendizaje visual | 39,6±15,7 | ||||
| Razonamiento y resolución de problemas | 35,9±9,4 | ||||
| Cognición social | 5±18,1 | ||||
AP: antipsicótico; BNSS: Escala Breve de Síntomas Negativos; BZ: benzodiazepinas; CAINS: Entrevista de Evaluación Clínica de los Síntomas Negativos; CDS: Escala de Depresión de Calgary; CGI: impresión clínica global; CLZ: clorpromazina; CS: controles sanos; DE: desviación estándar; EXP: expresión; IMC: índice de masa corporal; MAP: motivación y placer; MCCB: Batería Cognitiva del Consenso MATRICS; NA: no aplicable; PANSS: Escala del Síndrome Positivo y Negativo; PSP: Escala de Funcionamiento Personal y Social; SZ: esquizofrenia..
Las variables sociodemográficas y clínicas relacionadas con la SZ se evaluaron mediante una entrevista semiestructurada, incluyendo: duración de la enfermedad, tratamiento psicofarmacológico, historial de hospitalizaciones psiquiátricas, y consumo de tabaco (medido en cigarrillos por día en ambos grupos). La dosis de cada antipsicótico se convirtió en mg/día equivalentes de clorpromazina27. El tratamiento con benzodiazepinas se registró en dosis equivalentes de diazepam28.
Los datos antropométricos incluían el peso (kg), la altura (cm) y el perímetro abdominal (cm), medidos en ambos grupos. El índice de masa corporal (kg/m2) se calculó como el cociente entre el peso del individuo y el cuadrado de su altura. La prevalencia del síndrome metabólico (MetS) se estimó utilizando los criterios de la declaración de la American Heart Association y el National Heart, Lung and Blood Institute29. Así, se definió por la presencia de 3 o más de los siguientes componentes: hipertensión (presión arterial sistólica y diastólica≥130/85mmHg), hipertrigliceridemia (concentración de triglicéridos en ayunas≥150mg/dl), dislipidemia (colesterol HDL en ayunas<40mg/dL en hombres y<50mg/dL en mujeres), hiperglucemia (concentración de glucosa en ayunas≥100mg/dL) y obesidad abdominal (perímetro abdominal>102cm en hombres y>88cm en mujeres).
Evaluación clínicaPsicopatología y nivel de funcionamiento globalTodos los individuos en el grupo SZ fueron evaluados con las versiones en español de la Escala de Síndrome Positivo y Negativo (PANSS)30, Entrevista de Evaluación Clínica para Síntomas Negativos (CAINS)31, Escala Breve de Síntomas Negativos (BNSS)32, Escala de Depresión de Calgary (CDS)33, Escala de Impresión Clínica Global (CGI)34 y Escala de Funcionamiento Personal y Social (PSP)35. Debido a los problemas metodológicos de la PANSS para evaluar la sintomatología negativa36, se utilizó la CAINS, que se compone de 2 subescalas que cubren «motivación/placer» (CAINS-MAP, cuyos ítems incluyen placer esperado y motivación para las actividades recreativas, sociales, laborales y académicas) y «expresión» (CAINS-EXP, cuyos ítems incluyen expresión facial y verbal, gestos expresivos y cantidad de habla), y la BNSS, organizada en 6 subescalas (anhedonia, malestar, déficit en la interacción social, abulia, embotamiento afectivo y alogia).
CogniciónLa versión en español de la Batería Cognitiva del Consenso MATRICS (MCCB) se administró para explorar el funcionamiento neuropsicológico. La MCCB incluye 10 pruebas neuropsicológicas estandarizadas para medir el rendimiento cognitivo en 7 dominios cognitivos: velocidad de procesamiento, atención/vigilancia, memoria de trabajo, aprendizaje verbal, aprendizaje visual, razonamiento y resolución de problemas, y cognición social37.
Extracción de muestras sanguíneasTodas las muestras de sangre se obtuvieron entre las 8:00 y las 10:00 de la mañana por venopunción después de un ayuno nocturno confirmado, y el mismo día de la evaluación clínica. Los hemogramas y pruebas bioquímicas de rutina se realizaron en el laboratorio del Hospital Universitario Central de Asturias, e incluyeron el perfil lipídico, glucosa en ayunas y homocisteína.
Las muestras de sangre restantes se procesaron en los Laboratorios de Psiquiatría y Respuesta Celular al Estrés Oxidativo (Departamento de Morfología y Biología Celular) de los Grupos de Investigación de la Universidad de Oviedo. Los tubos de sangre se centrifugaron (3.000RPM durante 15min, 4°C) y, posteriormente, el plasma resultante se dividió en alícuotas y se almacenó a −20°C. Los eritrocitos se lavaron 2 veces con solución isotónica de NaCl enfriada con hielo (0,9%) seguido de centrifugación (4.000RPM durante 5min, 4°C). Los preparados hemolizados se almacenaron a −20°C a la espera de análisis. Las membranas de eritrocitos se prepararon mediante el método desarrollado por Dodge et al.38 y se almacenaron a −80°C.
Parámetros de estrés oxidativoPara estudiar la resistencia in vitro de eritrocitos a especies reactivas de oxígeno, se realizó la prueba de hemólisis eritrocitaria utilizando una modificación de la técnica descrita por Farrel et al. y de Gonzalo-Calvo et al.39,40. El grado de hemólisis se determinó mediante espectrofotometría midiendo la absorbancia del hemolizado a 540nm en un lector de microplacas (Thermo Scientific, Thermo Plate, EE. UU.).
La LPO de las membranas de eritrocitos se analizó determinando los niveles del aldehído reactivo malondialdehído (MDA), un producto final de la cascada de LPO41. Las cantidades de MDA se determinaron en los eritrocitos usando un kit de ensayo LPO (SIGMA, 108383, 1,1,3,3-tetrametoxipropano) basado en la reacción de condensación del cromógeno N-metil-2-fenilindol con MDA. Los datos se expresaron como nmoles de MDA/gramo de hemoglobina.
La actividad catalasa en eritrocitos (CAT) (EC 1.11.1.6) se determinó mediante el método de Lubinsky y Bewley42 usando peróxido de hidrógeno (H2O2) como sustrato. Este método mide la tasa de reducción de H2O2 a agua y oxígeno molecular por CAT mediante espectrofotometría a 240nm a 25°C. Las medidas se registraron cada minuto durante un total de 4min. Una unidad de enzima de CAT se define como la cantidad necesaria de enzima para reducir 1μmol de H2O2 por minuto en las condiciones del ensayo. Los datos se expresaron como μmoles de H2O2/miligramo de hemoglobina por minuto.
Análisis estadísticosSe utilizó el paquete de software estadístico SPSS 23.0 para Windows para el análisis estadístico. Los outliers extremos de los biomarcadores se eliminaron de la base de datos y se analizó la normalidad de los datos mediante la prueba de Kolmogorov-Smirnov. Las variables categóricas en los grupos CS y SZ se compararon usando la prueba Chi-cuadrado mientras que las variables continuas se compararon usando la prueba t de Student para muestras independientes y, asimismo, la prueba no paramétrica U de Mann-Whitney para las variables con una distribución no normal. Además, los parámetros continuos de estrés oxidativo se compararon usando el análisis de la covarianza (ANCOVA) o el ANCOVA no paramétrico (test de Quade) ajustado por la presencia de MetS y cigarrillos al día. Las diferencias se consideraron estadísticamente significativas si p<0,05.
Las asociaciones entre biomarcadores de estrés oxidativo y las variables clínicas en el grupo de pacientes se identificaron mediante las correlaciones de Pearson. Una vez que se determinaron los factores de confusión asociados con cualquiera de estos biomarcadores (género, MetS, tabaco, dosis equivalentes de clorpromazina y diazepam), fueron incluidos como covariables en los análisis de regresión múltiple por pasos sucesivos para explorar el efecto de los biomarcadores en las puntuaciones de las dimensiones clínicas. También incluimos edad, duración de la enfermedad, número de años de estudio e índice de masa corporal como posibles factores de confusión por criterio experto y con el aval de literatura previa.
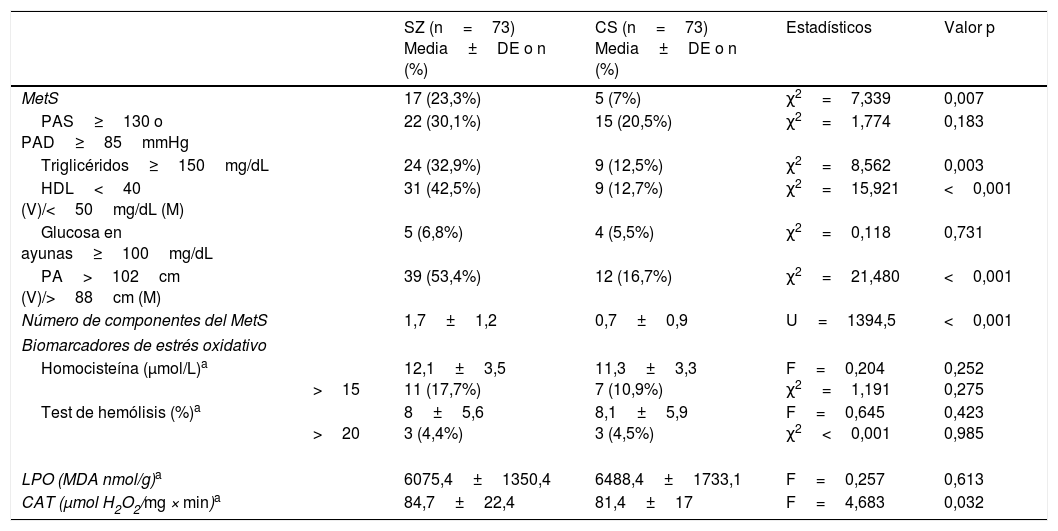
ResultadosDatos sociodemográficos y clínicosLa tabla 1 resume las características de la muestra estudiada, incluyendo las puntuaciones psicopatológicas y los dominios cognitivos (T-scores) en el grupo SZ. Como era de esperar, ambos grupos no diferían en cuanto a la edad y el sexo. La duración media de los años de evolución de la enfermedad de los pacientes en el momento de inclusión al estudio fue de 4,6±3,4 años. Solo 17 pacientes (23,3%) recibían politerapia antipsicótica y 5 (6,8%) no estaban tomando ningún antipsicótico. La mayoría de los antipsicóticos eran atípicos, excepto un paciente que tomaba haloperidol en combinación con otro antipsicótico. Como se muestra en la tabla 2, el MetS era más prevalente en el grupo de pacientes (23,3 vs. 7%) con una mayor prevalencia de hipertrigliceridemia y obesidad abdominal, y niveles más bajos de HDL.
Comparación del síndrome metabólico y los biomarcadores de estrés oxidativo entre los pacientes con esquizofrenia y los controles sanos
| SZ (n=73) Media±DE o n (%) | CS (n=73) Media±DE o n (%) | Estadísticos | Valor p | ||
|---|---|---|---|---|---|
| MetS | 17 (23,3%) | 5 (7%) | χ2=7,339 | 0,007 | |
| PAS≥130 o PAD≥85mmHg | 22 (30,1%) | 15 (20,5%) | χ2=1,774 | 0,183 | |
| Triglicéridos≥150mg/dL | 24 (32,9%) | 9 (12,5%) | χ2=8,562 | 0,003 | |
| HDL<40 (V)/<50mg/dL (M) | 31 (42,5%) | 9 (12,7%) | χ2=15,921 | <0,001 | |
| Glucosa en ayunas≥100mg/dL | 5 (6,8%) | 4 (5,5%) | χ2=0,118 | 0,731 | |
| PA>102cm (V)/>88cm (M) | 39 (53,4%) | 12 (16,7%) | χ2=21,480 | <0,001 | |
| Número de componentes del MetS | 1,7±1,2 | 0,7±0,9 | U=1394,5 | <0,001 | |
| Biomarcadores de estrés oxidativo | |||||
| Homocisteína (μmol/L)a | >15 | 12,1±3,5 11 (17,7%) | 11,3±3,3 7 (10,9%) | F=0,204 χ2=1,191 | 0,252 0,275 |
| Test de hemólisis (%)a | >20 | 8±5,6 3 (4,4%) | 8,1±5,9 3 (4,5%) | F=0,645 χ2<0,001 | 0,423 0,985 |
| LPO (MDA nmol/g)a | 6075,4±1350,4 | 6488,4±1733,1 | F=0,257 | 0,613 | |
| CAT (μmol H2O2/mg × min)a | 84,7±22,4 | 81,4±17 | F=4,683 | 0,032 | |
CAT: actividad de catalasa en eritrocitos; CS: controles sanos; DE: desviación estándar; HDL: lipoproteína de alta densidad; LPO: peroxidación lipídica; M: mujeres; MDA: malondialdehído; MetS: síndrome metabólico; PA, perímetro abdominal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; SZ: esquizofrenia; V: varones.
Las diferencias entre parámetros metabólicos fueron analizadas mediante la prueba de Chi-cuadrado para variables categoriales, y t de Student para muestras independientes, o la prueba no paramétrica U de Mann-Whitney para variables continuas. Los biomarcadores de estrés oxidativo se compararon mediante el análisis de la covarianza (ANCOVA) o la prueba no paramétrica ANCOVA (test de Quade) ajustado por la presencia de síndrome metabólico y cigarrillos/día.
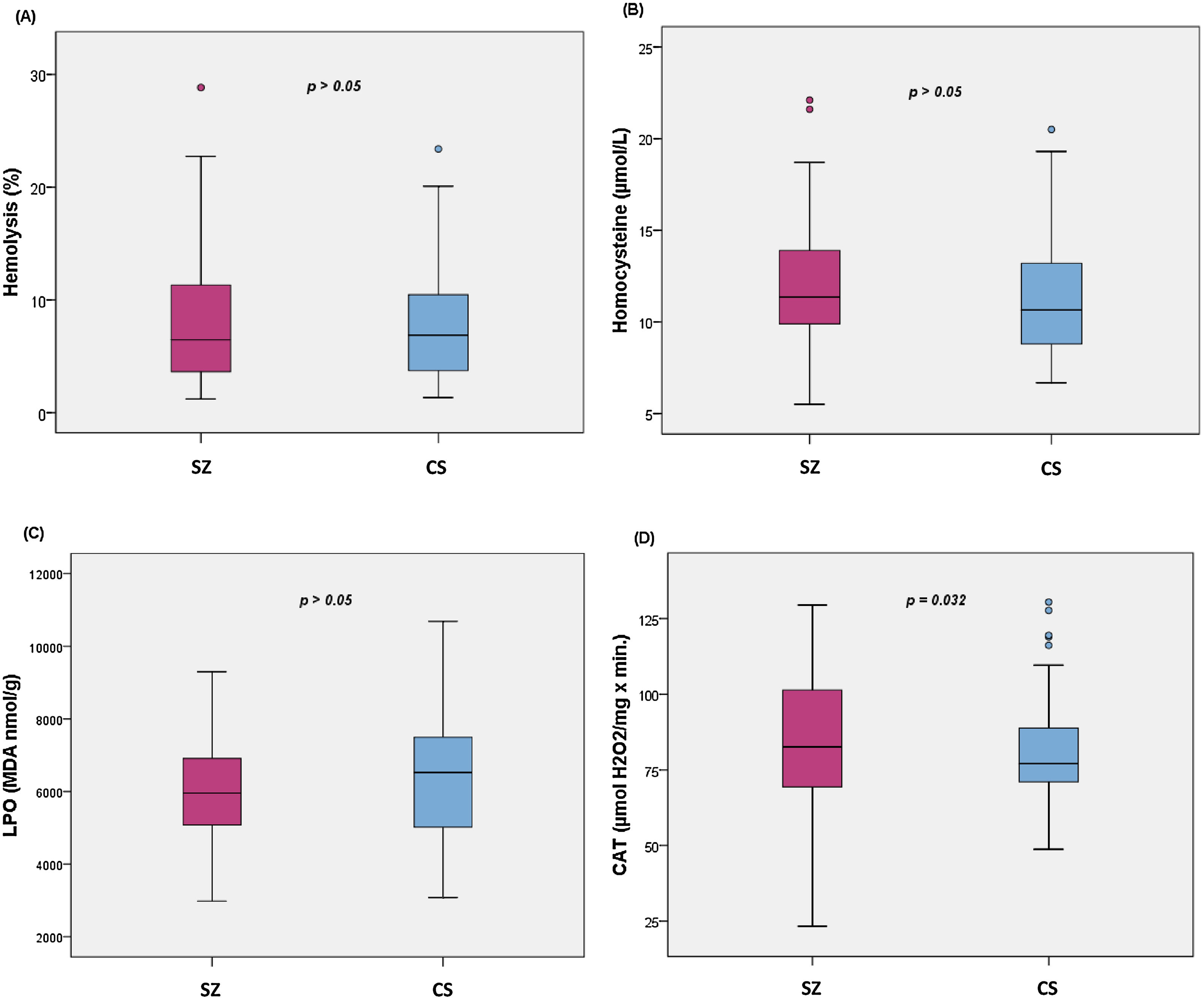
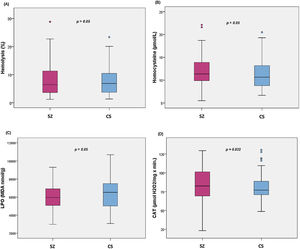
La comparación de los diferentes biomarcadores entre los grupos CS y SZ se muestran en la tabla 2. Tras controlar por MetS (presencia/ausencia) y cigarrillos/día, solo CAT fue significativamente mayor en los pacientes en comparación con los CS. Los diagramas de cajas de los parámetros de estrés oxidativo se muestran en la figura 1.
Diagramas de cajas de los biomarcadores de estrés oxidativo: (A) porcentaje de hemólisis (fragilidad eritrocitaria), (B) homocisteína, (C) subproductos de peroxidación lipídica, (D) actividad catalasa en eritrocitos (CAT); con los valores p del análisis de la covarianza entre pacientes con esquizofrenia (SZ) e individuos sanos (CS), tras ajustar por la presencia de síndrome metabólico y cigarrillos/día; MDA: malondialdehído.
Los análisis de correlación demostraron que los niveles de homocisteína se correlacionan positivamente con las puntuaciones en la PANSS-Positiva (r=0,295; p=0,02), PANSS-General (r=0,301; p=0,017), CGI-Gravedad (r=0,253; p=0,049), dominio de expresión de la CAINS (r=0,268; p=0,035), y negativamente con la puntuación de la PSP (r=−0,253; p=0,047). Por otro lado, la LPO se relaciona negativamente con la puntuación en las subescalas PANSS-Negativa (r=−0,330; p=0,005) y Factor Marder Negativo (r=−0,345; p=0,003), BNSS-Total (r=−0,290; p=0,015), y, específicamente, con las subescalas de la BNSS, abulia (r=−0,277; p=0,020), alogia (r=−0,237; p=0,049) y embotamiento afectivo (r=−0,325; p=0,006), y el dominio de expresión de la CAINS (r=−0,282; p=0,018). La LPO también se asoció con la PSP (r=0,246; p=0,04). No se encontraron asociaciones entre hemólisis eritrocitaria, CAT, y psicopatología o funcionalidad. Finalmente, ninguno de los biomarcadores correlacionó con la sintomatología depresiva.
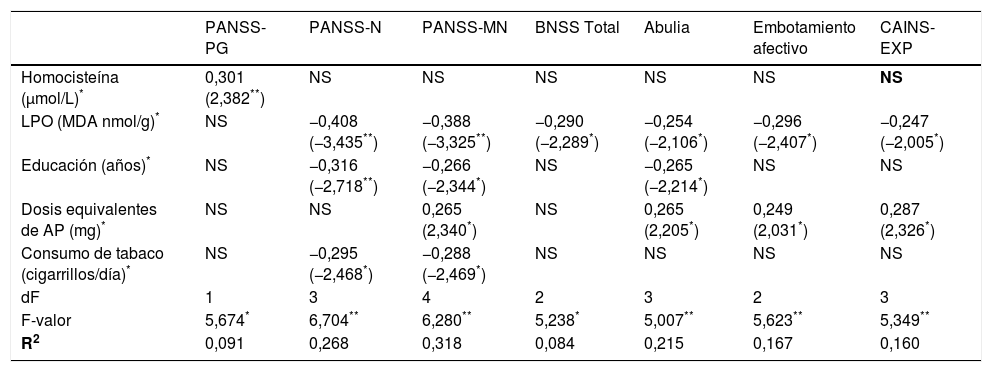
Los modelos finales obtenidos del análisis de regresión en el que se evaluaba el efecto de la homocisteína y LPO sobre la psicopatología o el nivel de funcionamiento se presentan en la tabla 3, que incluye solo aquellas variables explicativas con efecto significativo sobre dimensiones clínicas específicas.
Resumen de los modelos de regresión lineal en la asociación entre biomarcadores de estrés oxidativo y las puntuaciones clínicas
| PANSS-PG | PANSS-N | PANSS-MN | BNSS Total | Abulia | Embotamiento afectivo | CAINS-EXP | |
|---|---|---|---|---|---|---|---|
| Homocisteína (μmol/L)* | 0,301 (2,382**) | NS | NS | NS | NS | NS | NS |
| LPO (MDA nmol/g)* | NS | −0,408 (−3,435**) | −0,388 (−3,325**) | −0,290 (−2,289*) | −0,254 (−2,106*) | −0,296 (−2,407*) | −0,247 (−2,005*) |
| Educación (años)* | NS | −0,316 (−2,718**) | −0,266 (−2,344*) | NS | −0,265 (−2,214*) | NS | NS |
| Dosis equivalentes de AP (mg)* | NS | NS | 0,265 (2,340*) | NS | 0,265 (2,205*) | 0,249 (2,031*) | 0,287 (2,326*) |
| Consumo de tabaco (cigarrillos/día)* | NS | −0,295 (−2,468*) | −0,288 (−2,469*) | NS | NS | NS | NS |
| dF | 1 | 3 | 4 | 2 | 3 | 2 | 3 |
| F-valor | 5,674* | 6,704** | 6,280** | 5,238* | 5,007** | 5,623** | 5,349** |
| R2 | 0,091 | 0,268 | 0,318 | 0,084 | 0,215 | 0,167 | 0,160 |
AP: antipsicóticos; BNSS: Escala Breve de Síntomas Negativos; CAINS: Entrevista de Evaluación Clínica de los Síntomas Negativos; EXP: expresión; LPO: peroxidación lipídica; MDA: malondialdehído; MN: negativa factor Marder; N: negativa; NS: variables excluidas en el modelo final; PANSS: Escala del Síndrome Positivo y Negativo; PG: psicopatología general.
a beta estandarizado (t valor).
Niveles más elevados de homocisteína mostraron un efecto predictor sobre la psicopatología general evaluada por la PANSS, mientras que concentraciones más bajas de LPO predecían mayores puntuaciones en las subescalas PANSS-Negativa, PANSS-Negativa Factor Marder, CAINS-EXP y, específicamente, en las subescalas de abulia y embotamiento afectivo de la BNSS.
En el caso de la PANSS-Positiva, solo la variable dosis equivalentes de antipsicótico, pero ningún parámetro de estrés oxidativo, fue predictora en el modelo de regresión (β=0,330; p=0,004; R2=0,100). Además, la puntuación en la subescala de alogia de la BNSS solo fue explicada por una menor duración de la enfermedad (β=−0,320; p=0,014; R2=0,102) y tanto la gravedad global, evaluada por la CGI, como el nivel de funcionamiento, medido por la PSP, se explicaron significativamente por las dosis equivalentes de antipsicótico y los años de estudio (R2=0,181 y R2=0,188 respectivamente).
CogniciónCon relación al rendimiento cognitivo, solo la CAT mostró una correlación positiva significativa con el dominio específico de la MCCB, aprendizaje verbal (r=0,239; p=0,046). Sin embargo, el análisis de regresión múltiple reveló que únicamente los años de estudio (β=0,330; p=0,004) y las dosis equivalentes de antipsicótico (β=−0,239; p=0,036) fueron predictores de las puntuaciones T de aprendizaje verbal (modelo dF=2; F=6,561; p=0,002).
DiscusiónEntre los biomarcadores de estrés oxidativo estudiados, encontramos que solo la CAT está incrementada en pacientes con SZ estables, durante los primeros 10 años de evolución de la enfermedad, en comparación con los CS, al controlar por la presencia de MetS y hábito tabáquico.
Pocos estudios previos en pacientes estables con SZ han descrito una mayor CAT en los eritrocitos43,44 mientras otros detectan niveles más bajos45,46. No obstante, nuestros hallazgos son consistentes con el metaanálisis de Flatow et al. en el que se describe cómo esta enzima antioxidante podría ser un marcador de estado, al encontrarse sus niveles significativamente más bajos en un primer episodio de psicosis, aumentados en pacientes estabilizados y, posteriormente, disminuidos en pacientes crónicos47.
Es probable que, en pacientes estabilizados después de un episodio agudo, el aumento de la actividad CAT, dentro del sistema de defensa antioxidante, neutralice los radicales libres, evitando el daño potencial debido a la persistencia del estrés oxidativo. En esta línea, el hallazgo de niveles normales de LPO y hemólisis de eritrocitos en nuestra muestra podría ser el resultado de una respuesta antioxidante eficiente. Además, a diferencia de hallazgos previamente publicados48, no hemos detectado niveles aumentados de homocisteína, un aminoácido que provoca estrés oxidativo en las células al interactuar con el receptor NMDA, y que se ha implicado en la patogénesis de la SZ49.
Otro hallazgo de nuestro trabajo es la relación significativa entre algunos parámetros de estrés oxidativo y la gravedad de algunas dimensiones clínicas. Cuando se consideraron los factores de confusión, las asociaciones entre estos biomarcadores y la sintomatología general y negativa siguieron siendo significativas, mientras que las de las dimensiones positiva y cognitiva no.
Por un lado, la gravedad de la psicopatología general se relacionó con niveles más altos de homocisteína, al igual que se reportó en un estudio previo50. Sin embargo, no hemos replicado los hallazgos previos de la asociación positiva entre la homocisteína y la gravedad de los síntomas negativos50–52. Por otro lado, los niveles de LPO parecen ser más bajos en pacientes con mayor gravedad de los síntomas negativos, evaluados por las escalas PANSS y BNSS. Una única publicación describió esta asociación negativa significativa en un análisis de regresión lineal múltiple53, mientras que la mayoría de los estudios no encontraron ninguna correlación entre este parámetro y las características clínicas47. Por el contrario, un estudio previo observó un incremento en los parámetros de estrés oxidativo en pacientes con SZ deficitaria54. Hasta donde sabemos, somos los primeros en describir cómo niveles más bajos de LPO se relacionan específicamente con los síntomas de abulia y embotamiento afectivo, pero no con la anhedonia, déficit en la interacción social o alogia, en pacientes ambulatorios estables en sus primeros 10 años de enfermedad. Cabe mencionar que Garcia-Portilla et al. propusieron una estructura de 3 componentes de la BNSS, en la cual tanto la abulia como el embotamiento afectivo constituían el componente «mundo interno» de la dimensión negativa55. El estado antioxidante diferente en los pacientes durante una etapa temprana de la SZ podría ser el responsable de esta discrepancia. Nuestra hipótesis es que los pacientes jóvenes con un exceso de actividad antioxidante logran compensar el estrés oxidativo, incluso alcanzando niveles inferiores de lo habitual, aunque a largo plazo estos mecanismos se agotan. Los mecanismos subyacentes a esta asociación necesitarían una investigación más profunda en estudios longitudinales. Finalmente, con relación al funcionamiento neurocognitivo, a pesar de que la homocisteína se ha relacionado con el rendimiento cognitivo en sujetos sanos de edad avanzada56, no podemos concluir ninguna relación significativa con ninguno de los parámetros de estrés oxidativo en la SZ.
Se deben mencionar varias limitaciones de nuestro estudio. En primer lugar, el grupo de pacientes difiere del grupo control no solo en su enfermedad, sino también en el tratamiento psicofarmacológico, lo que puede haber contribuido a las diferencias halladas en los parámetros analizados. Sin embargo, no se detectó ninguna correlación significativa entre las concentraciones de CAT y las dosis equivalentes de clorpromazina en nuestra muestra (datos no presentados). En segundo lugar, en este estudio no se consideraron otros factores como el ejercicio, la dieta y los niveles de vitaminas, que podrían afectar a los biomarcadores de estrés oxidativo. Otra limitación es que solo disponíamos de un grupo de individuos sanos, pero no otro grupo de pacientes con trastorno mental grave, como el trastorno bipolar, para poder comparar. Por lo tanto, únicamente podemos determinar biomarcadores que diferencien a pacientes con SZ de los sujetos sanos, pero no podemos concluir que sean específicos de este trastorno. Respecto a las asociaciones con las dimensiones clínicas, aunque controlamos por dosis equivalentes de antipsicótico y benzodiazepinas, no se consideró el potencial efecto diferencial sobre los biomarcadores de cada tipo de antipsicótico ni el efecto de otros psicofármacos como los estabilizadores del ánimo (2 pacientes recibían valproato y un paciente litio) o los fármacos anticolinérgicos (2 pacientes tomaban biperideno). Finalmente, la naturaleza transversal de los datos presentados en este trabajo no nos permite inferir causalidad. Se necesitan estudios con un diseño longitudinal para poder dilucidar las relaciones causales entre los biomarcadores de estrés oxidativo, los síntomas psicopatológicos y los déficits a nivel cognitivo.
A pesar de estas limitaciones, cabe mencionar algunas fortalezas del presente estudio. La presencia de un grupo de control de la misma edad y sexo en nuestra muestra de estudio, y la consideración de una gran cantidad de factores de confusión en los análisis de regresión múltiple, son algunas de estas fortalezas. Además, se utilizaron instrumentos psicométricos precisos para una evaluación clínica detallada en el grupo de pacientes, especialmente para la sintomatología negativa, la cognición y el nivel de funcionamiento global. Hasta donde sabemos, ningún estudio previo sobre biomarcadores de estrés oxidativo en SZ ha empleado la BNSS, CAINS o PSP para una evaluación más precisa de la dimensión negativa y la funcionalidad global, y un limitado número de estudios han utilizado herramientas cognitivas fiables y válidas como la MCCB para examinar el rendimiento cognitivo en esta población. Finalmente, nuestra muestra fue relativamente homogénea, al incluir pacientes ambulatorios clínicamente estables en sus primeros 10 años de SZ, y en su mayoría tratados con antipsicóticos en monoterapia.
En conclusión, estos hallazgos que conectan los mecanismos biológicos con las características clínicas en pacientes con SZ son especialmente relevantes para la investigación traslacional en psiquiatría. Aunque todavía estamos lejos de encontrar biomarcadores válidos y específicos de esta enfermedad tan heterogénea, un enfoque biológico de este tipo nos permite acercarnos a horizontes prometedores en el campo del diagnóstico, capacidad pronóstica e intervención terapéutica en la práctica clínica.
FinanciaciónEste estudio está financiado por una beca del Ministerio de Economía y Competitividad, Instituto de Salud Carlos III (PI13/02263) y el Fondo Europeo de Desarrollo Regional (FEDER).
Conflicto de interesesLGB ha recibido una beca de la Fundación de Psiquiatría y Salud Mental. Además, esta autora ha recibido honorarios como ponente y soporte logístico para asistir a Congresos de Janssen-Cilag, Otsuka, Lundbeck, y Pfizer.
MPGPG ha sido consultora y ha recibido honorarios/becas de Alianza Otsuka-Lundbeck, CIBERSAM, European Commission, Instituto de Salud Carlos III, Janssen-Cilag, Lilly, Lundbeck, Otsuka, Pfizer, Servier, Roche, y Rovi.
LGA ha recibido honorarios de 7th Framework Program European Union.
PAMS ha sido consultora y ha recibido honorarios/becas de Adamed, AstraZeneca, Brainpharma, Bristol-Myers Squibb, CIBERSAM, Esteve, European Commission, Ferrer inCode, GlaxoSmithKline, Instituto de Salud Carlos III, Janssen-Cilag, Lilly, Lundbeck, Otsuka, Pfizer, Plan Nacional Sobre Drogas, Rovi, y Servier.
JBG ha recibido becas de investigación y ha sido consultor/ponente en los últimos 5 años de: AB-Biotics, Adamed, Almirall, AstraZeneca, Bristol-Myers Squibb, Ferrer, Glaxo- Smith-Kline, Hoffman La Roche, Janssen-Cilag, Indivior, Lilly, Lundbeck, Merck, Novartis, Organon, Otsuka, Pfizer, Pierre-Fabre, Reckitt-Benckiser, Sanofi-Aventis, Servier, Shering-Plough and Shire, fondos de investigación del Ministerio de Economía y Competitividad–Centro de Investigación Biomedica en Red Área de Salud Mental (CIBERSAM) e Instituto de Salud Carlos III-, Spanish Ministry of Health, Social Services and Equality - Plan Nacional sobre Drogas- y el 7th Framework Program of the European Union.
LFT, CIG, SRG, y ACM no tienen conflictos de intereses.