La sintomatología de la esquizofrenia es heterogénea, no existiendo ningún síntoma patognomónico de la misma. Además, su diagnóstico presenta dificultades, ya que se basa en información subjetiva en lugar de en marcadores. El propósito de este estudio es ofrecer una revisión del estado actual de los biomarcadores sanguíneos de las dimensiones psicopatológicas de la esquizofrenia. En pacientes con esquizofrenia se han observado disfunciones inflamatorias, hormonales o metabólicas y se ha intentado establecer los biomarcadores responsables de esas disfunciones. La identificación de estos podría contribuir al diagnóstico y tratamiento de la esquizofrenia.
Symptomatology of schizophrenia is heterogeneous, there is not any pathognomonic symptom. Moreover, the diagnosis is difficult, since it is based on subjective information, instead of markers. The purpose of this study is to provide a review of the current status of blood-based biomarkers of psychopathological dimensions of schizophrenia. Inflammatory, hormonal or metabolic dysfunctions have been identified in patients with schizophrenia and it has attempted to establish biomarkers responsible for these dysfunctions. The identification of these biomarkers could contribute to the diagnosis and treatment of schizophrenia.
La esquizofrenia es un trastorno mental grave, complejo y multifactorial caracterizado por una amplia variación fenotípica, una etiología heterogénea y una evolución fluctuante, cuya edad de inicio es la adolescencia tardía o la adultez temprana y que incluye síntomas positivos, negativos, afectivos y cognitivos, y afecta al menos al 0,7% de la población1,2.
La sintomatología de la esquizofrenia es heterogénea, no existiendo ningún síntoma patognomónico de la misma. Además, su diagnóstico presenta dificultades, ya que se basa en información subjetiva, proporcionada por los propios pacientes, o en la habilidad del clínico para hacer inferencias, en vez de en marcadores, como las pruebas de laboratorio o de neuroimagen. Por ello, la investigación actual está centrada en la búsqueda de esos marcadores que permitan una evaluación de los resultados más sensible y precisa. Así, se han investigado tanto marcadores biológicos como neuropsicológicos o del fenotipo psiquiátrico. Chan et al. (2014) han hecho una revisión de una selección de estudios sobre biomarcadores sanguíneos en pacientes con esquizofrenia, trastorno bipolar y trastorno depresivo mayor para enfatizar la importancia de implementar biomarcadores válidos que permitan no solo el diagnóstico y el tratamiento efectivo, sino también mejorar el pronóstico de los pacientes3. El National Institute of Mental Health, por su parte, ha puesto en marcha el Research Domain Criteria Project4, cuyo objetivo es aumentar el conocimiento sobre las relaciones cerebro-conducta e infundir este conocimiento sobre la disfunción neural en la práctica clínica para poder desarrollar tratamientos más efectivos.
El propósito de este estudio es ofrecer una revisión del estado actual de los biomarcadores sanguíneos de las dimensiones psicopatológicas de la esquizofrenia.
Dimensión positivaRespecto a la dimensión positiva de la esquizofrenia, su evaluación no plantea problemas ya que los instrumentos utilizados tradicionalmente la miden de forma adecuada. Las 2 escalas más ampliamente utilizadas y que se han empleado para su evaluación tanto en investigación como en la práctica clínica han sido la Scale for the Assessment of Positive Symptoms5 y la Positive and Negative Syndrome Scale for Schizophrenia (PANSS)6–8.
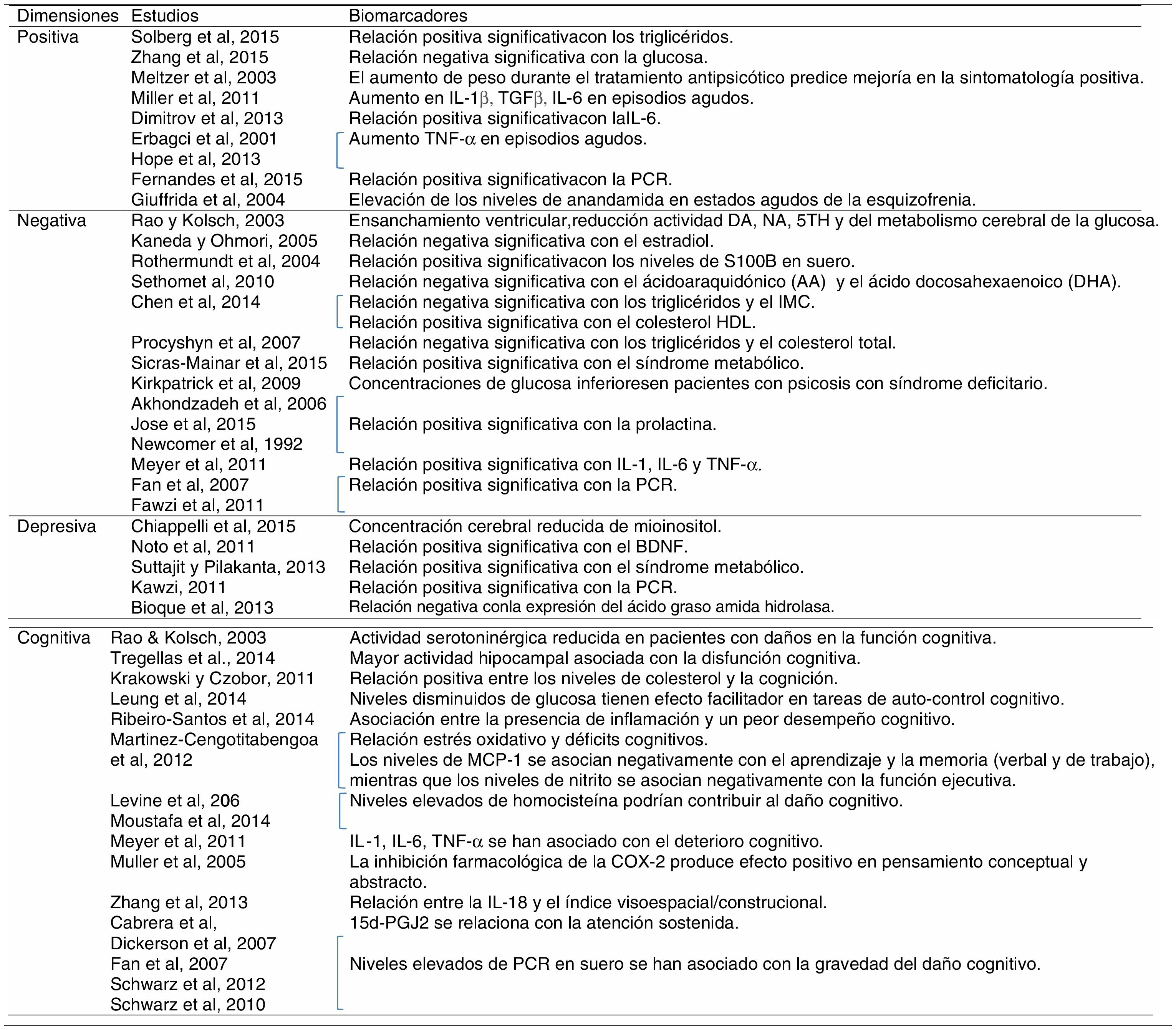
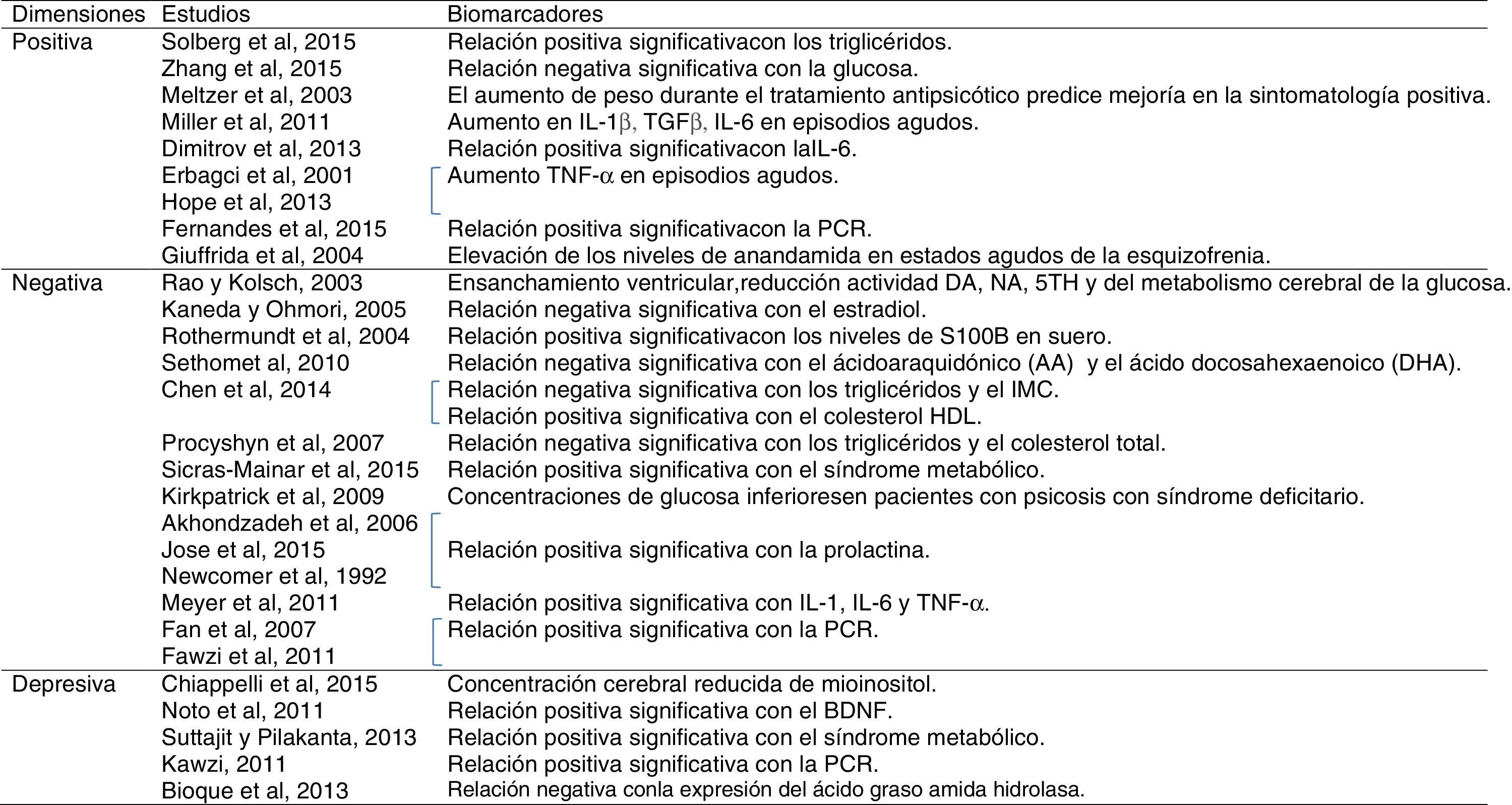
Con respecto a los biomarcadores de la dimensión positiva, se ha observado una relación significativa entre los niveles de triglicéridos en suero y los síntomas positivos evaluados con la escala positiva de la PANSS9. Además, se ha observado una relación negativa estadísticamente significativa entre los niveles de glucosa en plasma y los síntomas positivos valorados con la PANSS, evidenciando que el metabolismo de la glucosa alterado podría estar asociado con la patogénesis y la sintomatología de la esquizofrenia en fases tempranas de la enfermedad10. Estos autores concluyen que los factores que mejor predicen los niveles de glucosa en pacientes con esquizofrenia son la resistencia insulínica, la insulina y la puntuación en sintomatología positiva de la PANSS10. El aumento de peso durante el tratamiento antipsicótico, por su parte, predice una mejoría en el síndrome psicótico y en la sintomatología positiva11.
Además, se han observado alteraciones en varios parámetros inflamatorios: la interleucina (IL)-1β parece aumentar sus niveles en episodios agudos12 y en fases iniciales de la enfermedad13, el TGF-β y la IL-6 también muestran un aumento de sus niveles en los episodios agudos12. Una mayor sintomatología positiva (alucinaciones y delirios) parece relacionada con la expresión de interleucinas en los pacientes con esquizofrenia14; así, por ejemplo, Dimitrov et al. (2013)15 encontraron una asociación positiva entre los niveles de IL-6 y la sintomatología positiva evaluada mediante la PANSS. El factor de necrosis tumoral (TNF)-α también se ha relacionado con la gravedad de la dimensión positiva16, así como con el número de hospitalizaciones y episodios de descompensación que reflejan una mayor gravedad17, apuntando a la posibilidad de que sea un biomarcador específico de esta dimensión. Todos estos datos muestran la existencia de marcadores específicos de estado, es decir, durante los primeros episodios psicóticos y durante las reagudizaciones se producirían una serie de procesos inflamatorios e inmunes relacionados12,18. Asimismo, se ha observado una relación positiva entre los niveles periféricos de PCR y la gravedad de los síntomas positivos19.
Finalmente, el sistema endocannabinoide ha sido descrito como un sistema endógeno antiinflamatorio neuroprotector, y ciertos marcadores de este sistema, como la elevación de los niveles de anandamida, se han vinculado con la sintomatología positiva20.
Dimensión negativaEn cuanto a la dimensión negativa de la esquizofrenia, se ha medido tradicionalmente con la Brief Psychiatric Rating Scale21, la Scale for the Assessment of Negative Symptoms22 y la PANSS6,22. Además, Marder et al. (1997) establecieron, mediante un análisis factorial, el factor negativo de la PANSS. Sin embargo, la PANSS e incluso el factor negativo obtenido por Marder et al.23 presentan limitaciones psicométricas y conceptuales importantes24,25.
Esta dimensión negativa ha ido adquiriendo en los últimos años mayor interés debido al reto diagnóstico y terapéutico que supone y al gran impacto que provoca, junto con los síntomas cognitivos, sobre el funcionamiento de las personas que tienen esquizofrenia24. Los síntomas negativos muestran una mínima respuesta a la medicación antipsicótica y por ello son una diana atractiva para el desarrollo de nuevos tratamientos. Sin embargo, ningún antipsicótico utilizado hasta el momento ha demostrado ser eficaz para el tratamiento de dichos síntomas26. Además, el reconocimiento, la evaluación y el registro de estos síntomas son inferiores a los de los síntomas positivos a pesar de su persistencia e impacto, en parte debido a las limitaciones de las herramientas de evaluación. Sin embargo, gracias a la iniciativa del National Institute of Mental Health27–29, la evaluación psicométrica está experimentando un gran desarrollo y refinamiento metodológico24 debido a la creación de nuevas escalas, como la Clinical Assessment Interview for Negative Symptoms30 y la Brief Negative Symptom Scale31.
En cuanto a los biomarcadores de la dimensión negativa, se ha observado en estudios post mórtem del cerebro y del líquido cefalorraquídeo de pacientes con esquizofrenia con síntomas negativos una reducción en la actividad dopaminérgica, noradrenérgica y serotoninérgica32. El ensanchamiento ventricular está asociado con la gravedad de los síntomas negativos, la baja actividad de las monoaminas y un metabolismo cerebral de la glucosa reducido32. Además, una mejora en la transmisión glutamatérgica se ha asociado con una reducción en la sintomatología negativa32. El estradiol, la más potente hormona femenina, influye no solo en los caracteres sexuales primarios y secundarios, sino también en el crecimiento embrionario y fetal y en el desarrollo de redes aminérgicas cerebrales, implicadas en la esquizofrenia. El estradiol presentaría propiedades neuroprotectoras que podrían ser relevantes para el curso de la esquizofrenia y que podrían explicar la diferencias de género que existen con respecto a la progresión, los síntomas negativos y la respuesta terapéutica en los pacientes con esquizofrenia32. Según Kaneda y Ohmori (2005), las concentraciones de estradiol serían un posible biomarcador de la sintomatología negativa en varones33. También se han planteado los niveles de S100B (proteína producida por las astroglias que regula el balance entre la proliferación y la diferenciación de neuronas y células gliales) en suero como posible biomarcador de los síntomas negativos en la esquizofrenia34.
El ácido araquidónico, un ácido graso poliinsaturado omega-6 PUFA, y el ácido docosahexaenoico, un ácido graso poliinsaturado omega-3 PUFA, se encuentran negativamente correlacionados con el síndrome negativo en pacientes con esquizofrenia y el tratamiento antipsicótico parece aumentar esos niveles35. Según Chen et al. (2014)36, los triglicéridos y el colesterol HDL son posiblemente los 2 principales componentes lipídicos implicados en el desarrollo de la esquizofrenia y del síndrome negativo, observándose una relación negativa entre la sintomatología negativa y los triglicéridos, y una relación positiva con el colesterol HDL36 (tabla 1). En otro estudio se ha observado cómo niveles elevados de triglicéridos y colesterol total se asocian con una disminución en la sintomatología negativa37. Además, los síntomas negativos correlacionan de manera negativa con el IMC36. Asimismo, se ha observado una mayor prevalencia del síndrome metabólico en pacientes con esquizofrenia con sintomatología negativa38.
Algunos estudios han observado otras anomalías metabólicas, como la diabetes, en pacientes con esquizofrenia. El riesgo incrementado de esta parece independiente del uso de antipsicóticos39,40 o de unos pobres hábitos de salud, y además, se observa un riesgo incrementado incluso en los familiares de estos pacientes40. Sin embargo, un estudio reciente observa un estado glucémico comparable entre pacientes con esquizofrenia sin tratamiento antipsicótico y controles sanos, siendo posteriormente el tratamiento antipsicótico el que estuvo asociado con una alteración en la regulación de la glucosa41. En un estudio en el que se compararon 3 grupos: pacientes con psicosis no afectivas con síndrome deficitario, es decir, con síntomas negativos primarios y falta de malestar o disforia; pacientes con psicosis sin este síndrome, ambos recientemente diagnosticados y, por tanto, sin tratamiento antipsicótico previo; y sujetos control, se observaron concentraciones de glucosa significativamente superiores en pacientes con psicosis sin síndrome deficitario comparados con los pacientes con síndrome deficitario, y estos últimos, a su vez, presentaban niveles significativamente superiores que los sujetos controles. Sin embargo, tal y como concluyen estos autores, los resultados no son consistentes con una interpretación según la cual el grupo con síndrome deficitario tendría una forma más grave de la misma disfunción, es decir, un metabolismo de la glucosa anómalo. Aunque demostrarían que las diferencias entre síndrome deficitario versus no síndrome deficitario se extienden más allá de la psicopatología42. Por otro lado, se ha planteado la implicación del gen PPARγ en la alteración de los niveles de glucosa; sin embargo, no se sabe si este gen podría modificar el riesgo de anomalías metabólicas o de psicosis, o causar anomalías metabólicas que conduzcan a la psicosis43.
Los niveles de prolactina en pacientes con esquizofrenia también se han asociado con una mayor sintomatología negativa44–46, pero no con la positiva o con la psicopatología general45.
Con respecto a los parámetros inmunoinflamatorios, las IL-1 e IL-6 y el TNF-α se han asociado con los síntomas negativos47. Además, los mayores niveles de PCR en pacientes con esquizofrenia48,49 se han relacionado con una mayor gravedad psicopatológica reflejada en la puntuación total de la PANSS50,51, en la subescala negativa50,51 y en la subescala general50. Sin embargo, no se ha observado con la subescala positiva en algunos estudios50,51, aunque no en todos19.
Dimensión depresivaCon respecto a la dimensión afectiva de la esquizofrenia, los síntomas depresivos son comunes y suponen un componente central de esta52. Además, se asocian con una alta tasa de recaídas, ideación suicida, un aumento de la mortalidad, un reducido ajuste social y una pobre calidad de vida53–55. El nivel de depresión se ha evaluado tanto con escalas específicas para esta población, como por ejemplo la Escala de Depresión de Calgary56, como con escalas generales empleadas en pacientes con trastornos depresivos, como la Escala de Hamilton para la Depresión57.
Según Chiappelli et al. (2015)58 no hay ningún biomarcador para la depresión en esquizofrenia, aunque proponen como uno de los potenciales biomarcadores neuroquímicos la concentración cerebral reducida de mioinositol. El factor neurotrófico derivado del cerebro, por su parte, se han relacionado de manera positiva con los síntomas depresivos en esquizofrenia59.
También, los bajos niveles de colesterol han sido asociados con la depresión y los trastornos afectivos, ya que pueden disminuir la expresión de los receptores serotoninérgicos y causar una reducción en la actividad serotoninérgica60. Sin embargo, en los últimos años esta relación se ha puesto en duda ya que algunos autores no han observado ninguna relación entre el nivel de colesterol y los trastornos psiquiátricos61. El síndrome metabólico se ha relacionado con la depresión en esquizofrenia, en concreto con el humor deprimido, el insomnio medio y el retardo o inhibición62.
En cuanto a los marcadores inmunoinflamatorios, los mayores niveles de PCR se han relacionado con la depresión tanto en pacientes no psicóticos63 como en pacientes con esquizofrenia51. Wen et al. (2012)64 observaron niveles bajos de ácido úrico, potencial agente antioxidante, en la depresión, pero no en otros trastornos como la esquizofrenia; sin embargo, no hay estudios que se centren en evaluarlos en pacientes con esquizofrenia con predominio de sintomatología depresiva.
Finalmente, la expresión del ácido graso amida hidrolasa, un marcador del sistema endocannabinoide, ha mostrado una relación negativa con la sintomatología depresiva en PEP65.
Dimensión cognitivaFinalmente, los fallos neurocognitivos han sido también ampliamente documentados y se han considerado una característica central de la esquizofrenia66–70. Estos fallos serían relativamente independientes de los síntomas psicóticos71,72 y detectables antes de cualquier signo de la enfermedad73,74. Además, el deterioro cognitivo mostrado por los pacientes durante un episodio psicótico es similar al observado en esos mismos pacientes cuando los síntomas están bajo control75. Por ello, las correlaciones entre la gravedad de los síntomas psicóticos y las medidas de evaluación cognitiva observadas son normalmente cero76,77. Por otro lado, un subgrupo de familiares de primer grado de pacientes con esquizofrenia sin síntomas psicóticos ha mostrado un patrón de alteraciones cognitivas similares a las encontradas en pacientes con esquizofrenia78,79, evidenciando que ciertas alteraciones cognitivas podrían ser componentes de una vulnerabilidad genética para la esquizofrenia.
Los fallos cognitivos más frecuentes incluyen déficits en la atención, la memoria (episódica y de trabajo), la coordinación visoespacial y las funciones ejecutivas80–85. Los datos muestran una fuerte conexión entre esos fallos y el grado de funcionamiento en pacientes con esquizofrenia69,86. Por tanto, la presencia y la gravedad de los síntomas cognitivos deben ser consideradas un factor importante para determinar la evolución de la enfermedad87,88, ya que están asociadas con un curso de la enfermedad más grave y un uso frecuente de los servicios psiquiátricos89.
El incremento del conocimiento sobre los fallos neurocognitivos y su impacto en el funcionamiento ha hecho que exista un mayor interés por las posibles intervenciones que podrían aliviar estos déficits y por la creación de baterías estandarizadas que permitan medir la neurocognición. Por ese motivo, el National Institute of Mental Health planteó la iniciativa Measurement and Treatment Research to Improve Cognition in Schizophrenia o MATRICS, siendo uno de sus objetivos la creación por consenso de una batería cognitiva que permitiera evaluar dicha dimensión en ensayos clínicos sobre esquizofrenia90. Además, existen otras pruebas neuropsicológicas disponibles para la esquizofrenia y otras psicosis, como la Brief Assessment of Cognition in Schizophrenia91 o la Screen for Cognitive Impairment in Psychiatry92.
En estudios post mórtem del cerebro y del líquido cefalorraquídeo de pacientes con esquizofrenia la actividad serotoninérgica parece reducida no solo en aquellos con sintomatología negativa, sino también en los que presentan daños en la función cognitiva32. Además, una mayor actividad hipocampal es una característica de la esquizofrenia que se ha encontrado ampliamente asociada con la disfunción cognitiva, por lo que se plantea como biomarcador candidato para el desarrollo terapéutico93.
En cuanto a las determinaciones analíticas, Krakowski y Czobor (2011)94 observaron una relación positiva entre los niveles de colesterol y la cognición en pacientes con esquizofrenia, asociación que fue especialmente marcada con la memoria verbal. Además, no observaron interacción entre la medicación, en los distintos grupos de pacientes (clozapina, olanzapina o haloperidol), y el nivel de colesterol, es decir, la relación positiva era independiente de la medicación. Algunas de las explicaciones que se han dado a estos hallazgos es que las concentraciones de colesterol en suero pueden influir en la neurotransmisión serotoninérgica y colinérgica, o que correlacionan con los ácidos grasos poliinsaturados94,95. El colesterol podría ser un marcador de los ácidos grasos poliinsaturados, los cuales están implicados en la composición de la membrana neuronal y en la síntesis de neurotransmisores colinérgicos y serotoninérgicos. Sin embargo, en pacientes con trastorno bipolar eutímicos se ha observado que aquellos que presentan obesidad tienen un peor desempeño cognitivo comparados con pacientes con trastorno bipolar y controles sanos con peso normal96. Estos autores plantean que hay varios factores que pueden moderar la asociación entre obesidad y cognición en el trastorno bipolar, como datos antropométricos y lipometría, que pueden mediar el impacto de la distribución de la grasa corporal en la cognición96.
En relación con la glucosa, se ha observado que los niveles disminuidos de esta tienen un efecto de facilitación en pacientes con esquizofrenia durante tareas de autocontrol cognitivo, pero no durante tareas de autocontrol físico97.
Recientemente, se han relacionado los marcadores inflamatorios con la función cognitiva en la esquizofrenia, evidenciando una asociación entre la presencia de inflamación y un peor desempeño cognitivo98. En PEP se ha observado también una relación entre los déficits cognitivos y el estrés oxidativo99. Los pacientes con PEP tienen niveles inferiores de antioxidantes, catalasa y glutatión peroxidasa comparados con los controles sanos. Los niveles de MCP-1 se asocian negativamente con el aprendizaje y la memoria (verbal y de trabajo), mientras que los niveles de nitrito se asocian negativamente con la función ejecutiva. Finalmente, los niveles de glutatión se asocian positivamente con la función ejecutiva99. La homocisteína, otro marcador oxidativo, que se encuentra elevado en pacientes con esquizofrenia100,101, parece tener un papel importante en los procesos cognitivos tal y como se ha observado en estudios que miden los niveles de homocisteína en sujetos ancianos sanos102,103. Partiendo de esos datos, se ha planteado que niveles elevados de homocisteína podrían contribuir al daño cognitivo observado en pacientes con esquizofrenia104,105. Sin embargo, en algunos estudios con PEP no se ha observado ninguna asociación entre los niveles de homocisteína y cognición, evidenciando que los niveles de homocisteína pueden variar con el estado clínico, produciéndose niveles más elevados en las fases más avanzadas de la enfermedad106,107.
Las citocinas podrían tener también un papel central en funciones complejas del SNC como la cognición. Así, la IL-1, la IL-6 y el TNF-α se han asociado con el deterioro cognitivo47. El papel proinflamatorio de las citocinas está mediado por las prostaglandinas y la COX-2. Se ha planteado que la COX-2 está implicada en la función cognitiva, ya que modelos animales han observado que tiene un papel inhibitorio en la fuerza de la conectividad sináptica, crítica para el aprendizaje y la consolidación de la memoria108. Además, Muller et al. (2005)109 observaron un efecto positivo en pensamiento conceptual y pensamiento abstracto con la inhibición farmacológica de la COX-2, evidenciando que la inhibición de la COX2 probablemente influye en diferentes aspectos de la cognición, específicamente en aquellos relacionados con el córtex prefrontal. Zhang et al. (2012)110 observaron una relación entre el índice visoespacial/construccional y la IL-18. Los modelos animales muestran el papel neuroprotector de las prostaglandinas en el SNC111. Un estudio reciente llevado a cabo con PEP observa una relación entre la atención sostenida y el 15d-PGJ2 después de controlar posibles factores de confusión (edad, sexo, años de educación, IMC, cannabis, tabaco y el nivel de antipsicóticos); un mejor desempeño en tareas de atención sostenida se asociaron con unos niveles más elevados de expresión antiinflamatoria (15d-PGJ2), por lo que plantean la posibilidad de considerarlo como un factor protector para la cognición107. Finalmente, los niveles elevados de PCR en suero se han asociado con la gravedad del daño cognitivo en pacientes con esquizofrenia50,112–114 y en pacientes con trastorno bipolar115. Además, un estudio reciente observó la asociación entre niveles incrementados de PCR y alteraciones sensoriales (supresión alterada de la P50) en pacientes con esquizofrenia116.
Finalmente, diferentes elementos del sistema endocannabinoide se han asociado con distintos dominios cognitivos en PEP117.
ConclusionesLa investigación actual en esquizofrenia está centrada en la búsqueda de biomarcadores que permitan una evaluación y un diagnóstico menos subjetivo. Así, se han estudiado biomarcadores relacionados no solo con la esquizofrenia en general, sino con cada una de sus dimensiones.
La dimensión positiva se ha relacionado de manera positiva con los triglicéridos y de manera negativa con la glucosa y el aumento de peso. Además, se han observado parámetros inmunoinflamatorios (IL-1β, TGF-β, IL-6, TNF-α, PCR) relacionados de manera positiva con los episodios agudos.
En cuanto a la dimensión negativa, se ha relacionado de manera positiva con el ensanchamiento ventricular, los niveles de S100B en suero, el colesterol HDL, el síndrome metabólico, la prolactina y con parámetros inmunoinflamatorios (IL-1, IL-6, TNF-α, PCR), y de manera negativa con la actividad de dopamina, noradrenalina, serotonina, estradiol, ácido araquidónico, ácido docosahexaenoico, triglicéridos, IMC, colesterol total y glucosa.
La dimensión depresiva se ha relacionado de manera positiva con el factor neurotrófico derivado del cerebro, el síndrome metabólico y la PCR, y de manera negativa con la concentración cerebral de mioinositol.
Finalmente, la dimensión cognitiva se ha relacionado de manera positiva con el colesterol. Por otro lado, la actividad serotoninérgica reducida, la mayor actividad hipocampal y los parámetros inmunoinflamatorios (homocisteína, IL-1, IL-6, TNF-α, PCR) se han relacionado con el deterioro cognitivo. Además, hay biomarcadores que se han asociado con tareas cognitivas específicas.
Sin embargo, a pesar de todos estos estudios, hasta el momento ninguno de los biomarcadores estudiados ha demostrado unos niveles de precisión adecuados para contribuir al diagnóstico y el tratamiento de las personas con esquizofrenia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.