Determinar si los antipsicóticos de segunda generación (ASG) son eficaces para el tratamiento de los síntomas negativos de esquizofrenia.
MétodosSe llevaron a cabo dos metaanálisis en los que se utilizó placebo o haloperidol para establecer comparaciones. Se realizaron búsquedas en las siguientes bases de datos: Pubmed, The Cochrane Central Register of Controlled Trials, Proquest Health and Medical Complete, Science Citation Index Expanded, y Current Contents Connect. La variable medida utilizada fue el cambio de los síntomas negativos, eligiendo un estadístico muestral normalizado (d de Cohen) para sintetizar los datos.
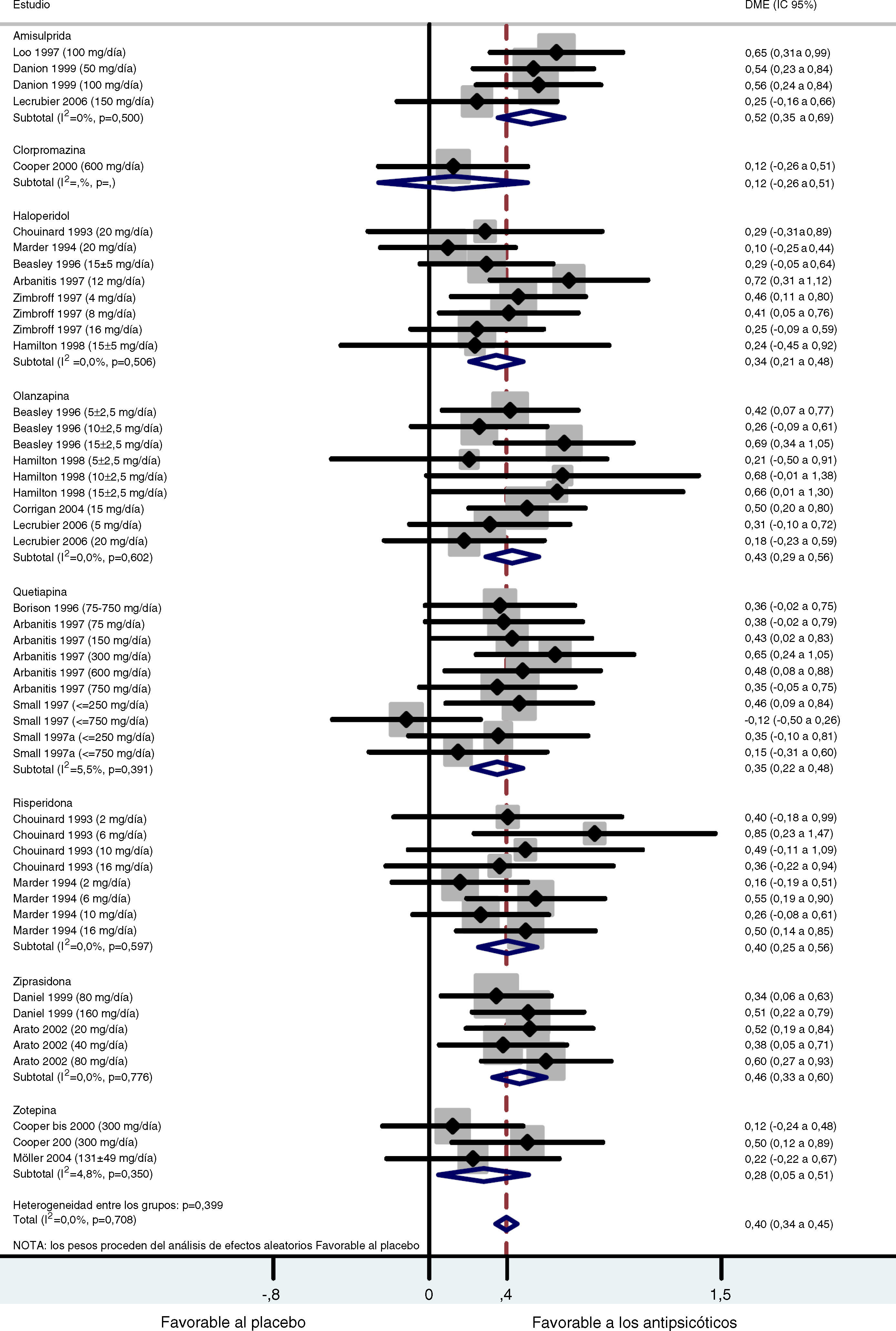
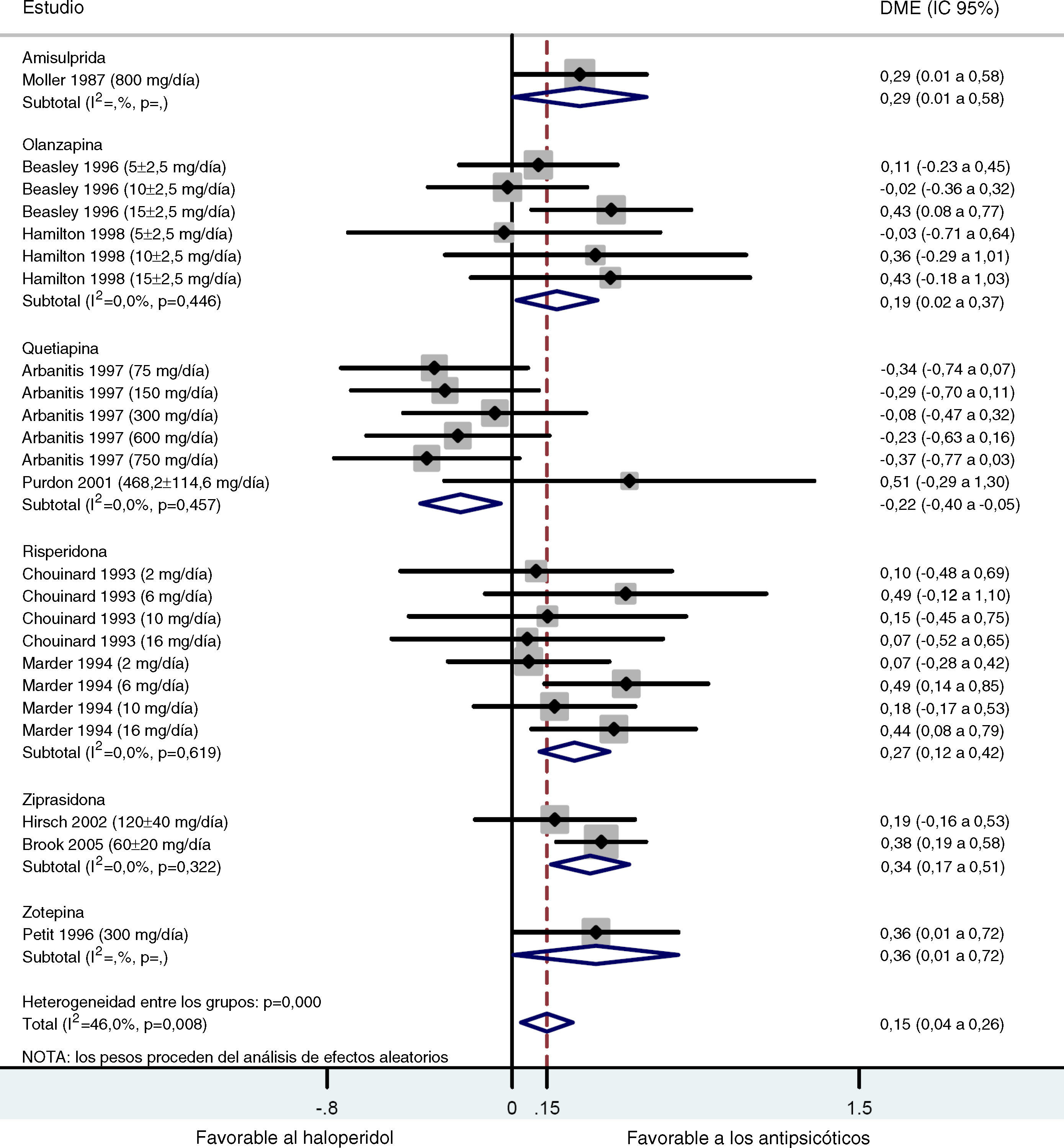
ResultadosEn el metaanálisis controlado con placebo, los tamaños del efecto (d de Cohen) que se obtuvieron con amisulprida, haloperidol, olanzapina, quetiapina, risperidona y ziprasidona fueron 0,52, 0,34, 0,43, 0,36, 0,40 y 0,46 respectivamente, unos resultados favorables al tratamiento activo respecto al placebo (p<0,001 en todos los casos). El metaanálisis controlado con haloperidol solo mostró una tendencia estadísticamente significativa favorable a los antipsicóticos respecto al haloperidol (d de Cohen=0,15).
ConclusionesLa mayoría de los antipsicóticos (amisulprida, haloperidol, olanzapina, quetiapina, risperidona y ziprasidona) son eficaces en el tratamiento de los síntomas negativos. El tamaño del efecto fue mayor con la amisulprida y la ziprasidona.
To determine whether second-generation-antipsychotics (SGAs) are effective for negative symptoms treatment in schizophrenia.
MethodsTwo meta-analyses were carried out using placebo or haloperidol as comparators. The search included the following databases: Pubmed, The Cochrane Central Register of Controlled Trials, Proquest Health and Medical Complete, Science Citation Index Expanded, and Current Contents Connect. The outcome measure used was the change in negative symptoms, choosing a standardized statistic (Cohen's d) to synthesize the data.
ResultsIn the placebo-controlled meta-analysis, the effect sizes (Cohen's d) obtained for amisulpride, haloperidol, olanzapine, quetiapine, risperidone and ziprasidone were 0.52, 0.34, 0.43, 0.36, 0.40 and 0.46, respectively, favoring active treatment against placebo (P<0.001 in all cases). The haloperidol-controlled meta-analysis only showed a statistically significant trend favoring antipsychotics over haloperidol (Cohen's d=0.15).
ConclusionsMost antipsychotics (amisulpride, haloperidol, olanzapine, quetiapine, risperidone and ziprasidone) are effective in the treatment of negative symptoms. Amisulpride and ziprasidone showed higher effect sizes.
Los síntomas negativos son característicos de la patología esquizofrénica y se asocian con deficiencias importantes de motivación, comunicación verbal y no verbal, afecto y función cognoscitiva y social1. Los síntomas negativos de la esquizofrenia son debilitantes y contribuyen a que los resultados y el funcionamiento en la esquizofrenia sean deficientes2. No se conocen bien los mecanismos subyacentes de los síntomas negativos. Varias hipótesis indicaban la relación entre los síntomas negativos y las alteraciones en la integración de emociones y la cognición que han sido consideradas durante mucho tiempo características distintivas de la esquizofrenia3.
Se ha afirmado que los medicamentos antipsicóticos de segunda generación (ASG) son más eficaces que los antipsicóticos tradicionales para el tratamiento de los síntomas negativos, sobre la base de una diversidad de estudios de distintos diseños y duraciones. Sin embargo, el entusiasmo inicial por los ASG como fármacos potentes para mejorar los síntomas negativos ha abierto paso al pesimismo relativo que afirma que los efectos de los actuales tratamientos farmacológicos podrían ser, como mucho, modestos4. La descripción de los ensayos clínicos en este campo debe incluir tanto la dosis usada como la duración del ensayo, debido a la aparición de reducciones en los síntomas negativos secundarios cuando la dosis de antipsicóticos tradicionales es baja o la duración del ensayo es mayor5.
El objetivo de este estudio fue investigar la eficacia de los antipsicóticos en el tratamiento de los síntomas negativos. La metodología usada fue el metaanálisis y se realizaron dos, un metaanálisis en el que se controlaban los ensayos con placebo y otro con haloperidol. El metaanálisis es un instrumento con una buena potencia estadística, los resultados pueden ser muy concluyentes cuando no se observa una variación notable entre los resultados de los distintos estudios, lo que demuestra también una clara superioridad sobre las revisiones tradicionales, que sólo ofrecen cálculos cualitativos de los efectos del tratamiento.
Procedimientos experimentalesBúsquedaSe utilizaron las siguientes bases de datos de ensayos clínicos para realizar las búsquedas, sin restricciones por fecha de publicación o tamaño de la muestra (N): Pubmed (de 1/1966 al 6 de noviembre de 2006), The Cochrane Central Register of Controlled Trials (CENTRAL) (versión actual, última búsqueda el 6 de noviembre de 2006), Proquest Health and Medical Complete (desde 1971 hasta el 31 de octubre de 2006), Science Citation Index Expanded (desde 1945 hasta el 6 de noviembre de 2006), y Current Contents Connect (desde 1998 hasta el 6 de noviembre de 2006). También identificamos estudios por referencias cruzadas de otros estudios que encontramos en dichas bases de datos. Los términos de la búsqueda fueron «schizophrenia negative trial» y «schizophrenia negative trial placebo».
SelecciónLos estudios incluidos en nuestros análisis fueron ensayos clínicos aleatorizados (ECA) controlados con placebo y con doble enmascaramiento que evaluaban la eficacia de los antipsicóticos que cumplían los criterios siguientes: 1) la muestra del estudio recibió el diagnóstico de esquizofrenia o trastorno esquizo-afectivo según los criterios del DSM-IV, DSM-III-R o ICD-10; 2) se evaluó y se notificó su eficacia en los síntomas negativos; 3) artículos en inglés, y 4) los pacientes no recibían más de un antipsicótico durante el ensayo (monoterapia). Se excluyeron de los análisis los estudios con cualquiera de las siguientes características: 1) estudios abiertos; 2) población resistente al tratamiento; 3) con antecedentes de ausencia de respuesta a cualquier antipsicótico y, estudios con pacientes; 4) diagnosticados con trastorno esquizofreniforme; 5) diagnosticados con trastorno delirante; 6) con abuso o dependencia de drogas; 7) que tomaban ansiolíticos, antidepresivos o estabilizadores del estado de ánimo durante el período de estudio, y 8) ensayos con una duración inferior a seis semanas. Excluimos también algunos estudios en los que no se facilitaban datos suficientes de variabilidad para nuestro estudio y no se pudo conseguir esta información tras ponernos en contacto con los autores. Se excluyeron también los estudios que investigaban indicaciones no registradas o medicamentos no comercializados. La búsqueda y la selección de los estudios se llevaron a cabo por dos investigadores y, en caso de discrepancia sobre la inclusión de un estudio, se llegó a un acuerdo sobre la inclusión o exclusión mediante el consenso con médicos.
Características del estudioEl variable medida fue el cambio medio en la puntuación entre la medición inicial y la final de los síntomas negativos. Todos los datos extraídos sobre la eficacia de los ensayos originales correspondían a un análisis por intención de tratar (ITT), lo que significa que se analizaron los datos de todos los pacientes aleatorizados que presentaban al menos una evaluación de eficacia tras la aleatorización. Este tipo de análisis es preferible a un análisis más completo, que incluye sólo los datos de los participantes que terminaron el ensayo y que, por tanto, provoca un posible sesgo en los resultados. Se utilizó en todos los ensayos la extrapolación de la última observación (LOCF), es decir, cuando un paciente se retiraba prematuramente del estudio, sus datos se incluían en los análisis de las mediciones finales extrapolando los datos de su última evaluación.
Existen varias escalas y subescalas para la evaluación de los síntomas negativos de la esquizofrenia. Sin embargo, las escalas más usadas y las que aparecen en los estudios incluidos en nuestro metaanálisis fueron: SANS (Scale for the Assessment of Negative Symptoms, escala para la evaluación de los síntomas negativos)6 y SANS summary (la versión modificada de la escala para la evaluación de los síntomas negativos)7, que es la suma de las clasificaciones globales de SANS, PANSS-N (sub-escala negativa de la Positive and Negative Syndrome Scale, escala del síndrome positivo y negativo)8, y BPRS-R (el factor de retraso de la Brief Psychiatric Rating Scale, escala breve de evaluación psiquiátrica), que es la suma de los ítems 3, 13 y 16 de la BPRS9: retraimiento emocional, retraso motor y afecto aplanado.
Entre los artículos encontrados utilizando las bases de datos mencionadas, se han descartado varios por los motivos siguientes: 1) tipo de artículo (revisiones, metaanálisis y acercamiento analítico de pautas); 2) evaluación de la eficacia de medicamentos que no sean antipsicóticos, o 3) estudio de otras enfermedades (que no sean esquizofrenia, p.ej., trastorno esquizotípico de la personalidad).
Síntesis de datos cuantitativosEl metaanálisis comparaba los ASG con el placebo o haloperidol. La diferencia media estandarizada (DME) usada fue el d de Cohen10 en ambos metaanálisis. Se eligió un estadístico estandarizado para posibilitar la combinación de resultados de distintas escalas que evalúan la misma variable medida. Los valores positivos de la DME indican efectos favorables al antipsicótico y los valores negativos efectos favorables al placebo o haloperidol. Se aplicó un modelo de efectos aleatorios, siguiendo el método de Der-Simonian y Laird11. Esta estrategia es preferible a una estrategia de efectos fijos que implica presuponer que los efectos calculados en los distintos estudios son idénticos. Para estudiar la heterogeneidad entre los estudios, se usaron el estadístico Q de Cochran12 y la prueba I213. Se calculó la I2 como I2=máx (0, 100 * (Q-df)/Q) donde Q es el estadístico de Q de Cochran y df son los grados de libertad (número de estudios-1). Se prefiere la I2 a la prueba de Q, ya que se sabe que la prueba de Q no detecta bien la heterogeneidad real cuando se trata de un número pequeño de estudios, como suele ser el caso de los metaanálisis. El sesgo de las publicaciones se evaluó mediante las pruebas de Begg y Egger14,15.
Los metaanálisis realizados se estratificaron agrupando los resultados por fármaco con placebo o haloperidol en los grupos de control, es decir, risperidona frente a placebo y olanzapina frente a haloperidol. Para realizar un metaanálisis con datos continuos usando la DME, fue necesaria la desviación estándar (DE) del cambio medio para cada grupo de tratamiento. En caso de que los ensayos no aportaran esta información y si no fuera posible obtener estos datos de los autores, se utilizaron los valores de p para calcular la DE media de los grupos experimental y de control. Se utilizaron intervalos de confianza del 95% y los valores de p<0,05 se consideraron estadísticamente significativos. Todos los cálculos se realizaron usando STATA (StataCorp versión 8.2).
ResultadosEstudios excluidos de los metaanálisisEnsayos controlados con placeboTras el primer proceso de selección, se seleccionaron 43 estudios para una evaluación más detallada. De éstos, se excluyeron cinco estudios porque no indicaban los resultados en escalas o subescalas de síntomas negativos, cinco porque su población incluía a pacientes con trastorno esquizofreniforme o trastorno esquizotípico de la personalidad, dos porque su población era resistente o intolerante al tratamiento con neurolépticos, dos estudios porque tenían un diseño cruzado, dos estudios porque la duración del ensayo fue menor de 6 semanas, y otros dos porque sólo estudiaban medicamentos no comercializados: fananserina y sertindol. Un estudio se excluyó porque algunos pacientes recibieron antidepresivos durante el proceso. Por último, tuvimos que excluir tres estudios porque fue imposible contactar con los autores, que no habían indicado suficientes medidas de la variabilidad de los síntomas negativos.
Ensayos controlados con haloperidolTras un primer proceso de selección, usando los mismos criterios que en la selección de ensayos controlados con placebo, se seleccionaron 26 estudios para una evaluación más detallada. Se excluyeron 5 de estos estudios porque no comunicaban los resultados en las escalas de síntomas negativos, otros 5 porque su población incluía a pacientes con trastorno esquizofreniforme y tres porque su población era resistente al tratamiento con neurolépticos. Uno de estos tres estudios fue el de Breier et al16, cuya población estaba formada por pacientes con una respuesta parcial. Se excluyó también el estudio de Zimbroff et al17 porque sólo comparaba el sertindol con el haloperidol. Se excluyó otro estudio porque no indicaba los datos sobre cambios en la puntuación de los síntomas negativos, la variable medida. Otro estudio se excluyó porque algunos pacientes recibieron antidepresivos durante el ensayo y otro porque no tenía un diseño con doble enmascaramiento, sino sólo un diseño con cierto enmascaramiento. Por último, fue necesario excluir un estudio, tras haberse puesto en contacto con los autores, porque no se indicaron suficientes medidas de la variabilidad de los síntomas negativos.
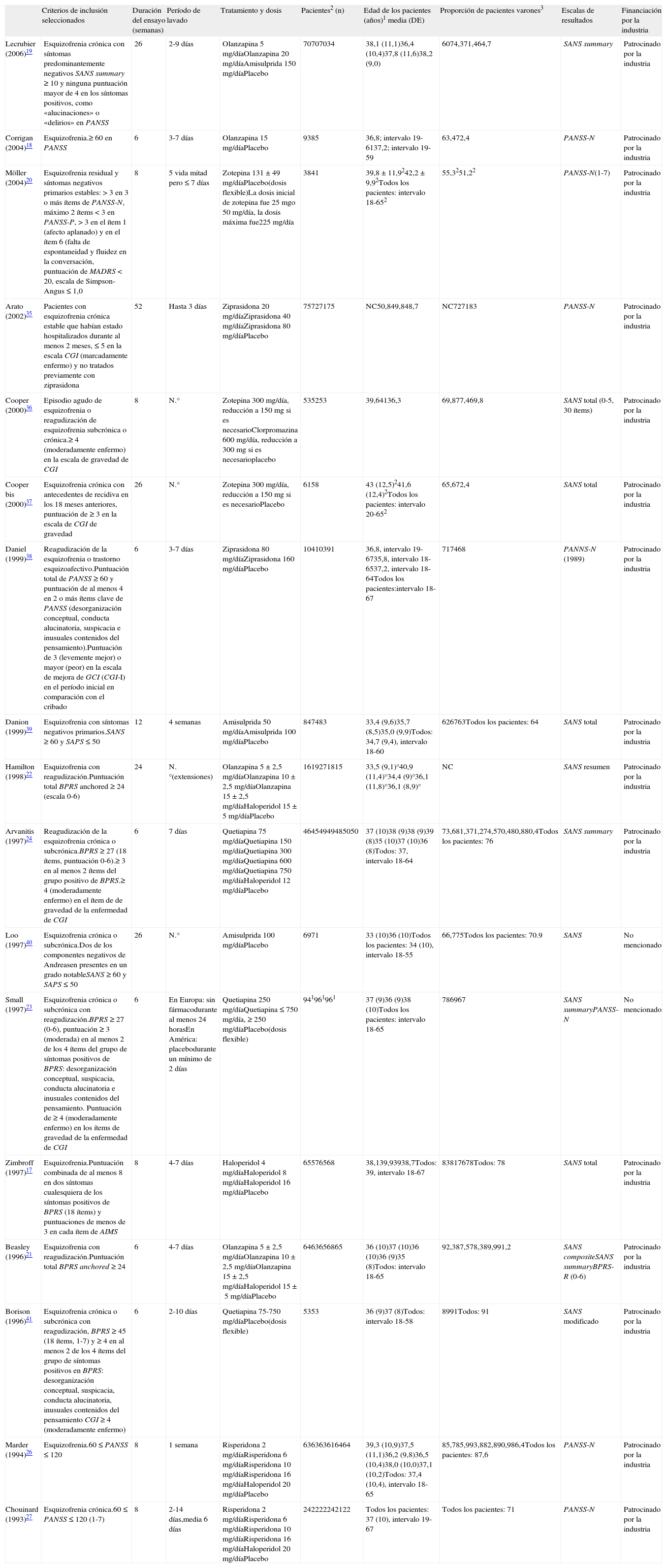
Estudios incluidos en el metaanálisis comparativo entre el placebo y el tratamiento activoEn la tabla 1 se enumeran y se describen los estudios incluidos en este metaanálisis. En conjunto, 18 artículos comunicaban eficacia sobre los síntomas negativos; 16 eran estudios con antipsicóticos de primera y de segunda generación: 3 de amisulprida, 6 de haloperidol, 4 de olanzapina, 4 de quetiapina, 2 de ziprasidona, 3 de zotepina, 2 de risperidona y uno de clorpromazina (algunos estudios comunicaron resultados de más de un antipsicótico). Todos los estudios estaban controlados con placebo, eran aleatorizados, con doble enmascaramiento y monoterapia. La duración del período con doble enmascaramiento oscilaba entre 6 semanas y un año. El diagnóstico de esquizofrenia se realizó según el DSM-III-R (manual diagnóstico y estadístico de trastornos mentales) en todos los ensayos, con las excepciones de Corrigan et al18, Lecrubier et al19, Zimbroff et al17, y Möller et al20, que utilizaron el DSM-IV, tanto DSM-III-R como DSM-IV, y el ICD-10 respectivamente. En la mayoría de los ensayos se permitió el uso de medicamentos concomitantes para el tratamiento del insomnio, la ansiedad, los SEP (síntomas extrapiramidales) o la acatisia. En cuanto a las diferencias de ámbito entre los estudios, algunos incluían sólo a poblaciones hospitalizadas, otros sólo a pacientes ambulatorios y otros a ambos tipos de pacientes. Todos los datos incluidos en el metaanálisis se obtuvieron utilizando un análisis LOCF por intención de tratar (ITT), lo que significa que los análisis incluían a todos los pacientes aleatorizados con una medición inicial y al menos una medición posterior. Si un paciente se retiraba del estudio, se extrapolaba la última observación y se utilizaba en el análisis de las mediciones finales. En el estudio de Möller et al20 un paciente del grupo de placebo usó prometazina como medicación concomitante. La prometazina tiene efectos anticolinérgicos y antes se utilizaba como antipsicótico, pero su efecto antipsicótico es de sólo aproximadamente una décima parte del de la clorpromazina. Aunque Lecrubier et al19 indicaron los análisis de los datos tanto ITT como por protocolo, sólo se utilizaron en el metaanálisis los datos del análisis ITT. En Zimbroff et al17 y Corrigan et al18, no se extrajeron los resultados del sertindol y el sonepiprazol, ya que el sertindol se retiró del mercado el 2 de diciembre de 1998 debido a un presunto riesgo de arritmia cardíaca y muerte súbita. El sonepiprazol no es eficaz para el tratamiento de los pacientes con esquizofrenia. Beasley et al21 y Hamilton et al22 publicaron los datos del mismo ensayo, Beasley et al21 publicaron los resultados de la fase aguda del ensayo y Hamilton et al22 de la extensión de respuesta del mismo ensayo. Aunque en Beasley et al21 la eficacia en los síntomas negativos se presentó mediante BPRS-R (factor de retraso de BPRS), SANS composite y SANS summary, sólo se usaron los datos de una estas escalas en el metaanálisis. Se eligió SANS summary para lograr la homogeneidad del grupo de escalas usadas en este estudio. Tanto los datos de PANSS-N como los de SANS summary de Small et al23 se utilizaron en el metaanálisis, puesto que correspondían a conjuntos de poblaciones distintas. PANSS-N se usó para la población europea y SANS summary para la población americana.
Características de los estudios incluidos en el metaanálisis de estudios controlados con placebo
| Criterios de inclusión seleccionados | Duración del ensayo (semanas) | Período de lavado | Tratamiento y dosis | Pacientes2 (n) | Edad de los pacientes (años)1 media (DE) | Proporción de pacientes varones3 | Escalas de resultados | Financiación por la industria | |
| Lecrubier (2006)19 | Esquizofrenia crónica con síntomas predominantemente negativos SANS summary ≥ 10 y ninguna puntuación mayor de 4 en los síntomas positivos, como «alucinaciones» o «delirios» en PANSS | 26 | 2-9 días | Olanzapina 5 mg/díaOlanzapina 20 mg/díaAmisulprida 150 mg/díaPlacebo | 70707034 | 38,1 (11,1)36,4 (10,4)37,8 (11,6)38,2 (9,0) | 6074,371,464,7 | SANS summary | Patrocinado por la industria |
| Corrigan (2004)18 | Esquizofrenia.≥ 60 en PANSS | 6 | 3-7 días | Olanzapina 15 mg/díaPlacebo | 9385 | 36,8; intervalo 19-6137,2; intervalo 19-59 | 63,472,4 | PANSS-N | Patrocinado por la industria |
| Möller (2004)20 | Esquizofrenia residual y síntomas negativos primarios estables: > 3 en 3 o más ítems de PANSS-N, máximo 2 ítems < 3 en PANSS-P, > 3 en el ítem 1 (afecto aplanado) y en el ítem 6 (falta de espontaneidad y fluidez en la conversación, puntuación de MADRS < 20, escala de Simpson-Angus ≤ 1,0 | 8 | 5 vida mitad pero ≤ 7 días | Zotepina 131 ± 49 mg/díaPlacebo(dosis flexible)La dosis inicial de zotepina fue 25 mgo 50 mg/día, la dosis máxima fue225 mg/día | 3841 | 39,8 ± 11,9242,2 ± 9,92Todos los pacientes: intervalo 18-652 | 55,3251,22 | PANSS-N(1-7) | Patrocinado por la industria |
| Arato (2002)35 | Pacientes con esquizofrenia crónica estable que habían estado hospitalizados durante al menos 2 meses, ≤ 5 en la escala CGI (marcadamente enfermo) y no tratados previamente con ziprasidona | 52 | Hasta 3 días | Ziprasidona 20 mg/díaZiprasidona 40 mg/díaZiprasidona 80 mg/díaPlacebo | 75727175 | NC50,849,848,7 | NC727183 | PANSS-N | Patrocinado por la industria |
| Cooper (2000)36 | Episodio agudo de esquizofrenia o reagudización de esquizofrenia subcrónica o crónica.≥ 4 (moderadamente enfermo) en la escala de gravedad de CGI | 8 | N.° | Zotepina 300 mg/día, reducción a 150mg si es necesarioClorpromazina 600 mg/día, reducción a 300mg si es necesarioplacebo | 535253 | 39,64136,3 | 69,877,469,8 | SANS total (0-5, 30 ítems) | Patrocinado por la industria |
| Cooper bis (2000)37 | Esquizofrenia crónica con antecedentes de recidiva en los 18 meses anteriores, puntuación de ≥ 3 en la escala de CGI de gravedad | 26 | N.° | Zotepina 300 mg/día, reducción a 150mg si es necesarioPlacebo | 6158 | 43 (12,5)241,6 (12,4)2Todos los pacientes: intervalo 20-652 | 65,672,4 | SANS total | Patrocinado por la industria |
| Daniel (1999)38 | Reagudización de la esquizofrenia o trastorno esquizoafectivo.Puntuación total de PANSS ≥ 60 y puntuación de al menos 4 en 2 o más ítems clave de PANSS (desorganización conceptual, conducta alucinatoria, suspicacia e inusuales contenidos del pensamiento).Puntuación de 3 (levemente mejor) o mayor (peor) en la escala de mejora de GCI (CGI-I) en el período inicial en comparación con el cribado | 6 | 3-7 días | Ziprasidona 80 mg/díaZiprasidona 160 mg/díaPlacebo | 10410391 | 36,8, intervalo 19-6735,8, intervalo 18-6537,2, intervalo 18-64Todos los pacientes:intervalo 18-67 | 717468 | PANNS-N (1989) | Patrocinado por la industria |
| Danion (1999)39 | Esquizofrenia con síntomas negativos primarios.SANS ≥ 60 y SAPS ≤ 50 | 12 | 4 semanas | Amisulprida 50 mg/díaAmisulprida 100 mg/díaPlacebo | 847483 | 33,4 (9,6)35,7 (8,5)35,0 (9,9)Todos: 34,7 (9,4), intervalo 18-60 | 626763Todos los pacientes: 64 | SANS total | Patrocinado por la industria |
| Hamilton (1998)22 | Esquizofrenia con reagudización.Puntuación total BPRS anchored ≥ 24 (escala 0-6) | 24 | N.°(extensiones) | Olanzapina 5 ± 2,5 mg/díaOlanzapina 10 ± 2,5 mg/díaOlanzapina 15 ± 2,5 mg/díaHaloperidol 15 ± 5 mg/díaPlacebo | 1619271815 | 33,5 (9,1)°40,9 (11,4)°34,4 (9)°36,1 (11,8)°36,1 (8,9)° | NC | SANS resumen | Patrocinado por la industria |
| Arvanitis (1997)24 | Reagudización de la esquizofrenia crónica o subcrónica.BPRS ≥ 27 (18 ítems, puntuación 0-6).≥ 3 en al menos 2 ítems del grupo positivo de BPRS.≥ 4 (moderadamente enfermo) en el ítem de de gravedad de la enfermedad de CGI | 6 | 7 días | Quetiapina 75 mg/díaQuetiapina 150 mg/díaQuetiapina 300 mg/díaQuetiapina 600 mg/díaQuetiapina 750 mg/díaHaloperidol 12 mg/díaPlacebo | 46454949485050 | 37 (10)38 (9)38 (9)39 (8)35 (10)37 (10)36 (8)Todos: 37, intervalo 18-64 | 73,681,371,274,570,480,880,4Todos los pacientes: 76 | SANS summary | Patrocinado por la industria |
| Loo (1997)40 | Esquizofrenia crónica o subcrónica.Dos de los componentes negativos de Andreasen presentes en un grado notableSANS ≥ 60 y SAPS ≤ 50 | 26 | N.° | Amisulprida 100 mg/díaPlacebo | 6971 | 33 (10)36 (10)Todos los pacientes: 34 (10), intervalo 18-55 | 66,775Todos los pacientes: 70.9 | SANS | No mencionado |
| Small (1997)23 | Esquizofrenia crónica o subcrónica con reagudización.BPRS ≥ 27 (0-6), puntuación ≥ 3 (moderada) en al menos 2 de los 4 ítems del grupo de síntomas positivos de BPRS: desorganización conceptual, suspicacia, conducta alucinatoria e inusuales contenidos del pensamiento. Puntuación de ≥ 4 (moderadamente enfermo) en los ítems de gravedad de la enfermedad de CGI | 6 | En Europa: sin fármacodurante al menos 24 horasEn América: placebodurante un mínimo de 2 días | Quetiapina 250 mg/díaQuetiapina ≤ 750 mg/día, ≥ 250 mg/díaPlacebo(dosis flexible) | 941961961 | 37 (9)36 (9)38 (10)Todos los pacientes: intervalo 18-65 | 786967 | SANS summaryPANSS-N | No mencionado |
| Zimbroff (1997)17 | Esquizofrenia.Puntuación combinada de al menos 8 en dos síntomas cualesquiera de los síntomas positivos de BPRS (18 ítems) y puntuaciones de menos de 3 en cada ítem de AIMS | 8 | 4-7 días | Haloperidol 4 mg/díaHaloperidol 8 mg/díaHaloperidol 16 mg/díaPlacebo | 65576568 | 38,139,93938,7Todos: 39, intervalo 18-67 | 83817678Todos: 78 | SANS total | Patrocinado por la industria |
| Beasley (1996)21 | Esquizofrenia con reagudización.Puntuación total BPRS anchored ≥ 24 | 6 | 4-7 días | Olanzapina 5±2,5 mg/díaOlanzapina 10±2,5 mg/díaOlanzapina 15±2,5 mg/díaHaloperidol 15±5 mg/díaPlacebo | 6463656865 | 36 (10)37 (10)36 (10)36 (9)35 (8)Todos: intervalo 18-65 | 92,387,578,389,991,2 | SANS compositeSANS summaryBPRS-R (0-6) | Patrocinado por la industria |
| Borison (1996)41 | Esquizofrenia crónica o subcrónica con reagudización, BPRS ≥ 45 (18 ítems, 1-7) y ≥ 4 en al menos 2 de los 4 ítems del grupo de síntomas positivos en BPRS: desorganización conceptual, suspicacia, conducta alucinatoria, inusuales contenidos del pensamiento CGI ≥ 4 (moderadamente enfermo) | 6 | 2-10 días | Quetiapina 75-750 mg/díaPlacebo(dosis flexible) | 5353 | 36 (9)37 (8)Todos: intervalo 18-58 | 8991Todos: 91 | SANS modificado | Patrocinado por la industria |
| Marder (1994)26 | Esquizofrenia.60 ≤ PANSS ≤ 120 | 8 | 1 semana | Risperidona 2 mg/díaRisperidona 6 mg/díaRisperidona 10 mg/díaRisperidona 16 mg/díaHaloperidol 20 mg/díaPlacebo | 636363616464 | 39,3 (10,9)37,5 (11,1)36,2 (9,8)36,5 (10,4)38,0 (10,0)37,1 (10,2)Todos: 37,4 (10,4), intervalo 18-65 | 85,785,993,882,890,986,4Todos los pacientes: 87,6 | PANSS-N | Patrocinado por la industria |
| Chouinard (1993)27 | Esquizofrenia crónica.60 ≤ PANSS ≤ 120 (1-7) | 8 | 2-14 días,media 6 días | Risperidona 2 mg/díaRisperidona 6 mg/díaRisperidona 10 mg/díaRisperidona 16 mg/díaHaloperidol 20 mg/díaPlacebo | 242222242122 | Todos los pacientes: 37 (10), intervalo 19-67 | Todos los pacientes: 71 | PANSS-N | Patrocinado por la industria |
AIMS: Abnormal Involuntary Movement Scale; BPRS: Brief Psychiatric Rating Scale; BPRS-A: BPRS-Anchored; BPRS-R: suma de los ítems retraimiento emocional, retraso motor y afecto aplanado de la BPRS; CGI: Clinical Global Impression; MADRS: Montgomery Asberg Depression Rating Scale (64); NC: no se comunica; PANSS: Positive and Negative Syndrome Scale; PANSS-N: escala negativa PANSS; PANSS-P: sub-escala positiva PANSS; QLS: Quality of Life Scale; Simpson-Angus Scale (65); SANS: Scale for the assessment of negative symptoms; SANS summary: suma de la SANS global ratings; SAPS: Scale for the Assessment of Positive Symptoms.
(0) datos de los pacientes con una medición inicial y al menos una valoración posterior QLS; (1) al inicio; (2) relativo a los pacientes incluidos en los análisis; (3) todos los datos se expresan como porcentajes.
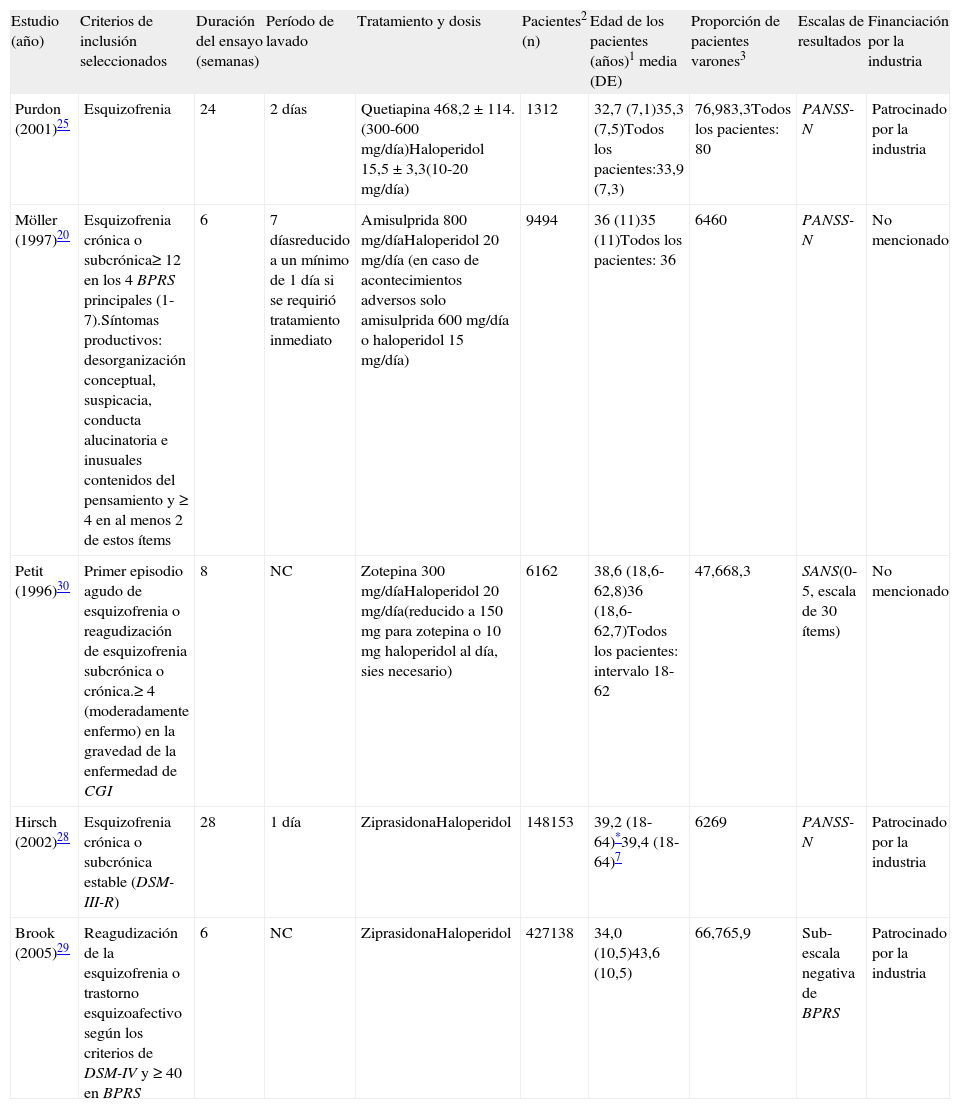
En este metaanálisis se utilizaron los datos de 10 artículos que comparaban el haloperidol con un ASG: 2 para la olanzapina21,22, 2 para la quetiapina24,25, 2 para la risperidona26,27, 2 para la ziprasidona28,29, uno para la amisulprida20 y uno para la zotepina30. Los estudios de Marder et al26, Arvanitis et al23, Beasley et al21, Hamilton et al22, y Chouinard et al27 ya se habían incluido en el metaanálisis de ensayos clínicos controlados con placebo, y cuyas características se presentan en la tabla 1. Para los estudios de Purdon et al25, Möller et al20, Hirsch et al27, Brook et al29 y Petit et al30, véase la tabla 2. Todos los estudios estaban controlados con haloperidol, era aleatorizados y monoterapia. La duración del período con doble enmascaramiento osciló entre 6 semanas y 6 meses. El diagnóstico de esquizofrenia se realizó según el DSM-III-R en todos los ensayos, a excepción del de Purdon et al25, que utilizaron el DSM-IV. Además, al igual que en el metaanálisis de ensayos controlados con placebo, en la mayoría de los ensayos se permitió el uso de medicamentos para el tratamiento del insomnio, la ansiedad, los SEP o la acatisia. Algunos ensayos incluían sólo a poblaciones hospitalizadas, otros solo a pacientes ambulatorios y otros a ambos tipos de pacientes. Todos los datos incluidos en el metaanálisis se obtuvieron utilizando un análisis LOCF por intención de tratar (ITT), con la excepción del estudio de Hirsch et al28. El estudio de Purdon et al25 se incluyó en el metaanálisis pese a su pequeño tamaño muestral (N=25). El estudio de Petit et al30 se incluyó en el metaanálisis. Aunque no se indicaba ninguna información sobre abuso o dependencia de fármacos en los pacientes; se incluía una declaración de la exclusión del ensayo de los pacientes con abuso o dependencia del alcohol. El estudio de Brook et al29 se incluyó en el metaanálisis aunque no tenía doble enmascaramiento, debido a que todas las evaluaciones fueron llevadas a cabo por evaluadores que no sabían que fármaco se había asignado a cada paciente. Véanse también las notas de Beasley et al21 y Hamilton et al22 que se han mencionado en el apartado anterior sobre los estudios incluidos que comparaban placebo con el tratamiento activo.
Características de algunos de los estudios incluidos en el metaanálisis de ensayos controlados con haloperidol
| Estudio (año) | Criterios de inclusión seleccionados | Duración del ensayo (semanas) | Período de lavado | Tratamiento y dosis | Pacientes2 (n) | Edad de los pacientes (años)1 media (DE) | Proporción de pacientes varones3 | Escalas de resultados | Financiación por la industria |
| Purdon (2001)25 | Esquizofrenia | 24 | 2 días | Quetiapina 468,2±114.(300-600 mg/día)Haloperidol 15,5±3,3(10-20 mg/día) | 1312 | 32,7 (7,1)35,3 (7,5)Todos los pacientes:33,9 (7,3) | 76,983,3Todos los pacientes: 80 | PANSS-N | Patrocinado por la industria |
| Möller (1997)20 | Esquizofrenia crónica o subcrónica≥ 12 en los 4 BPRS principales (1-7).Síntomas productivos: desorganización conceptual, suspicacia, conducta alucinatoria e inusuales contenidos del pensamiento y ≥ 4 en al menos 2 de estos ítems | 6 | 7 díasreducido a un mínimo de 1 día si se requirió tratamiento inmediato | Amisulprida 800 mg/díaHaloperidol 20 mg/día (en caso de acontecimientos adversos solo amisulprida 600 mg/día o haloperidol 15 mg/día) | 9494 | 36 (11)35 (11)Todos los pacientes: 36 | 6460 | PANSS-N | No mencionado |
| Petit (1996)30 | Primer episodio agudo de esquizofrenia o reagudización de esquizofrenia subcrónica o crónica.≥ 4 (moderadamente enfermo) en la gravedad de la enfermedad de CGI | 8 | NC | Zotepina 300 mg/díaHaloperidol 20 mg/día(reducido a 150mg para zotepina o 10mg haloperidol al día, sies necesario) | 6162 | 38,6 (18,6-62,8)36 (18,6-62,7)Todos los pacientes: intervalo 18-62 | 47,668,3 | SANS(0-5, escala de 30 ítems) | No mencionado |
| Hirsch (2002)28 | Esquizofrenia crónica o subcrónica estable (DSM-III-R) | 28 | 1 día | ZiprasidonaHaloperidol | 148153 | 39,2 (18-64)*39,4 (18-64)7 | 6269 | PANSS-N | Patrocinado por la industria |
| Brook (2005)29 | Reagudización de la esquizofrenia o trastorno esquizoafectivo según los criterios de DSM-IV y ≥ 40 en BPRS | 6 | NC | ZiprasidonaHaloperidol | 427138 | 34,0 (10,5)43,6 (10,5) | 66,765,9 | Sub-escala negativa de BPRS | Patrocinado por la industria |
BPRS: Brief Psychiatric Rating Scale; CGI: Clinical Global Impression; NC: no se comunica; PANSS: Positive and Negative Syndrome Scale; PANSS-N: escala negativa PANSS; SANS: Scale for the assessment of negative symptoms;
(0) datos de los pacientes con una medición inicial y al menos una valoración posterior QLS; (1) al inicio; (2) relativo a los pacientes incluidos en los análisis; (3) todos los datos se expresan como porcentajes.
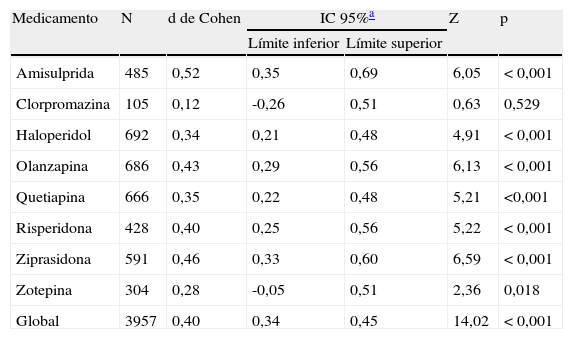
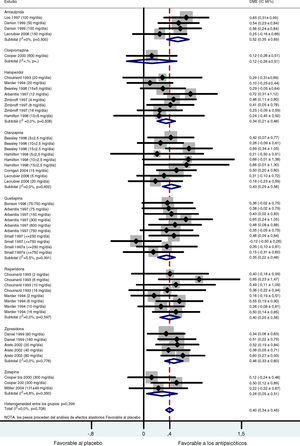
Al combinar los datos de todos los estudios controlados con placebo, se obtuvo un tamaño del efecto global moderado y significativo (d de Cohen=0,40; IC 95%: 0,34-0,45; p<0,001) favorable al tratamiento activo con respecto al placebo (fig. 1). Las pruebas Q e I2 no detectaron una heterogeneidad importante entre los estudios (Q=41.27.07; df=47; p=0,708; I2=0%). Además se llevó a cabo un análisis estratificado por fármaco. Para el grupo de la amisulprida se obtuvo una DME combinada moderada significativa, favorable al tratamiento activo con respecto al placebo para los síntomas negativos: d de Cohen=0,52; IC 95%: 0,35-0,69; p<0,001 (tabla 2) que indica que la media del grupo de amisulprida estaba aproximadamente en el percentil 70 del grupo placebo. Se obtuvieron resultados similares con la ziprasidona: d de Cohen=0,46; IC 95%: 0,33-0,60; p<0,001, (tabla 3), así como con el grupo de la olanzapina: d de Cohen=0,43; IC 95%: 0,29-0,56; p<0,001, y los grupos de la risperidona: d de Cohen=0,40; IC 95%: 0,25-0,56; p<0,001. Los tamaños del efecto del haloperidol y la quetiapina fueron estadísticamente significativos y de leves a moderados: d de Cohen=0,34; IC 95%: 0,21-0,48: p<0,001, y d de Cohen=0,35; IC 95%: 0,22-0,48; p<0,001, respectivamente. Los resultados del análisis de la zotepina mostraron sólo una tendencia estadísticamente significativa, favorable al tratamiento activo con respecto al placebo (zotepina: d de Cohen=0,28; IC 95%: -0,05-0,51; p=0,018) tabla 2. Sólo se dispuso de los datos de un ensayo para el análisis de clorpromazina (clorpromazina: d de Cohen=0,12; IC 95%: -0,26-0,51; p=0,529). La prueba I2 para heterogeneidad muestra el porcentaje de variación total entre los estudios que se debe a la heterogeneidad más que a la casualidad. Los resultados de la prueba I2 no revelaron la presencia de una incoherencia importante entre las observaciones. Los valores más significativos en cuanto a heterogeneidad se obtuvieron en los grupos de quetiapina y zotepina (I2=5,5% e I2=4,8%, respectivamente), lo que indica simplemente un pequeño grado de heterogeneidad.
Metaanálisis comparativo entre los antipsicóticos y el placebo en el tratamiento de los síntomas negativos
| Medicamento | N | d de Cohen | IC 95%a | Z | p | |
| Límite inferior | Límite superior | |||||
| Amisulprida | 485 | 0,52 | 0,35 | 0,69 | 6,05 | < 0,001 |
| Clorpromazina | 105 | 0,12 | -0,26 | 0,51 | 0,63 | 0,529 |
| Haloperidol | 692 | 0,34 | 0,21 | 0,48 | 4,91 | < 0,001 |
| Olanzapina | 686 | 0,43 | 0,29 | 0,56 | 6,13 | < 0,001 |
| Quetiapina | 666 | 0,35 | 0,22 | 0,48 | 5,21 | <0,001 |
| Risperidona | 428 | 0,40 | 0,25 | 0,56 | 5,22 | < 0,001 |
| Ziprasidona | 591 | 0,46 | 0,33 | 0,60 | 6,59 | < 0,001 |
| Zotepina | 304 | 0,28 | -0,05 | 0,51 | 2,36 | 0,018 |
| Global | 3957 | 0,40 | 0,34 | 0,45 | 14,02 | < 0,001 |
Z y p son el estadístico y el valor de p para la prueba de significación del tamaño del efecto d de Cohen.
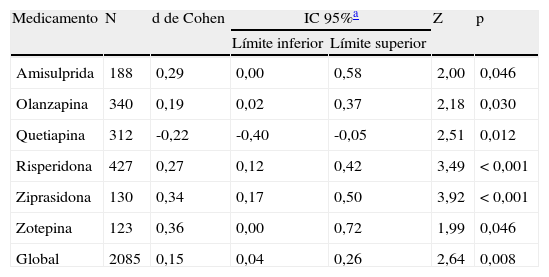
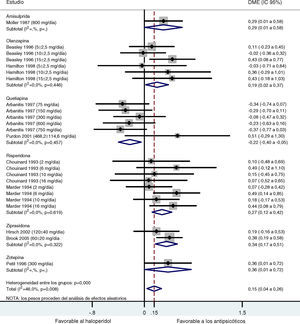
Los resultados obtenidos tras combinar las DME de todos los estudios que comparaban los ASG y el haloperidol mostraron una tendencia estadísticamente significativa favorable a los ASG con respecto al haloperidol en el tratamiento de los síntomas negativos (d de Cohen=0,15; IC 95%: 0,04-0,26; p=0,008; tabla 4 y fig. 2). Se detectó un grado importante de heterogeneidad en este análisis global tanto que la prueba Q y la I2 (Q=42,56; df=23; p=0,008; I2=46,0%), posiblemente debido a diferencias significativas reales en los efectos del tratamiento entre los distintos ASG y el haloperidol. En el subanálisis estratificado, donde las comparaciones se agruparon por fármaco, se obtuvieron las siguientes conclusiones: En los grupos de ziprasidona, risperidona y olanzapina, se observó una DME significativa leve y de leve a moderada, favorable a los ASG (d de Cohen=0,34 [IC 95%: 0,17-0,50; p<0,001]; 0,27 [0,12-0,42; p<0,001] y 0,19 [0,02-0,37; p=0,030], respectivamente). Por el contrario, en el análisis de la quetiapina se obtuvo una DME baja, pero esta vez favorable al haloperidol con respecto a los ASG (d=-0,22 [-0,40-(-0,05)]; p=0,012). Sólo se disponía de los datos de un ensayo para el análisis de la amisulprida (d=0,29 [0,00-0,58]; p=0,046) y la zotepina (d=0,36 [0,00-0,72]; p=0,046) (tabla 4). Se repitieron todos estos análisis, excepto el de Purdon et al25, cuyos datos no se distribuyeron normalmente debido al pequeño tamaño muestral, obteniéndose resultados casi idénticos. Sólo se han indicado los datos combinados de Purdon et al25.
Metaanálisis comparativo entre los antipsicóticos de segunda generación y el haloperidol en el tratamiento de los síntomas negativos
| Medicamento | N | d de Cohen | IC 95%a | Z | p | |
| Límite inferior | Límite superior | |||||
| Amisulprida | 188 | 0,29 | 0,00 | 0,58 | 2,00 | 0,046 |
| Olanzapina | 340 | 0,19 | 0,02 | 0,37 | 2,18 | 0,030 |
| Quetiapina | 312 | -0,22 | -0,40 | -0,05 | 2,51 | 0,012 |
| Risperidona | 427 | 0,27 | 0,12 | 0,42 | 3,49 | < 0,001 |
| Ziprasidona | 130 | 0,34 | 0,17 | 0,50 | 3,92 | < 0,001 |
| Zotepina | 123 | 0,36 | 0,00 | 0,72 | 1,99 | 0,046 |
| Global | 2085 | 0,15 | 0,04 | 0,26 | 2,64 | 0,008 |
Z y p son el estadístico y el valor de p para la prueba de significación del tamaño del efecto d de Cohen.
El metaanálisis es un instrumento con buena potencia estadística, pero tiene también algunas limitaciones características de esto tipo de técnicas. En primer lugar, su calidad depende directamente de la calidad de los estudios que se incluyan y, en segundo lugar, presupone que los datos de los estudios siguen una distribución normal, que puede no ser cierta en los estudios de pequeño tamaño muestral15 como en el caso del estudio de Purdon et al25, que se le asignó poco peso25 y no influyó de manera significativa en los resultados. La potencia estadística del metaanálisis es menor cuando sólo se dispone de unos pocos estudios. Por ejemplo, el grupo de la clorpromazina del metaanálisis controlado con placebo y los grupos de amisulprida y zotapina del metaanálisis controlado con haloperidol sólo contaba con datos de un estudio cada uno. La publicación de nuevos ensayos clínicos aleatorizados sobre la eficacia de los antipsicóticos en los síntomas negativos de la esquizofrenia podría modificar de manera significativa los resultados que se obtengan aquí.
La heterogeneidad, que nos permite obtener resultados concluyentes, es otra posible limitación en los metaanálisis14. La heterogeneidad puede deberse a una diversidad de razones, como a las diferencias en las características de los pacientes entre los estudios, las diferencias en el diseño del estudio y las diferencias en los instrumentos usados para evaluar la variable medida31. En este metaanálisis existe una variación en las características de la población (tablas 1 y 2), la duración de los ensayos con intervalos de 6 semanas a un año y hay pocos estudios que comunicaran suficientes datos sobre los síntomas negativos, lo que conlleva una mezcla de los resultados de los distintos instrumentos de evaluación: PANSS-N, SANS y BPRS-R. BPRS-R se utilizó en dos estudios, aunque tiene relativamente muy poca sensibilidad cuando se utiliza como instrumento único para medir los cambios en los síntomas negativos32. En este estudio, en las pruebas de heterogeneidad realizadas en el metaanálisis controlado con placebo no se observó una heterogeneidad importante, al contrario de los resultados que se obtuvieron en el metaanálisis de los estudios controlados con haloperidol, donde se detectó un grado importante de heterogeneidad, como se muestra en la tabla 4. Esto podría deberse a las diferencias reales en los efectos del tratamiento de los distintos ASG respecto al haloperidol.
El sesgo de publicación puede haber afectado a los resultados, ya que sólo se incluye en nuestro estudio la bibliografía publicada en inglés. Con frecuencia los resultados negativos de pequeños estudios tienden a no publicarse y es más probable que los investigadores cuya lengua materna no sea el inglés publiquen sus resultados no significativos en revistas no escritas en inglés33. Se llevaron a cabo dos análisis de sesgo (Begg y Egger), pero no se obtuvieron resultados significativos. Sin embargo, se sabe que estas pruebas tienen poca potencia estadística y, por tanto, no se pudo calcular la magnitud del sesgo de publicación.
Los datos relativos a ocho antipsicóticos distintos se sintetizaron en el primer metaanálisis sobre la eficacia del tratamiento de los síntomas negativos de la esquizofrenia en el que se utilizó placebo en el grupo control (antipsicóticos típicos: haloperidol y clorpromazina; antipsicóticos atípicos: amisulprida, olanzapina, quetiapina, risperidona, ziprasidona y zotepina). Sin embargo, el análisis de subgrupos de clorpromazina (como se muestra en la tabla 3) sólo constaba de un estudio por cada grupo, por lo que no sería apropiado extraer conclusiones de los resultados de este fármaco. Son necesarios más ensayos que evalúen los efectos de la clorpromazina sobre los síntomas negativos y su inclusión en posteriores metaanálisis. No hemos encontrado, utilizando nuestra estrategia de búsqueda, ningún ensayo que investigara la eficacia de la clozapina y que cumpliera con nuestros criterios de inclusión. Los datos relativos a 6 ASG distintos (amisulprida, olanzapina, quetiapina, risperidona, ziprasidona y zotepina) se sintetizaron en nuestro metaanálisis sobre la eficacia del tratamiento de los síntomas negativos de la esquizofrenia en el que se utilizó haloperidol en el grupo control.
Los resultados globales que se obtuvieron en el metaanálisis que comparaba los antipsicóticos y el placebo, indicaban que algunos antipsicóticos (amisulprida, haloperidol, olanzapina, quetiapina, risperidona, ziprasidona y zotepina) eran eficaces para tratar los síntomas negativos. Los tamaños del efecto de estos antipsicóticos oscilaron entre d=0,28 y d=0,52, por lo que, aunque la eficacia es estadísticamente significativa, sólo se obtuvieron tamaños de efecto moderados o bajos. Estos datos no respaldaba la idea de que los antipsicóticos de primera generación (APG) sean ineficaces para el tratamiento de los síntomas negativos. Se observó que el haloperidol tenía una eficacia equivalente a la quetiapina y que era mejor que la zotepina para el tratamiento de los síntomas negativos. Sin embargo, los ASG amisulprida, ziprasidona, olanzapina y risperidona fueron más eficaces para el tratamiento de los síntomas negativos que el haloperidol. Los resultados globales que se obtuvieron en el segundo metaanálisis indicaban que los ASG eran mejores que el haloperidol para el tratamiento de los síntomas negativos. Sin embargo, la DME global era pequeña y se detectó alguna heterogeneidad importante que indica que la eficacia superior depende del ASG usado en el grupo de estudio. Los datos obtenidos en el metaanálisis de ensayos clínicos controlados con haloperidol confirman las observaciones del metaanálisis de los estudios controlados con placebo: la superioridad de algunos ASG como la amisulprida, la olanzapina, la risperidona, la ziprasidona y la zotepina respecto al haloperidol en el tratamiento de los síntomas negativos. Además, los resultados del metaanálisis de los estudios controlados con haloperidol indicaban que éste es más eficaz que el ASG quetiapina, mientras que en el metaanálisis de los estudios controlados con placebo, estos fármacos parecían tener una eficacia equivalente. Sin embargo, todos los resultados obtenidos en el metaanálisis de ensayos clínicos controlados con haloperidol deben interpretarse con precaución, ya que el número de estudios incluidos en este metaanálisis fue relativamente bajo. Otra limitación de este estudio podría ser que, como no se ha realizado ningún análisis de la influencia de la dosis de haloperidol, no está claro si este aspecto podría haber afectado los resultados, ya que las dosis elevadas de haloperidol han mostrado efectos secundarios, lo que podría desvirtuar las medidas de eficacia en los síntomas negativos.
Los resultados de ambos metaanálisis respaldaban los obtenidos por Davis et al34 que mostraron que tanto la olanzapina como la risperidona eran moderadamente superiores a los APG para el tratamiento de los síntomas negativos.
En definitiva pueden extraerse tres conclusiones de ambos metaanálisis: 1) la mayoría de los antipsicóticos (amisulprida, haloperidol, olanzapina, quetiapina, risperidona, ziprasidona y zotepina) son significativamente eficaces para el tratamiento de los síntomas negativos, pero su eficacia parece depender del producto; 2) la amisulprida y la ziprasidona mostraron resultados ligeramente mejores que el resto y, 3) se observó una tendencia estadísticamente significativa favorable a los ASG con respecto al haloperidol en el tratamiento de los síntomas negativos.
FinanciaciónEste estudio ha sido financiado por Pfizer España.
Conflicto de interesesJavier Rejas es empleado de Pfizer España. El resto de autores declara no tener conflicto de intereses.
Los autores desean agradecer a todos los médicos participantes en el estudio, así como a Lisette Kaskens de BCN Health Economics and Outcomes Research su contribución en lo que respecta a los objetivos del estudio.