Investigar la relación entre tres polimorfismos serotoninérgicos (A-1438G [rs6311] del gen HTR2A, STin2 VNTR y 5-HTTLPR del gen SLC6A4) y la gravedad de la sintomatología de pánico y depresión en pacientes ambulatorios con un diagnóstico de trastorno de pánico (TP).
MétodosSe evaluó a un total de 92 pacientes ambulatorios con TP (criterios diagnósticos del DSM-IV) no emparentados, de una población española caucásica homogénea (media de edad±desviación estándar de 35,9±12,4 años; 28 [30,4%] varones) con el empleo de las escalas Panic and Agoraphobia Scale (PAS) y Hamilton Depression Rating Scale (HDRS), y se determinó su genotipo con métodos estándar.
ResultadosLa edad de inicio del TP variaba según el genotipo STin2 VNTR (F=3,21; p=0,045). En promedio, el inicio del TP se produjo antes en los pacientes con el genotipo 10/10 que en los que presentaban el genotipo 12/12 (25,1 frente a 33,3; p=0,043). No se observó relación alguna entre los genotipos A-1438G, 5-HTTLPR y STin2 VNTR y las puntuaciones totales de las escalas PAS o HDRS. La variación en las puntuaciones de la subescala de Ansiedad de la HDRS en función del genotipo A-1438G alcanzaba casi la significación estadística (F=3,03; p=0,053). Las comparaciones post hoc de datos emparejados pusieron de manifiesto un grado de ansiedad mayor en los portadores del genotipo A/G que en los portadores del A/A (4,1 frente a 2,9; p=0,043). Por último, la variación de las puntuaciones de la subescala de Preocupación por la Salud de la PAS, en función del genotipo 5-HTTLPR, se aproximaba a la significación estadística (F=2,56; p=0,083). Las comparaciones post hoc para datos emparejados mostraron unas puntuaciones más altas en los portadores del genotipo L/S que en los portadores del L/L (2,4 frente a 1,4; p=0,078).
ConclusionesNuestros datos respaldan la participación del sistema serotoninérgico, y en especial del gen HTR2A, en la gravedad del TP.
To investigate the association between three serotonergic polymorphisms (A-1438G [rs6311] of the HTR2A gene, STin2 VNTR and 5-HTTLPR of the SLC6A4 gene) and the severity of panic and depression symptomatology among mental health outpatients with diagnosis of panic disorder (PD).
Methods92 unrelated PD outpatients (DSM-IV criteria) from a homogeneous Spanish Caucasian population (mean age±SD, 35.9±12.4 years; 28 [30.4%] males) were assessed using the Panic and Agoraphobia Scale (PAS), and the Hamilton Depression Rating Scale (HDRS), and genotyped using standard methods.
ResultsAge of onset of PD varied by STin2 VNTR genotype (F=3.21; p=0.045). On average, onset of PD occurred earlier for those with the 10/10 than for those with the 12/12 genotype (25.1 νs 33.3; p=0.043). No relationship was found between A-1438G, 5-HTTLPR, and STin2 VNTR genotypes and PAS or HDRS total scores. Variation in scores on the HDRS Anxiety subscale by A-1438G genotype almost reached statistical significance (F=3.03; p=0.053). Post hoc pairwise comparisons showed higher anxiety levels among A/G than among A/A carriers (4.1 νs 2.9; p=0.043). Finally, variation in scores on the Preoccupied with Health subscale of the PAS by 5-HTTLPR genotype approached statistical significance (F=2.56; p=0.083). Post hoc pairwise comparisons showed higher scores among L/S than among L/L carriers (2.4 νs 1.4; p=0.078).
ConclusionsOur data provide support of an involvement of the serotonin system, particularly, the HTR2A gene in the severity of PD.
Se acepta que el trastorno de pánico (TP) se ve influido por factores genéticos, con una heredabilidad moderada. Hasta la fecha, en los estudios de agregación familiar se ha estimado que el riesgo de un trastorno mental en los familiares de pacientes con TP es 3,4-14,7 veces superior al riesgo existente en los familiares de controles sanos1. Además, el riesgo de TP en los familiares de pacientes con TP es de un 14%2–4, y la heredabilidad estimada es de alrededor el 50%5. Los estudios de ligamiento llevados a cabo en el TP han asociado este trastorno a diversas localizaciones del cromosoma 166, el cromosoma 207 y el cromosoma 158. No obstante, otros autores no han verificado estos datos9,10.
Los genes relacionados con la serotonina son candidatos adecuados para la investigación en el TP. Así, las variaciones genéticas de la transmisión serotoninérgica son un punto clave en la actuación de los inhibidores selectivos de la recaptación de serotonina (ISRS). Concretamente, el transportador de serotonina (5-HTT) desempeña un papel en el mecanismo de acción de los ISRS, al igual que la activación postsináptica del receptor de serotonina 2A (HTR2A), en la mejoría sintomática o la remisión de los pacientes.
El gen HTR2A está situado en el cromosoma 13q14-q21. Se ha descrito que dos polimorfismos de este gen, el T102C (rs6313) y el A-1438G (rs6311), están en desequilibrio de ligamiento completo en diferentes poblaciones11. Sin embargo, los estudios de asociación relativos al papel de estos polimorfismos en el TP han producido resultados contradictorios, con dos observaciones positivas12,13 y dos negativas14,15. Más recientemente, se ha indicado una asociación entre las variantes polimórficas del gen HTR2A (T102C, A-1438G y rs2296972) y la gravedad de la sintomatología del TP16,17.
El gen 5-HTT (también denominado SLC6A4 o SERT) se encuentra en el cromosoma 17q11.1-q12. Un polimorfismo funcional de este gen (5-HTTLPR), que afecta a dos alelos comunes L (inserción de 44 pares de bases) y S (deleción), está relacionado con una expresión diferente de lugares de unión de 5-HTT en las líneas celulares18. Se ha demostrado que el alelo S es menos activo, y causa una menor recaptación de serotonina y un aumento de serotonina en la hendidura sináptica. La mayor parte de los estudios previos de asociación de casos y controles13,15,17,19–27, e incluso la evidencia aportada por los metaanálisis28, no han observado una asociación entre el 5-HTTLPR y el TP. Por otro lado, más recientemente, Wachleski et al29, estudiando rasgos de personalidad, no han podido caracterizar fenotipos heredables relacionados con el 5-HTTLPR que están relacionados con el TP en relación con rasgos de personalidad. Sin embargo, se ha apuntado a la posibilidad de que el alelo L pudiera estar relacionado con el trastorno13, así como con una mejor respuesta de las mujeres a paroxetina30.
Otro polimorfismo del SCL6A4, un número variable de repeticiones en tándem de 17 pares de bases (pb) (denominado STin2 VNTR), implica a diferentes alelos que corresponden a unidades de 12, 10, 9 o 7 repeticiones de 17 pb. Se ha descrito que el alelo STin2.12 es un potenciador transcripcional31. Los estudios realizados para buscar una asociación entre este polimorfismo y el TP han producido resultados negativos13,15.
La mayor parte de los estudios previos sobre la relación entre el TP y los polimorfismos génicos serotoninérgicos se han limitado a las diferencias en las frecuencias genotípicas o alélicas entre los casos y los controles, y sólo hay dos estudios previos que se centren en la relación entre los polimorfismos serotoninérgicos y la gravedad de los síntomas en el TP16,17. El objetivo del presente estudio fue investigar la relación entre tres polimorfismos serotoninérgicos (A-1438G [rs6311] del gen HTR2A, y STin2 VNTR y 5-HTTLPR del gen SLC6A4) y la gravedad de la sintomatología de pánico y de depresión en pacientes ambulatorios con un diagnóstico de TP.
MétodosPoblación de pacientesLa muestra estaba formada por 92 pacientes ambulatorios no emparentados, de origen caucásico español, que tenían entre 17 y 82 años de edad (media ± desviación estándar [DE], 35,9 ± 12,4 años); 28 (30,4%) varones, 64 (69,6%) mujeres, de la región de Asturias, en el norte de España (población, un millón). Todos los pacientes tenían un diagnóstico de TP según los criterios del DSM-IV. Se tomó como edad de inicio aquella en que los síntomas habían sido de un grado suficiente como para cumplir los criterios del DSM-IV para el TP.
Todos los participantes incluidos en el estudio firmaron un formulario de consentimiento informado. El estudio estuvo sujeto y cumplió lo establecido en la legislación nacional española, se llevó a cabo según lo estipulado en la Declaración de Helsinki de la World Medical Association, y recibió la aprobación de la institución32.
EvaluaciónCon objeto de valorar la gravedad de la sintomatología de los pacientes, se administró a los 92 participantes la Panic and Agoraphobia Scale (PAS)33 y la versión de 17 ítems de la Hamilton Depression Rating Scale (HDRS)34. La PAS es una escala de 13 ítems que evalúa la gravedad de los síntomas de pánico según el período de referencia de la semana anterior. Proporciona una puntuación general (límites, 0-52), así como puntuaciones para las 5 subescalas siguientes: crisis de pánico (límites, 0-12), agorafobia (límites, 0-12), ansiedad (límites, 0-8), discapacidad (límites, 0-12) y preocupación por la salud (límites, 0-8).
La escala HDRS evalúa la gravedad de los síntomas depresivos actuales (de los 2 días previos para algunos ítems). Proporciona una puntuación general (límites, 0-34), así como puntuaciones para 3 subescalas: melancolía (límites, 0-12), ansiedad (límites, 0-8) y sueño (límites, 0-6).
Determinación del genotipoBrevemente, se extrajo ADN genómico de leucocitos de sangre periférica obtenidos de cada participante, según protocolos estándar35. Se identificaron los polimorfismos de los genes HTR2A y SLC6A4 con el empleo de métodos publicados con anterioridad15. Los genotipos fueron determinados por investigadores que no disponían de información sobre los pacientes participantes.
Análisis de los datosLos cálculos de la potencia estadística indicaron que un tamaño muestral de 90 proporcionaba una potencia del 80% para identificar como estadísticamente significativas, con un valor de significación del 5%, las correlaciones de intensidad media (coeficientes de correlación > 0,3) y las diferencias de una magnitud media entre los grupos (d de Cohen = 0,6).
Las frecuencias genotípicas observadas se compararon con las esperadas según el equilibrio de Hardy-Weinberg mediante la prueba de la χ2. El desequilibrio de ligamiento entre los marcadores se evaluó con el empleo de medidas obtenidas con el programa informático EMLD (http://epi.mdanderson.org/∼qhuang/Software/pub.htm). Se utilizó la prueba de la χ2 para examinar las relaciones entre las frecuencias genotípicas y el sexo. La evidencia indicativa de relaciones lineales entre la edad actual, la edad de inicio del TP, el tiempo de evolución de la enfermedad y las puntuaciones de las escalas PAS y HDRS se valoraron gráficamente y con el coeficiente de correlación de intervalo de Spearman, rho. Se utilizó la prueba de la t de Student para evaluar las diferencias entre los sexos en relación con la edad actual, la edad de inicio, el tiempo de evolución del TP y las puntuaciones de las escalas PAS y HDRS.
Se utilizó un análisis de la variancia (ANOVA) de una vía para valorar las diferencias en estas variables según los genotipos A-1438G, 5-HTTLPR y STin2 VNTR. En los casos en que el estadístico de Levene indicaba que se violaba el supuesto de igualdad de variancias, el resultado de la prueba de ANOVA se basó en el estadístico de Brown-Forsythe. La "prueba de diferencia honestamente significativa" de Tukey fue la utilizada post hoc si se cumplía el supuesto de igualdad de variancias. En los demás casos, se utilizó la T3 de Dunnett. Los análisis estadísticos se llevaron a cabo con el programa SPSS versión 15.0 (SPSS Inc., Chicago, Illinois, Estados Unidos) y el programa estadístico StatsDirect versión 2.5.7 (http://www.statsdirect.com).
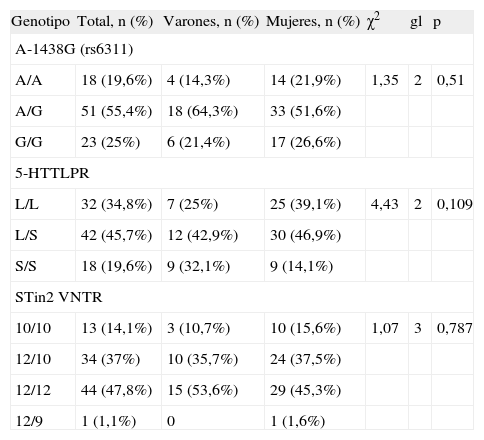
ResultadosEn la tabla 1 se detallan las frecuencias genotípicas de los polimorfismos A-1438G, 5-HTTLPR y STin2 VNTR. Todos ellos estaban en equilibrio de Hardy-Weinberg (A-1438G: χ2 = 1,15, p = 0,283; 5-HTTLPR: χ2 = 0,39, p = 0,531; STin2 VNTR: χ2 = 2,18, p = 0,140). Se observó un cierto grado de DL entre 5-HTTLPR y STin2 VNTR (V de Cramer = 0,3, p = 0,002, D′ = 0,502, r2 = 0,092).
Frecuencias genotípicas de los polimorfismos A-1438G, 5-HTTLPR y STin2 VNTR
| Genotipo | Total, n (%) | Varones, n (%) | Mujeres, n (%) | χ2 | gl | p |
| A-1438G (rs6311) | ||||||
| A/A | 18 (19,6%) | 4 (14,3%) | 14 (21,9%) | 1,35 | 2 | 0,51 |
| A/G | 51 (55,4%) | 18 (64,3%) | 33 (51,6%) | |||
| G/G | 23 (25%) | 6 (21,4%) | 17 (26,6%) | |||
| 5-HTTLPR | ||||||
| L/L | 32 (34,8%) | 7 (25%) | 25 (39,1%) | 4,43 | 2 | 0,109 |
| L/S | 42 (45,7%) | 12 (42,9%) | 30 (46,9%) | |||
| S/S | 18 (19,6%) | 9 (32,1%) | 9 (14,1%) | |||
| STin2 VNTR | ||||||
| 10/10 | 13 (14,1%) | 3 (10,7%) | 10 (15,6%) | 1,07 | 3 | 0,787 |
| 12/10 | 34 (37%) | 10 (35,7%) | 24 (37,5%) | |||
| 12/12 | 44 (47,8%) | 15 (53,6%) | 29 (45,3%) | |||
| 12/9 | 1 (1,1%) | 0 | 1 (1,6%) | |||
No se evidenciaron diferencias entre los dos sexos en cuanto a la distribución de genotipos de los tres polimorfismos (tabla 1).
Edad de inicio del trastorno de pánicoLa edad de inicio oscilaba entre los 14 y los 66 años (media ± DE, 31 ± 10,5 años; desconocida en 2 pacientes). Se observó una relación lineal positiva muy intensa entre la edad de inicio y la edad actual de los pacientes (p de Spearman = 0,83, p < 0,001). Cuando mayor era la edad del paciente, más tardío era el inicio del trastorno de pánico. Además, la evidencia obtenida indicaba que cuanto mayor era la edad, mayor era el tiempo de evolución del trastorno de pánico (p de Spearman = 0,38, p < 0,001). No se observaron diferencias entre los sexos en relación con la edad actual de los pacientes (varones, media ±DE, 33,6 ± 11,4 años; mujeres, 36,8 ± 12,7 años), la edad de inicio (varones, media ± DE, 28,2 ± 8,8 años; mujeres, 32,2 ± 11 años) o el tiempo de evolución del trastorno de pánico (varones, media ± DE, 4,8 ± 10 años; mujeres, 4,1 ± 6,9 años).
La edad actual, la edad de inicio y el tiempo de evolución del trastorno de pánico no presentaban diferencias significativas según el genotipo de A-1438G, 5-HTTLPR y STin2 VNTR, con una sola excepción. La evidencia indicaba que la edad de inicio del trastorno de pánico variaba según el genotipo STin2 VNTR (F = 3,21, gl = 2, 86, p = 0,045). Las medias de edades de inicio eran 25,1, 30,1 y 33,3 para los pacientes con los genotipos 10/10, 12/10 y 12/12, respectivamente. El análisis post hoc indicó que los grupos de genotipo 10/10 y 12/12 diferían de manera significativa (p = 0,043). En promedio, el inicio del trastorno de pánico se produjo 8,2 años antes en los pacientes con el genotipo 10/10 en comparación con los pacientes con el genotipo 12/12 (intervalo de confianza [IC] del 95%, 0,2-16,2 años).
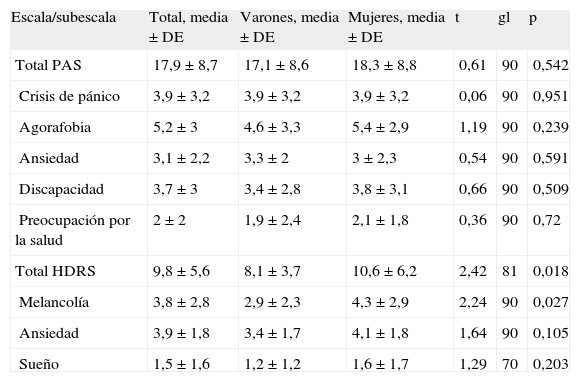
Síntomas de pánico y síntomas depresivosEn la tabla 2 se resumen las puntuaciones de las escalas y subescalas de la PAS y la HDRS para el conjunto de la muestra y para varones y mujeres por separado. Se observaron dos diferencias significativas entre los sexos. En promedio, las mujeres registraron unas puntuaciones totales más altas en la HDRS (mujeres, media ± DE, 10,6 ± 6,2; varones, 8,1 ± 3,7; t = 2,42, gl = 81, p = 0,018; diferencia media, 2,5; IC del 95%, 0,5-4,6) y en la subescala de Melancolía de la HDRS (mujeres, media ± DE, 4,3 ± 2,9; varones, 2,9 ± 2,3; t = 2,24, gl = 90, p = 0,027; diferencia media, 1,4; IC del 95%, 0,2-2,7).
Estadísticas de resumen de las escalas Panic and Agoraphobia Scale (PAS) y Hamilton Depression Rating Scale (HDRS)
| Escala/subescala | Total, media ± DE | Varones, media ± DE | Mujeres, media ± DE | t | gl | p |
| Total PAS | 17,9 ± 8,7 | 17,1 ± 8,6 | 18,3 ± 8,8 | 0,61 | 90 | 0,542 |
| Crisis de pánico | 3,9 ± 3,2 | 3,9 ± 3,2 | 3,9 ± 3,2 | 0,06 | 90 | 0,951 |
| Agorafobia | 5,2 ± 3 | 4,6 ± 3,3 | 5,4 ± 2,9 | 1,19 | 90 | 0,239 |
| Ansiedad | 3,1 ± 2,2 | 3,3 ± 2 | 3 ± 2,3 | 0,54 | 90 | 0,591 |
| Discapacidad | 3,7 ± 3 | 3,4 ± 2,8 | 3,8 ± 3,1 | 0,66 | 90 | 0,509 |
| Preocupación por la salud | 2 ± 2 | 1,9 ± 2,4 | 2,1 ± 1,8 | 0,36 | 90 | 0,72 |
| Total HDRS | 9,8 ± 5,6 | 8,1 ± 3,7 | 10,6 ± 6,2 | 2,42 | 81 | 0,018 |
| Melancolía | 3,8 ± 2,8 | 2,9 ± 2,3 | 4,3 ± 2,9 | 2,24 | 90 | 0,027 |
| Ansiedad | 3,9 ± 1,8 | 3,4 ± 1,7 | 4,1 ± 1,8 | 1,64 | 90 | 0,105 |
| Sueño | 1,5 ± 1,6 | 1,2 ± 1,2 | 1,6 ± 1,7 | 1,29 | 70 | 0,203 |
DE: desviación estándar.
Se observó alguna evidencia indicativa de una asociación lineal entre las puntuaciones de la subescala de Crisis de Pánico y tanto la edad actual (p de Spearman = −0,32, p = 0,002) como la edad de inicio (p de Spearman = −0,24, p = 0,024), así como entre las puntuaciones totales de la PAS y la edad actual (p de Spearman = −0,25, p = 0,018). La menor gravedad de las crisis de pánico se asociaba a la edad más avanzada o a la aparición más tardía del trastorno. Hubo alguna evidencia limitada (p de Spearman = 0,22, p = 0,042) que indicaba que cuanto mayor tiempo había transcurrido desde el inicio del trastorno de pánico, más graves eran los síntomas depresivos relacionados con el sueño.
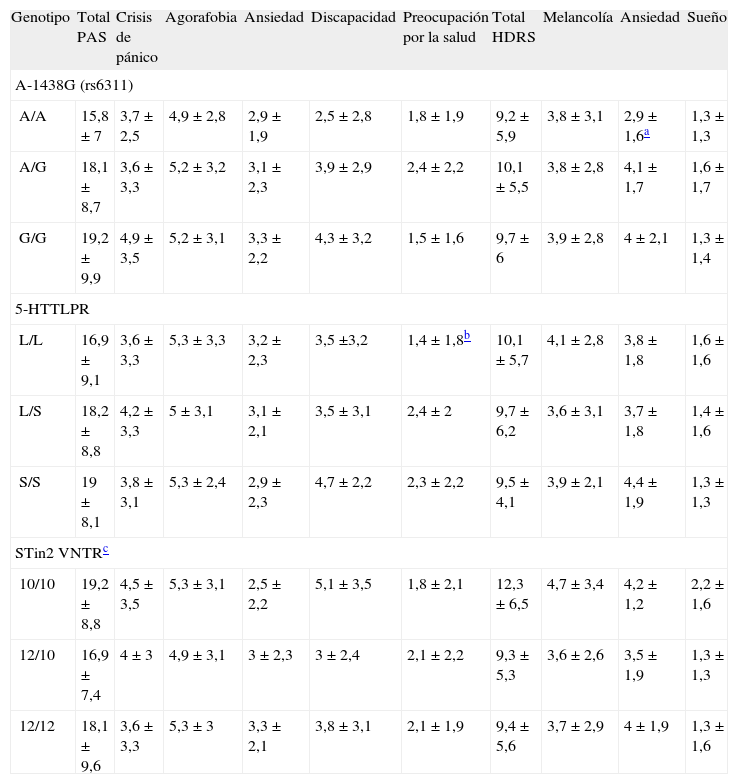
Al nivel de significación estadística de 0,05, las puntuaciones general y de subescalas de la PAS y la HDRS no presentaron variaciones significativas en función de los genotipos A-1438G, 5-HTTLPR y STin2 VNTR (tabla 3).
Estadísticas de resumen de las escalas Panic and Agoraphobia Scale (PAS) y Hamilton Depression Rating Scale (HDRS) según el genotipo de los polimorfismos A-1438G, 5-HTTLPR y STin2 VNTR
| Genotipo | Total PAS | Crisis de pánico | Agorafobia | Ansiedad | Discapacidad | Preocupación por la salud | Total HDRS | Melancolía | Ansiedad | Sueño |
| A-1438G (rs6311) | ||||||||||
| A/A | 15,8 ± 7 | 3,7 ± 2,5 | 4,9 ± 2,8 | 2,9 ± 1,9 | 2,5 ± 2,8 | 1,8 ± 1,9 | 9,2 ± 5,9 | 3,8 ± 3,1 | 2,9 ± 1,6a | 1,3 ± 1,3 |
| A/G | 18,1 ± 8,7 | 3,6 ± 3,3 | 5,2 ± 3,2 | 3,1 ± 2,3 | 3,9 ± 2,9 | 2,4 ± 2,2 | 10,1 ± 5,5 | 3,8 ± 2,8 | 4,1 ± 1,7 | 1,6 ± 1,7 |
| G/G | 19,2 ± 9,9 | 4,9 ± 3,5 | 5,2 ± 3,1 | 3,3 ± 2,2 | 4,3 ± 3,2 | 1,5 ± 1,6 | 9,7 ± 6 | 3,9 ± 2,8 | 4 ± 2,1 | 1,3 ± 1,4 |
| 5-HTTLPR | ||||||||||
| L/L | 16,9 ± 9,1 | 3,6 ± 3,3 | 5,3 ± 3,3 | 3,2 ± 2,3 | 3,5 ±3,2 | 1,4 ± 1,8b | 10,1 ± 5,7 | 4,1 ± 2,8 | 3,8 ± 1,8 | 1,6 ± 1,6 |
| L/S | 18,2 ± 8,8 | 4,2 ± 3,3 | 5 ± 3,1 | 3,1 ± 2,1 | 3,5 ± 3,1 | 2,4 ± 2 | 9,7 ± 6,2 | 3,6 ± 3,1 | 3,7 ± 1,8 | 1,4 ± 1,6 |
| S/S | 19 ± 8,1 | 3,8 ± 3,1 | 5,3 ± 2,4 | 2,9 ± 2,3 | 4,7 ± 2,2 | 2,3 ± 2,2 | 9,5 ± 4,1 | 3,9 ± 2,1 | 4,4 ± 1,9 | 1,3 ± 1,3 |
| STin2 VNTRc | ||||||||||
| 10/10 | 19,2 ± 8,8 | 4,5 ± 3,5 | 5,3 ± 3,1 | 2,5 ± 2,2 | 5,1 ± 3,5 | 1,8 ± 2,1 | 12,3 ± 6,5 | 4,7 ± 3,4 | 4,2 ± 1,2 | 2,2 ± 1,6 |
| 12/10 | 16,9 ± 7,4 | 4 ± 3 | 4,9 ± 3,1 | 3 ± 2,3 | 3 ± 2,4 | 2,1 ± 2,2 | 9,3 ± 5,3 | 3,6 ± 2,6 | 3,5 ± 1,9 | 1,3 ± 1,3 |
| 12/12 | 18,1 ± 9,6 | 3,6 ± 3,3 | 5,3 ± 3 | 3,3 ± 2,1 | 3,8 ± 3,1 | 2,1 ± 1,9 | 9,4 ± 5,6 | 3,7 ± 2,9 | 4 ± 1,9 | 1,3 ± 1,6 |
Los datos indican la media ± desviación estándar.
La variación de las puntuaciones de la subescala de Ansiedad de la HDRS, según el genotipo A-1438G, alcanzaba casi la significación estadística (F = 3,03; gl = 2, 89; p = 0,053) con una magnitud del efecto moderada (η2 = 0,064). Las comparaciones post hoc de datos emparejados mostraron una diferencia significativa entre los genotipos A/G y A/A (p = 0,043), de tal manera que el primero de ellos se asociaba a unas puntuaciones de ansiedad más elevadas (A/ G, media ± DE, 4,1 ± 1,7; A/A, 2,9 ± 1,6; diferencia media, 1,19; IC del 95%, 0,03-2,36).
La variación observada en las puntuaciones de la subescala de Preocupación por la salud de la PAS según el genotipo 5-HTTLPR se aproximaba a la significación estadística (F = 2,56; gl = 2,89; p = 0,083; η2 = 0,054). Las comparaciones post hoc de datos emparejados mostraron que esto correspondía a los genotipos L/S y L/L (p = 0,078). El genotipo L/S conllevaba unas puntuaciones algo mayores (L/S, media ± DE, 2,4 ± 2; L/L, 1,4 ± 1,8; diferencia media, 1; IC del 95%, −0,1-2,1).
Los análisis realizados para examinar los posibles efectos de interacción entre pares de polimorfismos respecto a la PAS y la HDRS no mostraron indicio alguno de interacción. Sin embargo, el número de casos de los subgrupos era limitado y ello hacía que la observación de resultados positivos fuera improbable. De igual modo, un modelo que incluía los efectos principales de los genotipos A-1438G, 5-HTTLPR y STin2 VNTR no mostró resultados significativos.
DiscusiónEn el presente estudio se observó una relación entre el polimorfismo STin2 VNTR del gen SLC6A4 y la edad de inicio del TP, de tal manera que los pacientes portadores del genotipo 10/10 presentaban un inicio del trastorno más temprano que el de los pacientes con el genotipo 12/12. Por otra parte, observamos una relación inversa entre la gravedad de los síntomas de pánico y tanto la edad actual como la edad de inicio del TP. No se observó relación alguna entre los genotipos A-1438G, 5-HTTLPR y STin2 VNTR y las puntuaciones totales de las escalas PAS o HDRS. Sin embargo, observamos alguna evidencia indicativa de una posible relación entre el polimorfismo A-1438G y las puntuaciones de ansiedad de la HDRS, de tal manera que los pacientes con el genotipo A/G presentaban unas puntuaciones de ansiedad mayores que las de los portadores de A/A. Por último, observamos una tendencia a una relación entre el polimorfismo 5-HTTLPR y las puntuaciones de la subescala de Preocupación por la Salud de la PAS. En otras palabras, el genotipo L/S conllevó unas puntuaciones de esta subescala más altas que las del genotipo L/L.
Los estudios de casos y controles llevados a cabo para identificar una posible relación entre el TP y los polimorfismos serotoninérgicos han producido resultados contradictorios, debido, al menos en parte, al pequeño tamaño muestral de los estudios28, las diferencias de etnia17 y la falta de definición clara del fenotipo, ya que los diagnósticos del DSM-IV pueden ser constructos heterogéneos que combinen elementos con influencias genéticas diferenciadas36. No obstante, datos recientes indican que las variantes genéticas de los genes serotoninérgicos, con un efecto individual menor, pueden contribuir a producir la susceptibilidad al TP. Sin embargo, esa variabilidad genética puede tener una influencia diferenciada en los fenotipos de TP puro o comórbido37.
A pesar de las implicaciones indicadas del sistema serotoninérgico en la etiología y el mecanismo terapéutico del TP, solamente dos estudios previos se han centrado en la relación entre polimorfismos serotoninérgicos y gravedad de los síntomas del TP16,17. Unschuld et al16 apuntaron a una asociación entre una variante polimórfica (rs2296972) del HTR2A y las puntuaciones de gravedad de la PAS. En este sentido, los pacientes con TP con síntomas más graves tendían a tener el alelo menos frecuente, lo cual indicaba un efecto de dosis del gen. Por otra parte, de manera similar a lo indicado por nuestros datos, estos autores no observaron relación alguna entre los polimorfismos A-1438G o T102C y las puntuaciones totales de la PAS. Además, este estudio16 señala intensas asociaciones en los polimorfismos intrónicos rs2770304, T102C y A-1438G y el rasgo de la personalidad de dependencia de recompensa. Más recientemente, Yoon et al17 han observado que las puntuaciones del API (Acute Panic Inventory) eran significativamente mayores en los pacientes con los genotipos 102C/C o -1438G/G del gen HTR2A. Las diferencias entre los resultados de Yoon et al17 y los presentados aquí pueden deberse al hecho de que el tipo de instrumento psicométrico utilizado para medir la gravedad desempeña un papel crucial en la detección de relaciones entre las variantes polimórficas y la gravedad del TP. Por otra parte, es importante tener presente que, en nuestra muestra, el genotipo A/G se asoció a unas puntuaciones más altas de ansiedad en la HDRS.
No se han realizado estudios previos para buscar una posible relación del gen SCL6A4 con la gravedad del TP. Por otra parte, por lo que respecta al polimorfismo 5-HTTLPR, la mayor parte de los estudios de asociación de casos y controles llevados a cabo en el TP se han realizado pensando que este polimorfismo es bialélico. No obstante, Hu et al38 han descrito que el polimorfismo 5-HTTLPR es funcionalmente trialélico (debido a una sustitución A →G en el alelo L), y el alelo LG es similar al alelo S en su efecto en la expresión génica, mientras que el alelo LA es el de expresión más alta. Por lo tanto, es posible que los alelos LG no reconocidos en los genotipos LL y LS pudieran minimizar las diferencias entre los grupos y llevarnos a unos resultados negativos.
Este estudio tiene algunas limitaciones. La potencia estadística reducida del estudio puede haber contribuido a una falta de resultados con alta significación estadística. Las variaciones de la subescala de Ansiedad de la PAS según el genotipo A-1438G casi alcanzaban la significación estadística al nivel de 0,05, aun cuando la magnitud del efecto, medida con la η2, no era pequeña. La potencia estadística del estudio para identificar la relación observada como estadísticamente significativa fue un 57% inferior al nivel del 80% que se prefiere para evitar el error de tipo II. En consecuencia, el estudio era vulnerable al error de tipo II y puede no haber identificado relaciones verdaderamente significativas. El estudio también puede haber sido propenso al error de tipo I, puesto que no introdujimos un ajuste para comparaciones múltiples. Es preciso tener presente que varios de los resultados del estudio no habrían alcanzado significación estadística si hubiéramos aplicado un ajuste de Bonferroni.
Los resultados presentados en este estudio podrían respaldar la implicación del sistema serotoninérgico, y en especial del gen HTR2A, en la gravedad del TP. Sin embargo, serán necesarios más estudios que reproduzcan esta investigación para poder confirmar o rechazar los datos obtenidos.
FinanciaciónEste estudio fue financiado en parte por las subvenciones de la Universidad de Oviedo MB-02-519, y por el Instituto de Salud Carlos III, Centro de Investigación Biomédica en Red de Salud Mental, CIBERSAM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.