El sistema inmunitario es una pieza fundamental en la defensa del organismo y participa en el mantenimiento de la homeostasis. Existe un interés creciente en las implicaciones etiopatogénicas y pronósticas del sistema inmunitario en los trastornos mentales, avalado por estudios previos que sugieren la existencia de una disregulación de la respuesta inmune y un estado proinflamatorio en pacientes con una enfermedad mental, así como la elevada prevalencia de síntomas neuropsiquiátricos en pacientes con enfermedades autoinmunes o que reciben tratamientos inmunológicos. En el presente trabajo se realiza una revisión narrativa de la literatura científica sobre el papel de la psiconeuroinmunología en los trastornos mentales, especialmente en aspectos diagnósticos, pronósticos y terapéuticos. El desarrollo de este cuerpo de conocimiento puede aportar en el futuro importantes avances en la vulnerabilidad, mecanismos etiopatogénicos, diagnóstico y tratamiento de algunos trastornos psiquiátricos.
The immune system is a key element in the organism's defence system and participates in the maintenance of homeostasis. There is growing interest in the aetiopathogenic and prognostic implications of the immune system in mental disorders, as previous studies suggest the existence of a dysregulation of the immune response and a pro-inflammatory state in patients with mental disorders, as well as an increased prevalence of neuropsychiatric symptoms in patients suffering from autoimmune diseases or receiving immune treatments. This study aims to conduct a narrative review of the scientific literature on the role of Psychoneuroimmunology in mental disorders, with special focus on diagnostic, prognostic and therapeutic issues. The development of this body of knowledge may bring in the future important advances in the vulnerability, aetiopathogenic mechanisms, diagnosis and treatment of some mental disorders.
Los primeros estudios sobre la interacción mente-cuerpo datan de la primera mitad del sigloXX, cuando el fisiólogo Walter Cannon acuñó el término homeostasis en su trabajo «The wisdom of the body»1. Allí describió los mecanismos fisiológicos que intervienen en un equilibrio físico-químico esencial para el organismo y demostró cómo el estado emocional de un animal (ansiedad, estrés, rabia) puede acompañarse de la detención de movimientos del estómago. Por otro lado, Hans Selye desarrolló el concepto de síndrome general de adaptación, un conjunto de cambios psicofisiológicos que padecían ratas expuestas a diferentes agentes nocivos en el laboratorio2 como una reacción del organismo ante condiciones nuevas, y que años después acabaría acuñando el término estrés3. En 1975, con los trabajos del psicólogo Robert Ader y el inmunólogo Nicholas Cohen se acuñó el término psiconeuroinmunología a partir de estudios que demostraban que una señal aversiva canalizada a través del sistema nervioso condicionaba respuestas en el sistema inmune4. Debido a que frecuentemente los factores inmunológicos se asocian con factores endocrinológicos, en ocasiones se habla del término psiconeuroendocrinoinmunología. Este campo de interés científico estaría dedicado al estudio tanto de los aspectos hormonales e inmunológicos de los trastornos mentales, como al de las manifestaciones psiquiátricas de enfermedades hormonales, inmunológicas y asociadas a tratamientos hormonales o inmunológicos.
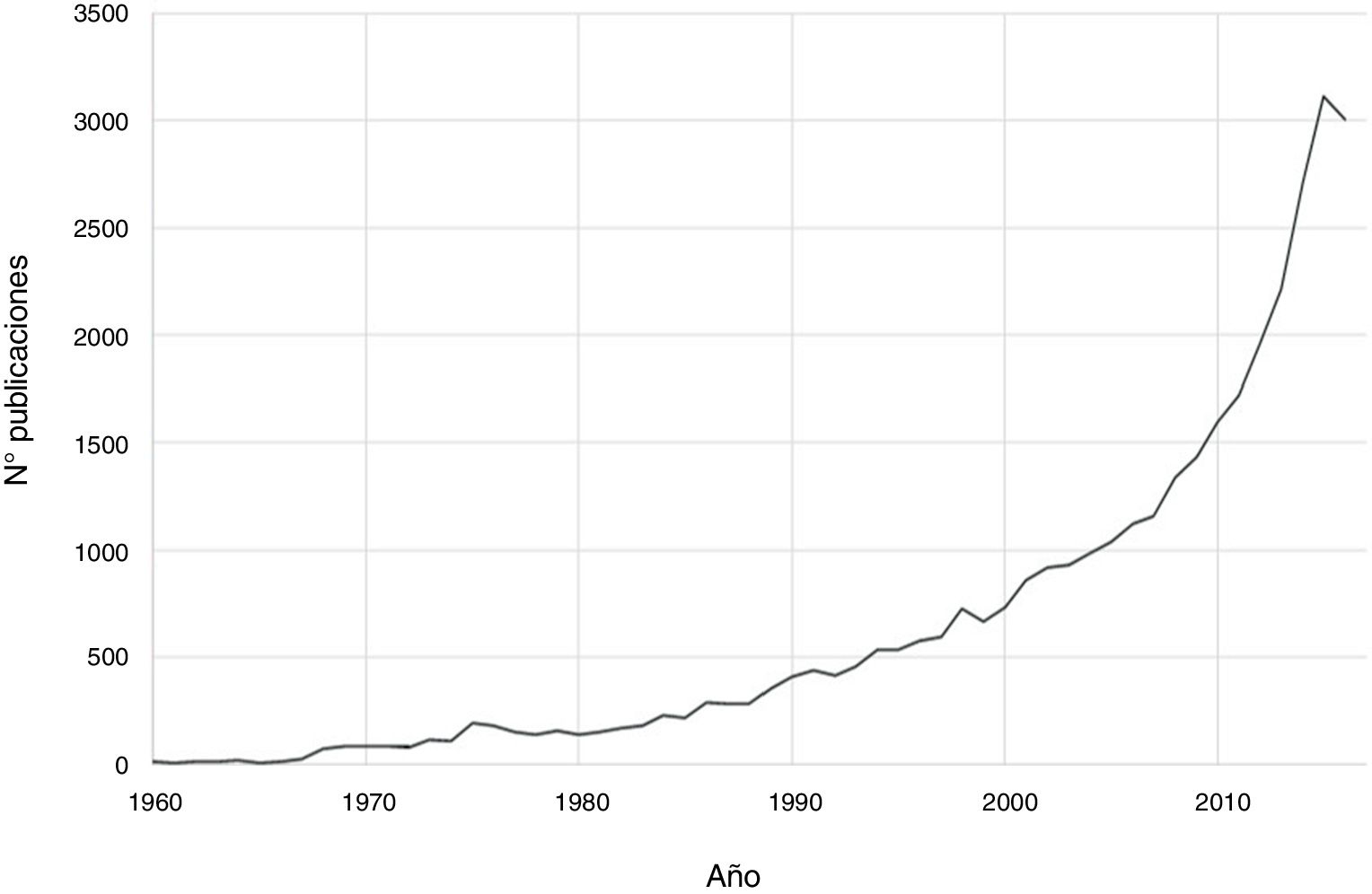
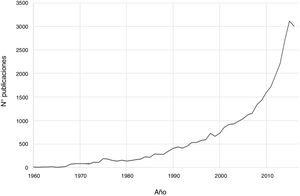
En las últimas décadas ha existido un progreso notable en el campo de la psiconeuroinmunología. Así, si se realiza una búsqueda en PubMed de aspectos inmunológicos de trastornos mentales con la estrategia de búsqueda (immune OR inflammat*) AND (psychiatry OR mental disorder OR schizophrenia OR depression OR bipolar), se obtienen un total de 36.127 publicaciones hasta el 2016, siendo el incremento exponencial en las últimas dos décadas (fig. 1). El avance en este campo de conocimiento relacionado con los trastornos mentales abarca desde aspectos etiopatogénicos hasta terapéuticos. De hecho, se ha avanzado en el descubrimiento de marcadores de autoinmunidad que han ayudado al diagnóstico de algunos cuadros de encefalitis que hasta hace pocos años no disponían de un diagnóstico preciso. Por otro lado, se ha propuesto la utilización de agentes antiinflamatorios en el abordaje terapéutico de varios trastornos mentales asociados a los tratamientos psicofarmacológicos y psicoterapéuticos convencionales.
Este artículo presenta una revisión narrativa sobre aspectos relevantes del sistema inmune en la patogenia, expresión clínica y oportunidades de tratamiento en los trastornos mentales. También se abordan aspectos relacionados con hormonas implicadas en la respuesta al estrés, por su importante relación con el sistema inflamatorio y su asociación con trastornos mentales severos, así como algunos trastornos específicos relacionados con el estrés. Para la realización de esta revisión se ha efectuado una búsqueda de artículos mediante PubMed utilizando una delimitación temporal desde el año 2000, incluyendo de forma puntual referencias previas clásicas y de trabajos seminales igualmente citadas en artículos recientes o revisiones de la misma temática.
El sistema inmunitarioGeneralidadesEl sistema inmunitario comprende aquellas estructuras y procesos biológicos que defienden al organismo frente a agresiones, tanto externas (p.ej., microorganismos patógenos) como internas (p.ej., células cancerosas), con el objetivo de restablecer la homeostasis (para una revisión general ver Delves y Roitt, 20005). Podemos clasificar al sistema inmunitario en «innato» (no específico) y «adquirido» (específico).
El primero proporciona la primera línea de defensa del organismo. Comprende barreras físicas, como la piel y las mucosas, y otros elementos como los fagocitos, entre los que encontramos a los macrófagos (que en el tejido cerebral constituyen la microglía) y los granulocitos (neutrófilos). La inmunidad adquirida es más sofisticada, de inicio retardado, y consiste en el reconocimiento y destrucción de antígenos. Esto implica el desarrollo de una «memoria inmunitaria» y para ello cuenta con los linfocitos como unidades básicas. Esta inmunidad incluye, a su vez, la inmunidad humoral (anticuerpos producidos por los linfocitosB y el sistema del complemento), y la inmunidad celular (mediada por linfocitosT, que se diferencian en otras subpoblaciones, como las célulasT citotóxicas [CD8] y las célulasT cooperadoras [CD4]). Los linfocitos natural killer se consideran una tercera población linfocitaria ya que, si bien se diferencian a partir de un antecesor común a los linfocitosT, no maduran en el timo y son componentes de la inmunidad innata.
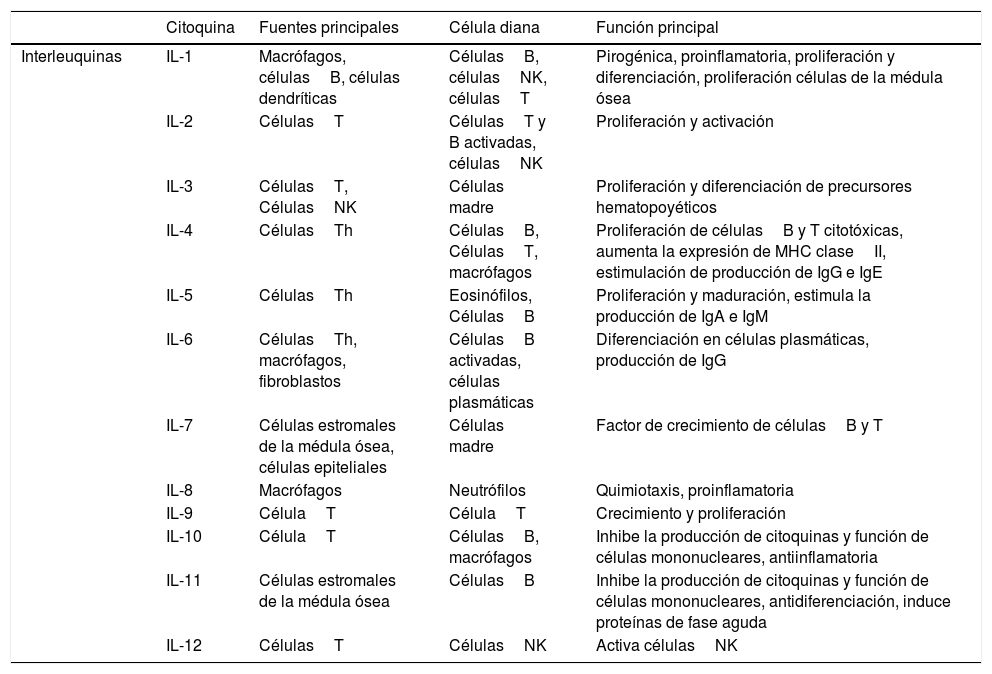
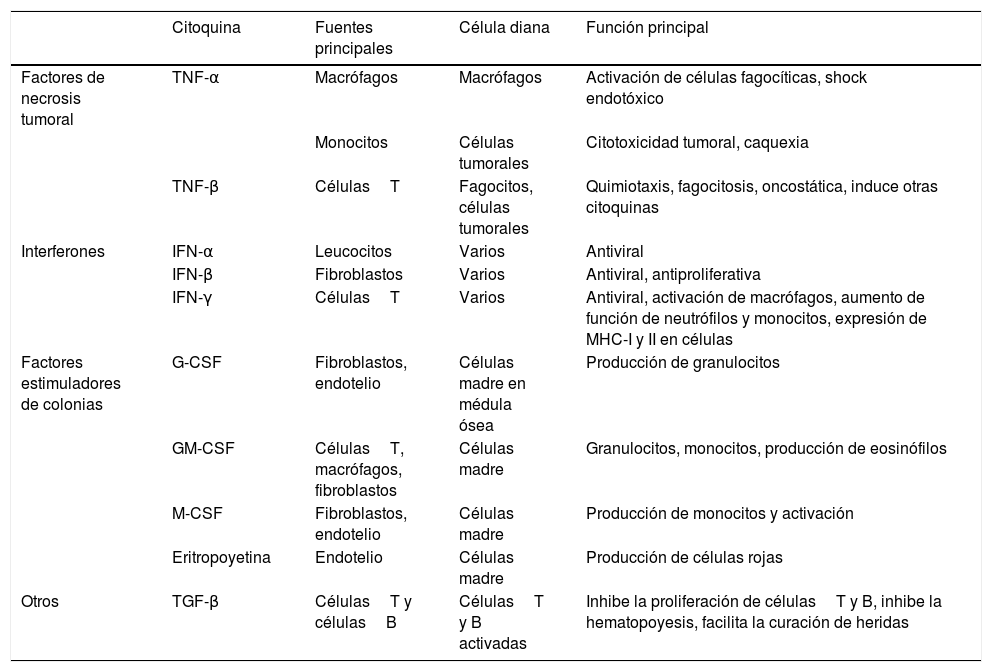
La respuesta inflamatoria de fase aguda es la primera respuesta del organismo ante una agresión, mediante la fagocitosis de los patógenos y la presentación de antígenos a los linfocitosT. En función de las características de la agresión, el sistema inmunitario reaccionará activando unas vías u otras y modulando la interacción entre los diferentes agentes que lo conforman, balanceando elementos pro y antiinflamatorios (tablas 1 y 2, adaptadas de Turner et al., 20146).
Funciones de las principales citoquinas (I): interleuquinas
| Citoquina | Fuentes principales | Célula diana | Función principal | |
|---|---|---|---|---|
| Interleuquinas | IL-1 | Macrófagos, célulasB, células dendríticas | CélulasB, célulasNK, célulasT | Pirogénica, proinflamatoria, proliferación y diferenciación, proliferación células de la médula ósea |
| IL-2 | CélulasT | CélulasT y B activadas, célulasNK | Proliferación y activación | |
| IL-3 | CélulasT, CélulasNK | Células madre | Proliferación y diferenciación de precursores hematopoyéticos | |
| IL-4 | CélulasTh | CélulasB, CélulasT, macrófagos | Proliferación de célulasB y T citotóxicas, aumenta la expresión de MHC claseII, estimulación de producción de IgG e IgE | |
| IL-5 | CélulasTh | Eosinófilos, CélulasB | Proliferación y maduración, estimula la producción de IgA e IgM | |
| IL-6 | CélulasTh, macrófagos, fibroblastos | CélulasB activadas, células plasmáticas | Diferenciación en células plasmáticas, producción de IgG | |
| IL-7 | Células estromales de la médula ósea, células epiteliales | Células madre | Factor de crecimiento de célulasB y T | |
| IL-8 | Macrófagos | Neutrófilos | Quimiotaxis, proinflamatoria | |
| IL-9 | CélulaT | CélulaT | Crecimiento y proliferación | |
| IL-10 | CélulaT | CélulasB, macrófagos | Inhibe la producción de citoquinas y función de células mononucleares, antiinflamatoria | |
| IL-11 | Células estromales de la médula ósea | CélulasB | Inhibe la producción de citoquinas y función de células mononucleares, antidiferenciación, induce proteínas de fase aguda | |
| IL-12 | CélulasT | CélulasNK | Activa célulasNK |
Ig: inmunoglobulina; IL: interleuquina; MHC: complejo principal de histocompatibilidad; NK: natural killer; Th: célulaT helper o cooperadora.
Funciones de las principales citoquinas (II): factores de necrosis tumoral, interferones y otros factores
| Citoquina | Fuentes principales | Célula diana | Función principal | |
|---|---|---|---|---|
| Factores de necrosis tumoral | TNF-α | Macrófagos | Macrófagos | Activación de células fagocíticas, shock endotóxico |
| Monocitos | Células tumorales | Citotoxicidad tumoral, caquexia | ||
| TNF-β | CélulasT | Fagocitos, células tumorales | Quimiotaxis, fagocitosis, oncostática, induce otras citoquinas | |
| Interferones | IFN-α | Leucocitos | Varios | Antiviral |
| IFN-β | Fibroblastos | Varios | Antiviral, antiproliferativa | |
| IFN-γ | CélulasT | Varios | Antiviral, activación de macrófagos, aumento de función de neutrófilos y monocitos, expresión de MHC-I y II en células | |
| Factores estimuladores de colonias | G-CSF | Fibroblastos, endotelio | Células madre en médula ósea | Producción de granulocitos |
| GM-CSF | CélulasT, macrófagos, fibroblastos | Células madre | Granulocitos, monocitos, producción de eosinófilos | |
| M-CSF | Fibroblastos, endotelio | Células madre | Producción de monocitos y activación | |
| Eritropoyetina | Endotelio | Células madre | Producción de células rojas | |
| Otros | TGF-β | CélulasT y célulasB | CélulasT y B activadas | Inhibe la proliferación de célulasT y B, inhibe la hematopoyesis, facilita la curación de heridas |
G-CSF: factor estimulante de colonias de granulocitos; GM-CSF: factor estimulante de colonias de granulocitos y macrófagos; IFN-α: interferónα; IFN-β: interferónβ; IFN-γ: interferónγ; M-CSF: factor estimulante de colonias de macrófagos; MHC: complejo principal de histocompatibilidad; TGF-β: factor de crecimiento transformanteβ; TNF-α: factor de necrosis tumoralα; TNF-β: factor de necrosis tumoralβ.
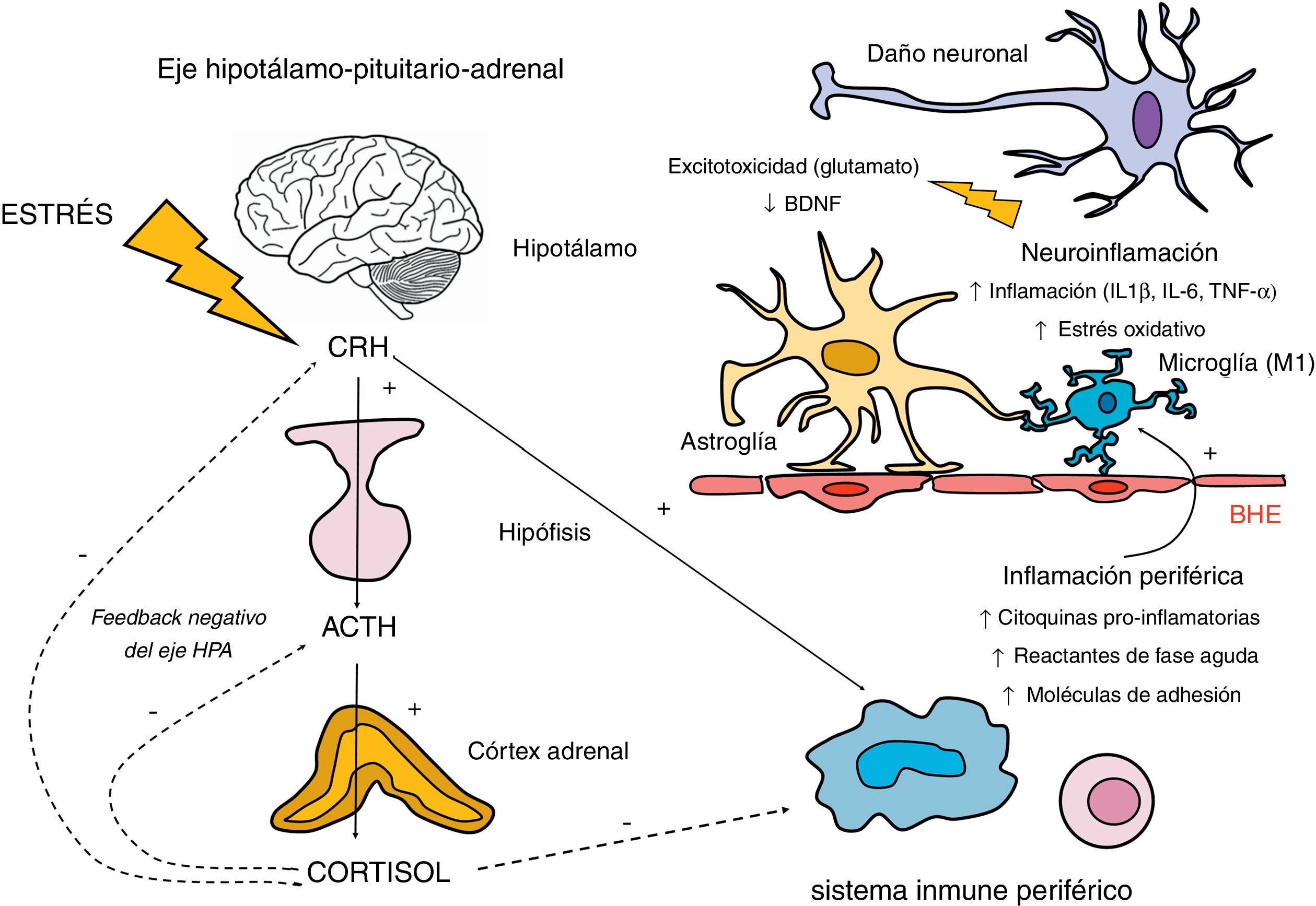
La comunicación entre los distintos componentes del sistema inmunitario se realiza mediante el contacto intercelular y la participación fundamental de las citoquinas, proteínas señalizadoras que actúan en cascada. Las vías de comunicación bidireccional entre el sistema inmune y el sistema nervioso central también incluyen la inervación vagal, el sistema linfático y su interacción con otros ejes neurohormonales, como el eje hipotálamo-pituitario-adrenal (HPA) (fig. 2).
Implicación del eje hipotálamo-pituitario-adrenal (HPA) y el sistema inmune en la respuesta neuroinflamatoria.
El eje HPA se activa en respuesta a la exposición a estímulos estresantes físicos y psicológicos, mediante la secreción de la hormona liberadora de corticotropina (CRH) por el hipotálamo. Esta hormona, a su vez, estimula la síntesis de corticotropina (ACTH) en la hipófisis, que estimula la secreción de cortisol por las glándulas adrenales. La regulación de la secreción de cortisol está sujeta a un mecanismo de retroalimentación negativo (conocido como feedback negativo), mediante el cual el propio cortisol inhibe la síntesis de sus precursores (CRH y ACTH). En esta inhibición participan los receptores glucocorticoideos del hipotálamo y la hipófisis, además de los receptores glucocorticoideos y mineralocorticoideos presentes en el hipocampo. En cuanto a la relación del eje HPA y la respuesta inflamatoria periférica, si bien el cortisol la inhibe ejerciendo un efecto inmunosupresor, existe una estimulación inflamatoria por otras hormonas del eje HPA como la CRH. Esta relación es bidireccional, ya que la activación de la respuesta inflamatoria periférica puede estimular al eje HPA. Los productos de esta inflamación periférica, en la que participan los macrófagos y linfocitos, pueden atravesar la barrera hematoencefálica (BHE) y desencadenar una reacción neuroinflamatoria mediante la estimulación de la microglía en formas activadas M1. Esta activación de la microglía genera una cascada inflamatoria mediante la liberación de citoquinas y especies reactivas del nitrógeno y oxígeno, induciendo la activación de la astroglía, que a su vez amplifica las señales inflamatorias dentro del sistema nervioso central. Además, existe una liberación excesiva de glutamato por parte de los astrocitos y también de mediadores de estrés oxidativo por parte de la microglía activada (relacionados con la inducción de la enzima indolamina 2,3 dioxigenasa [IDO]). Estos mecanismos afectan negativamente a la producción de factores neurotróficos, como el factor neurotrófico derivado del cerebro (BDNF), y a la neurogénesis.
Así, la respuesta de las citoquinas puede clasificarse en proinflamatoria (cuando desde la microglía se promueve un tipo de inflamación que puede resultar nociva para los tejidos, dirigida contra antígenos intracelulares) y en antiinflamatoria (cuando desde la astroglía se regula la inmunidad humoral dirigida contra antígenos extracelulares)7. Tanto las células cerebrales neuronales como las no neuronales expresan receptores para estos mediadores8 (tablas 1 y 2).
La microglía no únicamente modula la función neuronal durante la respuesta inflamatoria, sino que también está implicada en fenómenos fisiológicos de plasticidad y poda neuronal durante el desarrollo sináptico cerebral. Así, controla el estado funcional de las sinapsis, influye en los cambios neuroplásticos mediante la remodelación de espacios extracelulares y elimina elementos sinápticos mediante fagocitosis. En respuesta a estímulos nocivos, la microglía experimenta una serie de cambios (cuantitativos, funcionales y morfológicos), que se han identificado tanto en respuesta a estímulos inflamatorios clásicos como las infecciones, así como también en situaciones de estrés psicológico9.
A pesar de la protección inmunológica que brinda al cerebro la barrera hematoencefálica, se ha descrito un incremento de su permeabilidad en pacientes con trastornos mentales severos, por lo que factores pro o antiinflamatorios pueden entrar de la periferia o escapar del cerebro a la circulación sistémica en determinadas situaciones neuropatológicas10.
Por otro lado, existe el sistema neurohumoral bidireccional conocido como eje intestino-cerebro. La microbiota intestinal consiste en una comunidad bacteriana que reside mayoritariamente en el intestino delgado, en simbiosis con el individuo huésped. Investigaciones recientes sugieren que la microbiota afecta al desarrollo y la función cerebral y que podría ser relevante en la fisiopatología de algunos trastornos neuropsiquiátricos11. De hecho, se ha observado que la manipulación de la composición de la microbiota intestinal afecta a las concentraciones sistémicas de citoquinas tanto en modelos animales como en humanos12,13.
Enfermedades autoinmunes y síntomas psiquiátricosLa implicación de factores inmunológicos en los trastornos psiquiátricos parte de diferentes observaciones. Por un lado, existen enfermedades autoinmunes (p.ej., lupus eritematoso sistémico [LES], encefalitis por anticuerpos anti-NMDA) que cursan con una elevada prevalencia de síntomas psiquiátricos. Por otro lado, estudios previos en los que se han administrado moduladores del sistema inmunológico a animales o humanos han objetivado síntomas psiquiátricos. En modelos animales, la inyección de citoquinas proinflamatorias (IL-1β y TNF-α) produce un comportamiento similar al aislamiento social8. En humanos, la administración de endotoxinas induce anhedonia y desactiva el núcleo estriado ventral, región implicada en los circuitos de respuesta cerebral a la recompensa14. Otro dato reconocido es que el tratamiento de la hepatitisC con IFN-α induce síntomas depresivos con elevada frecuencia15.
A continuación se describe la relación entre algunas enfermedades autoinmunes y síntomas psiquiátricos.
Lupus eritematoso sistémico (LES)Hasta un 75% de los pacientes con LES tienen afectación cerebral16, apareciendo los síntomas psiquiátricos típicamente en los primeros años de la enfermedad, incluyendo ansiedad, depresión y psicosis. Si bien la clínica afectiva puede tener un componente adaptativo en el contexto de padecer la enfermedad sistémica y sus limitaciones, en otros casos existen manifestaciones psicopatológicas asociadas a la enfermedad, coincidiendo con el al aumento de parámetros de actividad inmunológica (anticuerpos ANA y anti-DNA). La psicosis lúpica, considerada un criterio diagnóstico del LES, se asocia frecuentemente a anticuerpos positivos contra el ribosoma-P, aunque metaanálisis recientes sugieren que no sería específico de psicosis, asociándose también a ansiedad o depresión17. Si consideramos la afectación cognitiva asociada al LES, hasta un 80% de los pacientes presentan síntomas cognitivos leves o moderados, y un 3-5% severos16. Los dominios más afectados son la atención, la memoria visual y verbal, las funciones ejecutivas y la velocidad de procesamiento de la información. Estudios de neuroimagen con resonancia cerebral estructural han demostrado la presencia de atrofia cortical, lesiones en la sustancia blanca subcortical y cambios difusos en la sustancia gris18,19.
Encefalitis autoinmunesLas encefalitis autoinmunes se caracterizan por un inicio agudo con crisis epilépticas del lóbulo temporal, síntomas conductuales o manifestaciones psiquiátricas y afectación cognitiva. Se han implicado autoanticuerpos contra autoantígenos a nivel sináptico o intracelular que pueden asociarse o no a un origen paraneoplásico20. Estos anticuerpos pueden estar dirigidos contra subunidades del receptor NMDA, canales voltaje-dependientes de potasio, complejos y contactina asociados a proteína2 (CASPR2), subunidades GluR1 y GluR2 del receptor del ácido amino-3-hidroxi-5-metil-l-4-isoxazolepropiónico (AMPAR) y subunidades B1 de los receptores B del ácido γ-aminobutírico (GABABR)7.
Las manifestaciones psiquiátricas pueden preceder a los síntomas neurológicos o incluso dominar el cuadro clínico en fases iniciales y comprenden síntomas afectivos, psicosis de tipo esquizofreniforme, o incluso sintomatología catatoniforme21. Así, hasta dos tercios de los pacientes con una encefalitis autoinmune por anticuerpos anti-NMDAR consultan inicialmente con dispositivos asistenciales de salud mental.
Trastorno autoinmune neuropsiquiátrico asociado a estreptococo (PANDAS)El trastorno autoinmune neuropsiquiátrico asociado a estreptococo (PANDAS) es un síndrome pediátrico raro descrito en niños que, tras padecer una infección por estreptococo del grupo A β-hemolítico, desarrollan tics, movimientos involuntarios y síntomas obsesivo-compulsivos22. Se han descrito tanto inicios como exacerbaciones de la sintomatología obsesivo-compulsiva tras este tipo de infecciones. Se sugiere la existencia de una reactividad cruzada entre los anticuerpos antiestreptococo y proteínas (autoantígenos) de los ganglios basales cerebrales, entre los que figuran unas enzimas (aldolasas, enolasas), implicadas en la neurotransmisión, el metabolismo neuronal y la señalización celular, y que muestran una estructura similar a proteínas estreptocócicas. La seropositividad para anticuerpos contra los ganglios basales en pacientes con trastorno obsesivo-compulsivo (TOC) se ha asociado con niveles elevados de glicina en el líquido cefalorraquídeo, sugiriendo que estos contribuyen al incremento del tono glutamatérgico que se ha descrito en pacientes con TOC7. La mejoría de los síntomas obsesivo-compulsivos con terapias inmunológicas apoya el papel de estos autoanticuerpos en la patogenia del TOC, o al menos en un subgrupo de pacientes que asocian los síntomas con el PANDAS23.
El sistema inmunológico y los trastornos psiquiátricos primariosExiste evidencia clínica y datos de laboratorio que demuestran que alteraciones en la inmunidad celular y humoral son más prevalentes en pacientes con trastornos mentales comparados con individuos sanos.
Estrés y carga alostáticaEl estrés puede definirse como una amenaza para la integridad psicológica o fisiológica de un individuo. Ante el estrés agudo, se liberan catecolaminas y cortisol desde la médula y la corteza suprarrenal, respectivamente. Esta respuesta fisiológica juega un papel protector a corto plazo, aunque si el estrés se mantiene de forma crónica o existe una disregulación de la secreción hormonal puede llegar a ser perjudicial para el organismo24. A este aspecto se refiere el modelo de carga alostática. El organismo tiende a buscar el equilibrio de sistemas regulatorios fisiológicos (homeostasis) mediante respuestas de adaptación (alostasis) que implican al sistema nervioso simpático y neuroendocrino, especialmente al eje HPA25. Cuando existe un estrés crónico y la carga alostática sobrepasa un límite, se objetiva una disregulación crónica de los mediadores de alostasis y una respuesta maladaptativa que se ha relacionado con diferentes condiciones médicas, entre las que se encuentran trastornos mentales (depresión unipolar26, trastorno bipolar27, eszquizofrenia28), neurodegenerativos (deterioro cognitivo29) o endocrino-metabólicos (obesidad y síndrome metabólico30).
En la respuesta al estrés y la capacidad de tolerar la carga alostática intervienen diferentes factores incluyendo las experiencias personales, la genética y el comportamiento. Cuando el cerebro percibe una experiencia como estresante, se desencadenan respuestas fisiológicas y comportamentales, incluyendo la participación del sistema inmunitario, que inician el proceso de alostasis y adaptación. El acúmulo de alostasis, la sobreexposición a mediadores de estrés celulares, endocrinológicos e inmunológicos conducirá al desarrollo de enfermedades. Se ha relacionado la carga alostática con diferentes condiciones mentales, como el burn-out o el síndrome de fatiga crónica, así como con parámetros relacionados con el envejecimiento, como el riesgo cardiovascular, la afectación cognitiva y la mortalidad en poblaciones de edad avanzada29.
Inflamación en depresiónLos trastornos depresivos, además de los síntomas psicológicos, presentan constelaciones de síntomas somáticos o vegetativos en su expresión clínica que recuerdan a síntomas inespecíficos de enfermedades físicas sistémicas, como la astenia, la anergia, el dolor inespecífico, las alteraciones del apetito, las anomalías en el sueño y los déficits de memoria. Además, la depresión mayor con síntomas melancólicos o las depresiones bipolares presentan un curso longitudinal episódico y recurrente con períodos de remisión que recuerda al curso de varias enfermedades autoinmunes. La administración de citoquinas exógenas como el IFN-α puede inducir síntomas depresivos15,31, apoyando la relación entre el sistema inmune y la depresión.
En las últimas décadas se han descrito alteraciones en la activación de la respuesta inflamatoria a varios niveles en pacientes con depresión, en forma de disminución de linfocitosB, T, Thelper y Tsupresores32, de la actividad de las células natural killer33, de la respuesta proliferativa a mitógenos inespecíficos, así como un aumento de neutrófilos, de IL-632, IL-134, del TNF-α35, de la proteínaC-reactiva34 y de la activación de factores nucleares señalizadores de la cascada inflamatoria36. Por otro lado, se han correlacionado los niveles de estos factores con la severidad de la depresión37,38 y su respuesta al tratamiento.
Se han descrito también alteraciones en el estrés oxidativo39, existiendo una doble interacción entre este y la inflamación: moléculas oxidativas activan mediadores inflamatorios, así como la activación de la microglía produce metabolitos de estrés oxidativo. En condiciones normales, la microglía controla el inicio y el final del proceso neuroinflamatorio, condicionando su autolimitación. Sin embargo, en la exposición al estrés se puede producir una hiperactivación de la microglía que se traduciría en un exceso de inflamación que podría provocar neurotoxicidad40. Los síntomas cognitivos se consideran una dimensión nuclear en la depresión mayor, pudiendo incluso persistir tras la remisión de los síntomas afectivos. Se ha sugerido que los síntomas cognitivos de la depresión pueden resultar de la interacción compleja de factores neuroinflamatorios y neurohormonales relacionados con el eje HPA15,41,42.
Considerando lo anterior, la hipótesis neuroinflamatoria de la depresión43, junto con las alteraciones en la respuesta neurohormonal y metabólica descritas en estos pacientes, refuerzan la implicación de una alteración en los mecanismos fisiológicos de respuesta al estrés y a diversas noxas biológicas en la etiopatogenia de los trastornos depresivos. Incluso se ha descrito un subtipo de trastorno depresivo asociado a citoquinas, denominado ICAD por sus siglas en inglés (inflammatory cytokine-associated depression)44.
Inflamación en esquizofreniaSe ha demostrado un estado proinflamatorio con un aumento de niveles de dichas citoquinas en pacientes con esquizofrenia respecto a controles sanos45. Aunque los niveles de factores inflamatorios son relativamente bajos en comparación con otras enfermedades inflamatorias, este estado de activación de bajo grado de la inflamación se ha implicado en un peor pronóstico de la esquizofrenia en relación con los síntomas psicóticos positivos46 y negativos46,47, la afectación cognitiva48 y la pérdida de volumen cerebral49. La asociación entre factores inflamatorios y un peor rendimiento cognitivo en primeros episodios psicóticos50 subraya la importancia de la inflamación en el peor pronóstico de los trastornos psicóticos en fases tempranas de la enfermedad. Se han descrito también niveles elevados de citoquinas proinflamatorias45 en las recaídas psicóticas, una reducción de los niveles de diferentes citoquinas proinflamatorias45 tras el tratamiento antipsicótico y la mejoría clínica, y aumentos de algunas citoquinas, como la IL-6, incluso antes de desarrollar una psicosis en poblaciones de riesgo51,52.
Como en otros trastornos, se ha propuesto que los efectos nocivos de la inflamación en la esquizofrenia se producirían mediante la participación del estrés oxidativo. Estudios realizados durante los últimos años han demostrado niveles anormales de metabolitos de estrés oxidativo tanto en tejido periférico53,54 como en tejido nervioso55,56, existiendo sinergias entre inflamación, mecanismos de excitotoxicidad, disfunción mitocondrial y agregación proteica anormal para inducir neurodegeneración. La activación o incremento de la densidad de la microglía puede conllevar la síntesis de prostaglandinas, citoquinas y especies reactivas del oxígeno, causando muerte celular57. A estos efectos hay que añadir el papel del eje HPA mediante la secreción mantenida de cortisol, pudiendo contribuir en cierto grado a la neurotoxicidad cerebral. De hecho, se ha descrito una asociación entre niveles elevados de cortisol y la reducción volumétrica de determinadas regiones cerebrales como el hipocampo58, región de gran relevancia en los procesos cognitivos, especialmente la memoria de trabajo, claramente afectada en pacientes con esquizofrenia. Esta reducción se ha vinculado a un peor funcionamiento social59 y una mayor duración de la enfermedad60.
Un aspecto planteado en estudios de pacientes con esquizofrenia y primeros episodios psicóticos es la posibilidad de que los factores inflamatorios y marcadores de estrés oxidativo puedan considerarse como marcadores de estado o de rasgo. A nivel de inflamación se ha sugerido que algunas citoquinas se comportarían como marcadores de estado (IL-1β, IL-6 o TGF-β), dado que aumentan en descompensaciones agudas y se normalizan con el tratamiento antipsicótico45. Otras citoquinas, en cambio, se podrían considerar marcadores de rasgo (IL-12, IFN-¿, TNF-α, y sIL-2R), dado que el incremento de las mismas en los episodios agudos persiste tras iniciar el tratamiento antipsicótico45. Algo similar sucede con los marcadores de estrés oxidativo, considerándose algunos como marcadores de estado (estado antioxidante total, actividad de catalasa en glóbulos rojos y nitrito plasmático) y otros de estado (actividad superóxido dismutasa en glóbulos rojos)54.
Aunque el número de estudios realizados hasta la fecha en pacientes con esquizofrenia es mayor que en trastornos afectivos, como la depresión mayor o el trastorno bipolar, la evidencia científica sugiere que el papel de la inflamación en la patogenia de estas enfermedades es compartido. Por ejemplo, en un metaanálisis reciente de estudios que han analizado diferentes citoquinas en líquido cefalorraquídeo61, el tamaño del efecto para el incremento de varias citoquinas (IL-1β, IL-6, e IL-8) ha sido similar entre diagnósticos y se ha objetivado tanto en pacientes con depresión como con esquizofrenia. Estas tres citoquinas se modulan a través de la vía de señalización del factor nuclear-kappaB (NF-kB), que se activa comúnmente en procesos inflamatorios y autoinmunes, sugiriendo que puedan existir vías patogénicas comunes en diferentes trastornos psiquiátricos primarios.
Inflamación en otros trastornos neuropsiquiátricosEn el trastorno bipolar se ha asociado un estado proinflamatorio con el perfil clínico, incluyendo mayor severidad de síntomas maníacos62, depresivos63 y cognitivos64,65, antecedentes de tentativas suicidas y una mayor duración de la enfermedad66. Estudios de cohortes realizados en población infantil han demostrado que algunas citoquinas, como la IL-667, son predictoras de hipomanía en la edad adulta. Otros estudios han comparado los niveles de factores inflamatorios entre pacientes con trastorno bipolar y depresión unipolar, detectando niveles mayores en los primeros, lo que sugiere la existencia de una mayor disregulación inflamatoria en este trastorno68.
En el trastorno por estrés postraumático (TEPT) se ha descrito la existencia de un estado proinflamatorio que ha sido replicado en diferentes cohortes de veteranos de guerra69. En un metaanálisis de 20 estudios que exploraron la relación entre factores inflamatorios y el diagnóstico de TEPT respecto a controles sanos, se demostró un incremento de los niveles de IL-6, IL-1β e IFN-γ en el TEPT70, asociándose los niveles de IL-1β con la duración del trastorno y los de IL-6 con la severidad sintomática.
Niveles elevados de citoquinas han sido descritos también en otros trastornos de ansiedad, incluyendo el trastorno de ansiedad generalizada, el trastorno de pánico, las fobias o el TOC, sugiriendo que los hallazgos no son específicos de un trastorno concreto71,72. Así, se sugiere que la activación de la respuesta al estrés induce la secreción de citoquinas a nivel periférico y central, además de existir un tono simpático aumentado y una menor actividad parasimpática, lo que contribuiría a incrementar todavía más el grado de inflamación, conllevando efectos negativos en regiones cerebrales críticas para la regulación del miedo y la ansiedad, como el córtex prefrontal, la ínsula, la amígdala y el hipocampo.
En pacientes con trastornos de la conducta alimentaria también se han descrito niveles incrementados de citoquinas proinflamatorias y marcadores de estrés oxidativo73. Un metaanálisis de estudios en anorexia nerviosa74 sugiere que existe un aumento de los niveles de TNF-α, IL-6, IL-1β, y TNF-R-II y un descenso de los niveles de proteínaC-reactiva e IL-6R respecto a controles sanos.
Implicaciones diagnósticas y terapéuticasEn un intento por mejorar la capacidad diagnóstica, en la quinta edición del Manual diagnóstico y estadístico de los trastornos mentales de la Asociación Americana de Psiquiatría (DSM-V) inicialmente se planteó la inclusión de biomarcadores junto a criterios diagnósticos clínicos. Sin embargo, finalmente se desestimó esta opción y el DSM-V, como las ediciones anteriores, se basa únicamente en criterios clínicos. Algunos autores75 señalan que las expectativas iniciales respecto a la utilidad práctica de los biomarcadores en psiquiatría eran poco realistas, por su baja capacidad para discriminar signos y síntomas definitorios. La mayoría de las pruebas de laboratorio son marcadores probabilísticos, no patognomónicos, de enfermedad. Por lo tanto, aunque es probable que en el futuro el uso de biomarcadores permita definir subgrupos o estadificaciones dentro de categorías diagnósticas76, a fecha de hoy ningún parámetro inflamatorio tiene la suficiente sensibilidad y especificidad como para tener utilidad diagnóstica en psiquiatría.
Además, el control de sesgos en la investigación de marcadores inflamatorios debe ser exhaustivo y considerar numerosas variables que pueden afectar a la caracterización de la función inmunológica más allá de las variables de estudio, como la variabilidad en las técnicas de laboratorio, el ritmo circadiano de los parámetros inflamatorios, la influencia de los factores moduladores o reguladores fisiológicos del marcador objeto de estudio, la calidad del sueño, el sexo, la edad, el peso, el consumo de sustancias y la exposición a agentes farmacológicos, entre otros.
Otro tema en discusión es el planteamiento del uso de fármacos antiinflamatorios en el tratamiento de los trastornos mentales. Varios metaanálisis que analizan el beneficio del uso de diversos antiinflamatorios en depresión unipolar77, trastorno bipolar64 y psicosis78 muestran resultados favorables. Sin embargo, existen importantes sesgos metodológicos, una elevada heterogeneidad entre estudios y tamaños muestrales pequeños, lo que en conjunto ha dificultado el poder atribuir los beneficios específicamente a las propiedades antiinflamatorias.
Así, a día de hoy todavía se requiere prudencia en la recomendación del uso de tratamientos antiinflamatorios en los trastornos mentales severos, ya que las implicaciones terapéuticas son aún un campo abierto a la investigación.
ConclusionesEl sistema inmunitario es una pieza fundamental en la defensa del organismo y participa en el mantenimiento de la homeostasis. La interacción entre el sistema endocrinológico y el sistema nervioso autónomo explicaría en parte el impacto recíproco del sistema inmunitario en las funciones psicológicas y la conducta, así como del estrés psicológico en la respuesta inmunitaria.
Varias alteraciones del sistema inmunitario se han asociado a la presencia de trastornos mentales, destacando una disregulación de la respuesta inflamatoria del organismo con el predominio de un estado proinflamatorio. La exposición a situaciones de estrés crónico puede conllevar respuestas maladaptativas de diferentes mediadores hormonales, inflamatorios y cardiovasculares que estarían implicados en la patogenia de diferentes trastornos metabólicos y neuropsiquiátricos. Por otro lado, existe una asociación robusta entre enfermedades autoinmunes y síntomas psiquiátricos, entre los que se incluyen síntomas obsesivo-compulsivos, depresivos o psicóticos.
El desarrollo de este cuerpo de conocimiento puede aportar en los próximos años importantes avances en la identificación de poblaciones de riesgo, mecanismos etiopatogénicos, diagnóstico y tratamiento de algunos trastornos psiquiátricos. Sin embargo, por el momento no se ha alcanzado un consenso sobre el uso de biomarcadores del sistema inmunitario que permita extender su aplicación en el diagnóstico ni recomendar tratamientos inmunomoduladores para los trastornos mentales primarios en la práctica clínica diaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente trabajo ha sido realizado con el apoyo del Ministerio de Economía, Industria y Competitividad a través del Instituto de Salud Carlos III (PI15/00662 y PI15/01386), el Fondo Europeo de Desarrollo Regional (FEDER) «Una manera de hacer Europa» y el Centro de Investigación Biomédica en Red de Salud Mental (CIBERSAM).






![Implicación del eje hipotálamo-pituitario-adrenal (HPA) y el sistema inmune en la respuesta neuroinflamatoria. El eje HPA se activa en respuesta a la exposición a estímulos estresantes físicos y psicológicos, mediante la secreción de la hormona liberadora de corticotropina (CRH) por el hipotálamo. Esta hormona, a su vez, estimula la síntesis de corticotropina (ACTH) en la hipófisis, que estimula la secreción de cortisol por las glándulas adrenales. La regulación de la secreción de cortisol está sujeta a un mecanismo de retroalimentación negativo (conocido como feedback negativo), mediante el cual el propio cortisol inhibe la síntesis de sus precursores (CRH y ACTH). En esta inhibición participan los receptores glucocorticoideos del hipotálamo y la hipófisis, además de los receptores glucocorticoideos y mineralocorticoideos presentes en el hipocampo. En cuanto a la relación del eje HPA y la respuesta inflamatoria periférica, si bien el cortisol la inhibe ejerciendo un efecto inmunosupresor, existe una estimulación inflamatoria por otras hormonas del eje HPA como la CRH. Esta relación es bidireccional, ya que la activación de la respuesta inflamatoria periférica puede estimular al eje HPA. Los productos de esta inflamación periférica, en la que participan los macrófagos y linfocitos, pueden atravesar la barrera hematoencefálica (BHE) y desencadenar una reacción neuroinflamatoria mediante la estimulación de la microglía en formas activadas M1. Esta activación de la microglía genera una cascada inflamatoria mediante la liberación de citoquinas y especies reactivas del nitrógeno y oxígeno, induciendo la activación de la astroglía, que a su vez amplifica las señales inflamatorias dentro del sistema nervioso central. Además, existe una liberación excesiva de glutamato por parte de los astrocitos y también de mediadores de estrés oxidativo por parte de la microglía activada (relacionados con la inducción de la enzima indolamina 2,3 dioxigenasa [IDO]). Estos mecanismos afectan negativamente a la producción de factores neurotróficos, como el factor neurotrófico derivado del cerebro (BDNF), y a la neurogénesis. Implicación del eje hipotálamo-pituitario-adrenal (HPA) y el sistema inmune en la respuesta neuroinflamatoria. El eje HPA se activa en respuesta a la exposición a estímulos estresantes físicos y psicológicos, mediante la secreción de la hormona liberadora de corticotropina (CRH) por el hipotálamo. Esta hormona, a su vez, estimula la síntesis de corticotropina (ACTH) en la hipófisis, que estimula la secreción de cortisol por las glándulas adrenales. La regulación de la secreción de cortisol está sujeta a un mecanismo de retroalimentación negativo (conocido como feedback negativo), mediante el cual el propio cortisol inhibe la síntesis de sus precursores (CRH y ACTH). En esta inhibición participan los receptores glucocorticoideos del hipotálamo y la hipófisis, además de los receptores glucocorticoideos y mineralocorticoideos presentes en el hipocampo. En cuanto a la relación del eje HPA y la respuesta inflamatoria periférica, si bien el cortisol la inhibe ejerciendo un efecto inmunosupresor, existe una estimulación inflamatoria por otras hormonas del eje HPA como la CRH. Esta relación es bidireccional, ya que la activación de la respuesta inflamatoria periférica puede estimular al eje HPA. Los productos de esta inflamación periférica, en la que participan los macrófagos y linfocitos, pueden atravesar la barrera hematoencefálica (BHE) y desencadenar una reacción neuroinflamatoria mediante la estimulación de la microglía en formas activadas M1. Esta activación de la microglía genera una cascada inflamatoria mediante la liberación de citoquinas y especies reactivas del nitrógeno y oxígeno, induciendo la activación de la astroglía, que a su vez amplifica las señales inflamatorias dentro del sistema nervioso central. Además, existe una liberación excesiva de glutamato por parte de los astrocitos y también de mediadores de estrés oxidativo por parte de la microglía activada (relacionados con la inducción de la enzima indolamina 2,3 dioxigenasa [IDO]). Estos mecanismos afectan negativamente a la producción de factores neurotróficos, como el factor neurotrófico derivado del cerebro (BDNF), y a la neurogénesis.](https://static.elsevier.es/multimedia/18889891/0000001100000002/v1_201804220435/S1888989117301003/v1_201804220435/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)