Al menos el 10% de pacientes con trastorno obsesivo-compulsivo (TOC) son refractarios al tratamiento psicofarmacológico. La aparición de nuevas tecnologías neuroquirúrgicas (estimulación cerebral profunda[ECP]) de modulación de la actividad neuronal alterada está posibilitando su extensión a casos graves y refractarios de TOC en los que anteriormente se utilizaban técnicas quirúrgicas no reversibles. El objetivo de este artículo es revisar la evidencia científica existente sobre la eficacia y aplicabilidad de esta técnica en este grupo de pacientes.
MétodoSe ha realizado una revisión sistemática de la literatura en las bases de datos PubMed/Medline, Embase y PsycINFO usando las palabras clave relacionadas con «deep brain stimulation», «DBS» y «obsessive-compulsive disorder», «OCD». Dos de los autores seleccionaron los artículos, de manera independiente, a partir de sus abstracts y en función de si describían alguno de los aspectos principales de la técnica en el TOC: aplicabilidad; mecanismo de acción; dianas terapéuticas cerebrales; efectividad; efectos secundarios, y coterapias. Toda la información fue sistemáticamente extraída y evaluada.
ResultadosEl análisis crítico de la evidencia señala que la aplicación de la ECP en el tratamiento del TOC refractario está aportando resultados satisfactorios, con rangos asumibles de efectos secundarios. Sin embargo, todavía no hay evidencia suficiente que permita priorizar el uso de una determinada diana cerebral. La selección de pacientes ha de seguir un análisis de riesgo/beneficio, debiéndose individualizar la decisión de mantener un tratamiento concomitante farmacológico/psicoterapéutico.
ConclusionesLa ECP se encuentra todavía en el ámbito de la investigación, pero su aplicación en el TOC-refractario es cada vez más frecuente, produciendo en la mayoría de los estudios una significativa mejoría de los síntomas, y también del funcionamiento y calidad de vida. Es preciso realizar más estudios controlados y aleatorizados sobre su efectividad a largo plazo, y sobre su relación riesgo/beneficio y costes.
At least 10% of patients with Obsessive-compulsive Disorder (OCD) are refractory to psychopharmacological treatment. The emergence of new technologies for the modulation of altered neuronal activity in Neurosurgery, deep brain stimulation (DBS), has enabled its use in severe and refractory OCD cases. The objective of this article is to review the current scientific evidence on the effectiveness and applicability of this technique to refractory OCD.
MethodWe systematically reviewed the literature to identify the main characteristics of deep brain stimulation, its use and applicability as treatment for obsessive-compulsive disorder. Therefore, we reviewed PubMed/Medline, Embase and PsycINFO databases, combining the key-words ‘Deep brain stimulation’, ‘DBS’ and ‘Obsessive-compulsive disorder’ ‘OCS’. The articles were selected by two of the authors independently, based on the abstracts, and if they described any of the main characteristics of the therapy referring to OCD: applicability; mechanism of action; brain therapeutic targets; efficacy; side-effects; co-therapies. All the information was subsequently extracted and analysed.
ResultsThe critical analysis of the evidence shows that the use of DBS in treatment-resistant OCD is providing satisfactory results regarding efficacy, with assumable side-effects. However, there is insufficient evidence to support the use of any single brain target over another. Patient selection has to be done following analyses of risks/benefits, being advisable to individualize the decision of continuing with concomitant psychopharmacological and psychological treatments.
ConclusionsThe use of DBS is still considered to be in the field of research, although it is increasingly used in refractory-OCD, producing in the majority of studies significant improvements in symptomatology, and in functionality and quality of life. It is essential to implement random and controlled studies regarding its long-term efficacy, cost-risk analyses and cost/benefit.
La estimulación cerebral profunda (ECP) es una técnica de estimulación de las regiones subcorticales del cerebro cuyo uso se ha ido extendiendo en las últimas décadas en el tratamiento de trastornos neurológicos de tipo motor, tras el trabajo de Benabid et al.1. Implica la implantación estereotáxica de electrodos que emiten impulsos eléctricos cortos, generalmente de alta frecuencia, con el objetivo de modular el funcionamiento de determinados circuitos cerebrales. Las principales áreas cerebrales que han sido objeto de estimulación son: tálamo; núcleo subtalámico; núcleo accumbens; brazo anterior de la cápsula interna (ALIC); núcleo del lecho de la estría terminal (BNST), y cíngulo. Su objetivo es eliminar o al menos modular en dichas áreas, a través de la reconfiguración de la actividad de los circuitos y/o redes neuronales, los procesos patológicos de transmisión cerebral.
Los mecanismos de acción de la ECP no están todavía claros. Se postulan distintas opciones: i) inhibición funcional reversible de las estructuras cerebrales estimuladas, que sería secundaria al bloqueo por despolarización de las neuronas circundantes al electrodo, o de modificaciones de los canales iónicos de membrana celular; ii) depresión sináptica secundaria a la estimulación de los axones aferentes, con la consecutiva inhibición de la transmisión debida al agotamiento de trasmisores, e iii) inhibición neuronal mediada por la sinapsis debido a la excitación de los circuitos inhibitorios gabaérgicos aferentes2. En todo caso, se han implicado mecanismos bioquímicos, neurohormonales, neurofisiológicos celulares y de neuroplasticidad, que terminan modulando la actividad de circuitos neuronales. Conviene señalar, no obstante, que, si bien pueden observarse cambios en síntomas emocionales en pocos segundos o minutos, en la ECP, al igual que ocurre en los tratamientos farmacológicos, el efecto tarda habitualmente en manifestarse una o varias semanas. Este hecho no puede explicarse a través de mecanismos directos de estimulación o inhibición; más bien nos hace pensar en procesos de modulación a largo plazo de los sistemas neuronales mediante procesos plásticos de adaptación.
Mecanismos acción de la estimulación cerebral profunda en el trastorno obsesivo-compulsivo grave refractarioLa justificación científica de la aplicación de la ECP en el trastorno obsesivo-compulsivo (TOC) se basa en la aceptación de la hipótesis neurobiológica de que dichos trastornos se asocian a una hiperactividad e hiperconectividad en el circuito «cortico-estriado-pálido-talámico-cortical». Dicha disfunción neuronal se daría también, por ejemplo, en estructuras concretas como es el caso del núcleo accumbens, que actúa como puerta de entrada a los ganglios basales, constituyéndose en interfaz de los sistemas motor y límbico y jugando un papel significativo en el procesamiento de los mecanismos de «premio/castigo», que parecen tener un papel relevante en la génesis del TOC. En dicho contexto, la ECP actuaría como mecanismo de modulación funcional de la hiperactividad patológica de los circuitos y estructuras alteradas3,4.
Aun cuando los mecanismos de acción de la ECP en el TOC refractario no son totalmente conocidos y su análisis detallado exigiría realizar de manera específica una revisión sistemática de la literatura, parece oportuno mencionar aquí las posibles alternativas de mecanismos de acción más comúnmente citadas en la literatura. i) Mecanismos de «lesión funcional» con inhibición local. Las teorías iniciales acerca de los mecanismos de acción de la ECP se basaban en su equiparación con los efectos de las técnicas de ablación neuroquirúrgica utilizadas para el tratamiento de estos trastornos5. Según estas, la lesión, bien sea anatómica o bien «funcional», produciría una inhibición neuronal local a través de mecanismos tales como, por ejemplo, el bloqueo de la conducción neuronal, la depleción de neurotransmisores, o la activación de impulsos inhibitorios6-9. ii) Mecanismos de excitación local. Se ha visto, mediante modelos computacionales y también a través de estudios experimentales, que la ECP es dependiente de mecanismos de excitación neuronal a nivel del axón, que se asocian a inhibición del soma, en los núcleos estimulados9. Así, por ejemplo, el estudio de Tsai et al. ha demostrado que la ECP del núcleo subtalámico genera un incremento de la descarga en ciertas neuronas, que se cree debida a la activación de las vías aferentes glutamatérgicas10. De manera similar, Li et al. demostraron una activación antidrómica de las capas neuronales profundas del núcleo subtalámico durante la ECP11. Se ha visto también que la estimulación del núcleo accumbens produce una inhibición del córtex orbitofrontal9. iii) Mecanismos de modulación del patrón temporal de descarga. Distintos estudios han demostrado que en estos trastornos las áreas neuronales que parecen estar implicadas, por ejemplo el núcleo subtalámico o el globo pálido, tienden a presentar patrones anormales de descarga12. En esta situación se postula que el efecto de la ECP, más que producir una inhibición local, lo que haría es modular en dichos núcleos un patrón de respuesta neuronal alterado9,13,14. iv) Mecanismos de neurogénesis y plasticidad. Al igual que sucede en el tratamiento farmacológico, la efectividad del tratamiento con ECP tarda semanas e incluso meses en manifestarse15. Esto sugiere que su mecanismo de acción no puede estar simplemente basado en una modificación aguda de los procesos de excitación o inhibición o de los patrones de respuesta neuronal. Se postula así, como mecanismo alternativo, o al menos complementario, la presencia de procesos de neurogénesis y plasticidad que se darían fundamentalmente a nivel de estructuras hipocámpicas9, estando esta teoría también apoyada por la experimentación en animales16,17.
La aplicación de la ECP se ha extendido recientemente desde los trastornos motores, como es el caso de la enfermedad de Parkinson, a los trastornos psiquiátricos, principalmente al TOC grave refractario. Su uso se ha experimentado también de manera preliminar en otros trastornos como el trastorno depresivo grave, el síndrome de Gilles de la Tourette, los trastornos de la conducta alimentaria y los trastornos por abuso de sustancias.
Aplicación de la estimulación cerebral profunda en el trastorno obsesivo-compulsivo grave refractario al tratamientoEl TOC es un cuadro psiquiátrico que, con una prevalencia vida situada entre el 2 y el 3%, se caracteriza por la presencia de obsesiones y compulsiones. Las obsesiones incluyen pensamientos, imágenes o impulsos recurrentes que el paciente reconoce como propios pero que no puede controlar, causándole marcada angustia y sufrimiento. El paciente trata de neutralizar la ansiedad que le generan las obsesiones mediante el desarrollo de conductas repetitivas, denominadas compulsiones. Dichos síntomas causan un acentuado sufrimiento, y afectan de manera significativa su calidad de vida y nivel de funcionamiento, generándole una marcada discapacidad18,19.
A pesar del más óptimo de los tratamientos farmacológicos y cognitivo-conductuales, al menos un 10% de los pacientes con TOC pueden ser considerados como resistentes o refractarios al tratamiento20. En dichos pacientes se ha llevado a cabo con frecuencia intervenciones neuroquirúrgicas que, como la capsulotomía anterior bilateral o la cingulotomía, han demostrado poseer porcentajes de éxito que, expresados en reducciones en la puntuación de la escala Yale-Brown Obsessive Compulsive Scale (Y-BOCS), oscilan entre el 25 y el 60%21-23. Sin embargo, dichas intervenciones poseen el inconveniente de generar modificaciones irreversibles de la estructura cerebral. Por ello, recientemente, el énfasis terapéutico se está centrando en el desarrollo de estrategias terapéuticas basadas en neuromodulación neuronal, que implica la administración de estímulos eléctricos que provocan cambios en el funcionamiento neuronal24. Entre dichas estrategias, que incluyen por ejemplo la terapia electroconvulsiva o la estimulación magnética transcraneal, se encuentra de manera muy específica la ECP. Con ella, basándose en los conocimientos adquiridos en los tratamientos de lesión neuronal, se pretende provocar una «ablación funcional» mediante estimulación eléctrica, inicialmente aplicada en aquellas estructuras cerebrales que habían demostrado efectividad en los tratamientos quirúrgicos de ablación neuronal, y más recientemente en otras dianas cerebrales estudiadas. La ventaja de la aplicación de dicha estrategia terapéutica se centra no tanto en una mejora de la efectividad, sino en sus menores efectos secundarios y mayor aceptabilidad25,26. En esta línea, Nuttin et al. decidieron en 1999 aplicar —con notable éxito— la ECP en el ALIC, al tratamiento del TOC grave refractario al tratamiento5. Desde entonces distintos autores han adoptado con buenos resultados la ECP para el tratamiento del TOC refractario. De tal forma que, en los últimos años, diversas revisiones sistemáticas y estudios de metaanálisis20,24,26 aportan datos apoyando la efectividad de la ECP, la cual, actuando en diversas dianas cerebrales, consigue una proporción de respuesta (reducciones de Y-BOCS mayores del 35%) en pacientes con TOC refractario cercana al 60%, y con reducciones medias en la gravedad de la sintomatología obsesivo-compulsiva (medida con la escala Y-BOCS) cercanas al 50%.
La ECP fue aprobada en 2009 por la Food and Drug Administration de EE.UU. como una opción terapéutica para el TOC, obteniendo en el mismo año el Certificado de Aprobación por la CE.
Definición de trastorno obsesivo-compulsivo resistente/refractario al tratamientoSi bien hay autores que proponen que a la hora de establecer en el TOC la falta de respuesta terapéutica los términos de «resistente» y «refractario» han de ser claramente diferenciados, planteando, por ejemplo, que el concepto de refractario denota un mayor grado de resistencia terapéutica27, lo cierto es que en la literatura revisada se da una clara tendencia a utilizar ambos términos como sinónimos. Ello se da, con frecuencia, asociado en los distintos estudios a variaciones en los criterios clínicos que definen las distintas categorías de respuesta terapéutica. Dicha situación, que tiene claras implicaciones negativas tanto para la actividad clínica como para el proceso de investigación, ha tratado de ser resuelta por el International Treatment Refractory OCD Consortium estableciendo para los TOC unos criterios operativos de «no respuesta terapéutica»28. Para ello los autores establecieron, en primer lugar, los distintos niveles posibles de respuesta terapéutica, definiendo la «respuesta completa» como aquella que presenta un 35% o más de reducción sintomatológica en el Y-BOCS, y un valor en la Clinical Global Impression (CGI) de 1 o 2; la «respuesta parcial» como la que presenta una reducción en el Y-BOCS mayor del 25% pero menor del 35%; y la «no respuesta» como aquella en la que se da una reducción menor del 25% en el Y-BOCS y un CGI de 4. En segundo término, el grupo estableció los criterios operativos que permiten definir 10 niveles progresivos de severidad de la «no respuesta». Dichos niveles exigen la presencia de ensayos terapéuticos de progresiva complejidad con i) hasta 3 inhibidores selectivos distintos de la recaptación de serotonina a dosis suficientes y por un periodo de tiempo suficientemente largo (al menos 12 semanas), solos y en combinación con una estrategia de psicoterapia cognitivo-conductual (TCC) que incluya exposición y prevención de respuesta a lo largo de un mínimo de 20 sesiones; ii) la instauración de un ensayo terapéutico con, por lo menos, 3 inhibidores selectivos de la recaptación de serotonina, incluyendo clomipramina (con ensayos por vía intravenosa) y su combinación con TCC, y/o con otros antidepresivos (NSRI, IMAO); iii) el uso de estrategias de potenciación con neurolépticos solos y/o en combinación con estabilizadores del ánimo, y con psicoestimulantes durante periodos suficientemente prolongados de tiempo.
Finalmente, cabe indicar que a la hora de establecer la categoría de «TOC resistente/refractario al tratamiento», algunos autores plantean la incorporación de un criterio de temporalidad estableciendo la presencia de un periodo mínimo de 5 años29-31.
El objetivo de esta revisión sistemática es el de analizar la viabilidad y conveniencia de aplicar la ECP en el TOC.
MétodosRevisamos sistemáticamente la literatura, siguiendo el modelo PRISMA, para identificar artículos científicos que aportasen datos sobre el uso de la ECP en el TOC. Para ello se realizó una búsqueda en bases de datos electrónicas, incluyendo PubMed/Medline, Embase, y PsycINFO, usando una combinación de términos clave comprendidos en «deep brain stimulation», «DBS» y «obsessive compulsive disorder», «OCD». Las listas de bibliografía de revisiones previas fueron también inspeccionadas en la búsqueda de artículos adicionales.
La revisión de la literatura se limitó a aquellos artículos en inglés o español, realizados en humanos desde enero del año 2000 y hasta diciembre del año 2016. Los estudios fueron elegidos para esta revisión si cumplían los siguientes criterios: 1) artículos originales, tales como ensayos clínicos, estudios comparativos, o estudios multicéntricos, que presentaron datos de más de un paciente, y 2) estudios que aportaran datos cuantitativos o cualitativos sobre el uso de la ECP en TOC acerca de i) criterios de elegibilidad para el uso de la técnica; ii) evaluación de eficacia y outcome utilizando el Y-BOCS, en el pre y en el postoperatorio, y/o calidad de vida/funcionamiento; iii) dianas terapéuticas cerebrales, y/o iv) efectos secundarios.
No obstante, para la revisión de otros aspectos significativos de la ECP en el TOC, así como para la elaboración de la introducción y discusión de los resultados, se han utilizado también estudios científicos sobre el uso de la ECP en el TOC que no cumplían alguno de los criterios previamente mencionados, así como revisiones sistemáticas y metaanálisis previos.
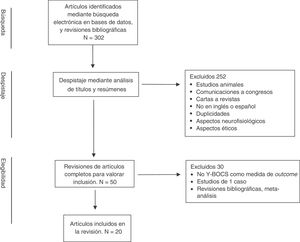
La búsqueda bibliográfica generó inicialmente un total de 302 artículos, los cuales fueron sometidos a un proceso multifásico de análisis (fig. 1). Los resúmenes de los artículos preseleccionados a partir de dicha búsqueda bibliográfica fueron revisados de manera independiente por 2 de los autores (JVB y JM), seleccionando aquellos en los que existía concordancia con los criterios de selección establecidos. Las discrepancias entre las 2 revisiones fueron resueltas a través de un nuevo proceso de valoración y toma de decisión realizada de forma conjunta. De esta manera se eliminaron 252 artículos debido, entre otros, a las siguientes aspectos: estudios en animales, abstracts de congresos y reuniones, duplicaciones, no utilización de inglés o español, focalización en aspectos neurofisiológicos o aspectos éticos, etc. En una segunda fase se llevó a cabo, mediante una revisión completa de los artículos seleccionados, un análisis cualitativo de la información contenida en ellos. Como consecuencia de dicho análisis se eliminaron 30 artículos que no incluían más de un paciente y/o no presentaban evaluaciones con Y-BOCS en el pre y postoperatorio y/o calidad de vida/funcionamiento, así como revisiones bibliográficas y metaanálisis.
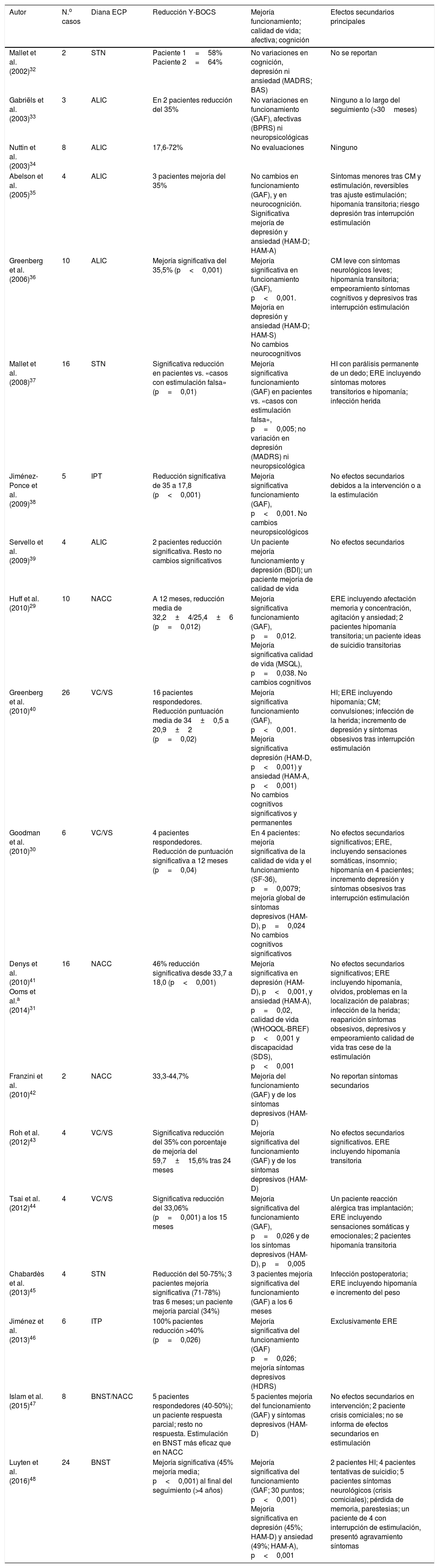
De esta manera se incluyeron finalmente para su revisión 20 artículos. El resumen de los artículos incluidos en esta revisión se presenta en la tabla 1.
Resumen de los artículos seleccionados
| Autor | N.o casos | Diana ECP | Reducción Y-BOCS | Mejoría funcionamiento; calidad de vida; afectiva; cognición | Efectos secundarios principales |
|---|---|---|---|---|---|
| Mallet et al. (2002)32 | 2 | STN | Paciente 1=58% Paciente 2=64% | No variaciones en cognición, depresión ni ansiedad (MADRS; BAS) | No se reportan |
| Gabriëls et al. (2003)33 | 3 | ALIC | En 2 pacientes reducción del 35% | No variaciones en funcionamiento (GAF), afectivas (BPRS) ni neuropsicológicas | Ninguno a lo largo del seguimiento (>30meses) |
| Nuttin et al. (2003)34 | 8 | ALIC | 17,6-72% | No evaluaciones | Ninguno |
| Abelson et al. (2005)35 | 4 | ALIC | 3 pacientes mejoría del 35% | No cambios en funcionamiento (GAF), y en neurocognición. Significativa mejoría de depresión y ansiedad (HAM-D; HAM-A) | Síntomas menores tras CM y estimulación, reversibles tras ajuste estimulación; hipomanía transitoria; riesgo depresión tras interrupción estimulación |
| Greenberg et al. (2006)36 | 10 | ALIC | Mejoría significativa del 35,5% (p<0,001) | Mejoría significativa en funcionamiento (GAF), p<0,001. Mejoría en depresión y ansiedad (HAM-D; HAM-S) No cambios neurocognitivos | CM leve con síntomas neurológicos leves; hipomanía transitoria; empeoramiento síntomas cognitivos y depresivos tras interrupción estimulación |
| Mallet et al. (2008)37 | 16 | STN | Significativa reducción en pacientes vs. «casos con estimulación falsa» (p=0,01) | Mejoría significativa funcionamiento (GAF) en pacientes vs. «casos con estimulación falsa», p=0,005; no variación en depresión (MADRS) ni neuropsicológica | HI con parálisis permanente de un dedo; ERE incluyendo síntomas motores transitorios e hipomanía; infección herida |
| Jiménez-Ponce et al. (2009)38 | 5 | IPT | Reducción significativa de 35 a 17,8 (p<0,001) | Mejoría significativa funcionamiento (GAF), p<0,001. No cambios neuropsicológicos | No efectos secundarios debidos a la intervención o a la estimulación |
| Servello et al. (2009)39 | 4 | ALIC | 2 pacientes reducción significativa. Resto no cambios significativos | Un paciente mejoría funcionamiento y depresión (BDI); un paciente mejoría de calidad de vida | No efectos secundarios |
| Huff et al. (2010)29 | 10 | NACC | A 12 meses, reducción media de 32,2±4/25,4±6 (p=0,012) | Mejoría significativa funcionamiento (GAF), p=0,012. Mejoría significativa calidad de vida (MSQL), p=0,038. No cambios cognitivos | ERE incluyendo afectación memoria y concentración, agitación y ansiedad; 2 pacientes hipomanía transitoria; un paciente ideas de suicidio transitorias |
| Greenberg et al. (2010)40 | 26 | VC/VS | 16 pacientes respondedores. Reducción puntuación media de 34±0,5 a 20,9±2 (p=0,02) | Mejoría significativa funcionamiento (GAF), p<0,001. Mejoría significativa depresión (HAM-D, p<0,001) y ansiedad (HAM-A, p<0,001) No cambios cognitivos significativos y permanentes | HI; ERE incluyendo hipomanía; CM; convulsiones; infección de la herida; incremento de depresión y síntomas obsesivos tras interrupción estimulación |
| Goodman et al. (2010)30 | 6 | VC/VS | 4 pacientes respondedores. Reducción de puntuación significativa a 12 meses (p=0,04) | En 4 pacientes: mejoría significativa de la calidad de vida y el funcionamiento (SF-36), p=0,0079; mejoría global de síntomas depresivos (HAM-D), p=0,024 No cambios cognitivos significativos | No efectos secundarios significativos; ERE, incluyendo sensaciones somáticas, insomnio; hipomanía en 4 pacientes; incremento depresión y síntomas obsesivos tras interrupción estimulación |
| Denys et al. (2010)41 Ooms et al.a (2014)31 | 16 | NACC | 46% reducción significativa desde 33,7 a 18,0 (p<0,001) | Mejoría significativa en depresión (HAM-D), p<0,001, y ansiedad (HAM-A), p=0,02, calidad de vida (WHOQOL-BREF) p<0,001 y discapacidad (SDS), p<0,001 | No efectos secundarios significativos; ERE incluyendo hipomanía, olvidos, problemas en la localización de palabras; infección de la herida; reaparición síntomas obsesivos, depresivos y empeoramiento calidad de vida tras cese de la estimulación |
| Franzini et al. (2010)42 | 2 | NACC | 33,3-44,7% | Mejoría del funcionamiento (GAF) y de los síntomas depresivos (HAM-D) | No reportan síntomas secundarios |
| Roh et al. (2012)43 | 4 | VC/VS | Significativa reducción del 35% con porcentaje de mejoría del 59,7±15,6% tras 24 meses | Mejoría significativa del funcionamiento (GAF) y de los síntomas depresivos (HAM-D) | No efectos secundarios significativos. ERE incluyendo hipomanía transitoria |
| Tsai et al. (2012)44 | 4 | VC/VS | Significativa reducción del 33,06% (p=0,001) a los 15 meses | Mejoría significativa del funcionamiento (GAF), p=0,026 y de los síntomas depresivos (HAM-D), p=0,005 | Un paciente reacción alérgica tras implantación; ERE incluyendo sensaciones somáticas y emocionales; 2 pacientes hipomanía transitoria |
| Chabardès et al. (2013)45 | 4 | STN | Reducción del 50-75%; 3 pacientes mejoría significativa (71-78%) tras 6 meses; un paciente mejoría parcial (34%) | 3 pacientes mejoría significativa del funcionamiento (GAF) a los 6 meses | Infección postoperatoria; ERE incluyendo hipomanía e incremento del peso |
| Jiménez et al. (2013)46 | 6 | ITP | 100% pacientes reducción >40% (p=0,026) | Mejoría significativa del funcionamiento (GAF) p=0,026; mejoría síntomas depresivos (HDRS) | Exclusivamente ERE |
| Islam et al. (2015)47 | 8 | BNST/NACC | 5 pacientes respondedores (40-50%); un paciente respuesta parcial; resto no respuesta. Estimulación en BNST más eficaz que en NACC | 5 pacientes mejoría del funcionamiento (GAF) y síntomas depresivos (HAM-D) | No efectos secundarios en intervención; 2 paciente crisis comiciales; no se informa de efectos secundarios en estimulación |
| Luyten et al. (2016)48 | 24 | BNST | Mejoría significativa (45% mejoría media; p<0,001) al final del seguimiento (>4 años) | Mejoría significativa del funcionamiento (GAF; 30 puntos; p<0,001) Mejoría significativa en depresión (45%; HAM-D) y ansiedad (49%; HAM-A), p<0,001 | 2 pacientes HI; 4 pacientes tentativas de suicidio; 5 pacientes síntomas neurológicos (crisis comiciales); pérdida de memoria, parestesias; un paciente de 4 con interrupción de estimulación, presentó agravamiento síntomas |
ALIC: brazo anterior cápsula interna; BAS: Brief Anxiety Scale; BDI: Beck Depression Inventory; BNST: núcleo del lecho de la estría terminal; BPRS: Brief Psychiatric Rating Scale; CGI: Clinical Global Impression; CM: complicaciones derivadas del fallo del material; ECP: estimulación cerebral profunda; ERE: efectos reversibles de la estimulación; GAF: Global Assessment of Functioning; HAM-A: Hamilton Anxiety Scale; HAM-D: Hamilton Depression Scale; HDRS: Hamilton Depression Rating Scale; HI: hemorragia intracraneal; ITP: pedúnculo talámico inferior; MADRS: Montgomery and Asberg Depression Rating Scale; MSQL: Modular System of Quality of Life; NACC: núcleo accumbens; SDS: Sheehan Disability Scale; SF-36: 36-Item Short Form Health Survey; STN: núcleo subtalámico; VC/VS: cápsula ventral/estriado ventral; WHOQOL-BREF: WHO Quality of Life Brief; Y-BOCS: Yale-Brown Obsessive Compulsive Scale.
Desde 1999 se han publicado numerosos estudios describiendo la aplicación de la ECP en casos de TOC. A partir de ellos se puede concluir que las estructuras diana comúnmente seleccionadas para la ECP han sido: i) el ALIC; ii) el núcleo accumbens; iii) el núcleo subtalámico; iv) la cápsula ventral/estriado ventral; v) el pedúnculo talámico inferior, y vi) el BNST. A continuación revisaremos la efectividad de la ECP en cada una de dichas estructuras cerebrales.
Brazo anterior de la cápsula interna (ALIC)Se trata de la parte anterior de la cápsula interna, que se sitúa entre la cabeza del núcleo caudado y el núcleo lenticular y cuyas fibras conectan el córtex prefrontal y el tálamo dorsomedial. Fue esta una de las estructuras neuronales sobre la que se realizaron en el pasado las técnicas de ablación neuroquirúrgica, siendo Nuttin et al. los primeros en substituir en ella, con buenos resultados, la aplicación de dichas técnicas de ablación por la ECP5. Desde entonces esta estructura ha sido seleccionada para la ECP en otros estudios20,26,33-36,39,48,49. En ellos se observaron porcentajes de mejoría que oscilan entre el 35 y el 79% de reducción Y-BOCS. Los mecanismos de acción a través de los que la ECP de la ALIC actúa en el tratamiento de los TOC son inciertos, pero podrían incluir una modulación de los circuitos talamocorticales y de los ganglios basales50. Sin embargo, un estudio reciente atribuye parte del efecto de la estimulación en el ALIC a la estimulación del BNST, e incluso proponen esta diana terapéutica como más eficaz que el ALIC48.
Núcleo accumbensSituado por debajo del ALIC, entre la porción anterior del putamen y la cabeza del núcleo caudado, permite estimular al mismo tiempo el núcleo accumbens y el ALIC. Además, con frecuencia los términos de núcleo accumbens y ventral estriado se utilizan como intercambiables para referirse a la confluencia del putamen con el caudado. Este núcleo ha sido seleccionado como «diana» para la ECP por su papel en el origen del TOC, a través de su mediación en la disfunción del sistema de recompensa49.
Se han identificado 4 estudios que incluían 32 pacientes con TOC refractario que habían sido tratados con ECP de este núcleo29,41,42,47. En ellos se encontró que la ECP producía una reducción significativa de la sintomatología obsesiva. Reducción que, por ejemplo, en el estudio de Denys et al. alcanzaba el 46% de la Y-BOCS41. Este estudio, además, ha sido catalogado como el único que demuestra la efectividad de la ECP bilateral del núcleo accumbens con un Nivel II de evidencia científica15. Y es además particularmente interesante porque demuestra a su vez un incremento de la respuesta cuando la ECP se combina con TCC.
Área ventral de la cápsula/Núcleo ventral del estriadoEl área estriatal ventral incluye el núcleo caudado ventral y el núcleo accumbes, los cuales junto con la capsula ventral se han denominado como «área ventral de la cápsula/ventral del estriado». Se cree que está implicada en los mecanismos psicológicos de «premio-castigo» y de la motivación. Se han identificado 4 estudios que incluían 38 pacientes refractarios al tratamiento tratados con ECP de esta estructura cerebral30,40,43,44, observando una media del 50% de respondedores, y alcanzando una reducción media del 41,5% de la Y-BOCS inicial, tras 12-36meses de seguimiento. Además, se ha observado recientemente que esta mejoría en la sintomatología obsesiva se mantiene a largo plazo51.
Núcleo subtalámicoEl núcleo subtalámico es una estructura que forma parte de los ganglios basales y se sitúa en proximidad al tálamo, sustancia negra y el tracto corticoespinal. Tradicionalmente se ha defendido que dicha estructura estaba exclusivamente involucrada en el control de los movimientos motores voluntarios, sin embargo, se ha visto que su estimulación mediante ECP es efectiva también en el tratamiento del TOC. En dicho caso, no obstante, los electrodos se sitúan de manera más medial que en el caso del tratamiento de la enfermedad de Parkinson, lo cual refleja la conveniencia de situar dichos electrodos en la parte límbica de dicho núcleo50. Se han identificado 3 estudios que incluían 22 pacientes, y en los que se consiguen disminuciones en la sintomatología obsesiva de entre el 50 y el 78% de la Y-BOCS32,37,45. De entre esos estudios, es de especial relevancia el de Mallet et al. por utilizar un diseño «doble ciego cruzado aleatorizado» sobre una muestra de 16 pacientes con TOC que recibieron alternativamente tratamiento de «ECP falsa» y «ECP real»37. Dicho estudio ha sido valorado como el único que demuestra la efectividad de la ECP en el TOC refractario con Nivel I de evidencia científica15.
Pedúnculo inferior talámicoSe trata de una estructura de conexión entre el córtex orbitofrontal y el tálamo. Se han identificado tan solo 2 estudios con un total de 11 pacientes, lo cual ha sido también constatado en 2 recientes revisiones38,46. En dichos estudios el nivel de mejoría sintomatológica tras la ECP, medida mediante la Y-BOCS, se sitúa entre el 40 y el 82,5%. No obstante, los autores plantean los resultados como tentativos dado el limitado número de pacientes tratados.
Núcleo del lecho de la estría terminal (BNST)El BNST es una estructura de la amígdala que ha sido implicada, en estudios previos sobre modelos animales, en conductas compulsivas, estrés y ansiedad. Se han identificado 2 estudios que incluyen en total 28 pacientes47,48. Luyten et al. (2016)48 describen la estimulación del área ALIC/BNST en 24 pacientes con TOC refractario, observando reducciones significativas a largo plazo (4 años; n=17) en Y-BOCS (reducción media del 66%), así como en sintomatología ansioso-depresiva medida por las escalas Hamilton de Ansiedad y Depresión (58% en HAM-A y 67% en HAM-D). Estos niveles de mejoría se mantienen a más largo plazo52, con porcentajes de respuesta del 65 y 60% tras 6 años (n=17) y 9 años (n=10) de seguimiento, respectivamente, concluyendo además que la BNST puede ser una mejor diana, comparada con la ALIC, en el tratamiento del TOC refractario48. En el trabajo de Islam et al. se describe el resultado del tratamiento de 8 pacientes con TOC resistente mediante la ECP del BNST (n=4) y al núcleo accumbens (n=4), observando un porcentaje de respuesta del 62,5% (mejorías mayores del 35% en Y-BOCS)47, y concluyen también tras el análisis individual de casos que aquellos pacientes con estimulación del BNST obtuvieron mejores resultados que aquellos con ECP en el núcleo accumbens.
Valoraciones global y comparativa de la efectividad de la estimulación cerebral profunda según la estructura neuronal dianaHamani et al. realizan un análisis crítico de la evidencia existente sobre la aplicación de ECP en TOC refractario15. De los 353 estudios inicialmente revisados, extrajeron los de mayor evidencia científica (n=7), y de ellos tan solo encontraron 3 con Nivel I o II29,37,41, concluyendo que:
- i)
Existe un Nivel I de evidencia científica, basado exclusivamente en el estudio de Mallet et al.37, para el uso de ECP bilateral del núcleo subtalámico.
- ii)
Existe un Nivel II de evidencia científica, basado exclusivamente en el estudio de Denys et al.41, para el uso de ECP bilateral del núcleo accumbens.
- iii)
No existe evidencia científica que demuestre la efectividad de la ECP unilateral del núcleo accumbens29. Y la menor efectividad de la estimulación unilateral del núcleo accumbens en comparación con la bilateral ha sido también demostrada en el trabajo de Blomstedt et al.53.
No obstante, hay que mencionar que, como conclusión de distintas revisiones sistemáticas de la literatura realizadas en los últimos años, se puede plantear que no disponemos de datos suficientes para determinar si existe una diana cerebral óptima respecto a las demás, en términos de efectividad en la reducción sintomatológica en el TOC tras la ECP20,26,49,50,53, debiéndonos además plantear si pudiese haber diferentes dianas óptimas para diferentes pacientes con TOC resistente54. En los trabajos revisados se describen reducciones significativas en la gravedad de la sintomatología que, por ejemplo, en el caso de la estimulación del núcleo subtalámico y del estriado, se sitúan en torno al 40% de la Y-BOCS, al igual que sucede en la estimulación del ALIC20. Interesantemente, De Koning et al. describen que la efectividad de la estimulación del núcleo accumbens se relacionaba con la estimulación de aquellos electrodos que estaban próximos al ALIC, lo cual hace pensar que en dicho estudio se estimulaban ambas estructuras49. Todo ello apoya la idea de que, como plantean Lipsman et al.50, las distintas estructuras seleccionadas para la ECP en el TOC participan en el mismo circuito cortico-estriado-talámico-cortical. Así, aun cuando desde el punto de vista estructural e histológico dichas estructuras sean diferentes, lo cierto es que no solo se sitúan en clara proximidad, sino que además se encuentran funcionalmente enlazadas mediante un rico sistema de fibras aferentes y eferentes. Este hecho, como plantean Alonso et al.26, podría explicar el «efecto a distancia» que la ECP tiene en la anormal conectividad neuronal que se da en el circuito cortico-estriado-talámico-cortical involucrado en el TOC, y también la similitud en la respuesta clínica que se obtiene estimulando cada una de ellas.
De especial interés es el reciente metaanálisis realizado por Kisely et al.24, utilizando la estrategia de evaluación Cochrane, dirigido específicamente a analizar el efecto de la ECP en el TOC, en estudios que analizan, con un diseño doble ciego, la comparación entre «ECP real» y «ECP falsa». Este análisis constata que la ECP produce un efecto significativo en la reducción de la sintomatología del TOC medida con la Y-BOCS. No obstante, dicha reducción que alcanza un valor medio de 9 puntos ha de ser vista en opinión de los autores como una reducción sintomatológica parcial24. Por todo ello las conclusiones sobre la efectividad de la ECP han de ser tomadas con precaución debido, en gran medida, a la escasez de trabajos realizados utilizando una metodología doble-ciego aleatorizada y a las limitaciones metodológicas que persisten en la actualidad en esta área15,55. Entre ellas cabe destacar la imprecisión existente en el conocimiento de:
- i)
Los criterios que definen en el TOC los «casos candidatos» a ECP.
- ii)
La efectividad de la ECP en los distintos núcleos y estructuras neuronales, a partir de la que seleccionar las estructuras diana idóneas para la ECP, según el perfil clínico de los pacientes con TOC.
- iii)
Los parámetros de estimulación que resultan más eficaces.
- iv)
Los criterios de «respuesta», «remisión» y «recuperación» sintomatológica que es preciso aplicar en estos ensayos clínicos.
Por todos estos factores, una gran parte de las revisiones que analizan la efectividad de la ECP en el tratamiento del TOC refractario plantean la necesidad de estandarizar de manera precisa dicha estrategia terapéutica, y la sitúan como «tratamiento muy prometedor pero todavía en fase experimental»15,20,24,49,50,53,55. En esta situación resulta esencial establecer un registro de los casos que reciben ECP en el que se recojan de manera estandarizada las variables clave relacionadas tanto con el historial clínico de los pacientes y el procedimiento de la técnica como con la medida y evaluación del outcome y las consecuencias de dicha intervención26,55.
Efecto sobre el funcionamiento y la calidad de vida de los pacientes y aceptabilidad de la estimulación cerebral profundaComo especifica Katschin (2006)56, el éxito de una intervención terapéutica no ha de estar limitado en exclusiva a la eliminación o reducción de los síntomas clínicos, sino que ha de incorporar también la mejoría del funcionamiento y la calidad de vida. Ello es especialmente relevante en tratamientos a largo plazo en los que, como ocurre con la ECP, es importante evaluar la medida en que las mejorías sintomatológicas repercuten en la calidad de vida de los pacientes en contraposición a posibles inconvenientes de la intervención terapéutica. En consecuencia con ello, y como podemos ver en la tabla 1, la práctica totalidad de los estudios incluidos en esta revisión han evaluado el impacto que la ECP tiene sobre la calidad de vida y el funcionamiento de pacientes con TOC resistente. Así, por ejemplo, Huff et al.29 obtuvieron un incremento significativo de la calidad de vida, medida mediante el Modular System of Quality of Life (MSLQ), de 41,3±15,8 a 53,2±19,8 en una serie de 9 pacientes que recibieron una estimulación durante un año del núcleo de la cápsula ventral/estriado ventral. De manera similar, Goodman et al.30 encontraron un incremento significativo de la calidad de vida, expresado a través de puntuaciones en la escala SF-36, después de un año de estimulación del ALIC. Finalmente, Ooms et al. (2014)31 detectaron, en una serie de pacientes que recibieron una estimulación del núcleo accumbens durante un periodo de 3 a 5 años, una mejoría significativa (90%) en la puntuación global de calidad de vida medida mediante la WHO Quality of Life Scale (WHOQOL), dándose también en dichos pacientes mejorías significativas en distintos dominios de dicha escala. De manera similar, la mayoría de los estudios incluyen como medida adicional de outcome y de efectividad de la ECP la evaluación del funcionamiento, utilizando generalmente como instrumento de medida el Global Assessment of Functioning (GAF), y observándose en la práctica totalidad de ellos una mejoría significativa del funcionamiento (tabla 1). Así, por ejemplo, en 2 de dichos estudios, comparando la efectividad al implantar sobre el BNST frente a otras dianas (cápsula interna [IC], ALIC)48,52, se observa globalmente una mejoría significativa y mantenida a largo plazo en el funcionamiento medido con la escala GAF, con medias de mejoría de 30 puntos (sobre un basal medio de 35).
La efectividad de la ECP, tanto en términos sintomatológicos como en la calidad de vida, en el TOC resistente, no justifica por sí sola la mayor popularidad de dicha estrategia terapéutica cuando se la compara con las técnicas de ablación neuroquirúrgica, en las que también se ha podido demostrar no solo una efectividad similar, sino incluso que sus efectos secundarios podían en líneas generales ser considerados como equivalentes a los de la ECP25. Es así que, como el trabajo de revisión de Pepper et al.25 comparando ambas técnicas ha podido demostrar, la preferencia de la ECP sobre las técnicas de ablación no es debida a una superior efectividad clínica, sino a su mayor aceptabilidad por parte de los pacientes y también de los profesionales. Uno de los elementos principales que determinan esta mayor aceptabilidad es la no producción de una lesión definitiva, adquiriendo así la ECP la condición de reversibilidad54.
Respuesta y aspectos relacionadosDefinición de respuestaNo existe una definición precisa o indicadores fiables de respuesta y recuperación. En la literatura revisada se describen definiciones distintas de respuesta dependiendo de que el estudio sea «abierto no aleatorizado» o «doble ciego».
En la mayoría de los estudios «abiertos no aleatorizados» se define respuesta en TOC cuando se da una mejoría del 35% o más en las puntuaciones Y-BOCS al compararlas con las puntuaciones basales. Respuesta parcial queda definida como aquella mejoría que se sitúa entre el 20 y el 35% de la puntuación Y-BOCS15,49.
En estudios «doble ciego» se suele definir como respuesta cuando la mejoría que se da en el grupo bajo tratamiento alcanza al menos un 25% de reducción de puntuación Y-BOCS y es además significativamente diferente a la que se da en el grupo que recibe tratamiento placebo15.
Existen también estudios que incorporan en la definición de respuesta a la ECP otras medidas de outcome como son la calidad de vida, el grado de recuperación funcional, o el nivel de discapacidad26,29,31,41.
Retraso en la respuesta a la estimulación cerebral profundaEl marco temporal en el que se instaura el efecto de la ECP está todavía sin precisar. En concreto, los resultados de las revisiones realizadas sobre distintos estudios tienden a demostrar que, al igual que ocurre en el tratamiento farmacológico, la respuesta a la ECP tarda tiempo en manifestarse (entre una semana y meses) y se incrementa a lo largo del tiempo15. Como ya hemos indicado, este hecho hace pensar en que su mecanismo de acción pudiera basarse en mecanismos de neurogénesis y plasticidad neuronal. Ello tiene también relevancia a la hora de establecer comparaciones entre estudios y también comparaciones entre las fases de los ensayos que incorporan un diseño cruzado con intervención on/off (intervención/suspensión/reinstauración), dado que en ellos se puede producir contaminación de los resultados por el «efecto de arrastre» o «efecto remanente» del tratamiento en la fase sin tratamiento.
Predicción de respuestaPor el momento no se han descrito factores predictores de respuesta a la ECP en el TOC refractario. No obstante, algunos autores han descrito en sus estudios datos que parecen apoyar una posible predicción de respuesta. Así, por ejemplo, se ha descrito que la aparición de risas inmotivadas durante el procedimiento quirúrgico de implantación y durante la estimulación eléctrica inicial parecían actuar como predictores de una buena respuesta49,57. Más aun, se ha visto una correlación entre la aparición de intensa risa inmotivada y una mayor reducción de las puntuaciones Y-BOCS 2 años después de la implantación de los electrodos. Se ha visto también, en un estudio sobre ECP de la cápsula ventral/estriado ventral, que el metabolismo preimplantación en determinadas áreas del córtex cingulado estaba significativamente relacionado con el outcome terapéutico58. También, la frecuencia del impulso en la estimulación eléctrica parece ser un factor predictor capaz de determinar la efectividad de la ECP49. Por último, un reciente estudio describe una mejor respuesta en aquellos casos que presentaron una mayor edad de inicio del TOC, así como la presencia de un patrón de clínica obsesivo-compulsiva de tipo sexual/religioso26.
Evaluación de la efectividad de la estimulación cerebral profunda en el trastorno obsesivo-compulsivo grave refractarioEscalas para la medida de la gravedad del trastorno obsesivo-compulsivoComo se constata en las revisiones sistemáticas realizadas, la mayoría de los estudios utilizan para la medida de la gravedad de la sintomatología obsesiva y para el análisis de la respuesta al tratamiento la escala Y-BOCS20,21,24-26,59,60.
Otras escalas psicopatológicasDebido a la frecuente comorbilidad con los trastornos afectivos, la mayoría de estudios (tabla 1) incluyen escalas que miden síntomas de depresión y ansiedad.
Escalas de funcionamiento cognitivoEn los distintos estudios se aplica de manera sistemática una batería de pruebas neuropsicológicas: coeficiente intelectual; aprendizajes visual y verbal; razonamiento conceptual; flexibilidad mental, y velocidad de procesamiento29,32,33,37,38.
Escalas de calidad de vidaLa efectividad de las intervenciones debe medirse también por cambios en la calidad de vida y el funcionamiento56. En línea con este planteamiento, en la actualidad los estudios que analizan la efectividad de la ECP en el TOC refractario incorporan también medidas de evaluación de estos dominios26,29-31,41, como la escala WHO Quality of Life Scale-Brief Version (WHOQOL-BREF).
Escalas de funcionamiento psicosocial y discapacidadSe suelen utilizar además de manera general medidas genéricas del nivel de funcionamiento psicosocial, como son las escalas GAF, CGI o la Sheeham Disability Scale24,31. Así, como podemos apreciar en la tabla 1, la práctica totalidad de los estudios evalúan el funcionamiento utilizando para ello el GAF.
Terapias concomitantesEn líneas generales, en la aplicación de la ECP a los TOC refractarios, se tiende a mantener los tratamientos tanto farmacológicos como psicológicos y a valorar su dosificación dependiendo de la respuesta del paciente.
Tratamiento farmacológicoHabitualmente, el tratamiento farmacológico se reduce progresivamente hasta su discontinuación total alrededor de 2 semanas antes de la intervención quirúrgica31. De esta manera se reduce el posible riesgo de sangrado que se ha descrito asociado al uso de antidepresivos serotoninérgicos en pacientes en el ámbito perioperatorio61-63. Después de la intervención puede reinstaurarse el tratamiento hasta el nivel habitual. Posteriormente se ajusta el tratamiento farmacológico dependiendo de la respuesta a la ECP y de las necesidades clínicas31,36. En algunos casos puede incluso llegar a suprimirse de manera total el tratamiento previo.
Tratamiento psicoterapéuticoAlgunos autores han descrito en sus series el mantenimiento, tras la ECP, de las intervenciones psicoterapéuticas, fundamentalmente la TCC, que se estaban previamente aplicando36. Es más, se ha visto en algunos estudios que la utilización conjunta de ECP con TCC se asocia a un significativo incremento de la respuesta terapéutica31,41. Dado que el criterio de «TOC refractario» implica una falta de efectividad también a la TCC, el que tras la ECP la TCC sea efectiva parece sugerir que dicha estimulación sensibilizaría al sistema neuronal, propiciando la efectividad de la intervención psicológica en la modificación de la conducta obsesiva20.
Otros estudios recientes han descrito que la administración conjunta de TCC con ECP del núcleo accumbens se asociaba a una mejoría a los 3 años, que se expresaba fundamentalmente en los dominios físico y psicológico y parecía estar relacionada más con la reducción de sintomatología de ansiedad y depresión que con los propios síntomas obsesivos31. Asimismo, se ha demostrado que la combinación de ECP con TCC resultaba ser la estrategia idónea para el tratamiento de dichos pacientes, actuando además la ECP como mecanismo facilitador de la efectividad de la TCC64. Con base en dichos resultados los autores concluyen que ambas estrategias terapéuticas actúan de forma complementaria64, siendo por lo tanto recomendable su uso conjunto en el tratamiento de estos pacientes.
Efectos secundarios de la estimulación cerebral profunda en el trastorno obsesivo-compulsivo grave refractarioLos efectos secundarios descritos en la aplicación de la ECP en los trastornos psiquiátricos son frecuentes, pero normalmente reversibles. Pueden clasificarse en los siguientes apartados: i) complicaciones de la intervención quirúrgica; ii) complicaciones relacionadas con los instrumentos; iii) complicaciones derivadas de la propia estimulación.
Complicaciones de la intervención quirúrgicaHoy en día las complicaciones secundarias a la intervención quirúrgica suelen ser escasas. Aun así pueden presentarse como consecuencia de la propia introducción del electrodo, provocando por ejemplo, en el peor de los casos, hemorragias que produzcan síntomas neurológicos focales, situándose la frecuencia de estos efectos secundarios en los distintos estudios en entre el 0,2 y el 5% de las intervenciones quirúrgicas2,20,49,65. En este sentido se ha descrito, a partir de estudios observacionales de cohortes y de casos-control, un mayor riesgo de sangrado asociado al uso de fármacos antidepresivos serotoninérgicos por un posible efecto antiagregante61-63, de tal forma que se recomienda su suspensión previa a la intervención quirúrgica. Raras son también las infecciones postoperatorias asociadas al electrodo implantado, las reacciones inmunológicas a los electrodos o los errores en la implantación de los electrodos2,20,49.
Complicaciones relacionadas con los instrumentosSe refiere a las complicaciones relacionadas con fallos técnicos del propio material, como pueden ser la rotura de elementos del aparato de ECP o fallos en el neuroestimulador. Dichas complicaciones, aunque con anterioridad alcanzaban al 8% de los casos, hoy en día gracias a las mejorías técnicas suelen ser muy raras2,20,49. Vora et al. revisaron las consecuencias de los fallos en la batería del neuroestimulador, describiendo la presencia de síntomas como inquietud, fatiga, alteraciones del afecto y ataques de pánico66.
Complicaciones derivadas de la propia estimulaciónEste tipo de complicaciones suelen ser frecuentes, aunque variables y dependientes de la estructura seleccionada para la estimulación. Por lo general suelen ser reversibles mediante el ajuste de los parámetros de estimulación. Pueden dividirse en a) complicaciones agudas o inmediatas a la estimulación, y b) complicaciones de la estimulación crónica.
- a)
Complicaciones agudas o inmediatas a la estimulación. En ocasiones se producen, de manera inmediata a la estimulación, síntomas neurológicos leves, como es el caso de discinesias, disartria, etc., los cuales remiten tras los ajustes en el patrón de la estimulación. Así, por ejemplo, se han descrito la presencia de sensaciones olfativas, gustativas y motoras, así como de respuestas fisiológicas que en su caso se asociaban de manera significativa con la posición ventral del electrodo67. También se han comunicado cambios agudos de la afectividad durante los primeros días de la estimulación eléctrica, sobre todo en el núcleo accumbens, el ALIC y el núcleo subtalámico, los cuales son, por lo general, transitorios y reversibles. Tal es el caso de la aparición de alteraciones de la conducta, labilidad emocional, síntomas depresivos o síntomas de ansiedad2,20,37,49. Los episodios transitorios de hipomanía son el efecto secundario que con más frecuencia aparece de manera inmediata tras la estimulación eléctrica. Su frecuencia se sitúa en entre el 50 y el 67% de los casos de ECP del ALIC y núcleo accumbens, descendiendo hasta cifras comprendidas entre el 4 y el 8% de los casos de ECP del núcleo subtalámico2,20,37,49, habiéndose descrito también un caso de progresión a manía tras estimulación de BNST68.
- b)
Complicaciones a largo plazo de la estimulación. Las complicaciones secundarias a la estimulación se pueden incluir en las 2 categorías de alteraciones afectivas y cognitivas. Alteraciones afectivas. La ECP crónica del TOC refractario produce modificaciones afectivas que aunque no son directamente buscadas resultan beneficiosas para el cuadro psíquico del paciente. Tal es el caso de la mejoría en el estado de ánimo, la cual resulta especialmente beneficiosa en la medida en que un alto número de pacientes con TOC refractario al tratamiento presentan clínica depresiva comórbida. Así, por ejemplo, distintos autores han obtenido una mejoría de la depresión tras la estimulación del ALIC, del estriado ventral/cápsula ventral y del núcleo accumbens30,36,39-42,49. Dicho efecto antidepresivo parece relacionarse con la estimulación del estriado ventral, no dándose dicho efecto en la estimulación del núcleo subtalámico37,41,49. Al igual que ocurre con los efectos secundarios a la estimulación aguda, un efecto secundario frecuente de la estimulación crónica es la hipomanía20. En algunos estudios se ha observado la aparición, o el incremento, de síntomas de depresión y de ideas de suicidio20. También se ha visto que el cese de la estimulación provoca en algunos pacientes un empeoramiento o reaparición de los síntomas obsesivos y del estado afectivo el cual, no obstante, se recupera al reinstaurar la ECP35,36,40,48,69,70. Se han descrito también de manera secundaria a modificaciones en los parámetros de estimulación, o en situaciones de agotamiento de la batería, incrementos agudos de síntomas de ansiedad e irritabilidad, los cuales se resuelven también tras el reajuste de dichos parámetros o tras el recambio de la batería. Lo que no está claro, como indican Ooms et al. (2014)31, es si este recrudecimiento de la sintomatología se daría también cuando la interrupción de la estimulación es gradual y no brusca. Efectos sobre la cognición. La posible presencia de alteraciones cognitivas secundarias a la aplicación de ECP en trastornos psiquiátricos ha sido ampliamente investigada sin que se hayan detectado efectos significativos o permanentes2,20,24,36,49. Algunos estudios han descrito la presencia de síntomas cognitivos leves, transitorios y relativamente inespecíficos26,41,49.
Un elemento central en el tratamiento con ECP del TOC refractario es el de la selección de pacientes candidatos. El trabajo de Garnaat et al. analiza esta problemática de manera muy específica, sentando las bases para la selección del paciente candidato a ECP71. Los distintos ensayos clínicos hasta la fecha han utilizado los siguientes criterios de inclusión/exclusión.
Criterios de inclusiónNo existen criterios fiables y universalmente aceptados sobre los que basar la selección de pacientes con «TOC refractario al tratamiento» como candidatos para la ECP. No obstante, en los trabajos revisados se tiende a utilizar, para la selección de los pacientes, los siguientes criterios:
- i)
Edad: superior a los 18 años.
- ii)
Gravedad sintomatológica:
- a.
Severidad de la psicopatología: el mínimo nivel de severidad psicopatológica que se suele exigir es el de una puntuación mayor de 28 en la Y-BOCS36,53. Sin embargo, en la mayoría de los estudios la puntuación media en la Y-BOCS es superior a los 30 puntos53.
- b.
Duración del cuadro: se suele exigir que el TOC refractario tenga una duración superior a los 5 años31,36,53. Sin embargo, la duración media de los pacientes incluidos en los estudios suele superar los 20 años36,53.
- iii)
Afectación funcionamiento: algunos estudios incluyen la dimensión «afectación del funcionamiento», caracterizada por una puntuación menor de 40 en la escala GAF y una puntuación superior a 4 en la escala CGI37.
- iv)
Resistencia al tratamiento (TOC refractario): aun cuando, como hemos visto previamente, no se han establecido criterios precisos y universalmente aceptados para definir el concepto de «TOC refractario», sí existe en la literatura una cierta uniformidad en los criterios que se han utilizado para delimitar dicha categoría nosológica y en función de ella seleccionar a los pacientes candidatos a ECP31,36. Dichos criterios son:
- a.
Ausencia de respuesta clínica significativa, al menos a 3 tentativas de tratamiento farmacológico a dosis máximas y por un periodo adecuado de duración (superior a 3 meses). De entre dichas intervenciones terapéuticas al menos una ha de incorporar un inhibidor selectivo de la recaptación de serotonina y otra un ensayo terapéutico con clomipramina.
- b.
Fracaso de una prueba de potenciación farmacológica, por ejemplo con un antipsicótico atípico, litio, buspirona, etc.
- c.
Ausencia de respuesta clínicamente significativa a un tratamiento psicológico, que incluya al menos 20 sesiones de TCC, y que haya sido realizado por un terapeuta convenientemente entrenado.
Se utilizan como criterios de exclusión, entre otros, los siguientes rasgos clínicos: i) antecedentes de psicosis o manía previos, o en todo caso en los 3 últimos años; ii) claro riesgo de suicidio; iii) dependencia a sustancias; iv) trastorno severo de la personalidad; v) trastorno dismorfofóbico; vi) anormalidad clínica significativa o trastorno neurológico significativo, e vii) incapacidad de establecer una adecuada adherencia terapéutica o de seguir las exigencias del tratamiento de ECP36. Es oportuno señalar aquí que en el trabajo de Gabriëls et al. (2003)33 se concluye que la presencia de un trastorno somatomorfo podría ser un criterio adicional de exclusión, hecho que no obstante no ha sido confirmado en otros estudios.
Procedimiento de aplicación de la estimulación cerebral profunda en el trastorno obsesivo-compulsivo grave refractarioEl procedimiento de aplicación de la ECP en los pacientes con trastorno psiquiátrico es, en líneas generales, el mismo que el que se usa en los trastornos del movimiento. Se inicia con una RMN planificadora, seguida de la implantación de la guía estereotáxica utilizando sedación y anestesia local y acompañada de tomografía axial computarizada intraoperatoria. A partir de los datos obtenidos y teniendo en cuenta el atlas estereotáxico se seleccionan las estructuras neuronales diana en las que se ha de implantar el electrodo. El establecimiento inicial de los parámetros de estimulación se decide de manera empírica, siendo posteriormente ajustados dependiendo de la respuesta clínica. Los parámetros iniciales oscilan entre amplitud de corriente desde 1 a 6V; duración del impulso de 60 a 200us, y frecuencia del estímulo de 120 a 180Hz. Posteriormente, en el mismo acto quirúrgico, se realiza la implantación del generador de impulsos en la región torácica o abdominal y se conecta a los electrodos cerebrales.
Modelos de sonda e implicaciones en la respuesta terapéuticaLa mayoría de los estudios describen la utilización de electrodos Medtronic modelos 3389 y 338749. Dichos electrodos, dependiendo del modelo, tienen un diámetro de 1,27mm y 4 contactos de 1,5 o 3mm de longitud separados por 0,5, 1,5 o 4mm53. Según De Koning, el modelo 3887 posee contactos más grandes que hacen más difícil saber la estructura exacta que es estimulada49.
Configuración de los electrodos y patrones de estimulaciónComo indican Morishita et al., el primer paso en la programación de una intervención terapéutica con ECP implica establecer de manera precisa la localización de los electrodos y definir la configuración de los electrodos que se ha de aplicar y que incluye la selección del tamaño de los contactos activos y la distancia entre ellos55. Dicha configuración variará en función de la estructura neuronal seleccionada para la ECP y del modelo de electrodo a utilizar. El siguiente paso en la programación conlleva establecer la intensidad, frecuencia y amplitud del impulso eléctrico a aplicar en cada punto de «contacto activo», en la fase aguda de estimulación. Dichas variables dependerán del efecto clínico positivo que se vaya consiguiendo con la estimulación, así como de los efectos secundarios que se presenten.
Con el fin de comprobar la adecuada implantación del electrodo, en ocasiones se ha descrito la realización de una estimulación intraoperatoria. Por ejemplo, en el trabajo de Greenberg et al. se describe una estimulación intraoperatoria de 130Hz, 210us y 2-6V36. Los efectos descritos para dicha estimulación fueron: mejoría del ánimo y de los síntomas de ansiedad, incremento de la fluidez verbal, aumento de la expresividad facial con potenciación del estado de alerta, e incremento de la frecuencia cardiaca36. Sin embargo, no siempre es posible detectar estos signos a pesar de implantaciones correctas, viéndose normalmente los efectos clínicos de forma diferida, por lo que en la práctica clínica no suele realizarse esta comprobación intraoperatoria.
Hay que tener presente que, como ya hemos indicado, en la fase aguda de la estimulación no siempre se encuentra de manera inmediata una respuesta favorable y permanente. Incluso, algunos pacientes pueden presentar síntomas psiquiátricos transitorios, sobre todo de tipo afectivo. Por ello, para establecer un adecuado patrón de estimulación crónica, es conveniente revisar la respuesta clínica del paciente con frecuencia, habitualmente de manera mensual, para reajustar el patrón de estimulación eléctrica de acuerdo con la respuesta clínica55.
En la revisión crítica realizada por Hamani et al. los parámetros de estimulación eléctrica utilizados en las 2 estructuras que presentan un mayor nivel de evidencia científica fueron: i) para el núcleo subtalámico, hasta 4V, 130Hz, y 60us; ii) para el núcleo accumbens, 5V, 130Hz, y 90us15.
ConclusionesLa presente revisión confirma el uso de la ECP en el tratamiento de casos graves y refractarios de TOC. Aunque no hay claros factores predictores de eficacia, y la selección de una diana cerebral frente a otra no parece aportar diferencias significativas en la efectividad, parece claro que este tipo de intervención resulta beneficiosa para un relevante, aunque limitado, número de pacientes. Su utilización se asocia, en la mayoría de los estudios revisados, a una significativa reducción de los síntomas clínicos, con una aparición de efectos secundarios, los cuales en todo caso son generalmente considerados como reversibles. Se ha visto, además, en algunos de los estudios revisados que su aplicación se asocia también a una clara mejoría del funcionamiento y la calidad de vida. La decisión de mantener o no un tratamiento concomitante farmacológico/psicoterapéutico en estos pacientes no queda claramente establecida en los estudios revisados, no existiendo ningún estudio que demuestre si resulta más eficaz mantener o suspender el tratamiento farmacológico y, como hemos visto, tan solo un estudio que describe la utilidad de la TCC tras la aplicación de la ECP. Hay que señalar, no obstante y como conclusión final acerca de la ECP, que el establecimiento definitivo de la eficacia real de dicha técnica está necesitado de más estudios controlados y aleatorizados que aporten una mayor evidencia científica sobre su efectividad a largo plazo, así como acerca de la relación riesgo/beneficio y costes de su aplicación en estos pacientes.
En dicho contexto, la correcta selección de los pacientes candidatos sigue siendo crucial para asegurar un mejor pronóstico. Por todo ello, como recomiendan Morishita et al.55, la decisión de aplicar la ECP en un paciente concreto ha de hacerse tras un riguroso análisis de la relación «riesgo/beneficio», debiendo ser la decisión final relativa a la selección de los pacientes candidatos refrendada por un comité institucional integrado por especialistas de las áreas implicadas en el que se incluya también un psiquiatra ajeno al programa. Se ha de garantizar, además, que el control del tratamiento se lleva a cabo en el contexto de un equipo de salud mental multidisciplinar especializado y que asume el seguimiento del paciente de manera permanente y a largo plazo.
Finalmente, una evaluación correcta de los pacientes tanto en el proceso de selección como a lo largo del seguimiento deberá comprender no solo el componente sintomatológico (ya sea tanto a través de la exploración psicopatológica como de escalas), sino también el funcionamiento, la discapacidad y la calidad de vida del sujeto. En este contexto se recomienda que toda la información relativa a los pacientes incluidos en este programa de intervención sea incorporada en un registro específico y permanente de «casos».
Conflicto de interesesLos autores declaran no presentar ningún conflicto de interés en la elaboración de este artículo.