El componente depresivo es el más prevalente del trastorno bipolar. La ketamina ha mostrado eficacia y rapidez como tratamiento de episodios depresivos. El objetivo del presente trabajo es realizar una revisión sistemática sobre la eficacia y seguridad de la ketamina como tratamiento de la depresión bipolar, y sus tipos de administración. Se obtuvieron 10 artículos relevantes que cumplían con los criterios del estudio: un ensayo clínico, 5 estudios de cohorte y 4 series de casos. La forma de administración utilizada en el 60% de los trabajos fue la infusión intravenosa. La ketamina parece ser un tratamiento seguro y eficaz para la depresión bipolar, aunque la duración de la acción es breve. Los efectos adversos que se observaron se produjeron generalmente en el momento de la infusión y tendieron a desaparecer completamente al cabo de 1-2h. Por tanto, es necesario realizar más estudios para explorar nuevas vías de administración, así como su seguridad y efectos adversos.
The depression is the most prevalent state throughout the life of the bipolar patient. Ketamine has been shown to be an effective and rapid treatment for depression. The objective of the present work is to perform a systematic review on the efficacy and safety of ketamine as treatment of bipolar depression, as well as its different patterns of administration. The search found 10 relevant manuscripts that met the inclusion criteria: one clinical trial, 5 cohort studies, and 4 case reports. Intravenous infusion was used in 60% of the studies. According to data, ketamine seems to be an effective and safe treatment for bipolar depression, although the length of its effect is short. Adverse effects observed generally occurred at the time of infusion, and tended to completely disappear within 1-2h. Therefore, more studies are necessary to explore new patterns of administration, as well as on its safety and adverse effects.
El trastorno bipolar (TB) se encuentra dentro de las enfermedades médicas más incapacitantes y costosas para el sistema sanitario1. La depresión, la distimia y los estados mixtos en conjunto suponen los componentes más prevalentes del TB2. A pesar de que existen tratamientos eficaces de la depresión bipolar3-6, sigue habiendo un porcentaje nada desdeñable de casos resistentes, bien por falta de eficacia, o bien por intolerancia a los efectos secundarios. Por ello, hay una gran necesidad de desarrollar nuevos fármacos que ejerzan un efecto antidepresivo rápido dado el riesgo suicida de estos pacientes7.
Durante la última década, diversos estudios han mostrado la implicación del sistema glutamatérgico, y en particular del receptor N-metil D-aspartato (NMDA), en la eficacia de los tratamientos antidepresivos, lo cual lo sitúa como diana de cara al desarrollo de nuevos tratamientos7. La ketamina es un derivado de la fenciclidina y antagonista del receptor NMDA, que ha demostrado un efecto rápido y eficaz ante episodios depresivos a dosis subanestésicas8,9. En el caso de la depresión unipolar, se han publicado al menos 8 ensayos clínicos en los que se ha visto la rapidez de acción y eficacia de la ketamina en este grupo diagnóstico10-17.
La presente revisión tiene como objetivo analizar de forma sistemática y resumir la evidencia científica de los trabajos más recientes acerca de la eficacia y seguridad del uso de la ketamina como tratamiento de la depresión bipolar, así como de sus diferentes tipos de administración.
Material y métodosSe realizó una búsqueda electrónica en las bases de datos PubMed y Embase. La búsqueda se limitó a trabajos prospectivos, series de casos, o ensayos clínicos, publicados en inglés o en castellano desde enero de 2012 a octubre de 2015. Se emplearon los siguientes términos MESH: «ketamine», «bipolar disorder» y «bipolar depression». La estrategia se restringió a estudios realizados en humanos. Posteriormente se realizó una búsqueda manual y una búsqueda hacia atrás a partir de los trabajos seleccionados. Se incluyeron aquellas publicaciones en las que la población de estudio estuviera formada por pacientes diagnosticados de TB. Se excluyeron aquellos trabajos cuya muestra fueran pacientes con un diagnóstico diferente al estudiado, y aquellos trabajos en los que no se evaluara la efectividad de la ketamina en la depresión.
Los artículos se sintetizaron y evaluaron a través de la herramienta on-line «Fichas de lectura crítica de Osteba» (FLC)18. Esta herramienta permitió realizar una lectura pormenorizada de los artículos y determinar la calidad metodológica de cada uno de ellos. Este proceso de selección y extracción de información fue realizado por 2 revisores, que en caso de desacuerdo se reunían para decidir cuáles incluir o excluir de la revisión, o sobre la calidad del artículo.
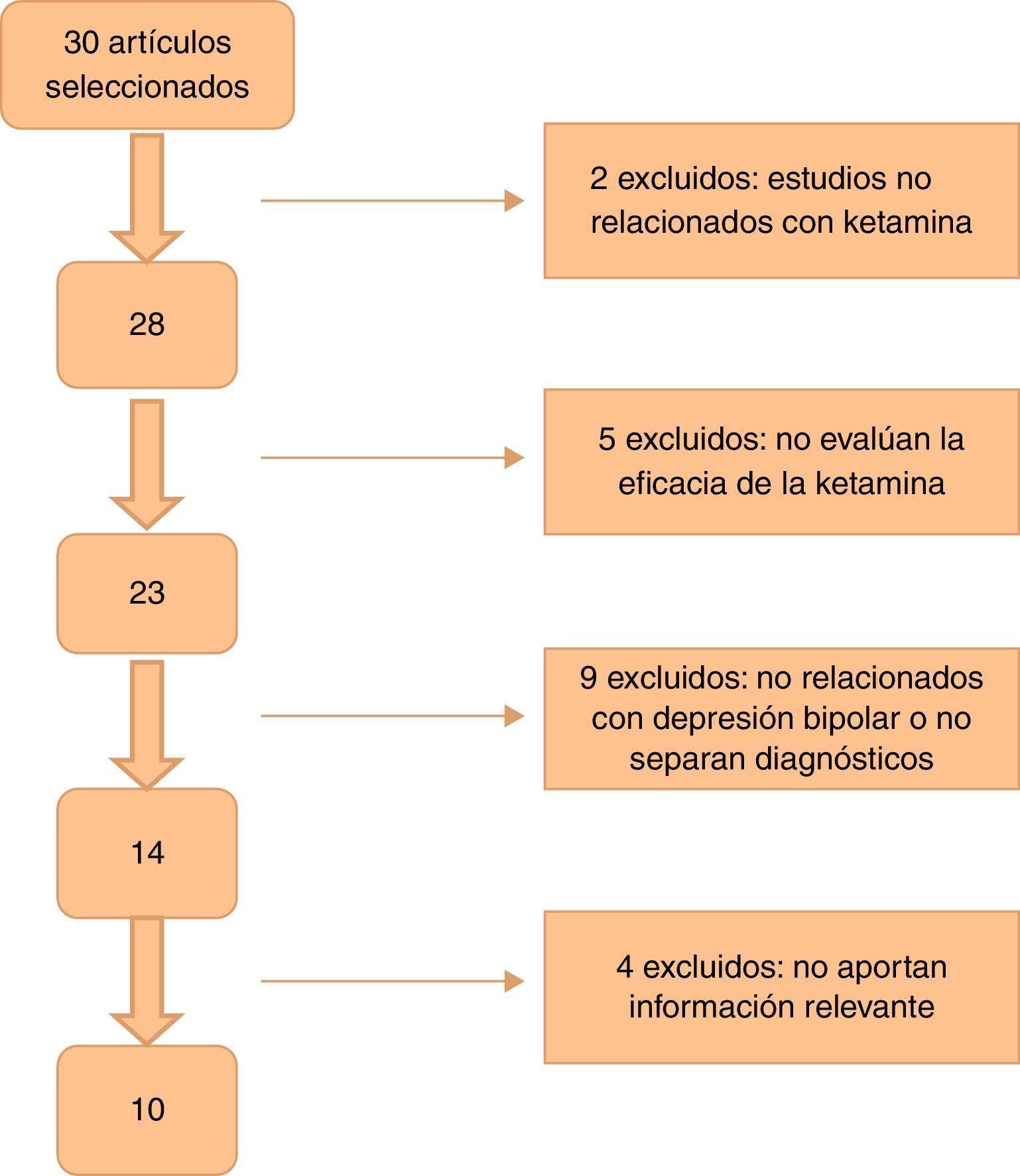
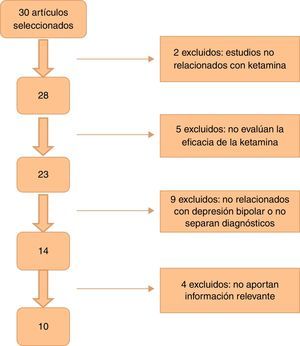
En la figura 1 se muestra el flujo de selección de artículos basándonos en la metodología PRISMA19.
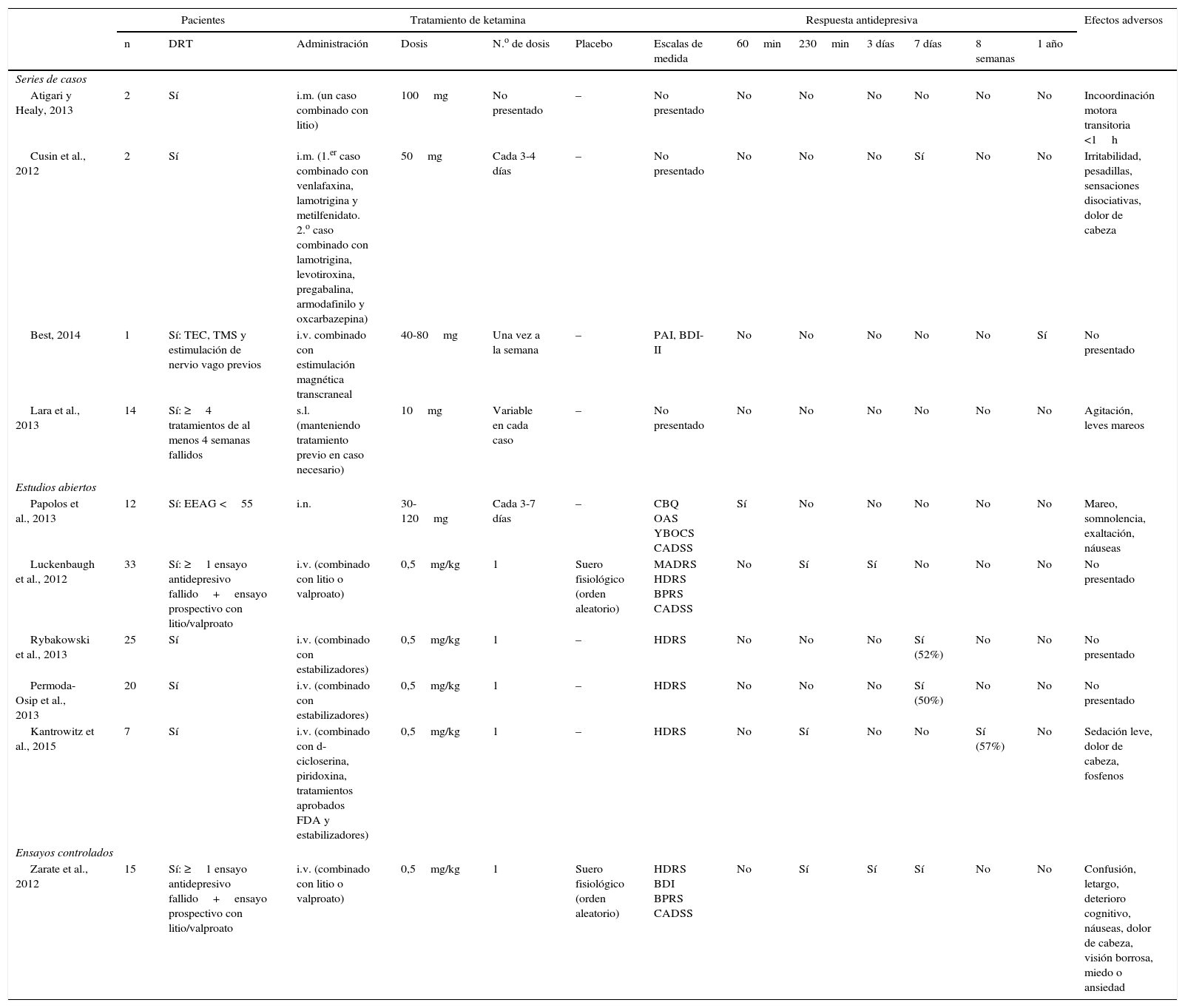
ResultadosEn la búsqueda inicial se obtuvieron un total de 30 artículos, de los cuales se seleccionaron 10 que cumplían los criterios de inclusión y contenían información relevante. No se añadió ningún trabajo seleccionado a partir de la búsqueda manual o hacia atrás. De ellos, uno es ensayo clínico, 5 son estudios de cohorte y 4 series de casos (resumidos en la tabla 1). La mayoría de los estudios utilizaron una dosis de ketamina de 0,5mg/kg administrado vía infusión intravenosa (i.v.). Dos estudios emplearon ketamina en dosis de 50-100mg vía intramuscular (i.m.)20,21, uno utilizó ketamina intranasal (i.n.) en dosis de 10mg/administración22, y otro empleó ketamina sublingual (s.l.) en dosis de 10mg23. En todos los artículos que especificaba un criterio de respuesta, y este se definió como una reducción de ≥50% en la puntuación de alguna de las escalas de medida de depresión (Hamilton Rating Scale for Depression [HDRS] o Montgomery-Asberg Depression Rating Scale [MADRS]).
Resumen de las series de casos, ensayos controlados aleatorizados y abiertos sobre el uso de ketamina como tratamiento de la depresión bipolar
| Pacientes | Tratamiento de ketamina | Respuesta antidepresiva | Efectos adversos | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | DRT | Administración | Dosis | N.o de dosis | Placebo | Escalas de medida | 60min | 230min | 3 días | 7 días | 8 semanas | 1 año | ||
| Series de casos | ||||||||||||||
| Atigari y Healy, 2013 | 2 | Sí | i.m. (un caso combinado con litio) | 100mg | No presentado | – | No presentado | No | No | No | No | No | No | Incoordinación motora transitoria <1h |
| Cusin et al., 2012 | 2 | Sí | i.m. (1.er caso combinado con venlafaxina, lamotrigina y metilfenidato. 2.o caso combinado con lamotrigina, levotiroxina, pregabalina, armodafinilo y oxcarbazepina) | 50mg | Cada 3-4 días | – | No presentado | No | No | No | Sí | No | No | Irritabilidad, pesadillas, sensaciones disociativas, dolor de cabeza |
| Best, 2014 | 1 | Sí: TEC, TMS y estimulación de nervio vago previos | i.v. combinado con estimulación magnética transcraneal | 40-80mg | Una vez a la semana | – | PAI, BDI-II | No | No | No | No | No | Sí | No presentado |
| Lara et al., 2013 | 14 | Sí: ≥4 tratamientos de al menos 4 semanas fallidos | s.l. (manteniendo tratamiento previo en caso necesario) | 10mg | Variable en cada caso | – | No presentado | No | No | No | No | No | No | Agitación, leves mareos |
| Estudios abiertos | ||||||||||||||
| Papolos et al., 2013 | 12 | Sí: EEAG <55 | i.n. | 30-120mg | Cada 3-7 días | – | CBQ OAS YBOCS CADSS | Sí | No | No | No | No | No | Mareo, somnolencia, exaltación, náuseas |
| Luckenbaugh et al., 2012 | 33 | Sí: ≥1 ensayo antidepresivo fallido+ensayo prospectivo con litio/valproato | i.v. (combinado con litio o valproato) | 0,5mg/kg | 1 | Suero fisiológico (orden aleatorio) | MADRS HDRS BPRS CADSS | No | Sí | Sí | No | No | No | No presentado |
| Rybakowski et al., 2013 | 25 | Sí | i.v. (combinado con estabilizadores) | 0,5mg/kg | 1 | – | HDRS | No | No | No | Sí (52%) | No | No | No presentado |
| Permoda-Osip et al., 2013 | 20 | Sí | i.v. (combinado con estabilizadores) | 0,5mg/kg | 1 | – | HDRS | No | No | No | Sí (50%) | No | No | No presentado |
| Kantrowitz et al., 2015 | 7 | Sí | i.v. (combinado con d-cicloserina, piridoxina, tratamientos aprobados FDA y estabilizadores) | 0,5mg/kg | 1 | – | HDRS | No | Sí | No | No | Sí (57%) | No | Sedación leve, dolor de cabeza, fosfenos |
| Ensayos controlados | ||||||||||||||
| Zarate et al., 2012 | 15 | Sí: ≥1 ensayo antidepresivo fallido+ensayo prospectivo con litio/valproato | i.v. (combinado con litio o valproato) | 0,5mg/kg | 1 | Suero fisiológico (orden aleatorio) | HDRS BDI BPRS CADSS | No | Sí | Sí | Sí | No | No | Confusión, letargo, deterioro cognitivo, náuseas, dolor de cabeza, visión borrosa, miedo o ansiedad |
BDI II: Beck Depression Inventory II; BPRS: Brief Psychiatric Rating Scale; CADDS: Clinician Administered Dissociative States Scale; CBQ: Child Bipolar Questionnaire; DRT: depresión resistente al tratamiento; EEAG: Escala de Evaluación de la Actividad Global; FDA: Food and Drug Administration; HDRS: Hamilton Rating Scale for Depression; i.m.: intramuscular; i.n.: intranasal; i.v.: intravenoso; s.l.: sublingual; MADRS: Montgomery-Asberg Depression Rating Scale; OAS: Overt Aggression Scale; PAI: Personality Assessment Inventory; TEC: terapia electroconvulsiva; TMS: estimulación magnética transcraneal; YBOCS: Yale Brown Obsessive-compulsive Scale.
El objetivo del trabajo realizado por Zarate et al.9 fue contrastar el resultado obtenido anteriormente por Diazgranados et al.8 de que la ketamina ejerce un rápido efecto antidepresivo en pacientes con depresión bipolar. Para ello realizó un estudio doble-ciego, aleatorizado, cruzado y controlado en el que los pacientes recibían ketamina i.v. (0,5mg/kg) o placebo con 2 semanas de diferencia. Los síntomas ansiosos y depresivos mejoraron más en los pacientes que recibieron ketamina frente al placebo en los 40min posteriores a la infusión (HDRS: F=3,08, p=0,001; VAS-Anxiety: F=2,12, p=0,030). La tasa de respuesta a los 40min de la infusión (reducción de MADRS ≥50%) fue del 64% para los pacientes con ketamina. Durante el primer día la tasa de respuesta fue del 43%, y aproximadamente el 30% se encontraba en remisión (MADRS <10). La duración del efecto antidepresivo fue de 3 días medido con la MADRS y HDRS, pero la mejoría de los síntomas depresivos según la escala Beck Depression Inventory (BDI) fue más duradera (14 días vs. 3 días). El resultado más interesante de este estudio fue que la ketamina ejerció un rápido y continuo efecto antisuicida (en los primeros 40min).
Luckenbaugh et al.24 realizaron un estudio para determinar en qué medida el efecto antidepresivo asociado a la ketamina está alterado en pacientes con depresión bipolar que tienen antecedentes familiares de dependencia de alcohol (FHAP). En el estudio se realizó un análisis post-hoc combinando las muestras de 2 estudios previos independientes, doble-ciegos, controlados y cruzados en los que se administró ketamina i.v. (0,5mg/kg) combinada con litio o valproato8,9. El principal resultado fue que los individuos con FHAP mostraron mayores mejorías y más duraderas en los síntomas depresivos en comparación con los que no tenían FHAP (MADRS: p=0,030, d=0,19, IC 95%: 0,02-0,37; HDRS: p=0,010, d=0,25, IC 95%: 0,05-0,45). Los sujetos con FHAP también mostraron menor distorsión perceptiva con ketamina. Al analizar los pacientes con antecedentes personales de alcoholismo, estos tuvieron menores puntuaciones en las escalas Clinician-Administered Dissociative States Scale ([CADSS]: F=2,33, p=0,010), Brief Psychiatric Rating Scale Positive ([BPRS] Positive: F=5,04, p=0,030) y BPRS Dysphoria (F=9,17, p=0,003).
En el trabajo publicado por Atigari y Healy20 se recogen los casos de 2 personas con largo historial de TB resistente que participaron en estudios de ketamina durante una fase de depresión. En uno de ellos el único tratamiento efectivo fue la terapia electroconvulsiva (TEC). El otro respondió al litio, aunque la respuesta fue diferente en cada episodio. Ambos casos experimentaron una respuesta inmediata al tratamiento con ketamina y se mantuvieron en remisión varios meses después. En el historial de ambas personas había un patrón de respuesta a tratamientos con propiedades convulsivas. Por ello, los autores subrayan la necesidad de investigar las propiedades convulsivas de tratamientos como la ketamina o TEC como un mecanismo adicional de su acción antidepresiva.
En el artículo publicado por Best25 se describe un caso clínico de depresión severa dentro de un TB I resistente a TEC, estimulación magnética transcraneal (TMS) o estimulación del nervio vago. Tras estas diferentes estrategias de tratamiento, el sujeto aceptó someterse a una combinación de tratamiento con TMS y ketamina (40-80mg) que recibió semanalmente durante 3 años. Al año de comenzar el tratamiento alcanzó una remisión de los síntomas con una mejora parcial del funcionamiento. Específicamente, mejoró la depresión, la ansiedad, la atención, la concentración y los pensamientos claros. El paciente también mostró mejor humor y ausencia de ideación suicida.
El estudio realizado por Kantrowitz et al.26 es el primer estudio que investiga la eficacia de la ketamina (0,5mg/kg) en depresión bipolar resistente seguida de dosis diarias de d-cicloserina durante 8 semanas (dosis inicial de 250mg aumentada hasta 1.000mg en 3 semanas). Todo esto se apoyó con piridoxina, tratamiento aprobado por la FDA, y estabilizadores del humor. Siete sujetos completaron el estudio y 4 de ellos alcanzaron la remisión (HDRS <7). Se obtuvo una respuesta significativa desde el momento basal a todos los momentos medidos excepto a las 2 semanas (F=161,8, p<0,001), con un alto tamaño de efecto el primer día (d cohen=2) y a las 8 semanas (d cohen=1,1). Los autores concluyen que sería recomendable realizar estudios para analizar la eficacia y la seguridad de la d-cicloserina como tratamiento independiente de la depresión bipolar.
En el trabajo realizado por Rybakowski et al.27 se incluyeron 25 pacientes con episodio depresivo bipolar a los que se les administró una única dosis de ketamina de forma i.v. (0,5mg/kg). Todos los pacientes recibían estabilizadores y habían sido resistentes a tratamiento con antidepresivos. Un paciente respondió al tratamiento tras 6h desde la infusión (reducción HDRS ≥50%). A las 24h, el 24% de los pacientes habían respondido, y a los 7 días el 52% mostraron buena respuesta, manteniéndola al día 14. La remisión (HDRS <7) fue alcanzada por 4 pacientes a las 24h del tratamiento y por 8 pacientes a los 7 días. Después de 14 días, 12 pacientes experimentaron remisión de sus síntomas depresivos.
Permoda-Osip et al.28 analizaron la eficacia de la ketamina y su relación con el déficit de vitaminas del grupo B en 20 pacientes con episodio depresivo bipolar. Para ello se les administró una dosis única de ketamina de forma i.v. (0,5mg/kg). A los 7 días de la infusión, 10 pacientes respondieron al tratamiento (reducción HDRS ≥50%). Además, observaron que en ellos los niveles de vitamina B12 estaban aumentados respecto de los sujetos no respondedores (p=0,047), aunque los autores resaltan que estos resultados pueden estar mediados por el sexo, ya que el 90% eran mujeres. Sin embargo, no encontraron resultados significativos con el ácido fólico o la homocisteína.
Tipos de administraciónPapolos et al.22 analizaron la eficacia y seguridad de la ketamina i.n. en 12 niños (6-19 años) diagnosticados de TB con síntomas fóbicos (BD-FOH). La ketamina i.n. fue bien tolerada con mínimos efectos secundarios, los cuales se observó que eran dosis-dependientes. El efecto terapéutico duró entre 36-60h. Se encontró una rápida mejoría de la hiperactividad, comportamientos agresivos y ansiedad. En la mayoría de los casos se observó una desaparición completa de los síntomas maníacos y depresivos. Una vez alcanzada la remisión, esta se mantuvo durante 3-7 días sin efectos secundarios. Sin embargo, una vez que desapareció el efecto de la ketamina, los síntomas volvieron bastante rápido de forma progresiva.
En el trabajo publicado por Cusin et al.21 se presentan 2 casos tratados con ketamina i.m. Tanto la administración de ketamina i.v. como oral no resultaron efectivas, sin embargo, la preparación de 50mg de ketamina i.m. cada 3-4 días mantuvo su eficacia durante varios meses y fue bien tolerada.
Lara et al.23 analizaron la eficacia y la tolerancia de dosis muy bajas de ketamina de forma s.l. (10mg). La posología variaba de un paciente a otro, pudiendo ser dosis única, o repetida cada 2-7 días. De los 14 pacientes diagnosticados de TB en fase depresiva, 4 de ellos alcanzaron una remisión de los síntomas depresivos y 5 de ellos mantuvieron la respuesta después del tratamiento con ketamina. Los autores observaron buena tolerancia en la mayoría de los casos y un rápido y fuerte efecto de la ketamina en el estado de ánimo y la cognición. Los beneficios terapéuticos de este tipo de administración s.l. se parecen a los obtenidos de forma i.v., pero tiene mejor tolerancia, es más fácil de usar y tiene mayor seguridad en cuanto a efectos adversos.
Efectos secundariosEn el trabajo publicado por Zarate et al.9, encontraron que durante la infusión de ketamina o placebo, alrededor del 10% de los sujetos sintieron mareos, somnolencia, deterioro cognitivo, ansiedad, nauseas, visión borrosa o dolores de cabeza. No hubo diferencias significativas respecto a los efectos secundarios con relación al placebo a los 80min. Durante la fase de infusión los pacientes experimentaron mareos, dificultad para conciliar el sueño, sequedad de boca y flatulencia. No hubo cambios significativos en cuanto al ritmo cardíaco, respiratorio, o valores del laboratorio durante el estudio. Estos efectos también se observaron en el trabajo realizado por Cusin et al.21.
Papolos et al.22 raramente observaron efectos secundarios después de 1h de la administración. Los efectos disociativos que se experimentaron fueron: distorsión de la realidad, sensación de cambios corporales, actuar como en un sueño, sensación de irrealidad, o confusión de identidad. Generalmente, estos efectos fueron de intensidad leve o moderada y duraron siempre menos de 60min tras la administración. Una vez desarrollada tolerancia (4-5 administraciones de la dosis final efectiva) disminuyeron progresivamente, y apenas fueron observados.
En el estudio descrito por Kantrowitz et al.26, 3 sujetos mostraron sedación leve, 2 tuvieron dolores de cabeza, y uno experimentó fosfenos.
En el trabajo de Lara et al.23, 2 sujetos bipolares presentaron agitación durante unas horas. Fue común tener un leve aturdimiento que en la mayoría de los casos desaparecía en un tiempo inferior a 30min.
En otro reporte de casos20, uno de los pacientes experimentó descoordinación motora transitoria que desapareció a la hora de la administración.
ConclusionesSegún los estudios analizados en esta revisión (un ensayo clínico, 5 estudios de cohorte y 4 series de casos), los resultados sugieren que la ketamina es un antagonista del receptor NMDA que ha mostrado rápida eficacia en la disminución de la sintomatología depresiva y de los intentos de suicidio en sujetos deprimidos con TB, aunque no se ha visto que este efecto se mantenga en el tiempo8,9. Estos datos coinciden con los resultados obtenidos en diferentes revisiones publicadas recientemente sobre el uso y la eficacia de la ketamina en la depresión29-31. Además, de acuerdo con los resultados obtenidos, la ketamina podría ser recomendable como tratamiento adyuvante en pacientes con tratamiento antidepresivo o estabilizadores del humor cuya respuesta es incompleta, en aquellos con necesidad de tener una rápida respuesta, o en pacientes resistentes31. Sin embargo, creemos necesario realizar más estudios que apoyen esta afirmación. La duración del efecto antidepresivo varía entre 3-14 días en función de la escala utilizada para la medición de los síntomas. En cualquier caso, parece necesario instaurar un tratamiento de mantenimiento tras el abordaje inicial, ya que tras la discontinuación los síntomas aparecen de nuevo de un modo relativamente rápido. En pacientes con depresión bipolar parece indicado administrar ketamina en asociación a estabilizadores del ánimo, o como tratamiento de segunda elección en determinados subgrupos clínicos de pacientes (pacientes no respondedores), o en endofenotipos concretos de la enfermedad como pueden ser pacientes con FHAP. La TEC es un tratamiento altamente eficaz para la depresión5 y se ha sugerido que su eficacia podría aumentar al administrar ketamina en la realización de la prueba32. Sin embargo, esto no ha sido claramente demostrado y la asociación no presenta ventajas claras frente a la TEC por sí sola29. Loo et al.33 evaluaron el efecto neuroprotector y la eficacia de la ketamina como complemento del tiopental durante la anestesia de la TEC en pacientes con trastorno depresivo mayor. Contrariamente a la hipótesis principal, no se encontró que la administración de ketamina durante la TEC reduzca los efectos secundarios cognitivos. Solamente se vio una mejora de la eficacia en la primera semana de tratamiento (F=4,56, p=0,039, ŋ2=0,102). Estos resultados coinciden con los obtenidos en otros estudios en los que no separan la depresión mayor del TB34. Sin embargo, los autores advierten que en este estudio se emplea una dosis subanestésica de ketamina (0,5mg/kg) en combinación con tiopental, lo cual deja mucho espacio a futuras investigaciones con dosis diferentes de ketamina, en combinación con otros anestésicos, o con otras formas de TEC.
Entre los factores de riesgo para la depresión se incluyen niveles bajos de vitamina B12 y ácido fólico, así como niveles altos de homocisteína. De hecho, se ha visto una relación entre estos factores en pacientes deprimidos35. Además, se ha visto que la vitamina B12 influye en el mecanismo de acción de la ketamina28. Por ello, sería interesante vigilar los niveles de dicha vitamina a la hora de pautar ketamina, ya que se ha visto que ambas moléculas tienen un efecto sinérgico36. El importante papel de la vitamina B12 puede deberse a que dicha vitamina es esencial para el correcto funcionamiento de la metionina sintasa y la metilmalonil-CoA mutasa. Estas enzimas actúan como catalizadoras en la conversión de la homocisteína en metionina. La metionina es un aminoácido esencial para la síntesis del S-adenosil metionina (SAMe), el cual tiene un efecto estimulante en los neurotransmisores monoaminérgicos centrales. Para estudios posteriores sería recomendable analizar el efecto de la ketamina tras un suplemento de vitamina B12 en pacientes con niveles disminuidos. En esta línea, también han suscitado interés la vitamina B6 (piridoxina), que eleva el nivel de serotonina en sangre, y como suplemento al tratamiento podría ayudar a reducir los síntomas de la depresión, y la d-cicloserina, que en dosis altas (>750mg) actúa como antagonista del receptor NMDA y podría mejorar la seguridad en el tratamiento con ketamina26. Además, resultaría de gran interés poder disponer de biomarcadores que predigan qué pacientes van a ser respondedores o no a la ketamina. Hashimoto37 ha encontrado que el biomarcador inflamatorio IL-6 se encuentra más alto en el grupo de pacientes que posteriormente respondieron a ketamina. Por tanto, sería interesante explorar la relación entre el rápido efecto antidepresivo de ketamina y la expresión de las vías inflamatorias en la depresión.
Los resultados obtenidos por Luckenbaugh et al.24 confirman los de otros estudios en los que se muestra una mayor mejoría de los pacientes con dependencia alcohólica y de aquellos con FHAP tratados con ketamina38. Los autores sugieren que una variación genética del gen NR2A que expresa el receptor NMDA podría estar involucrado en la susceptibilidad a la dependencia de alcohol. Esta variación puede hacer a los pacientes con FHAP más sensibles al efecto de la ketamina39. Esto indicaría que las alteraciones en los receptores NMDA en pacientes con heredabilidad genética al alcoholismo podrían ser un subtipo neurobiológico distinto que conduce a tener respuestas alteradas a la ketamina.
Aunque la forma más común de administración de la ketamina es la infusión i.v., recientemente se están estudiando nuevos formatos como la vía oral, i.n., i.m. o s.l. Con la administración oral la ketamina experimenta una transformación metabólica de primer paso en el hígado y se convierte en norketamina40. La norketamina tiene menor potencia biológica que la ketamina no metabolizada, pero tiene niveles plasmáticos 3 veces mayores y una vida media más larga (12h vs. 2h). Las máximas concentraciones plasmáticas tardan menos de 1min en alcanzarse con la ketamina i.v., mientras que con la i.m. tarda 5-15min y 30-60min en la administración oral. Las preparaciones parenterales tienen un alto nivel de biodisponibilidad (i.m. 93%, i.v. 100%), mientras que la administración i.n. presenta una biodisponibilidad del 25-50%, y la preparación oral tiene una pobre absorción gastrointestinal (20% biodisponibilidad)40. En cuanto a la ketamina oral, encontramos casos en los que no parece efectiva21, mientras que otros estudios sí obtienen una disminución de los síntomas41. Diversos estudios han señalado que la administración i.m. produce un rápido y sostenido efecto en los síntomas depresivos, tanto en depresión bipolar como en otro tipo de trastornos (trastorno obsesivo-compulsivo o depresión mayor)20,21. Las formas i.n. y s.l. también han mostrado eficacia en distintos diagnósticos y mejor tolerancia, uso y seguridad que la vía i.v., por lo que se presentan como fuertes alternativas, aunque los resultados aún son preliminares22,23. El interés en el desarrollo de nuevas formas de administración reside sobre todo en facilitar la aplicación de cara a las dosis de mantenimiento con vías menos invasivas, y así mejorar la adherencia. Para repetidas dosis de ketamina, sería más factible la administración i.n. o i.m. La preparación oral debería considerarse como tratamiento de mantenimiento una vez que el paciente haya respondido a una dosis i.v. inicial42, aunque debido al potencial adictivo de la ketamina y a la facilidad de acceso de este tipo de preparación, puede aumentar el riesgo de un mal uso y debe administrarse con precaución29.
Debido al creciente interés en el uso de la ketamina como tratamiento antidepresivo, es importante evaluar los efectos secundarios que puedan derivarse de su uso. La administración de dosis subanestésicas de ketamina puede producir efectos adversos, tanto físicos como psicotomiméticos y neuropsicológicos. En general, se ha descrito una aparición de síntomas positivos, negativos, disociativos y maníacos8,9,42. Este tipo de efectos se producen generalmente en el momento de la infusión de ketamina y tienden a desaparecer completamente a los 60min. En otros estudios también se han observado alteraciones perceptivas que no se prolongaban más de 2h9. No se ha visto que la severidad de estos efectos adversos varíe en función de la dosis o del tipo de administración35. Los efectos adversos físicos más observados son dolor de cabeza, náuseas, ligero aturdimiento, somnolencia y mareos9,21-23,26,30. Este tipo de síntomas tienden a ser dosis-dependientes, aunque de nuevo se limitan al momento de la infusión y generalmente se prolongan durante un periodo corto de tiempo43.
Los efectos sinaptogénicos y del comportamiento de la ketamina dependen de la estimulación del receptor mammalian target of rapacymin (mTOR)44. Estudios señalan que una sobrerregulación del mTOR puede causar una aceleración del crecimiento de los tumores45, por lo que no parece indicado utilizar ketamina en pacientes bipolares deprimidos con historia actual o pasada de neoplasia. Además, la ketamina debe administrarse con cautela en pacientes con enfermedades cardiovasculares (hipertensión o enfermedad isquémica del corazón), ya que esta estimula el sistema cardiovascular aumentando el esfuerzo y frecuencia cardíaca, así como la presión arterial31,46. Por otro lado, es habitual que los sujetos con abuso de ketamina reciban dosis mayores que la pautada para tratar los síntomas depresivos, e incluso que la reciban con mayor frecuencia de la necesaria. Además, en estos casos también suele producirse el consumo de otro tipo de sustancias46, por lo que el tratamiento con ketamina en estos pacientes debe realizarse con extrema precaución. Diversos estudios han asociado el abuso de ketamina con el desarrollo de cistitis o dilatación biliar47,48. Por ello, es necesario realizar estudios sobre su seguridad para el desarrollo de tratamientos con ketamina a largo plazo.
A modo de conclusión podemos decir que la ketamina podría considerarse como un tratamiento seguro que tendría efectividad en el tratamiento de la depresión bipolar en algunos casos, aunque con una breve duración de la acción, a falta de estudios confirmatorios diseñados ad hoc para la depresión bipolar. Es necesaria la realización de más estudios para explorar nuevas vías de administración, así como su seguridad y efectos adversos, a fin de mejorar el cumplimiento, dado que el tratamiento debe mantenerse en el tiempo para evitar recaídas. La efectividad de este fármaco abre las puertas a explorar vías alternativas para el abordaje de la depresión bipolar, que suponen la mayor esperanza actual en innovación psicofarmacológica49,50.
Conflicto de interesesLa Dra. Gonzalez-Pinto ha recibido becas y ha ejercido como asesora, tutora o ponente experta en las siguientes entidades: Almirall, AstraZeneca, Bristol-Myers Squibb, Cephalon, Eli Lilly, Glaxo-Smith-Kline, Janssen-Cilag, Jazz, Johnson & Johnson, Lundbeck, Merck, Otsuka, Pfizer, Sanofi-Aventis, Servier, Shering-Plough, Solvay, Ministerio Español de Ciencia e Innovación (CIBERSAM), Ministerio de Ciencia (Instituto Carlos III), Gobierno Vasco, Instituto de Investigación Médica Stanley, and Wyeth.
El Dr. Vieta ha recibido becas y ha ejercido como asesor, tutor o ponente experto en las siguientes entidades: AB-Biotics, Actavis, Allergen, AstraZeneca, Bristol-Myers Squibb, Ferrer, Forest Research Institute, Gedeon Richter, Glaxo-Smith-Kline, Janssen, Lundbeck, Otsuka, Pfizer, Roche, Sanofi-Aventis, Servier, Shire, Sunovion, Takeda, Telefónica, Fundación del Cerebro y el Comportamiento, Ministerio Español de Economía y Competitividad (CIBERSAM y PI 12/00910), 7.o Programa Marco Europeo (ENBREC), Instituto de Investigación Médica Stanley, y en el Comissionat per a Universitats i Recerca del DIUE de la Generalitat de Catalunya (2014 SGR 398).
Los demás autores declaran no tener conflicto de intereses.
Este estudio estuvo apoyado por fondos del Gobierno de España «Fondo de Investigación Sanitaria» FEDER (PI12/02077); el Fondo Europeo de Desarrollo Regional: «Mastermind» (parcialmente financiado por el Programa de Apoyo a la Política ICT [ICT PSP] como parte del Programa Marco de Innovación y Competitividad de la Comunidad Europea), la Fundación Vasca de Innovación e Investigación Sanitarias (BIOEF); el Centro de Investigación en Red de Salud Mental (CIBERSAM) y la Universidad del País Vasco (GIC12/84). La Unidad de Investigación de Psiquiatría del Hospital Universitario Araba está apoyada por la «Stanley Research Foundation» (03-RC-003). Instituto Carlos III (ISCIII).