Realizar un análisis descriptivo de la serie de pacientes con cáncer de mama (CM) y embarazo diagnosticadas en nuestro centro en relación con los métodos terapéuticos empleados y supervivencia global de la serie.
Pacientes y métodosEntre 1982 y 2009, de 5.906 pacientes diagnosticadas de CM, se trató a 27 pacientes con CM y embarazo (0,46%). Analizamos las características clínicas y anatomopatológicas, el diagnóstico, los tratamientos y la evolución de estas pacientes en nuestro centro.
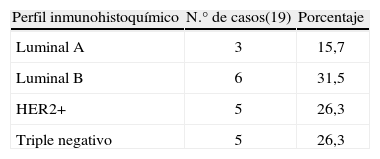
ResultadosLa edad media al diagnóstico fue de 35 años. Durante la gestación se diagnosticó a 21 pacientes y en el posparto, a 6. El retraso medio diagnóstico desde el inicio de los síntomas fue de 4 meses. Respecto al perfil inmunohistoquímico determinado en 19 pacientes, 5 (26%) eran receptor 2 de factor de crecimiento epidérmico humano (HER2) positivo; otros 5 (26%), triple negativo; 3, luminal A, y en las 6 restantes, luminal B. Al diagnóstico, se clasificó a 5, 9, 11 y 2 pacientes en estadio I, II, III y IV, respectivamente. Histológicamente, 21 (78%) eran carcinomas ductales infiltrantes; 11 (41%), de alto grado histológico, y 4 casos (15%) presentaron características de carcinoma tipo inflamatorio al diagnóstico. Se pautó quimioterapia neoadyuvante en 16 pacientes (59%), sin que se detectaran complicaciones fetales. Se operó a todas las pacientes, y se realizó mastectomía radical modificada en 24 (89%), así como cirugía conservadora en 3. Con un tiempo medio de seguimiento de 60 meses, la supervivencia global fue del 70%. Cuatro pacientes (15%) presentaron recaída local y 13 (48%), recaída sistémica.
ConclusionesEl carcinoma de mama durante el embarazo se asocia con un retraso diagnóstico, estadios avanzados y grados histológicos altos. El tratamiento quirúrgico conlleva un alto porcentaje de mastectomías radicales. La quimioterapia no produjo efectos adversosproalto porcentaje de mastectomías en el feto tras el primer trimestre de gestación. El pronóstico de CM durante el embarazo es similar al de las pacientes no gestantes de la misma edad y estadio tumoral.
To perform a descriptive analysis of patients with breast cancer (BC) and pregnancy diagnosed in our centre, as regards the therapeutic methods used and the overall survival of the series.
Patients and methodsBetween 1982–2009, 5906 patients were diagnosed with BC, of whom 27 (0.46%) were treated for pregnancy-associated BC. We analysed the characteristics, diagnosis, treatments and outcome of these patients in our centre.
ResultsThe mean age at diagnosis was 35 years. Twenty-one patients were diagnosed during pregnancy and six of them in the post-partum period. The mean diagnostic delay from the onset of symptoms was four months. In the immunohistochemical profile performed in 19 patients, 5 (26%) were HER2, 5 (26%) were triple-negative, luminal A in three patients, and luminal B in the other 6 cases. At diagnosis, 5, 9, 11 and 2 patients were classified into stages I, II, III and IV, respectively. Histologically, 21 (78%) were infiltrating ductal carcinomas, 11 (41%) were high grade carcinomas and 4 (15%) were inflammatory carcinomas at diagnosis. Neoadjuvant chemotherapy was prescribed in 16 patients (59%), with no foetal complications detected. All patients underwent surgery; 24 (89%) had modified radical mastectomy while three had conservative surgery. The mean follow-up time was 60 months, in which the overall survival was 70%. Four patients (15%) had local recurrence and 13 (48%) had systemic recurrence.
ConclusionsBreast carcinoma during pregnancy is associated with diagnostic delay, advanced stages and high histological grades. Surgical treatment involves a high percentage of radical mastectomies. Chemotherapy did not produce adverse effects in the foetus after the first trimester. The prognosis for BC during pregnancy is similar to that of non-pregnant patients of the same age and tumour stage.
El cáncer de mama asociado al embarazo (CME) es el diagnóstico de una neoplasia maligna mamaria durante la gestación, la lactancia o durante el primer año posparto. Su frecuencia se estima entre 1/3.000 y 1/10.000 gestaciones, con una incidencia aproximada del 10–20% de los cánceres de mama (CM) diagnosticados en mujeres menores de 30 años y entre el 0,5 y el 3% de todos los CM1,2. Es el tumor no ginecológico más frecuente durante la gestación y el segundo de todos los cánceres en la gestante, después del cáncer de cérvix uterino.
Actualmente se acepta que no hay una relación directa de causa-efecto entre el desarrollo de un cáncer de mama y el embarazo. Entre las diversas hipótesis acerca de un posible efecto de la gestación como factor favorecedor del crecimiento tumoral, ni el aumento de los factores de la angiogénesis (PGF, sFlt-1 y s-endoglina) durante el embarazo3, ni el estado de hiperestrogenismo4, ni el aumento de estradiol endógeno placentario o algunos fármacos utilizados en tratamientos de fertilidad, como el clomifeno1, han logrado demostrar que el embarazo sea un factor de riesgo para el desarrollo de un cáncer de mama. Respecto al efecto proalto tector de la edad en el primer embarazo, el metaanálisis de Ma et al5 indica el efecto protector de la gestación en el CM esporádico con receptores estrogénicos (RE) positivos, pero no en la incidencia de CM con RE negativos, como suele suceder en el CME.
En pacientes con CME, la mamografía tiene una sensibilidad diagnóstica menor (78–86%)2,4, con un 11% de resultados falsos negativos. Por el contrario, la ecografía mamaria en el embarazo es altamente sensible (80–100%), específica (100%) y útil, además, para la estadificación axilar1,2,4,6. La resonancia magnética (RM) no está contraindicada en el embarazo si se realiza sin contraste de gadolinio4. Aunque el 80% de los nódulos de mama detectados en el período gestacional será benigno, todo nódulo o masa mamaria se deberá biopsiar mediante punción aspirativa con aguja fina o biopsia con aguja gruesa para estudio histológico1,4,7, con el fin de evitar retrasos diagnósticos de carcinoma en la mama grávida. Además, el inicio de algunos tratamientos, como la quimioterapia (QT) y/o la radioterapia, quedarán condicionados al período gestacional de estas paciente. La administración de QT en el primer trimestre de embarazo aumenta el riesgo de malformaciones, y resulta segura después de este período6, mientras que la hormonoterapia, trastuzumab y la radioterapia son tratamientos reservados para el período posparto por el elevado riesgo de producir daños fetales4,6,8–11.
El objetivo de este estudio es realizar un análisis descriptivo de la serie de pacientes con CME diagnosticadas en nuestro centro en relación con las características patológicas e inmumohistoquímicas de los CME, los métodos terapéuticos empleados y la supervivencia global de la serie.
Pacientes y métodosRealizamos un análisis descriptivo retrospectivo de todas las pacientes diagnosticadas de un CME entre enero de 1982 y diciembre del 2009. Se obtuvieron 5.906 pacientes diagnosticadas de CM en la Unidad de Patología y Cirugía Mamaria del Hospital Clínico Universitario de Valencia, de las cuales 27 eran CME.
De la historia clínica se recogieron datos referentes a información demográfica, como edad y antecedentes familiares de CM, sintomatología y demora diagnóstica. Entre los factores pronósticos clínicos se analizó el tamaño tumoral, la afectación axilar y se clasificaron los tumores por estadios según la clasificación del tumor, ganglios (nodes en inglés), metástasis (TNM) de la 6.ª edición del American Joint Committee on Cancer (AJCC)12.
Como factores pronósticos y predictivos moleculares, valoramos el grado histológico, Ki67 y la expresión de los RE y de progesterona (RP) mediante técnicas inmonohistoquímicas realizadas sobre tejido tumoral fijado en formol e incluido en parafina (Dako [Envision©]), Roche Diagnostics – Ventana (Benchmark XT©).
La determinación inmunohistoquímica de la expresión de la proteína del receptor 2 de factor de crecimiento epidérmico humano (HER2) se realizó con la técnica de Herceptest© (Dako, clon A0485), y se consideró positiva en caso de presentar 3+ (tinción intensa y circunferencial en más del 30% de las células,) en caso de tinción 2+ se consideró como “indeterminado” y se procedió a realizar hibridación in situ con fluorescencia (FISH) (Dako HER2 FISH pharmDx Kit, K5331). Se consideraron HER2 negativo los casos de 0 y 1+ en el Herceptest ©. Con los datos inmunohistoquímicos consideramos 4 subtipos13: luminal A (RE+ y/o RP+, HER2– y Ki67 < 14%); luminal B (RE+ y RP+/—, HER2+/— y Ki67 ≥ 14%); HER2 (RE—, RP— y HER2+) y triple negativo (RE—, RP— y HER2—).
Asimismo ofrecimos el estudio de los genes BRCA 1 y 2 a las pacientes con CME, que se realizó en 3 casos. Respecto al tratamiento de las pacientes con CME, analizamos el tipo de cirugía, si recibió QT y/o radioterapia u otros tratamientos adyuvantes, y determinamos la supervivencia global y la supervivencia libre de enfermedad de las pacientes con CME mediante el análisis de Kaplan-Meier utilizando el software SPSS (SPSS Inc, Chicago, Illinois [Estados Unidos]).
ResultadosLa incidencia de CME (27 pacientes) supone el 0,46% del total de los CM tratados en nuestra Unidad de Patología y Cirugía Mamaria. La edad media de las pacientes al diagnóstico fue de 35 años, con un rango de 29–43 años. En 10 casos (37%) había antecedentes familiares de CM, y en 3 pacientes se determinaron mutaciones de los genes BRCA 1 y 2, siendo 2 de ellas portadoras de la mutación del gen BRCA1.
El CM se diagnosticó durante la gestación en 21 casos (78%) con una media de 23 semanas (9–38 semanas), y en 6 pacientes (22%) durante el primer año posparto, entre los 2 y los 5 meses, con una media de 2,6 meses.
El signo clínico de alerta más frecuente fue el nódulo mamario en 17 pacientes (64%), seguido de alteraciones inflamatorias en 4, adenopatías axilares palpables en otras 4 y retracción del pezón en 2 pacientes (7%). La localización del CME fue similar en mama derecha e izquierda, con 13 y 14 casos, respectivamente.
El tiempo medio desde el inicio de los síntomas hasta la consulta diagnóstica osciló entre 1 y 12 meses, con un retraso diagnóstico medio de 4 meses.
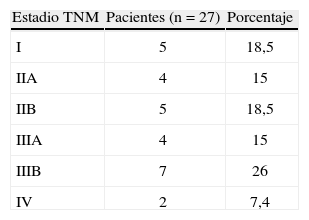
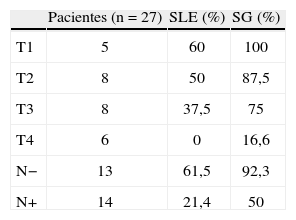
En la tabla 1 se muestran los estadios tumorales TNM, para los que se clasificaron 5, 9, 11 y 2 pacientes en estadios I, II, III y IV, respectivamente, destacando el estadio IIIB (26%) como el más frecuente. Dos pacientes (7%) presentaron metástasis hepáticas sincrónicas al CME. Según el tamaño tumoral, 16 pacientes (59%) eran T2 y T3, y 14 pacientes (52%) presentaron adenopatías axilares metastásicas (tabla 2). Respecto a las características histológicas de los CME, 21 tumores (77%) fueron carcinomas ductales infiltrantes, carcinoma medular y lobulillar infiltrante en 2 pacientes, y 4 (14,5%) presentaron signos de carcinoma inflamatorio. La mayoría de los tumores fueron de alto grado: G3 en 11 pacientes, G2 en 4 y G1 en 4 casos.
Estadios tumorales de nuestra serie de cáncer de mama asociado al embarazo. Clasificación TNM según la 6.ª edición del American Joint Committee on Cancer
| Estadio TNM | Pacientes (n=27) | Porcentaje |
| I | 5 | 18,5 |
| IIA | 4 | 15 |
| IIB | 5 | 18,5 |
| IIIA | 4 | 15 |
| IIIB | 7 | 26 |
| IV | 2 | 7,4 |
TNM: tumor, ganglios (nodes en inglés), metástasis.
El perfil inmunohistoquímico se determinó en 19 pacientes. Como se señala en la tabla 3, los tipos HER2+ y triples negativos corresponden a 5 casos cada uno; luminal A en 3 pacientes, y luminal B en 6 pacientes.
Los métodos diagnósticos por imagen utilizados fueron similares a los empleados en pacientes no gestantes de la misma edad, siendo la ecografía la técnica más frecuentemente empleada en 14 pacientes, la mamografía con protección abdominal en 11 pacientes y la RM en 2 pacientes durante el período posparto.
Veinticuatro pacientes (89%) recibieron QT: 16 en régimen de QT neoadyuvante y 9 pacientes como QT adyuvante tras la cirugía; en ambos se utilizó el esquema FAC. En las pacientes embarazadas se administró tras el primer trimestre de gestación, y en ningún caso se detectaron complicaciones en el feto secundarias al tratamiento quimioterápico. Todas las pacientes fueron intervenidas quirúrgicamente, y se realizó mastectomía radical modificada en 24 (89%) y cirugía conservadora en 3 (11%) durante el tercer trimestre de gestación. En un caso se practicó biopsia selectiva del ganglio centinela en el período posparto. En dicho período se asoció tratamiento hormonal con antiestrógenos a 14 pacientes, radioterapia en 7 y trastuzumab en 5 casos. Cuatro pacientes optaron por el aborto terapéutico, y las otras 17 pacientes tuvieron partos por vía vaginal o por cesárea, sin ninguna complicación ni malformaciones fetales.
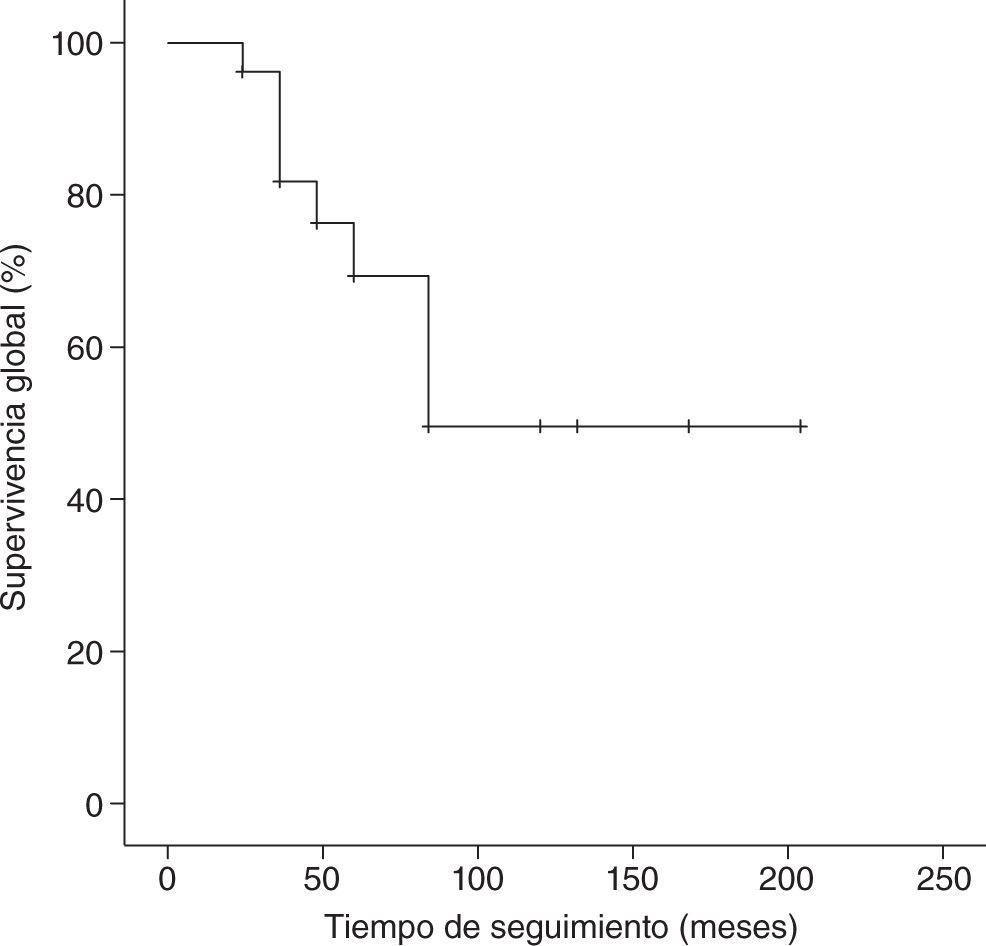
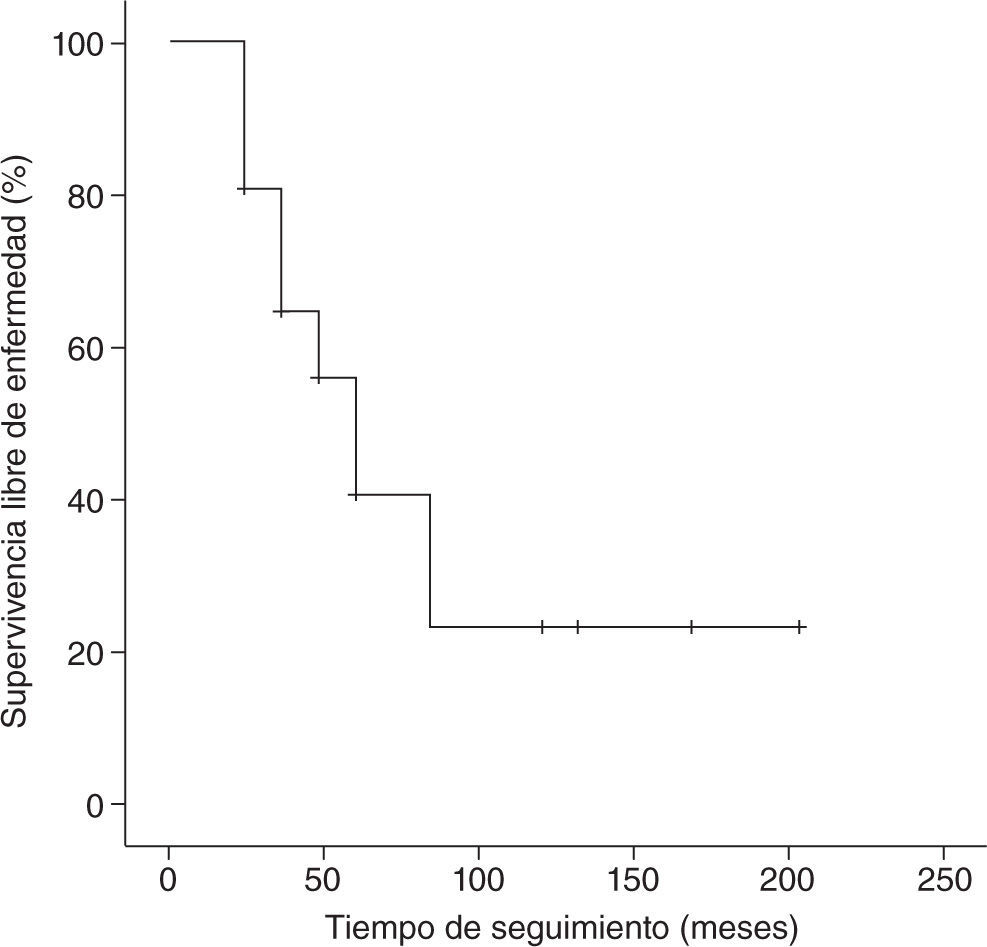
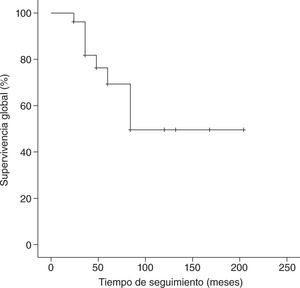
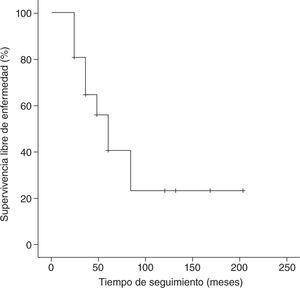
Con un tiempo medio de seguimiento de 60 meses (rango de 7 meses a 17 años), la supervivencia global a 5 años de nuestra serie es del 70%, siendo el tiempo medio ± desviación estándar (DE) de supervivencia de 130,5±19,6 meses, con un intervalo de confianza (IC) del 95% de 92–169,1 meses. La supervivencia libre de enfermedad es del 37%, con un tiempo medio ± DE de 85,8±14,8 meses y un IC del 95% de 56,7–115 meses. En las figuras 1 y 2 se muestran las gráficas de la supervivencia global de nuestra serie y la supervivencia libre de enfermedad, respectivamente. En la tabla 2 se señalan la supervivencia global y la supervivencia libre de enfermedad en relación con el tamaño tumoral y la afectación axilar.
En el seguimiento se evidenciaron 4 casos (14,5%) de recaída local, a los 7 meses, 2, 2 y 8 años, respectivamente, y destaca el hecho que dos pacientes eran portadoras de la mutación BRCA1. No hemos detectado ninguna recidiva local tras cirugía conservadora. Trece pacientes (48%) presentaron recaída sistémica (entre 7 meses y 17 años), y la localización más frecuente fue en el hígado. Finalmente, 8 pacientes (30%) fallecieron por progresión tumoral.
DiscusiónNo hay estudios aleatorizados o controlados sobre CME6, y los datos acerca de su incidencia se basan, como en nuestro trabajo, en el análisis retrospectivo de series de escaso tamaño muestral. Diversos estudios señalan que está aumentando la frecuencia del cáncer de mama en el embarazo, debido al retraso de la edad de gestación en las mujeres en el mundo occidental, y se estima que de las mujeres menores de 40 años afectadas de CM, aproximadamente un 10% estarán embarazadas1,2,4,6. Para García Manero et al2, la edad media de las pacientes con CME es de 34 años, similar a nuestra serie, y aunque la mayoría de los casos se diagnostican en el período posparto1, en nuestra experiencia el diagnóstico se realizó de modo más frecuente durante el período gestacional.
Al igual que en otros estudios1,2,4, coincidimos en la existencia de un retraso diagnóstico mayor y, en consecuencia, en la presencia de tumores en estadios avanzados en este grupo de pacientes. El retraso diagnóstico se relaciona con la mayor dificultad en detectar signos patológicos en la mama grávida por la ingurgitación e hipertrofia fisiológica de la mama gestante o lactante6. Como en la serie de la Clínica de Navarra, el signo clínico más frecuente fue la detección de un nódulo mamario2.
Acerca del riesgo de CME en portadoras de la mutación del gen BRCA, se han señalado resultados dispares8,14,15. Para Britt et al14, la paridad protege del desarrollo de CM en pacientes BRCA1, pero no en portadoras del BRCA2 en las que la incidencia de CME se incrementa en un 15% por cada embarazo adicional. Por el contrario, Johansson et al16 señalan un incremento de CME en gestantes BRCA1, pero no en BRCA2, y para Narod17 la paridad ejerce un efecto protector en mujeres de más de 40 años con alteración del BRCA2. A raíz de la posibilidad de que las mujeres con CME sean portadoras de estas alteraciones, se recomienda el estudio genético en todas ellas.
Las características histológicas y el perfil inmunohistoquímico de los CME son similares a las mujeres con CM en la edad temprana y no embarazadas. La mayoría son CM infiltrantes de tipo ductal o lobulillar (>80%), de grado nuclear alto (>60%), infiltración linfovascular y receptores de estrógenos negativos (40–70%), con frecuente afectación metastásica en adenopatías axilares (>50%) y similar frecuencia en la expresión del HER2/neu2,4,7,15. En nuestra serie destacamos también una alta frecuencia de CM con RE negativos (10 pacientes), así como 4 casos (14,5%) de carcinomas inflamatorios, muy superior a la frecuencia global del 2–6% en el CM.
En opinión de diversos autores, las características anatomopatológicas del CME y el mayor retraso diagnóstico conllevan la detección en estadios más avanzados, que en un 70% son carcinomas T2–31,2,4,6 con alta incidencia de metástasis ganglionares en axila (50–89%), resultados similares a los de nuestra serie.
Actualmente, ya no se acepta que el CME sea un factor independiente para un pronóstico desfavorable18, el cual es similar al del CM para la misma edad y estadio tumoral al diagnóstico, con una supervivencia global a los 5 años del 50–70%15. Oscila entre el 60–100% en pacientes sin afectación axilar (N0) y el 30–50% en caso de adenopatías axilares positivas5,7,15,17, cifras que concuerdan con las de nuestra serie.
Las pautas terapéuticas en el CME serán idénticas a las de las pacientes no embarazadas con las modificaciones necesarias para la protección del feto. El aborto terapéutico queda limitado a la decisión personal de las pacientes, ya que no hay datos de que afecte al pronóstico y no implica un cambio notable en la estrategia terapéutica4,6,7.
Sin embargo, las opciones de tratamiento del CME ofrecen particularidades en relación con el período gestacional. El tratamiento quirúrgico se puede efectuar en cualquier período del embarazo, si bien es recomendable posponer la intervención quirúrgica hasta la semana 12 para disminuir el riesgo de abortos espontáneos4,6,7. La tumorectomía es una opción quirúrgica adecuada, pero obliga a la posterior irradiación de la mama y, por ello, debe indicarse tras el primer trimestre gestacional, bien como tratamiento de inicio, bien después de completar la QT neoadyuvante en períodos avanzados de la gestación. La radioterapia a dosis habituales de 50Gy está contraindicada en el embarazo, ya que la irradiación tiene efectos abortivos y teratogénicos, condiciona alteraciones neurológicas o de crecimiento fetal y debe realizarse en el período posparto4,6,9.
La mastectomía radical modificada sigue siendo la técnica quirúrgica utilizada con más frecuencia9,16, como también sucede en nuestra experiencia, debido a que un porcentaje alto de pacientes con CME son diagnosticadas en estadios avanzados. Respecto a la estadificación axilar, desde la reunión de expertos en 200619, se puede ofrecer la biopsia selectiva de ganglio centinela durante el embarazo con eficacia y seguridad, ya que se ha constatado que la dosis fetal absorbida de tecnecio 99 es muy inferior a las dosis teratogénica de 100 mGy. Los colorantes vitales sí están contraindicados en el CME, por el riesgo de anafilaxia4. En nuestra serie, se realizó sólo en una paciente en el período posparto, y la linfadenectomía axilar es el procedimiento indicado habitualmente.
El tratamiento quimioterápico es una opción fundamental en el tratamiento del CME. Es conocido que la administración de QT durante el primer trimestre de embarazo aumenta el riesgo de malformaciones fetales en un 10–20%, pero después del primer trimestre gestacional la aplicación de QT con antraciclinas es segura con un riesgo bajo (1–3%) de malformaciones neonatales, incidencia similar al 2–3% de la población general6. Aun así, la QT administrada en el segundo y tercer trimestres de gestación ocasiona retraso del crecimiento intrauterino, parto prematuro y bajo peso al nacer, por lo que debe evitarse en las 3–4 semanas antes del parto para disminuir las complicaciones infecciosas o hemorrágicas por la neutropenia10,11,15,20, lo cual obliga a suspender la lactancia. En nuestra serie, sólo observamos un caso de parto prematuro y, como, en otros estudios con esquema FAC de QT4,6, no se encontraron malformaciones fetales ni complicaciones en el parto.
La hormonoterapia con tamoxifeno o fármacos diana anti- HER2, como trastuzumab o lapatinib, están contraindicadas durante la gestación y se indicarán en el período posparto, ya que la hormonoterapia puede inducir malformaciones fetales (faciales y genitales) y el trastuzumab se relaciona con oligohidramnios por daño renal transitorio4,8,10,11.
Por último, debemos señalar que en nuestras pacientes con CME encontramos una alta tasa de recaídas sistémicas, lo cual podría explicarse por la elevada frecuencia de factores histológicos y bioquímicos de mal pronóstico (estadios TNM avanzados, receptores hormonales negativos y diferenciación histológica de grado alto), incluida una elevada incidencia de carcinomas inflamatorios en nuestra serie.
En nuestra experiencia, el CME se asocia con un retraso diagnóstico de 4 meses, con frecuencia se detecta el CM en estadios avanzados y se asocia con una incidencia elevada de grados histológicos altos, receptores estrogénicos negativos y frecuente afectación metastásica axilar. Por ello, el tratamiento quirúrgico conlleva aún un alto porcentaje de mastectomías radicales. En nuestra serie, la QT administrada después del primer trimestre de gestación no produjo efectos adversos en el feto, siendo el pronóstico en supervivencia global y libre de enfermedad similar al de las pacientes con CM no gestantes de la misma edad y el mismo estadio tumoral.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.