Carcinoma adenoide quístico de la mama en el varón
Adenoid cystic carcinoma of the male breast
J. F. Cameselle**, J. C. Canós*, S. Bagué*, X. Matias-Guiu*, L. Colomo*, E. Lerma*
* Servicio de Anatomía Patológica. Hospital de la Santa Creu i Sant Pau. Barcelona.
** Servicio de Anatomía Patológica. Hospital Xeral de Vigo.
Correspondencia:
Jorge F. Cameselle Teijeiro.
Urzaiz, 178, 1.°
36025 Vigo.
SUMMARY
We present the case of a 67 years old man with an adenoid cystic carcinoma of the breast. Adenoid cystic carcinoma of the breast is exceedingly rare (less than 0.1%). The justification for this term rests on its similarity with the well known adenoid cystic carcinoma of the salivary gland.
Palabras clave
Carcinoma adenoide quístico, Cáncer de mama, Mama del varón.
Key words
Adenoid cystic carcinoma, Breast cancer, Male breast.
INTRODUCCIÓN
El carcinoma adenoide quístico (CAQ) es una variante histológica rara y representa menos del 0,1% de los cánceres de mama (CM) primarios, 1-3 afectando a mujeres adultas, siguiendo una distribución por edades similar al CM convencional, con enfermas entre los 25 y 80 años y unas edades medias que varían desde 50 a 63 años según las series. 2, 4, 5
Por otra parte, sólo aproximadamente el 0,9% de los CM afectan al varón, 6-11 correspondiendo el 85% de éstos a la variedad ductal infiltrante, la mayoría moderada o pobremente diferenciados. Carcinomas papilares, a menudo con un componente quístico, son relativamente más comunes en los hombres (3-5%) que en la mujeres (1-2%). 12 Destacamos también que cerca del 5% de los CM masculinos son lesiones enteramente intraductales. 13
No obstante, tipos histológicos poco comunes han sido descritos en la mama del varón, tales como carcinoma medular, mucinoso, escamoso, lobulillar, 14 así como casos aislados del tipo adenoi-de quístico. 15-17 Un CAQ cutáneo ha sido descrito afectando la región periareolar de un hombre de 35 años. 18
DESCRIPCIÓN DEL CASO
Se presenta el caso de un varón de 67 años que acude a consulta por presentar una tumoración en la mama izquierda, de consistencia dura, con retrac-ción cutánea de pezón y aréola, sin estar adherida a
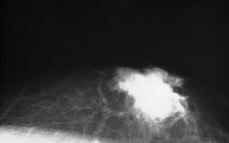
planos profundos. Mamográficamente se correspondía a una lesión estrellada que retrae piel y pezón (Fig. 1). Se practicó biopsia para confirmar el diagnóstico, seguida de cuatro ciclos de quimioterapia (FAC). Posteriormente se realizó mastectomía izquierda y vaciamiento axilar.
Fig. 1. Mamografía: ginecomastia y lesión sólida de contornos estrellados que retrae piel y pezón.
El tamaño macroscópico de la lesión fue de 2,5 cm, de forma nodular y contorno estrellado con retracción de la piel de aréola y pezón, consistencia firme y una superficie de corte de tonalidad blanquecina, sin evidencia de áreas quísticas, hemorrágicas ni de necrosis.
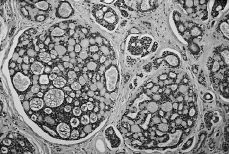
Microscópicamente tanto en la biopsia como en la pieza de mastectomía se identificó una proliferación epitelial con una estructura heterogénea (Fig. 2) en la que se reconocen varios patrones arquitecturales: tubular, cribiforme de contenido mucoide, basófilo o hialino eosinófilo, cilindromatoso y pequeños regueros de aspecto infiltrativo. El componente sólido fue menor del 30%. También se reconocía invasión perineural. Los receptores de estrógenos y progesterona fueron negativos. Nuestro diagnóstico fue de carcinoma adenoide quístico con patrones tubular y cribiforme de grado 2 (según los criterios de Ro et al 19). Aislándose un total de 21 ganglios axilares, todos ellos negativos. El paciente permanece vivo y libre de enfermedad cuatro años después del diagnóstico inicial.
Fig. 2. Carcinoma adenoide quístico. Estructura heterogénea: patrones tubular y cribiforme. (HE, 100*.)
DISCUSIÓN
Rosen (1996) estima que a pesar de su rareza, el CAQ de la mama despierta interés por su excelente pronóstico y por su semejanza morfológica con aquéllos localizados en la glándula salival, tracto respiratorio superior y otras localizaciones. 2 Los casos de CAQ afectando la mama del varón son excepcionales. 15, 16
Clásicamente se presenta como una masa palpable, y en ocasiones pueden retraer la piel, ulcerarla o presentar piel de naranja. 2 Nuestro caso se acompañaba de retracción cutánea de la aréola y el pezón, lo que se vio facilitado por la localización superficial. A pesar del hecho de que este tumor asienta con una alta frecuencia en la región central o en la subareolar de la mama, no suele observarse derrame por el pezón. 20 La determinación de receptores hormonales en el tumor resultó negativa, lo cual coincide con la mayoría de los casos evaluados en la literatura. 20-23
Esta neoplasia, que representa el 4% de todos los tumores de las glándulas salivales, presenta una variedad de patrones histológicos que también van a ser encontrados cuando el carcinoma asienta en la mama. La coincidencia de varios de estos patrones arquitectuales en el mismo tumor le dan una apariencia heterogénea. Se observan imágenes cribiformes, sólidas, glandulares (túbulos), reticulares (trabéculas) y basalioides. Ocasionalmente se asocian áreas de diferenciación sebácea, adenomioepiteliomatosa y escamosa. 2 El estroma puede ocasionalmente mostrar cambios metaplásicos y entonces simular un adenoma pleomórfico del tipo de glándula salival. 3
Ro et al 19 propuso en 1987 que el CAQ sea estratificado en tres grados, sobre la base del porcentaje de crecimiento sólido dentro de la lesión [1) no elementos sólidos; 2) menos del 30%, y 3) más del 30%]. En nuestro caso el componente sólido representó menos del 30% del tumor, y las células eran de pequeño tamaño, con escaso citoplasma, núcleo ovoide de contorno regular, ocasionales nucléolos prominentes y escasas mitosis.
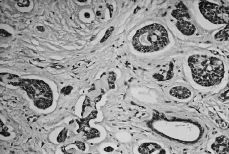
Con frecuencia se observan artefactos de retracción (Fig. 3), los cuales tienden a ser más pronunciados en las porciones más fibróticas del tumor, y pueden ser erróneamente interpretadas como émbolos tumorales linfáticos en el seno de un CAQ de mama. 2
Fig. 3. Artefacto de retracción que pueden simular émbolos tumorales linfáticos. (HE, 400*.)
Brevemente estos tumores están compuestos morfológicamente por dos tipos de células: 1) epiteliales cuboideas con un citoplasma más bien abundante y núcleo pálido, las cuales rodean estructuras tubulares tipo ductos, conteniendo polisacáridos neutros (PAS positivo, diastasa sensible), y 2) células mioepiteliales, las cuales son de un mayor tamaño que las epiteliales, aunque tienen un citoplasma y un núcleo más densamente teñido; estas células elaboran mucopolisacáridos ácidos (azul alcian y mucicarmín positivos) y abundante material de tipo lámina basal, que resulta en un componente estromal prominente, originando una apariencia focalmente cilindromatosa por todas las áreas del tumor. 24, 25
En general, las lesiones de alto grado suelen asociarse con células neoplásicas pobremente diferenciadas, a menudo con citoplasma escaso y un núcleo relativamente grande e hipercromático. 19 En la serie de cuatro casos de CAQ referida por Pastolero et al 26 todos tenían un grado nuclear bajo, receptores hormonales negativos y DNA diploide. Tres de éstos sin metástasis, con una actividad proliferativa baja y ausencia de expresión de la proteina p53. Por contra, el caso que mostraba metástasis en los ganglios axilares era de mayor tamaño, con una más alta actividad proliferativa y expresión de la proteína p53, sugiriendo estos autores que este factor puede jugar un papel en el comportamiento biológico de estos tumores. En nuestro caso, la expresión Ki67 (índice de proliferación celular) fue del 10-15%.
En cuanto al tamaño del tumor, las lesiones de bajo grado tienden a ser más pequeñas, con un diámetro medio de 1,6 cm, mientras los de alto grado tienden a ser mayores (diámetro medio de 3,5 cm); nuestro caso medía 2,5 cm. En la literatura se recogen tamaños tumorales que oscilan entre 0,5 y 10 cm. 2, 27 La invasión de los nervios de alrededor (invasión perineural) es encontrada en una minoría de estos tumores; 1, 2, 24 estaba presente en nuestro caso.
El diagnóstico diferencial debe establecerse fundamentalmente con carcinomas ductales con un prominente componente cribiforme, con algunos carcinomas papilares y mucinosos, 2 así como con una entidad benigna, la esferulosis colágena, la cual no representa más que un cambio inespecífico en el contexto de las enfermedades proliferativas benignas de la mama. 28 Los criterios citodiagnósticos por PAAF del CAQ de mama y sus posibles diagnósticos diferenciales son aportados y revisados por diferentes autores. 29, 30, 31
La supervivencia libre de enfermedad a los diez años es del 85% en pacientes tratados con mastectomía. 32 Las metástasis axilares son excepcionales. Tumores circunscritos pequeños que carecen de la invasión microscópica más allá de los límites del tumor macroscópico pueden ser tratados en la mayoría de los casos con una excisión solamente. Pero esto no es factible para tales tumores cuando están localizados superficialmente en la región subareolar. Así pues, al contrario que los localizados en la glándula salival, los CAQ de la mama están asociados con un pronóstico excelente. 33 El varón de nuestro caso permanece vivo y libre de enfermedad cuatro años después del tratamiento.
Kleer y Oberman (1998) publican una serie de 31 nuevos casos de CAQ, de los cuales uno era un varón, siendo el rango de edad de 33 a 74 años, con una edad media de 52,7. Se hizo el seguimiento y su correlación clínica, histológica y terapéutica de 20 de estos casos y los autores concluyeron como hallazgos más significativos que el tamaño de los tumores osciló entre 0,5 a 5 cm, con un tamaño medio de 1,84 cm. El 50% fueron de localización subareolar, y todos estaban macroscópicamente bien circunscritos; sin embargo, el 60% tenían infiltración periférica focal. El 25% fueron receptores estrogénicos positivos. Los autores no encontraron correlación estadística entre la expresión de Ki67 (MIB 1) y el grado histológico, nuclear, infiltración de la grasa y parénquima mamario adyacente, o con el estado de los receptores estrogénicos. Todos los pacientes estaban vivos sin evidencia de enfermedad después de una media de 7 años. Ninguno de los tumores tenía metástasis linfática. Debido a que más de la mitad de los CAQ eran focalmente infiltrativos, la excisión del tumor a de ser completa con márgenes no afectados. 34
RESUMEN
Presentamos el caso de un varón de 67 años con un carcinoma adenoide quístico (CAQ) en la mama. El CAQ de la mama es sumamente raro (menos del 0,1%). La justificación para este término descansa en su semejanza histológica con el clásico CAQ de la glándula salival.
REFERENCIAS
1.Rosai, J. Ackerman''s surgical pathology, 8.a ed. New York: Mosby; 1996.
2.Rosen, PP. Breast pathology. New York: Lippincott-Reven; 1996.
3.Page DL, Anderson TJ. Diagnostic histopathology of the breast. London: Churchill Livingstone; 1987.
4.Cavanzo FJ, Taylor HB. Adenoid cystic carcinoma of the breast. An analysis of 21 cases. Cancer 1969; 24:740-5.
5.De la Rue T, Orhant E. Adenoid cystic carcinoma of the breast. Rev Fr Gynecol Obstet 1995;90:22-6.
6.Jonasson JG, Agnarsson BA, Thorkacius S, Eyfjord JF, Tulinius H. Male breast cancer in iceland. Int J Cancer 1996;65:446-9.
7.Cameselle JF. Epidemiología y factores de riesgo del cáncer de mama en el sur de Galicia (tesis doctoral). Universidad de Santiago de Compostela; 1988.
8.Sanjuán A, García A, Ferrero E, et al. Cáncer precoz de mama en el varón. Rev Senología y Patol Mam 1993;6:191-5.
9.Sierra A, Fernández F, Cipagauta L, et al. Consideraciones sobre el cáncer de mama masculino a propósito de 20 casos estudiados. Rev Senología y Patol Mam 1991;4:248-55.
10.Rezola R, Laka A, Arias-Camison I, et al. Cáncer de mama masculino: estudio clínico-patológico de 17 pacientes. Oncología 1986;9:19-25.
11.Alonso A, Melguizo F, Santos JA, et al. Cáncer de mama en el varón. Revisión de 33 casos. Oncología 1983;6:29-35.
12.Heller KS, Rosen PP, Schottenefeld D, et al. Male breast cancer: a clinicopathologic study of 97 cases. Ann Surg 1978;188:60-5.
13.Langlands AO, Maclean N, Kerr GR. Carcinoma of the male breast: report of a series of 88 cases. Clin Radiol 1976;27:21-5.
14.García A, García A, Redondo C. Lobular carcinoma of the breast in a patient with Klinefelter syndrome. Cancer 1986;57:1181-3.
15.Hjurth S, Magnusson PH, Blomquiste PJ. Adenoid cystic carcinoma of the breast. Report of a case in male and review of literature. Acta Chir Scand 1977; 143:155-8.
16.Qizilbash AH, Patterson MC, Oliveira KF. Adenoid cystic carcinoma of the breast. Light and electron microscopy and brief review of literature. Arch Pathol Lab Med 1977;10:302-6.
17.Ferlito A, Di Bonito L. Adenoid cystic carcinoma of the male breast: report of a case. Amer Surg 1974;40:72-6.
18.Hollingsworth AB, Iezzoni JC. Primary cutaneous adenoid cystic carcinoma of the male breast: a case report and review of the literature. Breast Dis 1994; 7:213-8.
19.Ro JY, Silva EG, Gallager HS. Adenoid cystic carcinoma of the breast. Hum Pathol 1987;18:1276-81.
20.Rosen PP. Adenoid cystic carcinoma of the breast. A morphologically heterogeneous neoplasm. Pathol Annu 1989;24:237-54.
21.Zaloudek C, Oertel YC, Orestein JM. Adenoid cystic carcinoma of the breast. Am J Clin Pathol 1984;81: 297-307.
22.Düe W, Herbst H, Loy V, et al. Characterization of adenoid cystic carcinoma of the breast by immunohistology. J Clin Pathol 1989;42:470-6.
23.Lamovec J, Us-Krasovec M, Zidar A, et al. Adenoid cystic carcinomas of the breast: a histologic, cytologic and immunohistochemical study. Semin Diagn Pathol 1989;6:153-64.
24.Cheng J, Saku T, Obake H, et al. Basement membranes in adenoid cystic carcinoma. An immunohistochemical study. Cancer 1992;69:2631-40.
25.Quinodoz IS, Berger SD, Schafer P, et al. Adenoid cystic carcinoma of the breast: Utility of inmunocytochemical study with collagen IV on fine-needle aspiration. Diagn Cytopathol 1997;16:442-5.
26.Pastolero G, Hanna W, Zbieranowski, et al. Proliferative activity and p53 expression in adenoid cystic carcinoma of the breast. Mod Pathol 1996;9:215-9.
27.Wells CA, Nicoll S, Ferguson DJP. Adenoid cystic carcinoma of the breast: a case with axillary lymph node metastasis. Histopathology 1986;10:415-24.
28.Cardesi E, Cera G, Campione D, et al. Collagenous spherulosis of the breast. Case report. Pathologica 1994;86:656-8.
29.Gutpa RK, Dowle C. Fine-needle aspiration cytodiagnosis of adenoid cystic carcinoma of the breast. Diagn Citopathol 1996;14:328-30.
30.Culubret M, Roig I. Fine-needle aspiration biopsy of adenoid cystic carcinoma of the breast: a case report. Diagn Cytopathol 1996;15:431-4.
31.McCluggage WG, McManus DI, Caughley LM. Fine-neddle aspiration (FNA) cytology of adenoid cystic carcinoma and adenomyoepithelioma of breast: two lesions rich in myoepithelial cells. Cytopathology 1997; 8:31-9.
32.Sinn HP, Lehnert T, Otto HF. Adenoid cystic cancer of breast. Case report and meta-analysis of the literature. Chirurg 1993;64:198-202.
33.Peters GN, Wolff M. Adenoid cystic carcinoma of the breast. Report of 11 new cases: review of the literature and discussion of biological behavior. Cancer 1982; 52:680-6.
34. Kleer CG, Oberman HA. Adenoid cystic carcinoma of the breast. Value of histologic grading and proliferative activity. Am J Sug Pathol 1998;22:569-75.